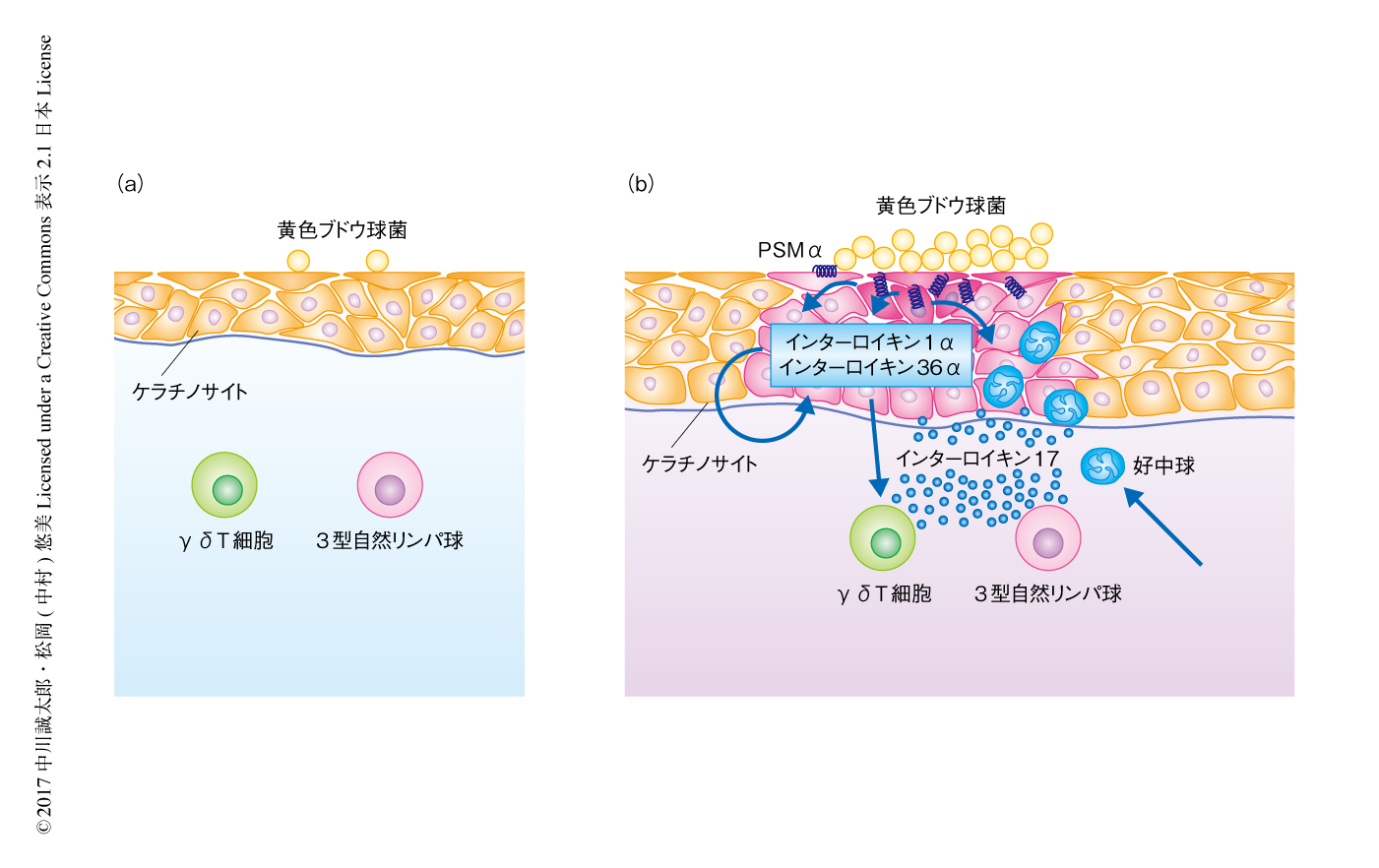
黄色ブドウ球菌に由来する外分泌毒素PSMαはケラチノサイトからのアラーミンの放出を介してインターロイキン17に依存性の皮膚炎を惹起する
中川誠太郎・松岡 (中村) 悠美
(千葉大学大学院医学研究院 皮膚科学)
email:松岡 (中村) 悠美
DOI: 10.7875/first.author.2017.134
Staphylococcus aureus virulent PSMα peptides induce keratinocyte alarmin release to orchestrate IL-17-dependent skin inflammation.
Seitaro Nakagawa, Masanori Matsumoto, Yuki Katayama, Rena Oguma, Seiichiro Wakabayashi, Tyler Nygaard, Shinobu Saijo, Naohiro Inohara, Michael Otto, Hiroyuki Matsue, Gabriel Núñez, Yuumi Nakamura
Cell Host & Microbe, 22, 667-677.e5 (2017)
黄色ブドウ球菌は健常人の皮膚にはほとんど定着していない一方,アトピー性皮膚炎の患者の90%以上においては皮膚の病変部に定着が認められる.しかし,黄色ブドウ球菌の皮膚への定着がアトピー性皮膚炎にどのように関与するのかについては不明な点が多い.これまで,筆者らの研究グループは,黄色ブドウ球菌の表皮感染マウスモデルを用いて,黄色ブドウ球菌の産生するδ毒素が真皮に存在する肥満細胞の脱顆粒を介してアレルギー型の皮膚炎を惹起することを報告している.この研究においては,黄色ブドウ球菌の産生するPSMαという外分泌毒素が表皮のケラチノサイトからのインターロイキン1αおよびインターロイキン36の細胞傷害による分泌を介して皮膚炎を惹起することをつきとめた.インターロイキン1の下流のアダプタータンパク質であるMyd88のノックアウトマウス,ケラチノサイトに特異的なMyd88ノックアウトマウス,抗インターロイキン36受容体抗体を投与したインターロイキン1受容体ノックアウトマウスにおいては,野生型のマウスと比べ皮膚炎が抑制され,皮膚組織におけるインターロイキン17の減少および好中球の組織への浸潤の抑制が確認された.さらに,インターロイキン17Aとインターロイキン17Fのダブルノックアウトマウスにおいても皮膚炎は有意に抑制された.以上の結果から,皮膚の表面の黄色ブドウ球菌が産生するPSMαが,ケラチノサイトからのアラーミンとしてインターロイキン1αおよびインターロイキン36αの放出をひき起こし,ケラチノサイトにおけるMyd88を介したシグナルを介してインターロイキン17に依存性の皮膚炎を惹起することが示された.
皮膚はからだの内と外とをへだてる人体において最大の臓器であり,細菌の侵入や外部の有害な環境因子から宿主をまもるための物理的なバリアとして重要な役割を担う1).黄色ブドウ球菌(Staphylococcus aureus)は健常人の皮膚にはほとんど定着していない一方,アトピー性皮膚炎の患者の90%以上においては皮膚の病変部に定着が認められる2).しかし,皮膚の表面に定着した黄色ブドウ球菌がどのような機序によりアトピー性皮膚炎に関与するのかについては不明な点が多い.黄色ブドウ球菌が環境に定着するのに重要なはたらきをする病原因子の一部は,周囲の細菌の密度を感知して発現するAgr遺伝子により発現が制御されている3).Agr遺伝子により発現が制御される毒素のひとつとしてPSMが知られている.これまで,筆者らの研究グループは,黄色ブドウ球菌の表皮感染マウスモデルを用いて,PSMファミリーのひとつであるδ毒素(別名,PSMγ)が真皮に存在する肥満細胞の脱顆粒を介してアレルギー型の皮膚炎を惹起することを報告している4).また,PSMαはケラチノサイトを含む多くの細胞に対し高い細胞傷害性を示すことが知られているが4,5),PSMαがケラチノサイトに作用して皮膚炎を惹起する機序については報告されていなかった.
ケラチノサイトは細胞が傷害された際に細胞外に放出され宿主に炎症を起こすアラーミンとよばれる物質を発現する6).皮下に直接に菌体を打ち込む黄色ブドウ球菌の皮下感染マウスモデルにおいては,インターロイキン1受容体ファミリーおよびToll様受容体(Toll-like receptor:TLR)と共役してはたらくMyd88のノックアウトマウスは野生型のマウスに比べ大きな潰瘍および膿瘍を形成し,Myd88が皮下への黄色ブドウ球菌の感染に対する防御において重要な役割をはたすことが報告されている7).しかし,皮膚の表面からの黄色ブドウ球菌の感染において,ケラチノサイトあるいはMyd88を介したシグナルがどのようなはたらきをするのかについては明らかにされていなかった.
先行研究により確立された黄色ブドウ球菌の表皮感染マウスモデルを用いて4),ケラチノサイトにおけるMyd88の重要性について検討した.表皮への黄色ブドウ球菌の感染から7日目に,野生型のマウスは好中球の浸潤や表皮の肥厚をともなう重篤な皮膚炎を起こす.一方,Myd88ノックアウトマウスにおいて皮膚炎はほとんど生じず,皮膚の表面に感染した黄色ブドウ球菌の数は維持されたものの野生型のマウスと比べ減少した.この結果は,ケラチノサイトを介さない黄色ブドウ球菌の皮下感染マウスモデルにおいてMyd88ノックアウトマウスが野生型のマウスに比べ重篤な皮膚の潰瘍および膿瘍の形成を呈し,感染の部位により多くの黄色ブドウ球菌のみられる,という結果と相反した.この違いが表皮のケラチノサイトを介した現象であるのかどうかを確認するため,表皮に特異的なMyd88ノックアウトマウスを用いた.その結果,表皮への黄色ブドウ球菌の7日間の感染により,表皮に特異的なMyd88ノックアウトマウスにおいても同様に皮膚炎が抑制されることがわかった.感染から7日目に表皮に特異的なMyd88ノックアウトマウスにおいては野生型のマウスと同等の数の黄色ブドウ球菌がみられた.これらの結果から,黄色ブドウ球菌の表皮感染モデルにおいて,とくにケラチノサイトにおけるMyd88を介した応答が皮膚炎の惹起に重要な役割をはたすことが示唆された.
Myd88はTLR,インターロイキン1受容体,インターロイキン18受容体,インターロイキン36受容体を介したさまざまな炎症性シグナルの伝達に必須のアダプタータンパク質である8).TLR2とTLR4のダブルノックアウトマウスおよびインターロイキン18ノックアウトマウスの表皮に黄色ブドウ球菌を感染させたところ,野生型のマウスと同様の重篤な皮膚炎を示し,TLR2およびTLR4,また,インターロイキン18受容体は表皮への黄色ブドウ球菌の感染における皮膚炎の惹起には関与しないことがわかった.古典的に,ケラチノサイトはインターロイキン1αを細胞に蓄積し免疫系に影響をおよぼすことが知られている.そこで,インターロイキン1αおよびインターロイキン1βと結合するインターロイキン1受容体のノックアウトマウスの表皮に黄色ブドウ球菌を感染させたところ,皮膚炎の中等度の抑制がみられた.さらに,ケラチノサイトにおける発現が知られているインターロイキン36のはたらきについて検討するため,抗インターロイキン36受容体中和抗体を投与した野生型のマウスの表皮に黄色ブドウ球菌を感染させたところ,皮膚炎の中等度の抑制がみられた.そこで,インターロイキン1受容体ノックアウトマウスに抗インターロイキン36受容体中和抗体を投与してインターロイキン1およびインターロイキン36を阻害したところ,野生型のマウスと比べ皮膚炎が劇的に抑制された.MyD88ノックアウトマウスと同様に,感染から7日目の黄色ブドウ球菌の数は野生型のマウスと同等であった.これらの結果から,インターロイキン1受容体を介したシグナルおよびインターロイキン36受容体を介したシグナルの両方が表皮への黄色ブドウ球菌の感染における皮膚炎の惹起に重要であることが明らかにされた.
インターロイキン1受容体シグナルが黄色ブドウ球菌の表皮感染マウスモデルにおける皮膚炎に関係することが明らかにされたことから,ケラチノサイトに豊富に発現するインターロイキン1αと,ケラチノサイトより下流のシグナルにおいて重要と考えられるインターロイキン1βのどちらが皮膚炎に寄与するのかを調べた.インターロイキン1βノックアウトマウスにおいては野生型のマウスと同様の皮膚炎が観察されたのに対し,抗インターロイキン1α中和抗体を投与した野生型のマウスにおいては対照となる抗体を投与した野生型のマウスに比べ皮膚炎が有意に抑制された.このことから,インターロイキン1βよりもインターロイキン1αのほうが重要であることが確認された.蛍光免疫染色法によりインターロイキン1αおよびインターロイキン36αの発現について調べたところ,表皮に黄色ブドウ球菌を感染させた野生型のマウスのケラチノサイトにおいてインターロイキン1αおよびインターロイキン36αの発現が促進されたのに対し,Myd88ノックアウトマウスおよび表皮に特異的なMyd88ノックアウトマウスにおいては野生型のマウスと比べこれらの発現が抑制されていた.このことから,黄色ブドウ球菌はケラチノサイトにおいてMyd88を介して自己分泌性にケラチノサイトからのアラーミンであるインターロイキン1αおよびインターロイキン36αの発現を促進することが明らかにされた.
黄色ブドウ球菌の産生する物質がケラチノサイトにおいてインターロイキン1αおよびインターロイキン36αの発現および細胞外への放出を促進するかin vitroにおいて調べるため,野生型のマウスおよびMyd88ノックアウトマウスから得た初代培養ケラチノサイトを黄色ブドウ球菌の培養上清により刺激した.その結果,野生型のマウスに由来する初代培養ケラチノサイトからは細胞障害の機序を介してインターロイキン1αおよびインターロイキン36αが細胞外へと放出されたのに対し,Myd88ノックアウトマウスに由来する初代培養ケラチノサイトからはインターロイキン1αの放出は観察されずインターロイキン36αの放出も抑制された.さらに,インターロイキン1受容体ノックアウトマウスに由来する初代培養ケラチノサイトを黄色ブドウ球菌の培養上清により刺激したところ,インターロイキン36αの放出は軽度に抑制されただけであったが,インターロイキン1αの放出は劇的に抑制された.また,抗IL-36受容体中和抗体により処理した野生型のマウスに由来する初代培養ケラチノサイトからのインターロイキン1αの放出はごく軽度に抑制されたのに対し,インターロイキン36αの放出は劇的に抑制された.これらの結果から,黄色ブドウ球菌に由来する物質がケラチノサイトの細胞障害を介して細胞外にアラーミンを放出し,自己分泌性にケラチノサイトのMyd88シグナルを介してケラチノサイトからのアラーミンであるインターロイキン1αおよびインターロイキン36αの発現を促進することが明らかにされた.
表皮への黄色ブドウ球菌の感染により惹起される皮膚炎において,インターロイキン1あるいはインターロイキン36の下流においてどのようなサイトカインが重要なはたらきをするのかについて調べた.すでに,インターロイキン1受容体シグナルはTh17細胞の分化に重要なサイトカインであることが報告されている.実際,黄色ブドウ球菌の表皮感染マウスモデルの皮膚の病変部から細胞を回収し,CD45陽性CD90陽性の血球系細胞について,インターロイキン17A,インターロイキン17F,インターロイキン22,インターフェロンγ,顆粒球単球コロニー刺激因子を産生する細胞の数をフローサイトメトリーにより解析したところ,野生型マウスの皮膚においてインターロイキン17Aを産生する細胞が劇的に増加しており,インターロイキン17Fあるいはインターロイキン22を産生する細胞も増加したが,そのほかのサイトカインを産生する細胞についてはごく軽度の増加を認めるのみであった.一方で,Myd88ノックアウトマウスにおいては野生型のマウスと比べインターロイキン17Aを産生する細胞が有意に減少した.さらに,皮膚炎の生じた皮膚組織におけるインターロイキン17Aの産生をタンパク質レベルにて測定したところ,野生型のマウスと比較して,表皮に特異的なMyd88ノックアウトマウス,インターロイキン1受容体ノックアウトマウス,抗インターロイキン36受容体中和抗体を投与したインターロイキン1受容体ノックアウトマウスにおいて有意に減少した.また,野生型のマウスと比較して,インターロイキン1受容体ノックアウトマウス,抗インターロイキン36受容体中和抗体を投与したインターロイキン1受容体ノックアウトマウスにおいて,インターロイキン17Fも減少した.インターロイキン17Aあるいはインターロイキン17Fが黄色ブドウ球菌の表皮感染マウスモデルにおいて重要であるかどうか調べるため,インターロイキン17Aとインターロイキン17Fのダブルノックアウトノックアウトマウスと野生型のマウスを比較したところ,インターロイキン17Aとインターロイキン17Fのダブルノックアウトノックアウトマウスにおいては皮膚炎および組織への好中球の浸潤が有意に抑制されていた.これらの結果から,表皮に感染した黄色ブドウ球菌はおもにケラチノサイトのMyd88シグナルを介してインターロイキン1およびインターロイキン36の発現を促進し,その下流においてインターロイキン17の産生を増加させて皮膚炎を惹起する可能性が考えられた.
黄色ブドウ球菌の表皮感染マウスモデルにおいてインターロイキン17を産生する細胞について調べた.皮膚炎の生じた皮膚組織をフローサイトメトリーにより解析したところ,γδT細胞および3型自然リンパ球がインターロイキン17Aを産生することがわかった.γδT細胞の皮膚炎への寄与がどれくらいであるかを調べるため,黄色ブドウ球菌の表皮感染マウスモデルにおいて野生型のマウスとγδT細胞ノックアウトマウスとを比較したところ,γδTノックアウト欠損マウスは野生型のマウスと同等の皮膚炎を呈した.しかし,γδT細胞ノックアウトマウスにおいて3型自然リンパ球を欠損させたところ,野生型のマウスに比べ有意に皮膚炎が抑制された.以上の結果から,γδT細胞および3型自然リンパ球から産生されるインターロイキン17が黄色ブドウ球菌の表皮感染マウスモデルにおいて重要な役割をはたすことがわかった.
黄色ブドウ球菌の表皮感染マウスモデルにおいて皮膚炎を惹起する病原因子を同定するため,黄色ブドウ球菌の種々の遺伝子欠損株の培養上清により初代培養ケラチノサイトを刺激し,インターロイキン1αおよびインターロイキン36αの放出を測定した.その結果,PSMαの欠損株の培養上清により刺激した場合にはインターロイキン1αおよびインターロイキン36αの放出がみられなかったのに対し,野生株やPSMβの欠損株の培養上清による刺激によりインターロイキン1αおよびインターロイキン36αの放出がみられた.さらに,この現象はケラチノサイトの細胞傷害を介することが確認された.PSMαがin vivoにおいて重要なはたらきをするかどうかを確認するため,野生型のマウスの表皮に黄色ブドウ球菌の野生型株あるいはPSMαの欠損株を感染させたところ,PSMα欠損株の感染により皮膚炎が劇的に抑制された.以上の結果から,黄色ブドウ球菌に由来するPSMαは皮膚炎の惹起において重要な病的因子であることがわかった.
この研究において,皮膚に定着した黄色ブドウ球菌が産生するPSMαが,ケラチノサイトからの細胞傷害を介したアラーミンとしてのインターロイキン1およびインターロイキン36の放出により,インターロイキン17に依存性の皮膚炎を惹起することが示された(図1).とくに,乳児期のアトピー性皮膚炎の病態においてはインターロイキン17の関与がいわれているが9),これは同じPSMファミリーのひとつであるδ毒素が肥満細胞の脱顆粒をひき起こしアレルギー型の皮膚炎を惹起することとあわせて4),黄色ブドウ球菌の皮膚への定着がアトピー性皮膚炎の発症の原因となる可能性を示唆した.ほかの研究グループからも,黄色ブドウ球菌の定着がさまざまな機序により皮膚炎を惹起することが報告されており,皮膚への黄色ブドウ球菌の定着がアトピー性皮膚炎の原因のひとつである可能性を示唆する報告が増えてきている10).黄色ブドウ球菌の皮膚への定着とアトピー性皮膚炎との関連についてはいまだ不明な部分もあるが,さらなる機序の解明および臨床的なデータの蓄積がアトピー性皮膚炎の理解,そして,新規の治療法および予防法の開発につながると考えられる.
略歴:千葉大学大学院医学研究院 在学中.
研究テーマ:黄色ブドウ球菌とアトピー性皮膚炎の関係.
抱負:これから頑張ります!
松岡 (中村) 悠美(Yuumi Nakamura)
千葉大学大学院医学研究院 助教.
© 2017 中川誠太郎・松岡 (中村) 悠美 Licensed under CC 表示 2.1 日本
(千葉大学大学院医学研究院 皮膚科学)
email:松岡 (中村) 悠美
DOI: 10.7875/first.author.2017.134
Staphylococcus aureus virulent PSMα peptides induce keratinocyte alarmin release to orchestrate IL-17-dependent skin inflammation.
Seitaro Nakagawa, Masanori Matsumoto, Yuki Katayama, Rena Oguma, Seiichiro Wakabayashi, Tyler Nygaard, Shinobu Saijo, Naohiro Inohara, Michael Otto, Hiroyuki Matsue, Gabriel Núñez, Yuumi Nakamura
Cell Host & Microbe, 22, 667-677.e5 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
PSMα, インターロイキン17, IL-17, δ毒素(P0C1V1), インターロイキン1α(P01582), インターロイキン36, インターロイキン1, Myd88(P22366), インターロイキン36受容体(Q9ERS7), インターロイキン1受容体, インターロイキン17A(Q62386), インターロイキン17F(Q7TNI7), インターロイキン36α(Q9JLA2), Agr, PSM, PSMγ(P0C1V1), Toll様受容体, Toll-like receptor, TLR, インターロイキン18受容体(Q61098), TLR2(Q9QUN7), TLR4(Q9QUK6), インターロイキン18(Q8C257), インターロイキン1β(P10749), MyD88(P22366), IL-36受容体(Q9ERS7), サイトカイン, CD45(P06800), CD90(P01831), インターロイキン22(Q9JJY9), インターフェロンγ(P01580), PSMβ
要 約
黄色ブドウ球菌は健常人の皮膚にはほとんど定着していない一方,アトピー性皮膚炎の患者の90%以上においては皮膚の病変部に定着が認められる.しかし,黄色ブドウ球菌の皮膚への定着がアトピー性皮膚炎にどのように関与するのかについては不明な点が多い.これまで,筆者らの研究グループは,黄色ブドウ球菌の表皮感染マウスモデルを用いて,黄色ブドウ球菌の産生するδ毒素が真皮に存在する肥満細胞の脱顆粒を介してアレルギー型の皮膚炎を惹起することを報告している.この研究においては,黄色ブドウ球菌の産生するPSMαという外分泌毒素が表皮のケラチノサイトからのインターロイキン1αおよびインターロイキン36の細胞傷害による分泌を介して皮膚炎を惹起することをつきとめた.インターロイキン1の下流のアダプタータンパク質であるMyd88のノックアウトマウス,ケラチノサイトに特異的なMyd88ノックアウトマウス,抗インターロイキン36受容体抗体を投与したインターロイキン1受容体ノックアウトマウスにおいては,野生型のマウスと比べ皮膚炎が抑制され,皮膚組織におけるインターロイキン17の減少および好中球の組織への浸潤の抑制が確認された.さらに,インターロイキン17Aとインターロイキン17Fのダブルノックアウトマウスにおいても皮膚炎は有意に抑制された.以上の結果から,皮膚の表面の黄色ブドウ球菌が産生するPSMαが,ケラチノサイトからのアラーミンとしてインターロイキン1αおよびインターロイキン36αの放出をひき起こし,ケラチノサイトにおけるMyd88を介したシグナルを介してインターロイキン17に依存性の皮膚炎を惹起することが示された.
はじめに
皮膚はからだの内と外とをへだてる人体において最大の臓器であり,細菌の侵入や外部の有害な環境因子から宿主をまもるための物理的なバリアとして重要な役割を担う1).黄色ブドウ球菌(Staphylococcus aureus)は健常人の皮膚にはほとんど定着していない一方,アトピー性皮膚炎の患者の90%以上においては皮膚の病変部に定着が認められる2).しかし,皮膚の表面に定着した黄色ブドウ球菌がどのような機序によりアトピー性皮膚炎に関与するのかについては不明な点が多い.黄色ブドウ球菌が環境に定着するのに重要なはたらきをする病原因子の一部は,周囲の細菌の密度を感知して発現するAgr遺伝子により発現が制御されている3).Agr遺伝子により発現が制御される毒素のひとつとしてPSMが知られている.これまで,筆者らの研究グループは,黄色ブドウ球菌の表皮感染マウスモデルを用いて,PSMファミリーのひとつであるδ毒素(別名,PSMγ)が真皮に存在する肥満細胞の脱顆粒を介してアレルギー型の皮膚炎を惹起することを報告している4).また,PSMαはケラチノサイトを含む多くの細胞に対し高い細胞傷害性を示すことが知られているが4,5),PSMαがケラチノサイトに作用して皮膚炎を惹起する機序については報告されていなかった.
ケラチノサイトは細胞が傷害された際に細胞外に放出され宿主に炎症を起こすアラーミンとよばれる物質を発現する6).皮下に直接に菌体を打ち込む黄色ブドウ球菌の皮下感染マウスモデルにおいては,インターロイキン1受容体ファミリーおよびToll様受容体(Toll-like receptor:TLR)と共役してはたらくMyd88のノックアウトマウスは野生型のマウスに比べ大きな潰瘍および膿瘍を形成し,Myd88が皮下への黄色ブドウ球菌の感染に対する防御において重要な役割をはたすことが報告されている7).しかし,皮膚の表面からの黄色ブドウ球菌の感染において,ケラチノサイトあるいはMyd88を介したシグナルがどのようなはたらきをするのかについては明らかにされていなかった.
1.ケラチノサイトのMyd88は表皮への黄色ブドウ球菌の感染における皮膚炎の惹起において重要である
先行研究により確立された黄色ブドウ球菌の表皮感染マウスモデルを用いて4),ケラチノサイトにおけるMyd88の重要性について検討した.表皮への黄色ブドウ球菌の感染から7日目に,野生型のマウスは好中球の浸潤や表皮の肥厚をともなう重篤な皮膚炎を起こす.一方,Myd88ノックアウトマウスにおいて皮膚炎はほとんど生じず,皮膚の表面に感染した黄色ブドウ球菌の数は維持されたものの野生型のマウスと比べ減少した.この結果は,ケラチノサイトを介さない黄色ブドウ球菌の皮下感染マウスモデルにおいてMyd88ノックアウトマウスが野生型のマウスに比べ重篤な皮膚の潰瘍および膿瘍の形成を呈し,感染の部位により多くの黄色ブドウ球菌のみられる,という結果と相反した.この違いが表皮のケラチノサイトを介した現象であるのかどうかを確認するため,表皮に特異的なMyd88ノックアウトマウスを用いた.その結果,表皮への黄色ブドウ球菌の7日間の感染により,表皮に特異的なMyd88ノックアウトマウスにおいても同様に皮膚炎が抑制されることがわかった.感染から7日目に表皮に特異的なMyd88ノックアウトマウスにおいては野生型のマウスと同等の数の黄色ブドウ球菌がみられた.これらの結果から,黄色ブドウ球菌の表皮感染モデルにおいて,とくにケラチノサイトにおけるMyd88を介した応答が皮膚炎の惹起に重要な役割をはたすことが示唆された.
2.インターロイキン1受容体シグナルおよびインターロイキン36受容体シグナルが表皮への黄色ブドウ球菌の感染における皮膚炎の惹起において重要である
Myd88はTLR,インターロイキン1受容体,インターロイキン18受容体,インターロイキン36受容体を介したさまざまな炎症性シグナルの伝達に必須のアダプタータンパク質である8).TLR2とTLR4のダブルノックアウトマウスおよびインターロイキン18ノックアウトマウスの表皮に黄色ブドウ球菌を感染させたところ,野生型のマウスと同様の重篤な皮膚炎を示し,TLR2およびTLR4,また,インターロイキン18受容体は表皮への黄色ブドウ球菌の感染における皮膚炎の惹起には関与しないことがわかった.古典的に,ケラチノサイトはインターロイキン1αを細胞に蓄積し免疫系に影響をおよぼすことが知られている.そこで,インターロイキン1αおよびインターロイキン1βと結合するインターロイキン1受容体のノックアウトマウスの表皮に黄色ブドウ球菌を感染させたところ,皮膚炎の中等度の抑制がみられた.さらに,ケラチノサイトにおける発現が知られているインターロイキン36のはたらきについて検討するため,抗インターロイキン36受容体中和抗体を投与した野生型のマウスの表皮に黄色ブドウ球菌を感染させたところ,皮膚炎の中等度の抑制がみられた.そこで,インターロイキン1受容体ノックアウトマウスに抗インターロイキン36受容体中和抗体を投与してインターロイキン1およびインターロイキン36を阻害したところ,野生型のマウスと比べ皮膚炎が劇的に抑制された.MyD88ノックアウトマウスと同様に,感染から7日目の黄色ブドウ球菌の数は野生型のマウスと同等であった.これらの結果から,インターロイキン1受容体を介したシグナルおよびインターロイキン36受容体を介したシグナルの両方が表皮への黄色ブドウ球菌の感染における皮膚炎の惹起に重要であることが明らかにされた.
3.黄色ブドウ球菌はケラチノサイトにおいてMyd88を介してインターロイキン1αおよびインターロイキン36αの発現を促進する
インターロイキン1受容体シグナルが黄色ブドウ球菌の表皮感染マウスモデルにおける皮膚炎に関係することが明らかにされたことから,ケラチノサイトに豊富に発現するインターロイキン1αと,ケラチノサイトより下流のシグナルにおいて重要と考えられるインターロイキン1βのどちらが皮膚炎に寄与するのかを調べた.インターロイキン1βノックアウトマウスにおいては野生型のマウスと同様の皮膚炎が観察されたのに対し,抗インターロイキン1α中和抗体を投与した野生型のマウスにおいては対照となる抗体を投与した野生型のマウスに比べ皮膚炎が有意に抑制された.このことから,インターロイキン1βよりもインターロイキン1αのほうが重要であることが確認された.蛍光免疫染色法によりインターロイキン1αおよびインターロイキン36αの発現について調べたところ,表皮に黄色ブドウ球菌を感染させた野生型のマウスのケラチノサイトにおいてインターロイキン1αおよびインターロイキン36αの発現が促進されたのに対し,Myd88ノックアウトマウスおよび表皮に特異的なMyd88ノックアウトマウスにおいては野生型のマウスと比べこれらの発現が抑制されていた.このことから,黄色ブドウ球菌はケラチノサイトにおいてMyd88を介して自己分泌性にケラチノサイトからのアラーミンであるインターロイキン1αおよびインターロイキン36αの発現を促進することが明らかにされた.
黄色ブドウ球菌の産生する物質がケラチノサイトにおいてインターロイキン1αおよびインターロイキン36αの発現および細胞外への放出を促進するかin vitroにおいて調べるため,野生型のマウスおよびMyd88ノックアウトマウスから得た初代培養ケラチノサイトを黄色ブドウ球菌の培養上清により刺激した.その結果,野生型のマウスに由来する初代培養ケラチノサイトからは細胞障害の機序を介してインターロイキン1αおよびインターロイキン36αが細胞外へと放出されたのに対し,Myd88ノックアウトマウスに由来する初代培養ケラチノサイトからはインターロイキン1αの放出は観察されずインターロイキン36αの放出も抑制された.さらに,インターロイキン1受容体ノックアウトマウスに由来する初代培養ケラチノサイトを黄色ブドウ球菌の培養上清により刺激したところ,インターロイキン36αの放出は軽度に抑制されただけであったが,インターロイキン1αの放出は劇的に抑制された.また,抗IL-36受容体中和抗体により処理した野生型のマウスに由来する初代培養ケラチノサイトからのインターロイキン1αの放出はごく軽度に抑制されたのに対し,インターロイキン36αの放出は劇的に抑制された.これらの結果から,黄色ブドウ球菌に由来する物質がケラチノサイトの細胞障害を介して細胞外にアラーミンを放出し,自己分泌性にケラチノサイトのMyd88シグナルを介してケラチノサイトからのアラーミンであるインターロイキン1αおよびインターロイキン36αの発現を促進することが明らかにされた.
4.インターロイキン17は表皮への黄色ブドウ球菌の感染により惹起される皮膚炎において重要である
表皮への黄色ブドウ球菌の感染により惹起される皮膚炎において,インターロイキン1あるいはインターロイキン36の下流においてどのようなサイトカインが重要なはたらきをするのかについて調べた.すでに,インターロイキン1受容体シグナルはTh17細胞の分化に重要なサイトカインであることが報告されている.実際,黄色ブドウ球菌の表皮感染マウスモデルの皮膚の病変部から細胞を回収し,CD45陽性CD90陽性の血球系細胞について,インターロイキン17A,インターロイキン17F,インターロイキン22,インターフェロンγ,顆粒球単球コロニー刺激因子を産生する細胞の数をフローサイトメトリーにより解析したところ,野生型マウスの皮膚においてインターロイキン17Aを産生する細胞が劇的に増加しており,インターロイキン17Fあるいはインターロイキン22を産生する細胞も増加したが,そのほかのサイトカインを産生する細胞についてはごく軽度の増加を認めるのみであった.一方で,Myd88ノックアウトマウスにおいては野生型のマウスと比べインターロイキン17Aを産生する細胞が有意に減少した.さらに,皮膚炎の生じた皮膚組織におけるインターロイキン17Aの産生をタンパク質レベルにて測定したところ,野生型のマウスと比較して,表皮に特異的なMyd88ノックアウトマウス,インターロイキン1受容体ノックアウトマウス,抗インターロイキン36受容体中和抗体を投与したインターロイキン1受容体ノックアウトマウスにおいて有意に減少した.また,野生型のマウスと比較して,インターロイキン1受容体ノックアウトマウス,抗インターロイキン36受容体中和抗体を投与したインターロイキン1受容体ノックアウトマウスにおいて,インターロイキン17Fも減少した.インターロイキン17Aあるいはインターロイキン17Fが黄色ブドウ球菌の表皮感染マウスモデルにおいて重要であるかどうか調べるため,インターロイキン17Aとインターロイキン17Fのダブルノックアウトノックアウトマウスと野生型のマウスを比較したところ,インターロイキン17Aとインターロイキン17Fのダブルノックアウトノックアウトマウスにおいては皮膚炎および組織への好中球の浸潤が有意に抑制されていた.これらの結果から,表皮に感染した黄色ブドウ球菌はおもにケラチノサイトのMyd88シグナルを介してインターロイキン1およびインターロイキン36の発現を促進し,その下流においてインターロイキン17の産生を増加させて皮膚炎を惹起する可能性が考えられた.
5.黄色ブドウ球菌の表皮感染マウスモデルにおいてγδT細胞および3型自然リンパ球がインターロイキン17を産生する
黄色ブドウ球菌の表皮感染マウスモデルにおいてインターロイキン17を産生する細胞について調べた.皮膚炎の生じた皮膚組織をフローサイトメトリーにより解析したところ,γδT細胞および3型自然リンパ球がインターロイキン17Aを産生することがわかった.γδT細胞の皮膚炎への寄与がどれくらいであるかを調べるため,黄色ブドウ球菌の表皮感染マウスモデルにおいて野生型のマウスとγδT細胞ノックアウトマウスとを比較したところ,γδTノックアウト欠損マウスは野生型のマウスと同等の皮膚炎を呈した.しかし,γδT細胞ノックアウトマウスにおいて3型自然リンパ球を欠損させたところ,野生型のマウスに比べ有意に皮膚炎が抑制された.以上の結果から,γδT細胞および3型自然リンパ球から産生されるインターロイキン17が黄色ブドウ球菌の表皮感染マウスモデルにおいて重要な役割をはたすことがわかった.
6.黄色ブドウ球菌に由来するPSMαがケラチノサイトからのインターロイキン1αおよびインターロイキン36αの放出を介し皮膚炎を惹起する
黄色ブドウ球菌の表皮感染マウスモデルにおいて皮膚炎を惹起する病原因子を同定するため,黄色ブドウ球菌の種々の遺伝子欠損株の培養上清により初代培養ケラチノサイトを刺激し,インターロイキン1αおよびインターロイキン36αの放出を測定した.その結果,PSMαの欠損株の培養上清により刺激した場合にはインターロイキン1αおよびインターロイキン36αの放出がみられなかったのに対し,野生株やPSMβの欠損株の培養上清による刺激によりインターロイキン1αおよびインターロイキン36αの放出がみられた.さらに,この現象はケラチノサイトの細胞傷害を介することが確認された.PSMαがin vivoにおいて重要なはたらきをするかどうかを確認するため,野生型のマウスの表皮に黄色ブドウ球菌の野生型株あるいはPSMαの欠損株を感染させたところ,PSMα欠損株の感染により皮膚炎が劇的に抑制された.以上の結果から,黄色ブドウ球菌に由来するPSMαは皮膚炎の惹起において重要な病的因子であることがわかった.
おわりに
この研究において,皮膚に定着した黄色ブドウ球菌が産生するPSMαが,ケラチノサイトからの細胞傷害を介したアラーミンとしてのインターロイキン1およびインターロイキン36の放出により,インターロイキン17に依存性の皮膚炎を惹起することが示された(図1).とくに,乳児期のアトピー性皮膚炎の病態においてはインターロイキン17の関与がいわれているが9),これは同じPSMファミリーのひとつであるδ毒素が肥満細胞の脱顆粒をひき起こしアレルギー型の皮膚炎を惹起することとあわせて4),黄色ブドウ球菌の皮膚への定着がアトピー性皮膚炎の発症の原因となる可能性を示唆した.ほかの研究グループからも,黄色ブドウ球菌の定着がさまざまな機序により皮膚炎を惹起することが報告されており,皮膚への黄色ブドウ球菌の定着がアトピー性皮膚炎の原因のひとつである可能性を示唆する報告が増えてきている10).黄色ブドウ球菌の皮膚への定着とアトピー性皮膚炎との関連についてはいまだ不明な部分もあるが,さらなる機序の解明および臨床的なデータの蓄積がアトピー性皮膚炎の理解,そして,新規の治療法および予防法の開発につながると考えられる.
文 献
- Segre, J. A.: Epidermal barrier formation and recovery in skin disorders. J. Clin. Invest., 116, 1150-1158 (2006)[PubMed]
- Rudikoff, D. & Lebwohl, M.: Atopic dermatitis. Lancet, 351, 1715-1721 (1998)[PubMed]
- Novick, R. P.: Autoinduction and signal transduction in the regulation of staphylococcal virulence. Mol. Microbiol., 48, 1429-1449 (2003)[PubMed]
- Nakamura, Y., Oscherwitz, J., Cease, K. B. et al.: Staphylococcus δ-toxin induces allergic skin disease by activating mast cells. Nature, 503, 397-401 (2013)[PubMed]
- Wang, R., Braughton, K. R., Kretschmer, D. et al.: Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA. Nat. Med., 13, 1510-1514 (2007)[PubMed]
- Nestle, F. O., Di Meglio, P., Qin, J. Z. et al.: Skin immune sentinels in health and disease. Nat. Rev. Immunol., 9, 679-691 (2009)[PubMed]
- Miller, L. S., O'Connell, R. .M, Gutierrez, M. A. et al.: MyD88 mediates neutrophil recruitment initiated by IL-1R but not TLR2 activation in immunity against Staphylococcus aureus. Immunity, 24, 79-91 (2006)[PubMed]
- Takeuchi, O. & Akira, S.: MyD88 as a bottle neck in Toll/IL-1 signaling. Curr. Top. Microbiol. Immunol., 270, 155-167 (2002)[PubMed]
- Esaki, H., Brunner, P. M., Renert-Yuval, Y. et al.: Early-onset pediatric atopic dermatitis is TH2 but also TH17 polarized in skin. J. Allergy Clin. Immunol., 138, 1639-1651 (2016)[PubMed]
- Williams, M. R., Nakatsuji, T. & Gallo, R. L.: Staphylococcus aureus: master manipulator of the skin. Cell Host Microbe, 22, 579-581 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:千葉大学大学院医学研究院 在学中.
研究テーマ:黄色ブドウ球菌とアトピー性皮膚炎の関係.
抱負:これから頑張ります!
松岡 (中村) 悠美(Yuumi Nakamura)
千葉大学大学院医学研究院 助教.
© 2017 中川誠太郎・松岡 (中村) 悠美 Licensed under CC 表示 2.1 日本