細胞外マトリックスに親和性の高い免疫チェックポイント阻害抗体は抗腫瘍効果が高く副作用が少ない
石原 純・石原亜香・Jeffrey A. Hubbell
(米国Chicago大学Institute for Molecular Engineering)
email:石原 純
DOI: 10.7875/first.author.2017.133
Matrix-binding checkpoint immunotherapies enhance antitumor efficacy and reduce adverse events.
Jun Ishihara, Kazuto Fukunaga, Ako Ishihara, Hans M. Larsson, Lambert Potin, Peyman Hosseinchi, Gabriele Galliverti, Melody A. Swartz, Jeffrey A. Hubbell
Science Translational Medicine, 9, eaan0401 (2017)
がんの治療において免疫チェックポイント阻害抗体は高い抗腫瘍効果を示しているが,一方で,副作用も多く報告されている.この研究において,筆者らは,全身性の副作用を下げるため,免疫チェックポイント阻害抗体に細胞外マトリックスに高い親和性をもつペプチドを修飾することにより腫瘍の周囲に滞留するよう改良した.この免疫チェックポイント阻害抗体は血中における濃度の低下や自己免疫疾患である1型糖尿病の発症のリスクなどを含む全身性の副作用の軽減を示した.また,メラノーマあるいは乳がんのモデルマウスに対し通常の免疫チェックポイント阻害抗体よりも高い抗腫瘍効果を示し,腫瘍において活性化したCD8陽性T細胞およびCD4陽性T細胞を増加させることにより遠隔の腫瘍に対しても抗腫瘍効果を示した.以上より,この技術を用いた免疫チェックポイント阻害抗体はより効果的で安全性が高いと考えられた.
免疫チェックポイント機構は免疫細胞の過剰な攻撃から宿主組織をまもるための免疫系のブレーキである1).近年,がんは免疫系からのがれるため免疫チェックポイント機構を利用することが明らかにされている.そのため,免疫チェックポイント機構の阻害はがんの治療における有望なアプローチとされている.その代表的な薬剤として,抗CTLA4抗体および抗PD-1抗体と抗PD-L1抗体がある.その併用療法は臨床試験において高い抗腫瘍効果を示したが2),患者の68.7%が副作用を示し,その36.4%は副作用のため治療をつづけることができなかった.
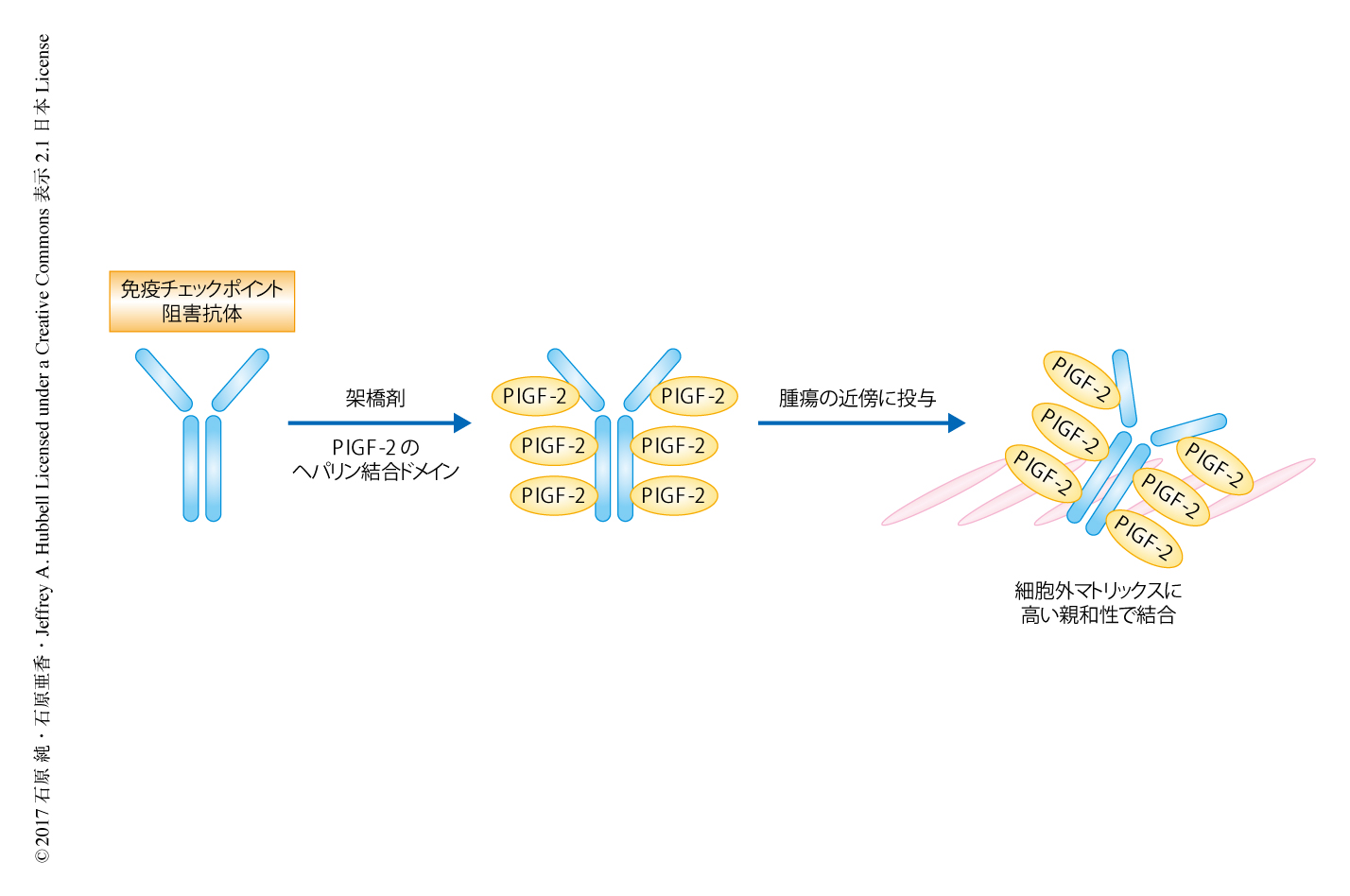
いくつかの成長因子に存在するヘパリン結合ドメインは,種々の細胞外マトリックスタンパク質に由来するヘパリン結合ドメインと直接的に結合する3-6).筆者らの研究室において,さまざまな細胞外マトリックスタンパク質に対する成長因子の結合のスクリーニングにより,PlGF-2のもつヘパリン結合ドメインが複数の細胞外マトリックスタンパク質に対し非常に高い親和性をもつことが見い出された3).そこで,筆者らは,このPlGF-2のヘパリン結合ドメインを免疫チェックポイント阻害抗体に結合させることにより,腫瘍の近傍に免疫チェックポイント阻害抗体が保持されるよう設計した.免疫チェックポイント阻害抗体の全身への曝露が低下することにより副作用が減少し,抗腫瘍効果が上昇すると考えた(図1).
in vitroにおいてPlGF-2のヘパリン結合ドメインにより修飾した抗体について調べた.免疫グロブリンGをスルホスクシンイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレートと混合したのち,PlGF-2のヘパリン結合ドメインと共有結合的に架橋させたところ,1個の免疫グロブリンGに対し平均して6個のPlGF-2のヘパリン結合ドメインが結合した.PlGF-2のヘパリン結合ドメインにより修飾した抗体は,フィブロネクチン,フィブリノーゲン,ビトロネクチン,オステオポンチン,I型コラーゲン,II型コラーゲン,III型コラーゲン,IV型コラーゲンの8種類の細胞外マトリックスタンパク質と結合した.PlGF-2のヘパリン結合ドメインにより修飾した抗CTLA4抗体あるいは抗PD-L1抗体は,それらの標的となる抗原を認識した.また,PlGF-2のヘパリン結合ドメインにより修飾した抗体は,通常の抗体と比べ,皮膚に注入したのち長時間にわたり皮膚に滞留した.
PlGF-2のヘパリン結合ドメインにより修飾した抗体は細胞外マトリックスに高親和性であるため,局所に投与したのちの血中の濃度は通常の抗体に比べ低いと考えられた.実際に,PlGF-2のヘパリン結合ドメインにより修飾した抗体の血中の濃度は,通常の抗体と比較していちじるしく低かった.また,通常の抗体は血中のサイトカインの濃度および肝臓の損傷を増加させたが,PlGF-2のヘパリン結合ドメインにより修飾した抗体は増加させなかった.抗PD-1抗体および抗PD-L1抗体は副作用として自己免疫疾患である1型糖尿病の発症をひき起こすことがマウスおよびヒトにおいて報告されている7,8).オスの非肥満糖尿病モデルマウスを用いて糖尿病の発症について評価したところ,PlGF-2のヘパリン結合ドメインにより修飾した抗PD-L1抗体の投与による糖尿病の発症は8匹のうち0匹であったのに対し,通常の抗PD-L1抗体の投与により8匹すべてにおいて糖尿病が発症した.以上の結果により,PlGF-2のヘパリン結合ドメインによる修飾により免疫チェックポイント阻害抗体の全身性の副作用は低下することが示された.
PlGF-2のヘパリン結合ドメインにより修飾した抗PD-L1抗体および抗CTLA4抗体による併用療法において,メラノーマおよび乳がんのモデルマウスを用いて抗腫瘍効果について検証した.その結果,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の腫瘍の近傍への注入は,すべてのモデルマウスにおいて腫瘍の増殖を抑制し生存期間を延長した.また,乳がんのモデルマウスにおいて,通常の免疫チェックポイント阻害抗体により15匹のうち5匹のマウスが完全に治癒したのに比べ,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体により16匹のうち11匹のマウスが完全に治癒した.以上より,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は通常の免疫チェックポイント阻害抗体に比べ複数のがんにおいて高い抗腫瘍効果をもつことが示された.
PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により,対照と比較して,腫瘍におけるCD8陽性CD3陽性T細胞の数が増加した.エフェクターCD8陽性T細胞の割合が対照と比較して上昇し,CD8陽性T細胞の活性化が示唆された.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与は腫瘍におけるCD4陽性T細胞の数も増加させ,エフェクターCD4陽性T細胞の割合も同様に上昇した.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により,対照と比較して,腫瘍のCD8陽性T細胞におけるサイトカインの産生が亢進した.この結果から,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体ががん抗原を認識し,攻撃しうるT細胞を増加させることが示唆された.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は腫瘍に浸潤性のT細胞を効果的に活性化し高い抗腫瘍効果をもたらしたと考えられた.
PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により腫瘍においてT細胞の活性化が観察されたことから,がん抗原を認識するT細胞が効果的に活性化されることが考えられた.活性化されたT細胞は血流などにのり全身をめぐり同種の腫瘍を攻撃することが考えられた.そこで,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の局所への投与により遠隔の腫瘍において抗腫瘍効果が示されるかどうかを調べた.メラノーマ細胞をマウスの左背側部および右背側部に接種し,左背側にのみ免疫チェックポイント阻害抗体を投与した.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は両方の腫瘍の増殖を遅らせたが,通常の免疫チェックポイント阻害抗体はいずれの腫瘍に対してもほとんど効果がみられなかった.この結果より,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の局所への投与は全身性の抗腫瘍効果をもたらすことがわかった.
抗PD-1抗体の投与により1型糖尿病を発症する例は臨床においても報告されており,PlGF-2のヘパリン結合ドメインによる修飾がそのリスクを低下させることは重要な結果である.また,臨床において用いられる量の25%の投与でも抗腫瘍効果が観察されたことから,投与量を減らすことも可能かもしれない.これらの結果は,副作用の問題により全身への投与が適用できない患者や副作用により治療を断念した患者において有望な結果である.
免疫チェックポイント阻害抗体の局所への投与は,多くのモデルマウスにおいて少ない投与量でも高い抗腫瘍効果を示しており,この結果をもとに,メラノーマ,リンパ腫,大腸がんに対し臨床治験もなされている.局所への投与と徐放との組合せはバイオマテリアルキャリアを用いたものが報告されているが,筆者らは,分子工学的な手法を用いて抗体それ自体に滞留性をもたせた.このことは,ひとつのバイアルでの製造を可能にし,実際に使う際の簡便性が高まると考えられる.
PlGF-2のヘパリン結合ドメインによる修飾の利点は簡単な合成法にある.また,PlGF-2のヘパリン結合ドメインは化学的に大量に合成することが可能なことも利点である.同じ化学反応を用いた薬剤がすでに米国食品医薬品局により承認されていることも,この技術の臨床応用へのハードルを下げると期待される.
今回,筆者らは,PlGF-2のヘパリン結合ドメインによる修飾により,現在,臨床において用いられている免疫チェックポイント阻害抗体の抗腫瘍効果が上昇し副作用が低下することを確認した.このようなドラッグデリバリー技術の開発が,臨床においてがん免疫療法により得られるメリットをさらに高めることを期待する.
略歴:2014年 東京大学大学院医学系研究科博士課程 修了,同年 スイスFederal Institute of Technology Lausanneポスドクを経て,2016年より米国Chicago大学ポスドク.
研究テーマ:がん免疫療法および再生医療におけるドラッグデリバリー法の開発.
石原 亜香(Ako Ishihara)
米国Chicago大学ポスドク.
Jeffrey A. Hubbell
米国Chicago大学Professor.
研究室URL:https://ime.uchicago.edu/hubbell_lab/
© 2017 石原 純・石原亜香・Jeffrey A. Hubbell Licensed under CC 表示 2.1 日本
(米国Chicago大学Institute for Molecular Engineering)
email:石原 純
DOI: 10.7875/first.author.2017.133
Matrix-binding checkpoint immunotherapies enhance antitumor efficacy and reduce adverse events.
Jun Ishihara, Kazuto Fukunaga, Ako Ishihara, Hans M. Larsson, Lambert Potin, Peyman Hosseinchi, Gabriele Galliverti, Melody A. Swartz, Jeffrey A. Hubbell
Science Translational Medicine, 9, eaan0401 (2017)
要 約
がんの治療において免疫チェックポイント阻害抗体は高い抗腫瘍効果を示しているが,一方で,副作用も多く報告されている.この研究において,筆者らは,全身性の副作用を下げるため,免疫チェックポイント阻害抗体に細胞外マトリックスに高い親和性をもつペプチドを修飾することにより腫瘍の周囲に滞留するよう改良した.この免疫チェックポイント阻害抗体は血中における濃度の低下や自己免疫疾患である1型糖尿病の発症のリスクなどを含む全身性の副作用の軽減を示した.また,メラノーマあるいは乳がんのモデルマウスに対し通常の免疫チェックポイント阻害抗体よりも高い抗腫瘍効果を示し,腫瘍において活性化したCD8陽性T細胞およびCD4陽性T細胞を増加させることにより遠隔の腫瘍に対しても抗腫瘍効果を示した.以上より,この技術を用いた免疫チェックポイント阻害抗体はより効果的で安全性が高いと考えられた.
はじめに
免疫チェックポイント機構は免疫細胞の過剰な攻撃から宿主組織をまもるための免疫系のブレーキである1).近年,がんは免疫系からのがれるため免疫チェックポイント機構を利用することが明らかにされている.そのため,免疫チェックポイント機構の阻害はがんの治療における有望なアプローチとされている.その代表的な薬剤として,抗CTLA4抗体および抗PD-1抗体と抗PD-L1抗体がある.その併用療法は臨床試験において高い抗腫瘍効果を示したが2),患者の68.7%が副作用を示し,その36.4%は副作用のため治療をつづけることができなかった.
いくつかの成長因子に存在するヘパリン結合ドメインは,種々の細胞外マトリックスタンパク質に由来するヘパリン結合ドメインと直接的に結合する3-6).筆者らの研究室において,さまざまな細胞外マトリックスタンパク質に対する成長因子の結合のスクリーニングにより,PlGF-2のもつヘパリン結合ドメインが複数の細胞外マトリックスタンパク質に対し非常に高い親和性をもつことが見い出された3).そこで,筆者らは,このPlGF-2のヘパリン結合ドメインを免疫チェックポイント阻害抗体に結合させることにより,腫瘍の近傍に免疫チェックポイント阻害抗体が保持されるよう設計した.免疫チェックポイント阻害抗体の全身への曝露が低下することにより副作用が減少し,抗腫瘍効果が上昇すると考えた(図1).
1.PlGF-2のヘパリン結合ドメインによる修飾は抗体の局所への滞留性を上昇させる
in vitroにおいてPlGF-2のヘパリン結合ドメインにより修飾した抗体について調べた.免疫グロブリンGをスルホスクシンイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレートと混合したのち,PlGF-2のヘパリン結合ドメインと共有結合的に架橋させたところ,1個の免疫グロブリンGに対し平均して6個のPlGF-2のヘパリン結合ドメインが結合した.PlGF-2のヘパリン結合ドメインにより修飾した抗体は,フィブロネクチン,フィブリノーゲン,ビトロネクチン,オステオポンチン,I型コラーゲン,II型コラーゲン,III型コラーゲン,IV型コラーゲンの8種類の細胞外マトリックスタンパク質と結合した.PlGF-2のヘパリン結合ドメインにより修飾した抗CTLA4抗体あるいは抗PD-L1抗体は,それらの標的となる抗原を認識した.また,PlGF-2のヘパリン結合ドメインにより修飾した抗体は,通常の抗体と比べ,皮膚に注入したのち長時間にわたり皮膚に滞留した.
2.PlGF-2のヘパリン結合ドメインによる修飾は免疫チェックポイント阻害抗体の全身への副作用を減少させる
PlGF-2のヘパリン結合ドメインにより修飾した抗体は細胞外マトリックスに高親和性であるため,局所に投与したのちの血中の濃度は通常の抗体に比べ低いと考えられた.実際に,PlGF-2のヘパリン結合ドメインにより修飾した抗体の血中の濃度は,通常の抗体と比較していちじるしく低かった.また,通常の抗体は血中のサイトカインの濃度および肝臓の損傷を増加させたが,PlGF-2のヘパリン結合ドメインにより修飾した抗体は増加させなかった.抗PD-1抗体および抗PD-L1抗体は副作用として自己免疫疾患である1型糖尿病の発症をひき起こすことがマウスおよびヒトにおいて報告されている7,8).オスの非肥満糖尿病モデルマウスを用いて糖尿病の発症について評価したところ,PlGF-2のヘパリン結合ドメインにより修飾した抗PD-L1抗体の投与による糖尿病の発症は8匹のうち0匹であったのに対し,通常の抗PD-L1抗体の投与により8匹すべてにおいて糖尿病が発症した.以上の結果により,PlGF-2のヘパリン結合ドメインによる修飾により免疫チェックポイント阻害抗体の全身性の副作用は低下することが示された.
3.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は高い抗腫瘍効果をもつ
PlGF-2のヘパリン結合ドメインにより修飾した抗PD-L1抗体および抗CTLA4抗体による併用療法において,メラノーマおよび乳がんのモデルマウスを用いて抗腫瘍効果について検証した.その結果,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の腫瘍の近傍への注入は,すべてのモデルマウスにおいて腫瘍の増殖を抑制し生存期間を延長した.また,乳がんのモデルマウスにおいて,通常の免疫チェックポイント阻害抗体により15匹のうち5匹のマウスが完全に治癒したのに比べ,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体により16匹のうち11匹のマウスが完全に治癒した.以上より,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は通常の免疫チェックポイント阻害抗体に比べ複数のがんにおいて高い抗腫瘍効果をもつことが示された.
4.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は腫瘍において活性化したT細胞の数を増加させる
PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により,対照と比較して,腫瘍におけるCD8陽性CD3陽性T細胞の数が増加した.エフェクターCD8陽性T細胞の割合が対照と比較して上昇し,CD8陽性T細胞の活性化が示唆された.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与は腫瘍におけるCD4陽性T細胞の数も増加させ,エフェクターCD4陽性T細胞の割合も同様に上昇した.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により,対照と比較して,腫瘍のCD8陽性T細胞におけるサイトカインの産生が亢進した.この結果から,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体ががん抗原を認識し,攻撃しうるT細胞を増加させることが示唆された.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は腫瘍に浸潤性のT細胞を効果的に活性化し高い抗腫瘍効果をもたらしたと考えられた.
5.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は全身性の抗腫瘍効果をもたらす
PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の投与により腫瘍においてT細胞の活性化が観察されたことから,がん抗原を認識するT細胞が効果的に活性化されることが考えられた.活性化されたT細胞は血流などにのり全身をめぐり同種の腫瘍を攻撃することが考えられた.そこで,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の局所への投与により遠隔の腫瘍において抗腫瘍効果が示されるかどうかを調べた.メラノーマ細胞をマウスの左背側部および右背側部に接種し,左背側にのみ免疫チェックポイント阻害抗体を投与した.PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体は両方の腫瘍の増殖を遅らせたが,通常の免疫チェックポイント阻害抗体はいずれの腫瘍に対してもほとんど効果がみられなかった.この結果より,PlGF-2のヘパリン結合ドメインにより修飾した免疫チェックポイント阻害抗体の局所への投与は全身性の抗腫瘍効果をもたらすことがわかった.
おわりに
抗PD-1抗体の投与により1型糖尿病を発症する例は臨床においても報告されており,PlGF-2のヘパリン結合ドメインによる修飾がそのリスクを低下させることは重要な結果である.また,臨床において用いられる量の25%の投与でも抗腫瘍効果が観察されたことから,投与量を減らすことも可能かもしれない.これらの結果は,副作用の問題により全身への投与が適用できない患者や副作用により治療を断念した患者において有望な結果である.
免疫チェックポイント阻害抗体の局所への投与は,多くのモデルマウスにおいて少ない投与量でも高い抗腫瘍効果を示しており,この結果をもとに,メラノーマ,リンパ腫,大腸がんに対し臨床治験もなされている.局所への投与と徐放との組合せはバイオマテリアルキャリアを用いたものが報告されているが,筆者らは,分子工学的な手法を用いて抗体それ自体に滞留性をもたせた.このことは,ひとつのバイアルでの製造を可能にし,実際に使う際の簡便性が高まると考えられる.
PlGF-2のヘパリン結合ドメインによる修飾の利点は簡単な合成法にある.また,PlGF-2のヘパリン結合ドメインは化学的に大量に合成することが可能なことも利点である.同じ化学反応を用いた薬剤がすでに米国食品医薬品局により承認されていることも,この技術の臨床応用へのハードルを下げると期待される.
今回,筆者らは,PlGF-2のヘパリン結合ドメインによる修飾により,現在,臨床において用いられている免疫チェックポイント阻害抗体の抗腫瘍効果が上昇し副作用が低下することを確認した.このようなドラッグデリバリー技術の開発が,臨床においてがん免疫療法により得られるメリットをさらに高めることを期待する.
文 献
- Allison, J. P.: Immune checkpoint blockade in cancer therapy: the 2015 Lasker-DeBakey Clinical Medical Research Award. JAMA, 314, 1113-1114 (2015)[PubMed]
- Larkin, J., Chiarion-Sileni, V., Gonzalez, R. et al.: Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N. Engl. J. Med., 2015, 23-34 (2015)[PubMed]
- Martino, M. M., Briquez, P. S., Guc, E. et al.: Growth factors engineered for super-affinity to the extracellular matrix enhance tissue healing. Science, 343, 885-888 (2014)[PubMed]
- Martino, M. M., Briquez, P. S., Ranga, A. et al.: Heparin-binding domain of fibrin(ogen) binds growth factors and promotes tissue repair when incorporated within a synthetic matrix. Proc. Natl. Acad. Sci. USA, 110, 4563-4568 (2013)[PubMed]
- Martino, M. M., Tortelli, F., Mochizuki. M. et al.: Engineering the growth factor microenvironment with fibronectin domains to promote wound and bone tissue healing. Sci. Transl. Med., 3, 100ra89 (2011)[PubMed]
- Tortelli, F., Pisano, M., Briquez, P. S. et al.: Fibronectin binding modulates CXCL11 activity and facilitates wound healing. PLoS One, 8, e79610 (2013)[PubMed]
- Ansari, M. J. I., Salama, A. D., Chitnis, T. et al.: The programmed death-1 (PD-1) pathway regulates autoimmune diabetes in nonobese diabetic (NOD) mice. J. Exp. Med., 198, 63-69 (2003)[PubMed]
- Miyoshi, Y., Ogawa, O. & Oyama, Y.: Nivolumab, an anti-programmed cell death-1 antibody, induces fulminant type 1 diabetes. Tohoku J. Exp. Med., 239, 155-1558 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院医学系研究科博士課程 修了,同年 スイスFederal Institute of Technology Lausanneポスドクを経て,2016年より米国Chicago大学ポスドク.
研究テーマ:がん免疫療法および再生医療におけるドラッグデリバリー法の開発.
石原 亜香(Ako Ishihara)
米国Chicago大学ポスドク.
Jeffrey A. Hubbell
米国Chicago大学Professor.
研究室URL:https://ime.uchicago.edu/hubbell_lab/
© 2017 石原 純・石原亜香・Jeffrey A. Hubbell Licensed under CC 表示 2.1 日本