活性化型の構造をとるインテグリンβ7は多発性骨髄腫のキメラ抗原受容体発現T細胞療法における新規の標的である
保仙 直毅
(大阪大学大学院医学系研究科 癌幹細胞制御学講座)
email:保仙直毅
DOI: 10.7875/first.author.2017.132
The activated conformation of integrin β7 is a novel multiple myeloma-specific target for CAR T cell therapy.
Naoki Hosen, Yukiko Matsunaga, Kana Hasegawa, Hiroshi Matsuno, Yuki Nakamura, Mio Makita, Kouki Watanabe, Mikako Yoshida, Kei Satoh, Soyoko Morimoto, Fumihiro Fujiki, Hiroko Nakajima, Jun Nakata, Sumiyuki Nishida, Akihiro Tsuboi, Yoshihiro Oka, Masahiro Manabe, Hiroyoshi Ichihara, Yasutaka Aoyama, Atsuko Mugitani, Takafumi Nakao, Masayuki Hino, Ryosuke Uchibori, Keiya Ozawa, Yoshihiro Baba, Seitaro Terakura, Naoki Wada, Eiichi Morii, Junichi Nishimura, Kiyoshi Takeda, Yusuke Oji, Haruo Sugiyama, Junichi Takagi, Atsushi Kumanogoh
Nature Medicine, 23, 1436-1443 (2017)
がんに特異的な表面抗原はモノクローナル抗体療法あるいはキメラ抗原受容体発現T細胞療法のための理想的な標的である.しかしながら,そのような表面抗原はトランスクリプトーム解析およびプロテオーム解析による広範な探索により同定しつくされたと考えられていた.この研究において,活性化型の構造をとるインテグリンが多発性骨髄腫の特異的な治療の標的となることが示された.多発性骨髄腫に対する10,000をこえるモノクローナル抗体のなかから特異的なモノクローナル抗体として同定されたMMG49は,インテグリンβ7を認識することが見い出された.インテグリンβ7は正常なリンパ球の多くに発現するが,MMG49はそれらとは結合しなかった.MMG49の認識するエピトープは,不活性化型の構造をとるインテグリンβ7においてはアクセスできない部位にあると推測され,MMG49は活性化型の構造をとるインテグリンβ7とのみ結合した.さらに,インテグリンβ7は多発性骨髄腫の細胞において高く発現するのみならず恒常的に活性化しているため,MMG49は多発性骨髄腫の細胞と特異的に結合した.MMG49に由来するキメラ抗原受容体発現T細胞は,正常な造血細胞を損傷することなく多発性骨髄腫に対し抗腫瘍効果を発揮した.これらの結果から,MMG49を用いたキメラ抗原受容体発現T細胞療法が多発性骨髄腫に対し有望であることが示されただけでなく,不活性型の構造をとる定常状態の膜タンパク質ががんに対する特異性をもたなくても,その活性化型の構造ががん免疫療法の標的となりうることが示された.
がんに特異的な表面抗原を認識するモノクローナル抗体はがんの治療において非常に有用なツールである.さらに,がんに特異的なモノクローナル抗体に由来するキメラ抗原受容体発現T細胞はがん免疫療法の有力な新しいアプローチである1,2)(保仙 直毅, がんに対するキメラ抗原受容体発現T細胞療法の最前線, 領域融合レビュー, 6, e005, 2017 も参照されたい).しかし,がんに特異的な遺伝子あるいはタンパク質は,これまでに実施されたトランスクリプトーム解析やプロテオーム解析によりすでに同定されつくされたと考えられ,がんに特異的な標的となる新規の抗原を同定することは困難である.しかし,糖鎖修飾や立体構造の変化などにより形成されるがんに特異的なエピトープはみのがされている可能性があり,がんに特異的なモノクローナル抗体を徹底的に探索し,そののち,それらが認識する抗原を同定することにより発見される可能性がある.この研究においては,多発性骨髄腫の治療における新規の標的としてそのような抗原の同定をめざした.多発性骨髄腫は治療の進歩にもかかわらずほとんどの例において再発するため,治療に新たなアプローチが必要とされている.
さまざまな多発性骨髄腫の細胞株と結合するモノクローナル抗体を産生する10,000をこえるハイブリドーマを樹立し,正常な末梢血単核細胞と結合しなかった約500のモノクローナル抗体を候補としてハイブリドーマを選択した.多発性骨髄腫患者の骨髄細胞を染色し,多発性骨髄腫の細胞とは結合するが正常な血液細胞とは結合しないモノクローナル抗体としてMMG49を同定した.51人の多発性骨髄腫の患者のうち45人において,多発性骨髄腫の細胞とのMMG49の明らかな結合がみられた.
MMG49により認識される抗原を同定するため,MMG49陽性の細胞から構築されたcDNAライブラリーをBa/F3細胞に導入し,蛍光セルソーターを用いてMMG49陽性になったBaF3細胞を濃縮した.導入されたcDNAの配列を決定したところインテグリンβ7をコードする遺伝子であったことから,MMG49はインテグリンβ7を認識すると考えられた.MMG49によるインテグリンβ7の特異的な認識は,免疫沈降,ELISA法,インテグリンβ7を欠損させた細胞との結合の消失により確認された.多発性骨髄腫の細胞においてインテグリンβ7とおもに会合するのはインテグリンα4であった.
既存の抗インテグリンβ7モノクローナル抗体であるFIB27により染色すると,健常人の末梢血のリンパ球,好酸球,ナチュラルキラー細胞においてインテグリンβ7陽性細胞の集団が存在することがわかった.しかし,MMG49はそれらの細胞とはほとんど結合しなかった.このことから,MMG49はインテグリンβ7の一部とのみ結合することが示唆された.インテグリンは,低いリガンド親和性をもつコンパクトに曲がった非活性化型の立体構造と,高いリガンド親和性をもつ伸長した活性化型の立体構造のいずれかをとることが知られている3).そこで,MMG49がインテグリンβ7の高次構造に感受性のエピトープと結合するかどうか調べた.インテグリンα4β7を活性化することの知られているMn2+の存在下においては4),インテグリンα4β7が非活性化するCa2+あるいはMg2+の存在下よりも,インテグリンα4β7を発現する細胞とのMMG49の結合は有意に増加した.このような違いは,その立体構造にかかわらずインテグリンβ7と結合するFIB27については観察されなかった.さらに,正常なT細胞とのMMG49の結合も,Mn2+の存在下においてはおだやかではあるが上昇した.これらの結果から,MMG49が活性化型のインテグリンβ7と特異的に結合する高次構造に依存性のモノクローナル抗体であることが強く示唆された.インテグリンβ7のエピトープはArg16からAla29のN末端側の領域にマッピングされ,Ala29が結合の親和性にもっとも重要な寄与をする.MMG49の認識するエピトープの領域は,活性化型に依存性の抗インテグリンβ3抗体であるAP5の認識するエピトープの領域と同様であり,不活性化型の構造において隠蔽される部位にあたると推測された.MMG49のエピトープはインテグリンα4β7のリガンドであるMAdCAM-1との結合によりマスクされなかった.
既存の抗インテグリンβ7抗体であるFIB27により染色したところ,多くの多発性骨髄腫患者の骨髄において,インテグリンβ7は多発性骨髄腫の細胞に高いレベルで発現していたが,リンパ球およびCD34陽性の未成熟な造血細胞においても中程度から低いレベルでインテグリンβ7を発現する細胞が存在した.対照的に,MMG49の高いレベルの結合は多発性骨髄腫の細胞に特異的で,ほかの骨髄細胞にはわずかな結合しか検出されなかった.CD19陽性B細胞の一部には多発性骨髄腫の細胞と匹敵するレベルでMMG49の抗原が発現しており,それらのなかに多発性骨髄腫の細胞と同一の免疫グロブリン再配列をもち骨髄腫前駆細胞の候補であるB細胞が濃縮されていた.
多発性骨髄腫の細胞においてはMn2+の処理によりMMG49との結合は上昇しなかった.患者に由来する多発性骨髄腫の細胞においても,Mn2+の処理によりMMG49との結合は上昇しなかった.これらの結果から,多発性骨髄腫の細胞においてはインテグリンβ7が恒常的に活性化しており,インテグリンβ7それ自体の高い発現とあいまって,MMG49の多発性骨髄腫に対する高い特異性の原因になることが強く示唆された.健常人の末梢血においては,正常なCD38陽性CD138陽性の形質細胞を除き,MMG49との結合はCD45陽性細胞およびCD45陰性細胞においてほとんど検出されなかった.また,インテグリンα4β7が活性化されているヒトの大腸粘膜に由来するリンパ球とのMMG49の結合はごくわずかであった.in vitroにおいてインテグリンを活性化させたT細胞や活性化したリンパ球とのMMG49の結合もごくわずかであった.インテグリンβ7をコードするmRNAは非造血組織においては検出されなかった.インテグリンβ7は赤血球および血小板に発現していなかった.
多発性骨髄腫の細胞におけるエピトープの密度はモノクローナル抗体により細胞傷害性が誘導されるのに十分なほど高くはなかったが,その多発性骨髄腫の細胞に対する特異性は明らかであった.そこで,低密度で存在する抗原であっても標的とすることを可能にするキメラ抗原受容体発現T細胞療法に目をむけた.
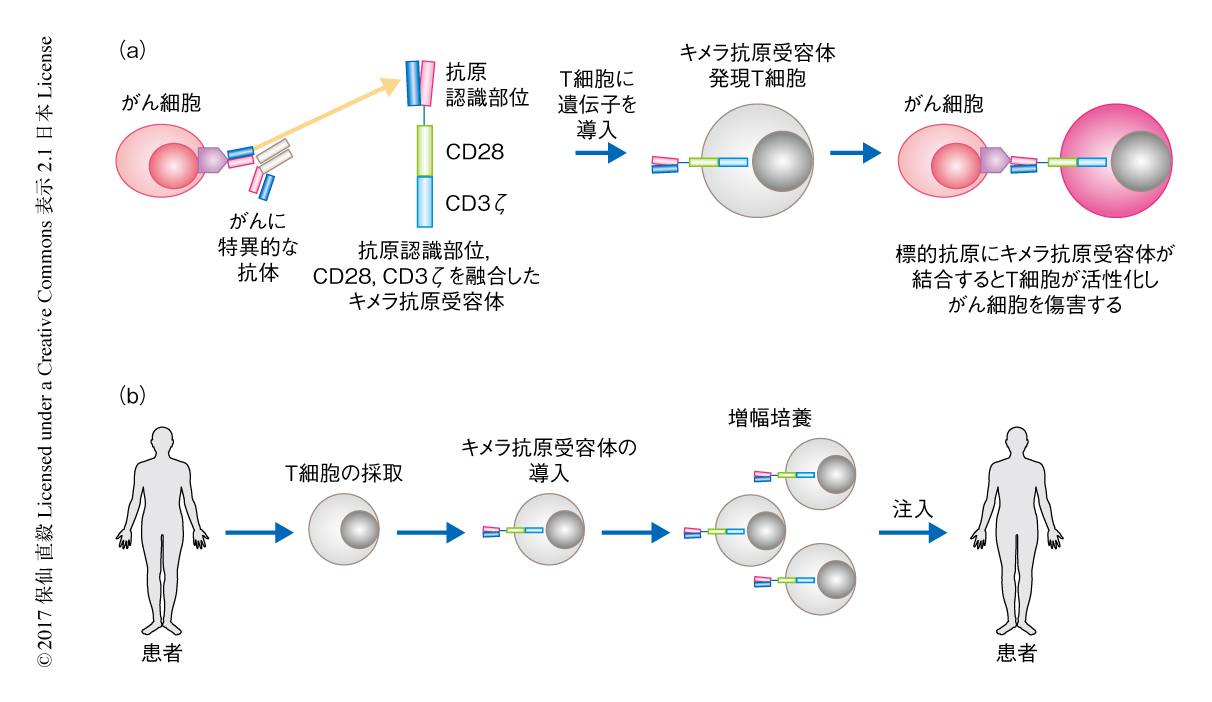
MMG49に由来するscFvをCD28およびCD3ζシグナル伝達ドメインと融合させてキメラ抗原受容体を設計した5).レトロウイルスを用いてこのキメラ抗原受容体をT細胞に導入し,in vitroにおいて増殖させMMG49に由来するキメラ抗原受容体発現T細胞を作製した(図1).このキメラ抗原受容体発現T細胞はCD4陽性T細胞とCD8陽性T細胞の比の有意な変化なしに指数関数的に増殖した.MMG49の抗原を発現する細胞と共培養した場合,MMG49に由来するキメラ抗原受容体発現T細胞はインターフェロンγおよびインターロイキン2を分泌し,細胞傷害活性を示し広範囲に増殖したが,MMG49の抗原を発現しない細胞との共培養ではそれらの現象はみられなかった.多発性骨髄腫の細胞はMMG49に由来するキメラ抗原受容体発現T細胞により完全に根絶され,攻撃をのがれて生き残ったクローンは観察されなかった.さらに,MMG49に由来するキメラ抗原受容体発現T細胞は患者に由来する多発性骨髄腫の細胞と共培養するとサイトカインを産生し細胞傷害性を示したが,対照的に,正常な末梢血単核細胞,結腸粘膜に由来する単核細胞,CD34陽性の造血前駆細胞との共培養により活性化されなかった.さらに,インテグリンβ7がMAdCAM-1およびCXCL12により活性化された場合においても,T細胞はMMG49に由来するキメラ抗原受容体発現T細胞により排除されなかった.さらに,刺激により活性化されたT細胞およびMMG49に由来するキメラ抗原受容体発現T細胞それ自体はMMG49に由来するキメラ抗原受容体を活性化しなかった.これらの正常な細胞におけるMMG49のエピトープの発現は,キメラ抗原受容体の活性化に必要な閾値より低い可能性が高いと考えられた.
免疫不全のモデルマウスの骨髄細胞に移植されたMMG49陽性の細胞は,MMG49に由来するキメラ抗原受容体発現T細胞の注入により根絶された.さらに,播種性の多発性骨髄腫の異種移植モデルにおいて,MMG49に由来するキメラ抗原受容体発現T細胞の注入は腫瘍を有意に減少させマウスの生存期間を延長した.これらの結果と一致して,骨髄へのキメラ抗原受容体発現T細胞の著明な浸潤および多発性骨髄腫の細胞とキメラ抗原受容体発現T細胞の共局在が観察された.MMG49に由来するキメラ抗原受容体発現T細胞を注入されたマウスの一部においては再発がみられたが,抗原を損失した変異をもつ多発性骨髄腫の細胞は出現しなかった.MMG49陽性の細胞からインテグリンβ7を欠損させたところ,MMG49に由来するキメラ抗原受容体発現T細胞により排除されなくなった.さらに,皮下腫瘍のモデルにおいてもMMG49に由来するキメラ抗原受容体発現T細胞による治療はマウスの生存期間を有意に延長した.対照的に,MMG49に由来するキメラ抗原受容体発現T細胞は,免疫不全のマウスに移植されたヒトの正常な造血細胞を排除しなかった.MMG49に由来するキメラ抗原受容体発現T細胞を注入されたマウスにおいて,予期されない副作用は観察されなかった.
この研究において,MMG49に由来するキメラ抗原受容体発現T細胞が正常な組織を損傷することなく多発性骨髄腫に対し特異的な抗腫瘍効果を発揮する可能性をもつことが示された.さらに,MMG49に由来するキメラ抗原受容体発現T細胞は,多発性骨髄腫の形質細胞だけでなく,多発性骨髄腫の前駆細胞の候補であるクローナルCD19陽性B細胞6,7) をも標的とする可能性があることが示された.今後,MMG49に由来するキメラ抗原受容体発現T細胞療法の臨床試験を実施し,ほかの抗原8) を標的とするキメラ抗原受容体発現T細胞と比較する予定である.
多発性骨髄腫の細胞におけるMMG49のエピトープの発現から,これらの細胞におけるインテグリンβ7の活性化型への構造変化は,リガンドの関与による“outside-in”シグナルの結果ではなく“inside-out”シグナルの結果であることが示された.その詳細な機序は,将来の研究において明らかにされるだろう.
この研究から,インテグリンそれ自体の発現は多発性骨髄腫に特異的でないにもかかわらず,インテグリンの活性化型の立体構造が多発性骨髄腫に対する免疫療法の標的となりうることが示された.一般に,インテグリンの活性化および不活性化にともなう構造変化は,2価カチオンの濃度を変化させることにより実験的に模倣することができる.この特徴を利用して,MMG49が活性化型の構造をとるインテグリンβ7において曝露されたエピトープを認識し,がん免疫療法の標的となりうるという明確な証拠が示された.構造変化をうける多くの表面タンパク質においてがん免疫療法の標的がまだ同定される可能性のあることが示唆された(図2).
(大阪大学大学院医学系研究科 癌幹細胞制御学講座)
email:保仙直毅
DOI: 10.7875/first.author.2017.132
The activated conformation of integrin β7 is a novel multiple myeloma-specific target for CAR T cell therapy.
Naoki Hosen, Yukiko Matsunaga, Kana Hasegawa, Hiroshi Matsuno, Yuki Nakamura, Mio Makita, Kouki Watanabe, Mikako Yoshida, Kei Satoh, Soyoko Morimoto, Fumihiro Fujiki, Hiroko Nakajima, Jun Nakata, Sumiyuki Nishida, Akihiro Tsuboi, Yoshihiro Oka, Masahiro Manabe, Hiroyoshi Ichihara, Yasutaka Aoyama, Atsuko Mugitani, Takafumi Nakao, Masayuki Hino, Ryosuke Uchibori, Keiya Ozawa, Yoshihiro Baba, Seitaro Terakura, Naoki Wada, Eiichi Morii, Junichi Nishimura, Kiyoshi Takeda, Yusuke Oji, Haruo Sugiyama, Junichi Takagi, Atsushi Kumanogoh
Nature Medicine, 23, 1436-1443 (2017)
要 約
がんに特異的な表面抗原はモノクローナル抗体療法あるいはキメラ抗原受容体発現T細胞療法のための理想的な標的である.しかしながら,そのような表面抗原はトランスクリプトーム解析およびプロテオーム解析による広範な探索により同定しつくされたと考えられていた.この研究において,活性化型の構造をとるインテグリンが多発性骨髄腫の特異的な治療の標的となることが示された.多発性骨髄腫に対する10,000をこえるモノクローナル抗体のなかから特異的なモノクローナル抗体として同定されたMMG49は,インテグリンβ7を認識することが見い出された.インテグリンβ7は正常なリンパ球の多くに発現するが,MMG49はそれらとは結合しなかった.MMG49の認識するエピトープは,不活性化型の構造をとるインテグリンβ7においてはアクセスできない部位にあると推測され,MMG49は活性化型の構造をとるインテグリンβ7とのみ結合した.さらに,インテグリンβ7は多発性骨髄腫の細胞において高く発現するのみならず恒常的に活性化しているため,MMG49は多発性骨髄腫の細胞と特異的に結合した.MMG49に由来するキメラ抗原受容体発現T細胞は,正常な造血細胞を損傷することなく多発性骨髄腫に対し抗腫瘍効果を発揮した.これらの結果から,MMG49を用いたキメラ抗原受容体発現T細胞療法が多発性骨髄腫に対し有望であることが示されただけでなく,不活性型の構造をとる定常状態の膜タンパク質ががんに対する特異性をもたなくても,その活性化型の構造ががん免疫療法の標的となりうることが示された.
はじめに
がんに特異的な表面抗原を認識するモノクローナル抗体はがんの治療において非常に有用なツールである.さらに,がんに特異的なモノクローナル抗体に由来するキメラ抗原受容体発現T細胞はがん免疫療法の有力な新しいアプローチである1,2)(保仙 直毅, がんに対するキメラ抗原受容体発現T細胞療法の最前線, 領域融合レビュー, 6, e005, 2017 も参照されたい).しかし,がんに特異的な遺伝子あるいはタンパク質は,これまでに実施されたトランスクリプトーム解析やプロテオーム解析によりすでに同定されつくされたと考えられ,がんに特異的な標的となる新規の抗原を同定することは困難である.しかし,糖鎖修飾や立体構造の変化などにより形成されるがんに特異的なエピトープはみのがされている可能性があり,がんに特異的なモノクローナル抗体を徹底的に探索し,そののち,それらが認識する抗原を同定することにより発見される可能性がある.この研究においては,多発性骨髄腫の治療における新規の標的としてそのような抗原の同定をめざした.多発性骨髄腫は治療の進歩にもかかわらずほとんどの例において再発するため,治療に新たなアプローチが必要とされている.
1.多発性骨髄腫に特異的なモノクローナル抗体の同定
さまざまな多発性骨髄腫の細胞株と結合するモノクローナル抗体を産生する10,000をこえるハイブリドーマを樹立し,正常な末梢血単核細胞と結合しなかった約500のモノクローナル抗体を候補としてハイブリドーマを選択した.多発性骨髄腫患者の骨髄細胞を染色し,多発性骨髄腫の細胞とは結合するが正常な血液細胞とは結合しないモノクローナル抗体としてMMG49を同定した.51人の多発性骨髄腫の患者のうち45人において,多発性骨髄腫の細胞とのMMG49の明らかな結合がみられた.
2.MMG49は活性化型の構造をとるインテグリンβ7を特異的に認識する
MMG49により認識される抗原を同定するため,MMG49陽性の細胞から構築されたcDNAライブラリーをBa/F3細胞に導入し,蛍光セルソーターを用いてMMG49陽性になったBaF3細胞を濃縮した.導入されたcDNAの配列を決定したところインテグリンβ7をコードする遺伝子であったことから,MMG49はインテグリンβ7を認識すると考えられた.MMG49によるインテグリンβ7の特異的な認識は,免疫沈降,ELISA法,インテグリンβ7を欠損させた細胞との結合の消失により確認された.多発性骨髄腫の細胞においてインテグリンβ7とおもに会合するのはインテグリンα4であった.
既存の抗インテグリンβ7モノクローナル抗体であるFIB27により染色すると,健常人の末梢血のリンパ球,好酸球,ナチュラルキラー細胞においてインテグリンβ7陽性細胞の集団が存在することがわかった.しかし,MMG49はそれらの細胞とはほとんど結合しなかった.このことから,MMG49はインテグリンβ7の一部とのみ結合することが示唆された.インテグリンは,低いリガンド親和性をもつコンパクトに曲がった非活性化型の立体構造と,高いリガンド親和性をもつ伸長した活性化型の立体構造のいずれかをとることが知られている3).そこで,MMG49がインテグリンβ7の高次構造に感受性のエピトープと結合するかどうか調べた.インテグリンα4β7を活性化することの知られているMn2+の存在下においては4),インテグリンα4β7が非活性化するCa2+あるいはMg2+の存在下よりも,インテグリンα4β7を発現する細胞とのMMG49の結合は有意に増加した.このような違いは,その立体構造にかかわらずインテグリンβ7と結合するFIB27については観察されなかった.さらに,正常なT細胞とのMMG49の結合も,Mn2+の存在下においてはおだやかではあるが上昇した.これらの結果から,MMG49が活性化型のインテグリンβ7と特異的に結合する高次構造に依存性のモノクローナル抗体であることが強く示唆された.インテグリンβ7のエピトープはArg16からAla29のN末端側の領域にマッピングされ,Ala29が結合の親和性にもっとも重要な寄与をする.MMG49の認識するエピトープの領域は,活性化型に依存性の抗インテグリンβ3抗体であるAP5の認識するエピトープの領域と同様であり,不活性化型の構造において隠蔽される部位にあたると推測された.MMG49のエピトープはインテグリンα4β7のリガンドであるMAdCAM-1との結合によりマスクされなかった.
3.多発性骨髄腫の細胞におけるインテグリンβ7の恒常的な活性化がMMG49の多発性骨髄腫に対する特異性の原因である
既存の抗インテグリンβ7抗体であるFIB27により染色したところ,多くの多発性骨髄腫患者の骨髄において,インテグリンβ7は多発性骨髄腫の細胞に高いレベルで発現していたが,リンパ球およびCD34陽性の未成熟な造血細胞においても中程度から低いレベルでインテグリンβ7を発現する細胞が存在した.対照的に,MMG49の高いレベルの結合は多発性骨髄腫の細胞に特異的で,ほかの骨髄細胞にはわずかな結合しか検出されなかった.CD19陽性B細胞の一部には多発性骨髄腫の細胞と匹敵するレベルでMMG49の抗原が発現しており,それらのなかに多発性骨髄腫の細胞と同一の免疫グロブリン再配列をもち骨髄腫前駆細胞の候補であるB細胞が濃縮されていた.
多発性骨髄腫の細胞においてはMn2+の処理によりMMG49との結合は上昇しなかった.患者に由来する多発性骨髄腫の細胞においても,Mn2+の処理によりMMG49との結合は上昇しなかった.これらの結果から,多発性骨髄腫の細胞においてはインテグリンβ7が恒常的に活性化しており,インテグリンβ7それ自体の高い発現とあいまって,MMG49の多発性骨髄腫に対する高い特異性の原因になることが強く示唆された.健常人の末梢血においては,正常なCD38陽性CD138陽性の形質細胞を除き,MMG49との結合はCD45陽性細胞およびCD45陰性細胞においてほとんど検出されなかった.また,インテグリンα4β7が活性化されているヒトの大腸粘膜に由来するリンパ球とのMMG49の結合はごくわずかであった.in vitroにおいてインテグリンを活性化させたT細胞や活性化したリンパ球とのMMG49の結合もごくわずかであった.インテグリンβ7をコードするmRNAは非造血組織においては検出されなかった.インテグリンβ7は赤血球および血小板に発現していなかった.
多発性骨髄腫の細胞におけるエピトープの密度はモノクローナル抗体により細胞傷害性が誘導されるのに十分なほど高くはなかったが,その多発性骨髄腫の細胞に対する特異性は明らかであった.そこで,低密度で存在する抗原であっても標的とすることを可能にするキメラ抗原受容体発現T細胞療法に目をむけた.
4.MMG49に由来するキメラ抗原受容体発現T細胞はin vitroにおいて多発性骨髄腫の細胞を特異的に認識し排除する
MMG49に由来するscFvをCD28およびCD3ζシグナル伝達ドメインと融合させてキメラ抗原受容体を設計した5).レトロウイルスを用いてこのキメラ抗原受容体をT細胞に導入し,in vitroにおいて増殖させMMG49に由来するキメラ抗原受容体発現T細胞を作製した(図1).このキメラ抗原受容体発現T細胞はCD4陽性T細胞とCD8陽性T細胞の比の有意な変化なしに指数関数的に増殖した.MMG49の抗原を発現する細胞と共培養した場合,MMG49に由来するキメラ抗原受容体発現T細胞はインターフェロンγおよびインターロイキン2を分泌し,細胞傷害活性を示し広範囲に増殖したが,MMG49の抗原を発現しない細胞との共培養ではそれらの現象はみられなかった.多発性骨髄腫の細胞はMMG49に由来するキメラ抗原受容体発現T細胞により完全に根絶され,攻撃をのがれて生き残ったクローンは観察されなかった.さらに,MMG49に由来するキメラ抗原受容体発現T細胞は患者に由来する多発性骨髄腫の細胞と共培養するとサイトカインを産生し細胞傷害性を示したが,対照的に,正常な末梢血単核細胞,結腸粘膜に由来する単核細胞,CD34陽性の造血前駆細胞との共培養により活性化されなかった.さらに,インテグリンβ7がMAdCAM-1およびCXCL12により活性化された場合においても,T細胞はMMG49に由来するキメラ抗原受容体発現T細胞により排除されなかった.さらに,刺激により活性化されたT細胞およびMMG49に由来するキメラ抗原受容体発現T細胞それ自体はMMG49に由来するキメラ抗原受容体を活性化しなかった.これらの正常な細胞におけるMMG49のエピトープの発現は,キメラ抗原受容体の活性化に必要な閾値より低い可能性が高いと考えられた.
5.MMG49に由来するキメラ抗原受容体発現T細胞はin vivoにおいて正常な造血細胞を傷害することなく多発性骨髄腫に対し抗腫瘍効果を発揮する
免疫不全のモデルマウスの骨髄細胞に移植されたMMG49陽性の細胞は,MMG49に由来するキメラ抗原受容体発現T細胞の注入により根絶された.さらに,播種性の多発性骨髄腫の異種移植モデルにおいて,MMG49に由来するキメラ抗原受容体発現T細胞の注入は腫瘍を有意に減少させマウスの生存期間を延長した.これらの結果と一致して,骨髄へのキメラ抗原受容体発現T細胞の著明な浸潤および多発性骨髄腫の細胞とキメラ抗原受容体発現T細胞の共局在が観察された.MMG49に由来するキメラ抗原受容体発現T細胞を注入されたマウスの一部においては再発がみられたが,抗原を損失した変異をもつ多発性骨髄腫の細胞は出現しなかった.MMG49陽性の細胞からインテグリンβ7を欠損させたところ,MMG49に由来するキメラ抗原受容体発現T細胞により排除されなくなった.さらに,皮下腫瘍のモデルにおいてもMMG49に由来するキメラ抗原受容体発現T細胞による治療はマウスの生存期間を有意に延長した.対照的に,MMG49に由来するキメラ抗原受容体発現T細胞は,免疫不全のマウスに移植されたヒトの正常な造血細胞を排除しなかった.MMG49に由来するキメラ抗原受容体発現T細胞を注入されたマウスにおいて,予期されない副作用は観察されなかった.
おわりに
この研究において,MMG49に由来するキメラ抗原受容体発現T細胞が正常な組織を損傷することなく多発性骨髄腫に対し特異的な抗腫瘍効果を発揮する可能性をもつことが示された.さらに,MMG49に由来するキメラ抗原受容体発現T細胞は,多発性骨髄腫の形質細胞だけでなく,多発性骨髄腫の前駆細胞の候補であるクローナルCD19陽性B細胞6,7) をも標的とする可能性があることが示された.今後,MMG49に由来するキメラ抗原受容体発現T細胞療法の臨床試験を実施し,ほかの抗原8) を標的とするキメラ抗原受容体発現T細胞と比較する予定である.
多発性骨髄腫の細胞におけるMMG49のエピトープの発現から,これらの細胞におけるインテグリンβ7の活性化型への構造変化は,リガンドの関与による“outside-in”シグナルの結果ではなく“inside-out”シグナルの結果であることが示された.その詳細な機序は,将来の研究において明らかにされるだろう.
この研究から,インテグリンそれ自体の発現は多発性骨髄腫に特異的でないにもかかわらず,インテグリンの活性化型の立体構造が多発性骨髄腫に対する免疫療法の標的となりうることが示された.一般に,インテグリンの活性化および不活性化にともなう構造変化は,2価カチオンの濃度を変化させることにより実験的に模倣することができる.この特徴を利用して,MMG49が活性化型の構造をとるインテグリンβ7において曝露されたエピトープを認識し,がん免疫療法の標的となりうるという明確な証拠が示された.構造変化をうける多くの表面タンパク質においてがん免疫療法の標的がまだ同定される可能性のあることが示唆された(図2).
文 献
- Porter, D. L., Levine, B. L., Kalos, M. et al.: Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N. Engl. J. Med., 365, 725-733 (2011)[PubMed]
- Grupp, S. A., Kalos, M., Barrett, D. et al.: Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N. Engl. J. Med., 368, 1509-1518 (2013)[PubMed]
- Takagi, J., Petre, B. M., Walz, T. et al.: Global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling. Cell, 110, 599-511 (2002)[PubMed]
- Tidswell, M., Pachynski, R., Wu, S. W. et al.: Structure-function analysis of the integrin beta 7 subunit: identification of domains involved in adhesion to MAdCAM-1. J. Immunol., 159, 1497-1505 (1997)[PubMed]
- Maher, J., Brentjens, R. J., Gunset, G. et al.: Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRζ/CD28 receptor. Nat. Biotechnol., 20, 70-75 (2002)[PubMed]
- Johnsen, H. E., Bogsted, M., Schmitz, A. et al.: The myeloma stem cell concept, revisited: from phenomenology to operational terms. Haematologica, 101, 1451-1459 (2016)[PubMed]
- Garfall, A. L., Maus, M. V., Hwang, W. T. et al.: Chimeric antigen receptor T cells against CD19 for multiple myeloma. N. Engl. J. Med., 373, 1040-1047 (2015)[PubMed]
- Ali, S. A., Shi, V., Maric, I. et al.: T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood, 128, 1688-1700 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
- NCBI
- Ensembl
著者プロフィール
略歴:2002年 大阪大学大学院医学系研究科 修了,2003年 米国Stanford大学 ポスドクを経て,2007年より大阪大学大学院医学系研究科 准教授.
研究テーマ:がん免疫療法,がん幹細胞,多発性骨髄腫.
抱負:がん免疫療法によるがん幹細胞の排除療法を開発したい.
© 2017 保仙 直毅 Licensed under CC 表示 2.1 日本