翻訳の途上の新生ポリペプチド鎖がひき起こすリボソームの不安定化および環境のセンサーとしての利用
茶谷悠平1・千葉志信2・伊藤維昭2・田口英樹1
(1東京工業大学科学技術創成研究院 細胞制御工学研究センター,2京都産業大学総合生命科学部)
email:田口英樹
DOI: 10.7875/first.author.2017.130
Intrinsic ribosome destabilization underlies translation and provides an organism with a strategy of environmental sensing.
Yuhei Chadani, Tatsuya Niwa, Takashi Izumi, Nobuyuki Sugata, Asuteka Nagao, Tsutomu Suzuki, Shinobu Chiba, Koreaki Ito, Hideki Taguchi
Molecular Cell, 68, 528-539.e5 (2017)
生命現象を担うタンパク質はすべてリボソームを中心とした翻訳により合成される.近年,翻訳の伸長過程の速度はいつも同じではなく,多くは途中で減速したり一時停止したりすることがわかってきた.筆者らは,翻訳の途上の新生ポリペプチド鎖は減速や一時停止にとどまらず,そのアミノ酸配列によっては終止コドンまで到達するまえにリボソームを不安定化して翻訳が途中で終了することを発見した.さらに,細胞はこのしくみを細胞におけるMg2+の感知に利用することも見い出した.リボソームは大サブユニットと小サブユニットの相互の回転運動をコドンごとにくり返しながらアミノ酸を連結していく.したがって,翻訳においてリボソームは構造の不安定化のリスクをつねにかかえている.細胞にはこの不安定化を抑制する機構が備わるが,アミノ酸配列によっては不安定化が打ち勝ち,終止コドンとは別に途中で翻訳が終了する.このようなリボソームの不完全さを生命はしたたかに利用し環境のセンサーとして利用していた.
生命をささえるタンパク質は遺伝子の塩基配列により決まるアミノ酸がリボソームにて順次つながってできた新生ポリペプチド鎖として生まれ,アミノ酸配列により決まる立体構造にフォールディングして機能を発揮する.このタンパク質が合成される翻訳の過程において,リボソームは大サブユニットと小サブユニットの相互の回転という大きな構造変化をともないながらアミノ酸を連結する1).この翻訳の伸長がmRNAの2次構造やtRNAの量などRNAの側の問題により遅延することは知られていたが,最近の筆者らによる研究などから,アミノ酸配列によっては新生ポリペプチド鎖がリボソームのペプチドトンネルの内壁と相互作用して翻訳にブレーキをかけるなど,翻訳には“緩急のリズム”が存在することが明らかにされてきた2,3).つまり,新生ポリペプチド鎖が翻訳の進行に積極的にかかわることがわかってきたといえるが,その全体像はまだみえていない.
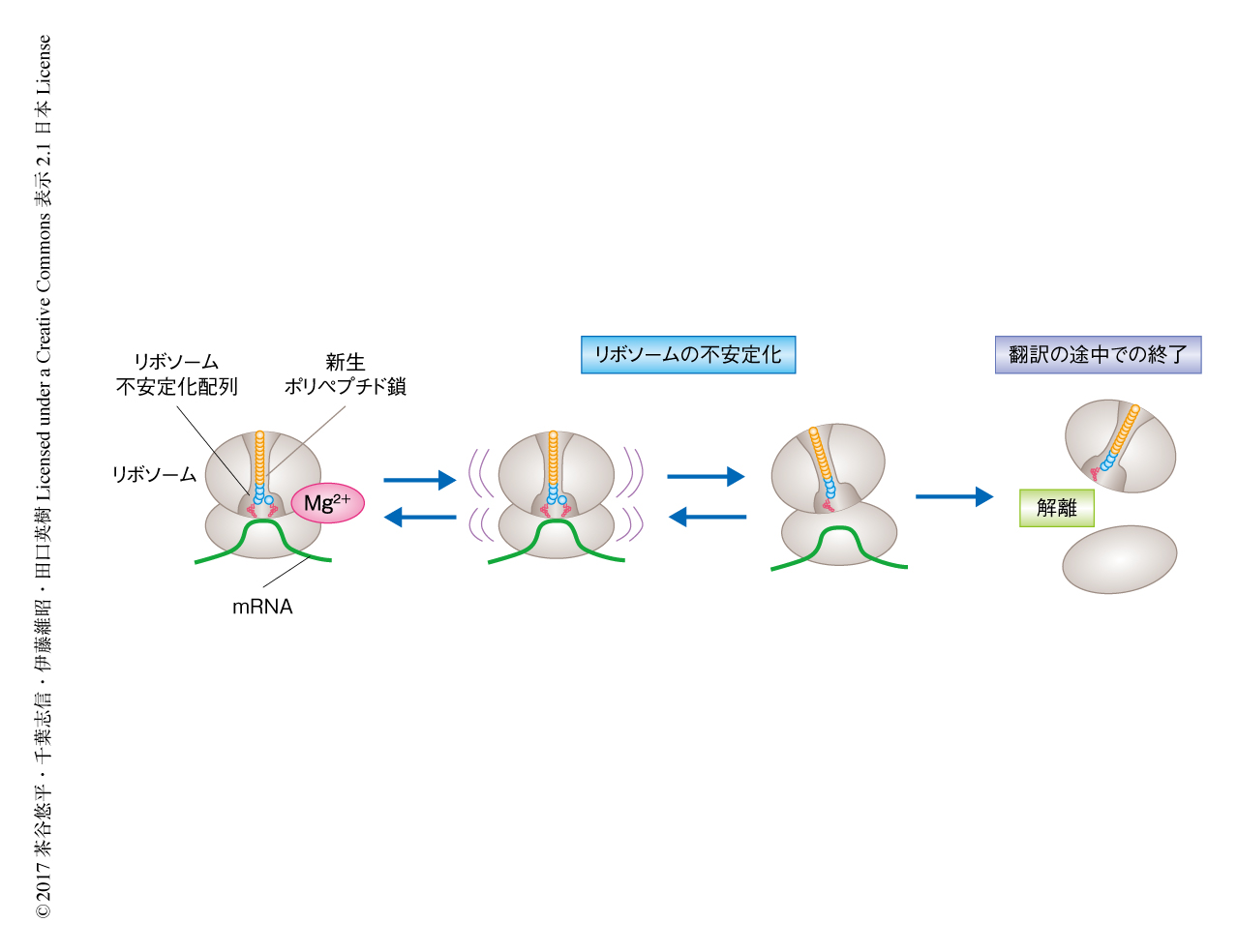
翻訳の速度を制御するアミノ酸配列を詳細に調べる過程において,AspおよびGluの酸性アミノ酸が10回ほど連続した配列,あるいは,酸性アミノ酸とProが交互に連なった配列を含むタンパク質を,大腸菌の再構成型の無細胞翻訳系であるPUREシステム4) において翻訳させると,途中で翻訳が終了することが見い出された.この翻訳の終了は,リボソームが新生ポリペプチド鎖との作用により不安定化し,最終的にリボソームが大サブユニットと小サブユニットとに解離することにより起こることが明らかにされた(図1).すでに,リボソームがどんなアミノ酸配列をもつタンパク質でも順調に合成できるわけではないことは大腸菌のSecMなどの翻訳の際に起こる翻訳アレストの研究などからも示されていたが2),この新生ポリペプチド鎖がひき起こす内発的なリボソームの不安定化(intrinsic ribosome destabilization:IRD)は,リボソームのサブユニットが解離するという新規の現象であった.
これまでも,まちがったアミノ酸の取り込みを校正するための機構として,真正細菌において翻訳の初期段階の新生ポリペプチド鎖がリボソームから脱落して翻訳が終了するペプチジルtRNAドロップオフという現象が知られていたが5),このドロップオフにおいては翻訳の終結因子やリサイクリング因子が必要なのに対し,内発的なリボソームの不安定化はこれらの因子がなくても起ったことから別の現象と考えられた.また,近年,真核生物において翻訳の伸長の阻害が原因で起こるmRNAおよび新生ポリペプチド鎖の品質管理がホットなトピックスになっているが6,7),このリボソーム品質管理機構はユビキチンリガーゼなどトランスにはたらく多くの因子がかかわるのに対し,PUREシステムによる実験から明らかなように,内発的なリボソームの不安定化は翻訳にかかわる最低限の因子だけでひき起こされるという点で,本質的に異なる現象であると考えられた.
細胞において数千種類から数万種類のタンパク質の合成を担うリボソームには多様なアミノ酸配列の組合せを自在に連結する能力があると考えられてきたが,合成しつつある新生ポリペプチド鎖によりリボソームが不安定化するという現象の発見から,翻訳は潜在的に途中で終了するリスクをともないながら進行するものであること,リボソーム不安定化配列をコードする遺伝子は翻訳が終止コドンまで到達しない事態もあることが示された.
内発的なリボソームの不安定化はin vitroにおける解析から見い出された.それでは,in vivoにおいてはどうなのであろうか.大腸菌のゲノムにはrpoD遺伝子やyihI遺伝子など酸性アミノ酸が連続した配列をコードする遺伝子やyagN遺伝子など酸性アミノ酸とProが交互に連なった配列をコードする遺伝子が存在する.これらの遺伝子の翻訳が内発的なリボソームの不安定化を起こすかどうか調べたところ,in vitroおよびin vivoにおいて翻訳の終了をひき起こす強いリボソーム不安定化配列がある一方,in vitroにおいては翻訳の終了をひき起こすがin vivoにおいては翻訳の終了は起こらない弱いリボソーム不安定化配列のあることがわかった.細胞には内発的なリボソームの不安定化を抑制する因子があると予想されたことから,非必須リボソームサブユニットの変異株を解析したところ,リボソームタンパク質のひとつbL31の欠損株においては内発的なリボソームの不安定化が起こりやすくなっていることがわかった.bL31はリボソームの大サブユニットと小サブユニットとを連結しており8),内発的なリボソームの不安定化を抑制する効果があると考えられた.なお,PUREシステムにおいてはbL31の一部が細胞破砕ののち失われているため,内発的なリボソームの不安定化が起こりやすい状況になっていたこともわかった.
では,いっけんリボソームの欠陥にもみえる内発的なリボソームの不安定化は,生物にとりどのような意味があるのだろうか? bL31を欠損した大腸菌株においてはリボソームがやや不安定になるため,潜在的なリボソームを不安定化するタンパク質をみつけることができると考えた.そこで,bL31欠損株のプロテオームを解析した結果,野生株と比べbL31欠損株においては多くのタンパク質の発現量が変動すること,とくに,Mg2+を細胞に取り込む膜輸送タンパク質のひとつMgtAが10倍以上も発現していることがわかった.さらに,MgtAの発現を制御するmgtL遺伝子9) は典型的なリボソーム不安定化配列をもっていた.詳細な解析の結果,大腸菌は野生株においても細胞におけるMg2+の濃度に応じmgtL遺伝子のリボソーム不安定化配列を使った特殊な機構によりMgtAの発現を制御していることがわかった.Mg2+は細胞における多くの生命現象に必須で,なかでも,リボソームを安定化することにより翻訳に必須である.そこで,大腸菌は生育する環境においてMg2+が少なくなった際,mgtL遺伝子のもつリボソーム不安定化配列を介してMgtAを大量に発現させ,Mg2+の濃度を高めるしくみを準備したと考えられた.つまり,生物は内発的なリボソームの不安定化を逆手にとり,細胞における環境の変化を感知するしくみをもっていた(図2).
生命のセントラルドグマにおいては,タンパク質はmRNAに存在する開始コドンから終止コドンまでがリボソームにより途切れなく合成され,できあがったアミノ酸配列に書き込まれた立体構造にフォールディングするのが原則であるが,この研究により,アミノ酸配列にはリボソームの安定性を左右して翻訳を途中で終了させるはたらきまでがあることが明らかにされた.この研究において発見されたリボソーム不安定化配列をきっかけとして,今後,さらに,翻訳を途中で終了させるアミノ酸配列が広くみつかる可能性がある.遺伝子発現の新しい制御機構が示されたことにより,Mg2+の濃度の維持のほか,内発的なリボソームの不安定化が種々の生物においてもつ役割の解明が期待される.また,発現のみられない遺伝子の一部は内発的なリボソームの不安定化によるためかもしれず,タンパク質の発現に関しても,これまで想定されていなかった新しいコンセプトが提供されたといえるかもしれない.
略歴:2012年 岡山大学大学院自然科学研究科 修了,同年 京都産業大学総合生命科学部 研究員,2015年 東京工業大学大学院生命理工学研究科 研究員を経て,2016年より東京工業大学科学技術創成研究院 研究員.
研究テーマ:新生ポリペプチド鎖により制御されるリボソームのダイナミクス.
抱負:楽しく謙虚に研究し,分野の発展に貢献していきたい.
千葉 志信(Shinobu Chiba)
京都産業大学総合生命科学部 准教授.
伊藤 維昭(Koreaki Ito)
京都産業大学総合生命科学部 シニアリサーチフェロー.
田口 英樹(Hideki Taguchi)
東京工業大学科学技術創成研究院 教授.
研究室URL:http://www.taguchi.bio.titech.ac.jp/
© 2017 茶谷悠平・千葉志信・伊藤維昭・田口英樹 Licensed under CC 表示 2.1 日本
(1東京工業大学科学技術創成研究院 細胞制御工学研究センター,2京都産業大学総合生命科学部)
email:田口英樹
DOI: 10.7875/first.author.2017.130
Intrinsic ribosome destabilization underlies translation and provides an organism with a strategy of environmental sensing.
Yuhei Chadani, Tatsuya Niwa, Takashi Izumi, Nobuyuki Sugata, Asuteka Nagao, Tsutomu Suzuki, Shinobu Chiba, Koreaki Ito, Hideki Taguchi
Molecular Cell, 68, 528-539.e5 (2017)
要 約
生命現象を担うタンパク質はすべてリボソームを中心とした翻訳により合成される.近年,翻訳の伸長過程の速度はいつも同じではなく,多くは途中で減速したり一時停止したりすることがわかってきた.筆者らは,翻訳の途上の新生ポリペプチド鎖は減速や一時停止にとどまらず,そのアミノ酸配列によっては終止コドンまで到達するまえにリボソームを不安定化して翻訳が途中で終了することを発見した.さらに,細胞はこのしくみを細胞におけるMg2+の感知に利用することも見い出した.リボソームは大サブユニットと小サブユニットの相互の回転運動をコドンごとにくり返しながらアミノ酸を連結していく.したがって,翻訳においてリボソームは構造の不安定化のリスクをつねにかかえている.細胞にはこの不安定化を抑制する機構が備わるが,アミノ酸配列によっては不安定化が打ち勝ち,終止コドンとは別に途中で翻訳が終了する.このようなリボソームの不完全さを生命はしたたかに利用し環境のセンサーとして利用していた.
はじめに
生命をささえるタンパク質は遺伝子の塩基配列により決まるアミノ酸がリボソームにて順次つながってできた新生ポリペプチド鎖として生まれ,アミノ酸配列により決まる立体構造にフォールディングして機能を発揮する.このタンパク質が合成される翻訳の過程において,リボソームは大サブユニットと小サブユニットの相互の回転という大きな構造変化をともないながらアミノ酸を連結する1).この翻訳の伸長がmRNAの2次構造やtRNAの量などRNAの側の問題により遅延することは知られていたが,最近の筆者らによる研究などから,アミノ酸配列によっては新生ポリペプチド鎖がリボソームのペプチドトンネルの内壁と相互作用して翻訳にブレーキをかけるなど,翻訳には“緩急のリズム”が存在することが明らかにされてきた2,3).つまり,新生ポリペプチド鎖が翻訳の進行に積極的にかかわることがわかってきたといえるが,その全体像はまだみえていない.
1.翻訳の途上でリボソームを不安定化し翻訳の終了をひき起こすアミノ酸配列の発見
翻訳の速度を制御するアミノ酸配列を詳細に調べる過程において,AspおよびGluの酸性アミノ酸が10回ほど連続した配列,あるいは,酸性アミノ酸とProが交互に連なった配列を含むタンパク質を,大腸菌の再構成型の無細胞翻訳系であるPUREシステム4) において翻訳させると,途中で翻訳が終了することが見い出された.この翻訳の終了は,リボソームが新生ポリペプチド鎖との作用により不安定化し,最終的にリボソームが大サブユニットと小サブユニットとに解離することにより起こることが明らかにされた(図1).すでに,リボソームがどんなアミノ酸配列をもつタンパク質でも順調に合成できるわけではないことは大腸菌のSecMなどの翻訳の際に起こる翻訳アレストの研究などからも示されていたが2),この新生ポリペプチド鎖がひき起こす内発的なリボソームの不安定化(intrinsic ribosome destabilization:IRD)は,リボソームのサブユニットが解離するという新規の現象であった.
これまでも,まちがったアミノ酸の取り込みを校正するための機構として,真正細菌において翻訳の初期段階の新生ポリペプチド鎖がリボソームから脱落して翻訳が終了するペプチジルtRNAドロップオフという現象が知られていたが5),このドロップオフにおいては翻訳の終結因子やリサイクリング因子が必要なのに対し,内発的なリボソームの不安定化はこれらの因子がなくても起ったことから別の現象と考えられた.また,近年,真核生物において翻訳の伸長の阻害が原因で起こるmRNAおよび新生ポリペプチド鎖の品質管理がホットなトピックスになっているが6,7),このリボソーム品質管理機構はユビキチンリガーゼなどトランスにはたらく多くの因子がかかわるのに対し,PUREシステムによる実験から明らかなように,内発的なリボソームの不安定化は翻訳にかかわる最低限の因子だけでひき起こされるという点で,本質的に異なる現象であると考えられた.
細胞において数千種類から数万種類のタンパク質の合成を担うリボソームには多様なアミノ酸配列の組合せを自在に連結する能力があると考えられてきたが,合成しつつある新生ポリペプチド鎖によりリボソームが不安定化するという現象の発見から,翻訳は潜在的に途中で終了するリスクをともないながら進行するものであること,リボソーム不安定化配列をコードする遺伝子は翻訳が終止コドンまで到達しない事態もあることが示された.
2.内発的なリボソームの不安定化を抑制する機構
内発的なリボソームの不安定化はin vitroにおける解析から見い出された.それでは,in vivoにおいてはどうなのであろうか.大腸菌のゲノムにはrpoD遺伝子やyihI遺伝子など酸性アミノ酸が連続した配列をコードする遺伝子やyagN遺伝子など酸性アミノ酸とProが交互に連なった配列をコードする遺伝子が存在する.これらの遺伝子の翻訳が内発的なリボソームの不安定化を起こすかどうか調べたところ,in vitroおよびin vivoにおいて翻訳の終了をひき起こす強いリボソーム不安定化配列がある一方,in vitroにおいては翻訳の終了をひき起こすがin vivoにおいては翻訳の終了は起こらない弱いリボソーム不安定化配列のあることがわかった.細胞には内発的なリボソームの不安定化を抑制する因子があると予想されたことから,非必須リボソームサブユニットの変異株を解析したところ,リボソームタンパク質のひとつbL31の欠損株においては内発的なリボソームの不安定化が起こりやすくなっていることがわかった.bL31はリボソームの大サブユニットと小サブユニットとを連結しており8),内発的なリボソームの不安定化を抑制する効果があると考えられた.なお,PUREシステムにおいてはbL31の一部が細胞破砕ののち失われているため,内発的なリボソームの不安定化が起こりやすい状況になっていたこともわかった.
3.内発的なリボソームの不安定化の生理的な意義
では,いっけんリボソームの欠陥にもみえる内発的なリボソームの不安定化は,生物にとりどのような意味があるのだろうか? bL31を欠損した大腸菌株においてはリボソームがやや不安定になるため,潜在的なリボソームを不安定化するタンパク質をみつけることができると考えた.そこで,bL31欠損株のプロテオームを解析した結果,野生株と比べbL31欠損株においては多くのタンパク質の発現量が変動すること,とくに,Mg2+を細胞に取り込む膜輸送タンパク質のひとつMgtAが10倍以上も発現していることがわかった.さらに,MgtAの発現を制御するmgtL遺伝子9) は典型的なリボソーム不安定化配列をもっていた.詳細な解析の結果,大腸菌は野生株においても細胞におけるMg2+の濃度に応じmgtL遺伝子のリボソーム不安定化配列を使った特殊な機構によりMgtAの発現を制御していることがわかった.Mg2+は細胞における多くの生命現象に必須で,なかでも,リボソームを安定化することにより翻訳に必須である.そこで,大腸菌は生育する環境においてMg2+が少なくなった際,mgtL遺伝子のもつリボソーム不安定化配列を介してMgtAを大量に発現させ,Mg2+の濃度を高めるしくみを準備したと考えられた.つまり,生物は内発的なリボソームの不安定化を逆手にとり,細胞における環境の変化を感知するしくみをもっていた(図2).
おわりに
生命のセントラルドグマにおいては,タンパク質はmRNAに存在する開始コドンから終止コドンまでがリボソームにより途切れなく合成され,できあがったアミノ酸配列に書き込まれた立体構造にフォールディングするのが原則であるが,この研究により,アミノ酸配列にはリボソームの安定性を左右して翻訳を途中で終了させるはたらきまでがあることが明らかにされた.この研究において発見されたリボソーム不安定化配列をきっかけとして,今後,さらに,翻訳を途中で終了させるアミノ酸配列が広くみつかる可能性がある.遺伝子発現の新しい制御機構が示されたことにより,Mg2+の濃度の維持のほか,内発的なリボソームの不安定化が種々の生物においてもつ役割の解明が期待される.また,発現のみられない遺伝子の一部は内発的なリボソームの不安定化によるためかもしれず,タンパク質の発現に関しても,これまで想定されていなかった新しいコンセプトが提供されたといえるかもしれない.
文 献
- Voorhees, R. M. & Ramakrishnan, V.: Structural basis of the translational elongation cycle. Annu. Rev. Biochem., 82, 203-236 (2013)[PubMed]
- Ito, K. & Chiba, S.: Arrest peptides: cis-acting modulators of translation. Annu. Rev. Biochem., 82, 171-202 (2013)[PubMed]
- Chadani, Y., Niwa, T., Chiba, S. et al.: Integrated in vivo and in vitro nascent chain profiling reveals widespread translational pausing. Proc. Natl. Acad. Sci. USA, 113, E829-E838 (2016)[PubMed]
- Shimizu, Y., Inoue, A., Tomari, Y. et al.: Cell-free translation reconstituted with purified components. Nat. Biotechnol., 19, 751-755 (2001)[PubMed]
- Heurgue-Hamard, V., Karimi, R., Mora, L. et al.: Ribosome release factor RF4 and termination factor RF3 are involved in dissociation of peptidyl-tRNA from the ribosome. EMBO J., 17, 808-816 (1998)[PubMed]
- Brandman, O. & Hegde, R. S.: Ribosome-associated protein quality control. Nat. Struct. Mol. Biol., 23, 7-15 (2016)[PubMed]
- Inada, T.: The ribosome as a platform for mRNA and nascent polypeptide quality control. Trends Biochem. Sci., 42, 5-15 (2017)[PubMed]
- Fischer, N., Neumann, P., Konevega, A. L. et al.: Structure of the E. coli ribosome-EF-Tu complex at <3Å resolution by Cs-corrected cryo-EM. Nature, 520, 567-570 (2015)[PubMed]
- Park, S. Y., Cromie, M. J., Lee, E. J. et al.: A bacterial mRNA leader that employs different mechanisms to sense disparate intracellular signals. Cell, 142, 737-748 (2010)[PubMed]
著者プロフィール
略歴:2012年 岡山大学大学院自然科学研究科 修了,同年 京都産業大学総合生命科学部 研究員,2015年 東京工業大学大学院生命理工学研究科 研究員を経て,2016年より東京工業大学科学技術創成研究院 研究員.
研究テーマ:新生ポリペプチド鎖により制御されるリボソームのダイナミクス.
抱負:楽しく謙虚に研究し,分野の発展に貢献していきたい.
千葉 志信(Shinobu Chiba)
京都産業大学総合生命科学部 准教授.
伊藤 維昭(Koreaki Ito)
京都産業大学総合生命科学部 シニアリサーチフェロー.
田口 英樹(Hideki Taguchi)
東京工業大学科学技術創成研究院 教授.
研究室URL:http://www.taguchi.bio.titech.ac.jp/
© 2017 茶谷悠平・千葉志信・伊藤維昭・田口英樹 Licensed under CC 表示 2.1 日本