ヒストンメチルトランスフェラーゼMLL1は概日リズムをつかさどる時計遺伝子群の発現に必要な場の制御を行う
堅田明子・Paolo Sassone-Corsi
(米国California大学Irvine校School of Medicine,Department of Pharmacology)
email:堅田明子
DOI: 10.7875/first.author.2010.071
The histone methyltransferase MLL1 permits the oscillation of circadian gene expression.
Sayako Katada & Paolo Sassone-Corsi
Nature Structural & Molecular Biology , 12, 1414-1421 (2010)
概日リズムの分子機構としては時計遺伝子の転写活性化とその産物による転写抑制という負のフィードバック機構が普遍的なモデルとして知られている.近年,遺伝子の転写制御についてヒストンの修飾によるクロマチンの構造変化(クロマチンリモデリング)が数多く報告されているが,生物時計の発振においてもその重要性が注目されている.筆者らは,時計遺伝子のプロモーター領域におけるヒストンH3の4番目のリジン残基のトリメチル化修飾に概日リズムがあること,また,このメチル化修飾が以前に報告したヒストンH3のアセチル化修飾と同じ時間帯に起こることを見い出した.ヒストンH3の4番目のリジン残基に特異的なメチルトランスフェラーゼであるMLL1は,時計遺伝子の転写因子としてはたらくCLOCK-BMAL1ヘテロ2量体と時間依存的に直接に相互作用することで時計遺伝子のプロモーター領域へとリクルートされ,安定的に結合することでヒストンH3の4番目のリジン残基のトリメチル化および転写活性を促進した.すなわち,MLL1はクロマチンリモデリングによって生物時計の発振に必須な転写因子がDNAに結合するための場の制御を行うことが明らかになった.
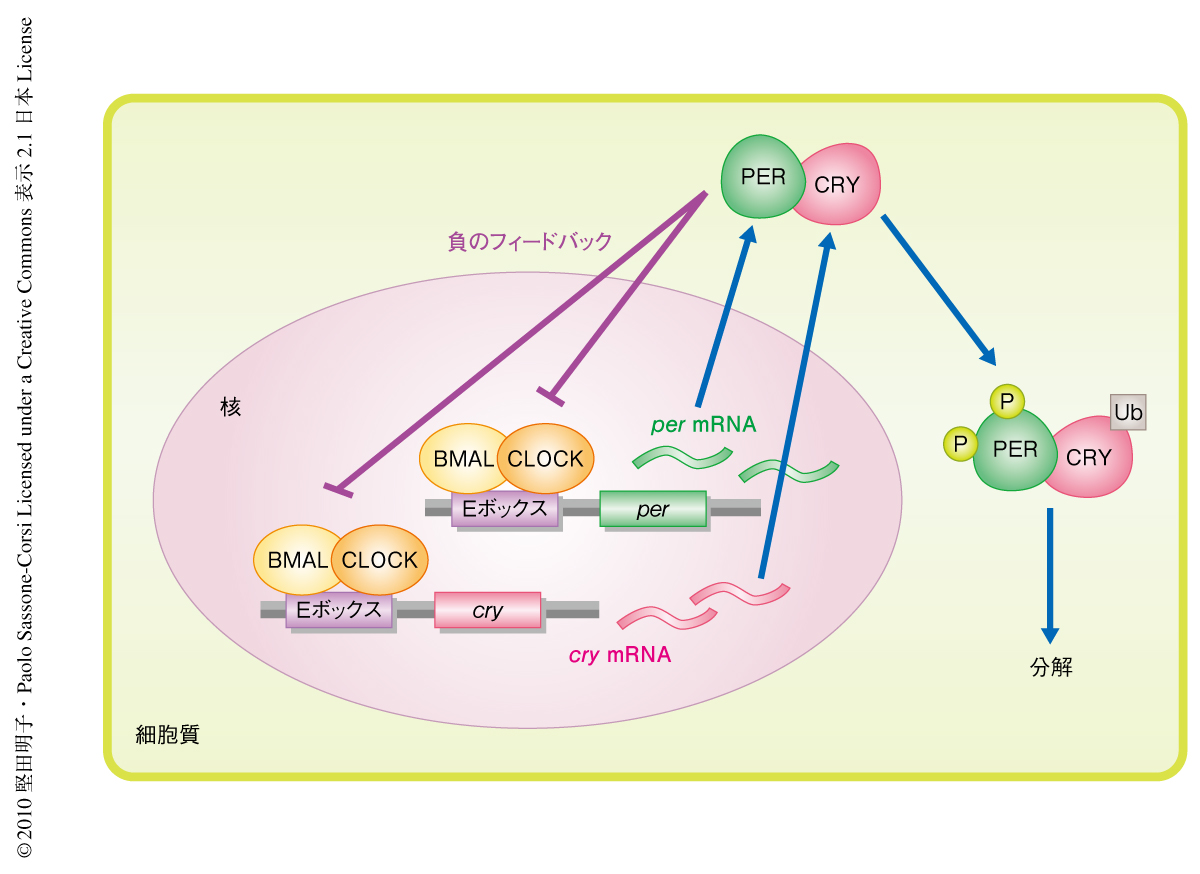
地球上に生息するほぼすべての生物は,その体内に正確に時間を刻む分子機構を獲得している.近年の報告では,全ゲノムのうち実に10%以上もの遺伝子においてその発現に概日リズム(サーカディアンリズム)が認められており1),これは生物が進化の過程でさまざまな生体機能を地球の自転時間である24時間と同調させて発達してきた証でもある.脊椎動物の生物時計の発振系においては,bHLH/PAS型の転写因子であるCLOCKとBMAL1とのヘテロ2量体が,時計遺伝子であるperiod(per)遺伝子やcryptochrome(cry)遺伝子のプロモーター領域に存在する6塩基の配列(Eボックス)に結合することで転写が活性化される.これら遺伝子の産物であるPERおよびCRYは直接にCLOCK-BMAL1ヘテロ2量体に作用して転写活性を抑制するため,自らの遺伝子の転写を負に制御する負のフィードバック機構が成立する(図1).このコアループが24時間という時間をかけて1サイクルすることにより生物時計のリズムが生み出されている2).
一般に,真核生物の遺伝子の転写活性化にはプロモーター領域のヒストンアセチル化が密接に関与することが知られているが,時計遺伝子であるper遺伝子やdbp遺伝子の転写制御においても転写が促進される時間帯にEボックス領域のヒストンがアセチル化されることが報告されている3).また近年,生物時計の発振の正の制御因子であるCLOCKがヒストンアセチルトランスフェラーゼ活性をもつこと4),また,ヒストンデアセチラーゼであるSIRT1がCLOCKと相互作用することで時計遺伝子のプロモーター領域におけるヒストンアセチル化のレベルを時間依存的に制御すること5),などが報告され,生物時計の分子機構においてクロマチンの構造制御の重要性が提唱されている.今回,筆者らは,ヒストンメチルトランスフェラーゼであるMLL1を介した時間依存的なクロマチンリモデリングが生物時計の発振に必須であることを明らかにした.
筆者らは,生物時計の発振におけるクロマチンリモデリングのはたらきをさらに追求すべく,ヒストンのアセチル化修飾にくわえてヒストンのメチル化修飾に注目した.ヒストンのアセチル化修飾は一般に塩基性タンパク質であるヒストンの正電荷を中和するためクロマチン構造が弛緩し転写の活性化が誘導される.一方,ヒストンのメチル化修飾はメチル化がひき起こされる部位(どのリジン残基あるいはアルギニン残基がメチル化されるか)とその程度(モノメチル化,ジメチル化,トリメチル化)によって作用が異なる6).ここでは,とくに転写活性化の指標としても知られるヒストンH3の4番目のリジン残基のトリメチル化に注目して解析を行った.
ヒストンH3の9番目と14番目のリジン残基のアセチル化,また,ヒストンH3の4番目のリジン残基のトリメチル化をそれぞれ認識する抗体を用いてクロマチン免疫沈降法を適用し,mRNAの発現が概日リズムを示しEボックス配列をもつ時計遺伝子dbpのヒストン修飾動態をマウス胎仔繊維芽細胞において解析した.その結果,dbp遺伝子のプロモーター領域におけるヒストンのアセチル化修飾,トリメチル化修飾ともに概日リズムが認められ,その転写活性が上昇する時間帯において修飾の度合いが最大であることが明らかになった.一方,dbp遺伝子の3’側非翻訳領域におけるヒストン修飾は1日をつうじて著しく低下していた.
ショウジョウバエTrithorax遺伝子の哺乳類ホモログの産物であるMLL1(mixed lineage leukemia 1)は,多くのヒストンメチルトランスフェラーゼに共通するSETドメインをそのC末端にもちヒストンH3の4番目のリジン残基を特異的にメチル化する酵素活性をもつ7).そこで,MLL1の転写活性化能を時計遺伝子のプロモーターを用いたレポーター遺伝子アッセイにて評価したところ,MLL1はCLOCK-BMAL1ヘテロ2量体に依存して転写活性を約6~7倍も上昇させた.この転写促進は,MLL1の酵素活性部位欠損体や,同じくヒストンH3の4番目のリジン残基に特異的なメチルトランスフェラーゼ活性をもつSET1Aの共発現では認められないことから,MLL1が時計遺伝子のプロモーター領域におけるヒストンH3の4番目のリジン残基のメチル化を介して特異的に時計遺伝子の発現を上昇させていることが示された.
そこで,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞を入手し,時計遺伝子であるper2遺伝子およびdbp遺伝子のプロモーター領域におけるヒストン修飾のレベルとmRNA量の日内変動を解析した.ヒストンH3の4番目のリジン残基のトリメチル化を認識する抗体を用いてクロマチン免疫沈降を行ったところ,野生型マウスに由来する胎仔繊維芽細胞では認められるトリメチル化の概日性の振動が,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞ではまったく認められず,このトリメチル化は1日を通じて著しく低下していた.興味深いことに,MLL1にはヒストンアセチルトランスフェラーゼ活性が認められないにもかかわらず,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞においては転写活性化の指標でもあるヒストンH3の9番目のリジン残基および14番目のリジン残基のアセチル化のレベルも低下していた.
つぎに,これらの細胞におけるper2遺伝子およびdbp遺伝子のmRNA量を測定したところ,ヒストン修飾の結果を反映するように,野生型マウスに由来する胎仔繊維芽細胞では認められるmRNAの概日性の発現量の変化がMLL1ノックアウトマウスに由来する胎仔繊維芽細胞では認められず,つねに低下していることが見い出された.
さらに,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞における遺伝子発現パターンを網羅的に解析すべくDNAマイクロアレイ解析を行ったが,野生型マウスに由来する胎仔繊維芽細胞で概日性の変動が認められた時計遺伝子のすべてにおいて発現量の変化は認められなかった.これらの結果は,時計遺伝子の発現にヒストンメチルトランスフェラーゼMLL1が必須であることを示したはじめての報告であった.
つぎに,共免疫沈降実験によってMLL1がCLOCKおよびBMAL1と直接に相互作用することを見い出した.タグを付加した代表的な時計遺伝子の転写因子をMLL1とともにHEK293細胞において共発現させ,MLL1と直接に相互作用するタンパク質の同定を試みた.その結果,MLL1は生物時計の発振の正の制御因子であるCLOCK,BMAL1とは直接に相互作用したが,負の制御因子であるPER1,PER2やCRY1,CRY2とは結合しないことが示された.
さらに,MLL1とCLOCK-BMAL1ヘテロ2量体との相互作用は時間依存的であることも明らかになった.すなわち,細胞に血清刺激をほどこすことで概日時間を同調させ,さまざまな概日時間をもつ細胞からタンパク質抽出液を作製して,抗CLOCK抗体を用いてCLOCKと相互作用するタンパク質を解析したところ,CLOCKとともにヘテロ2量体を形成するBMAL1は1日をつうじて一定量の結合が確認されたのにもかかわらず,MLL1との結合は転写活性の開始時間から最大となる時間帯においてのみ認められた.
また,時計遺伝子のプロモーター領域におけるCLOCK,BMAL1,MLL1の結合量の時間変化をクロマチン免疫沈降法により解析した結果,野生型マウスに由来する胎仔繊維芽細胞ではMLL1はCLOCK,BMAL1とともに転写の活性化されている時間帯に結合量が上昇しているにもかかわらず,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞ではいずれの時間においてもCLOCK,BMAL1の結合量が減少していた.すなわち,MLL1はCLOCK-BMAL1ヘテロ2量体と時間依存的に相互作用して時計遺伝子のプロモーター領域へとリクルートされ,転写因子複合体が安定的に結合するのに必須であることが明らかになった(図2a).
今回の報告において特筆すべきは,MLL1がCLOCKΔ19変異体とは相互作用しないことが示されたことである.HEK293細胞を用いてさきに述べた共免疫沈降実験を行った際に,MLL1は野生型CLOCKとは強く結合するものの,CLOCKΔ19変異体とはまったく相互作用しなかった.
CLOCKΔ19変異体は哺乳類において最初の時計遺伝子として発見されたclock遺伝子のクローニングのきっかけともなった変異体である.CLOCKΔ19変異マウスではclock遺伝子の19番目のエキソンにコードされる51アミノ酸残基が欠失することで行動レベルにおいても顕著な概日リズムの異常を示す8).CLOCKΔ19変異体は野生型CLOCKと同様にBMAL1とヘテロ2量体を形成してEボックスに結合し9),また,野生型CLOCKと同じ程度のヒストンアセチルトランスフェラーゼ活性をもつことから,CLOCKΔ19変異体の転写活性化能の欠失,また,それに起因する概日リズムの異常というマウスの劇的な表現型を説明する分子機構は,clock遺伝子のクローニング以来,長年にわたって不明であった.しかし,今回の報告はこのCLOCKΔ19変異体の分子機構を解明するものとしても非常に新しいものであった(図2b).
最後に,クロマチン免疫沈降法をCLOCKΔ19変異マウスに由来する胎仔繊維芽細胞に適用することでMLL1とBMAL1の時計遺伝子のプロモーター領域への結合量を解析したが,MLL1がCLOCKΔ19変異体と相互作用できない事実からも予想されたように,これらの細胞ではMLL1およびBMAL1の結合量は著しく減少していた.
筆者らの報告は,時計遺伝子の転写制御機構においてMLL1を介したクロマチンリモデリングが必須であることを示しただけでなく,哺乳類の最初の時計遺伝子として同定されたclock遺伝子の原因変異であるCLOCKΔ19変異の分子機構を十数年ごしに解明したという点においても非常にインパクトが高いものであった.
今回の報告により,CLOCK-BMALヘテロ2量体の結合による転写活性化の際のヒストン修飾状態および転写因子複合体の一端が解明されたが,今後は,転写抑制の際のクロマチンの動態に興味がもたれる.つまり,PER-CRYヘテロ2量体がプロモーター領域と相互作用する際にどのようなクロマチンリモデリング因子をリクルートするのか,また,転写活性化の指標となるヒストン修飾をどのように消去し転写抑制のためのクロマチン構造を形成するか,を明らかにすることが重要であろう.
哺乳類において概日リズムはほかの生物にみられないほど高度に発達しており,睡眠覚醒,体温上昇,ホルモン分泌,胃腸機能など,ほぼすべての生理現象が24時間のリズムを示す.したがって,薬物効果や代謝にも概日リズムが認められ,また,概日リズムの障害がさまざまなかたちで疾患とも密接に関連することが明らかにされつつある.概日リズムの研究は,成人病やがんなどの疾病との関連性を分子レベルで解明する研究にも波及効果をあたえることが期待される.
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,2007年より米国California大学Irvine校School of Medicinに留学中.
研究テーマ:クロマチンリモデリングによる時計遺伝子の発現制御機構の解明.
関心事:24時間を1周期として正確に遺伝子の発現量を調節する時計遺伝子の転写制御機構を解明することで,生物の発生や老化といった長期的に起こるさまざまな生命現象をどの程度まで普遍的に理解することができるのか興味深い.
Paolo Sassone-Corsi
米国California大学Irvine校School of MedicineにてDistinguished Professor.
© 2010 堅田明子・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本
(米国California大学Irvine校School of Medicine,Department of Pharmacology)
email:堅田明子
DOI: 10.7875/first.author.2010.071
The histone methyltransferase MLL1 permits the oscillation of circadian gene expression.
Sayako Katada & Paolo Sassone-Corsi
Nature Structural & Molecular Biology , 12, 1414-1421 (2010)
要 約
概日リズムの分子機構としては時計遺伝子の転写活性化とその産物による転写抑制という負のフィードバック機構が普遍的なモデルとして知られている.近年,遺伝子の転写制御についてヒストンの修飾によるクロマチンの構造変化(クロマチンリモデリング)が数多く報告されているが,生物時計の発振においてもその重要性が注目されている.筆者らは,時計遺伝子のプロモーター領域におけるヒストンH3の4番目のリジン残基のトリメチル化修飾に概日リズムがあること,また,このメチル化修飾が以前に報告したヒストンH3のアセチル化修飾と同じ時間帯に起こることを見い出した.ヒストンH3の4番目のリジン残基に特異的なメチルトランスフェラーゼであるMLL1は,時計遺伝子の転写因子としてはたらくCLOCK-BMAL1ヘテロ2量体と時間依存的に直接に相互作用することで時計遺伝子のプロモーター領域へとリクルートされ,安定的に結合することでヒストンH3の4番目のリジン残基のトリメチル化および転写活性を促進した.すなわち,MLL1はクロマチンリモデリングによって生物時計の発振に必須な転写因子がDNAに結合するための場の制御を行うことが明らかになった.
はじめに
地球上に生息するほぼすべての生物は,その体内に正確に時間を刻む分子機構を獲得している.近年の報告では,全ゲノムのうち実に10%以上もの遺伝子においてその発現に概日リズム(サーカディアンリズム)が認められており1),これは生物が進化の過程でさまざまな生体機能を地球の自転時間である24時間と同調させて発達してきた証でもある.脊椎動物の生物時計の発振系においては,bHLH/PAS型の転写因子であるCLOCKとBMAL1とのヘテロ2量体が,時計遺伝子であるperiod(per)遺伝子やcryptochrome(cry)遺伝子のプロモーター領域に存在する6塩基の配列(Eボックス)に結合することで転写が活性化される.これら遺伝子の産物であるPERおよびCRYは直接にCLOCK-BMAL1ヘテロ2量体に作用して転写活性を抑制するため,自らの遺伝子の転写を負に制御する負のフィードバック機構が成立する(図1).このコアループが24時間という時間をかけて1サイクルすることにより生物時計のリズムが生み出されている2).
一般に,真核生物の遺伝子の転写活性化にはプロモーター領域のヒストンアセチル化が密接に関与することが知られているが,時計遺伝子であるper遺伝子やdbp遺伝子の転写制御においても転写が促進される時間帯にEボックス領域のヒストンがアセチル化されることが報告されている3).また近年,生物時計の発振の正の制御因子であるCLOCKがヒストンアセチルトランスフェラーゼ活性をもつこと4),また,ヒストンデアセチラーゼであるSIRT1がCLOCKと相互作用することで時計遺伝子のプロモーター領域におけるヒストンアセチル化のレベルを時間依存的に制御すること5),などが報告され,生物時計の分子機構においてクロマチンの構造制御の重要性が提唱されている.今回,筆者らは,ヒストンメチルトランスフェラーゼであるMLL1を介した時間依存的なクロマチンリモデリングが生物時計の発振に必須であることを明らかにした.
1.時計遺伝子のプロモーター領域におけるヒストンのメチル化修飾には概日リズムがある
筆者らは,生物時計の発振におけるクロマチンリモデリングのはたらきをさらに追求すべく,ヒストンのアセチル化修飾にくわえてヒストンのメチル化修飾に注目した.ヒストンのアセチル化修飾は一般に塩基性タンパク質であるヒストンの正電荷を中和するためクロマチン構造が弛緩し転写の活性化が誘導される.一方,ヒストンのメチル化修飾はメチル化がひき起こされる部位(どのリジン残基あるいはアルギニン残基がメチル化されるか)とその程度(モノメチル化,ジメチル化,トリメチル化)によって作用が異なる6).ここでは,とくに転写活性化の指標としても知られるヒストンH3の4番目のリジン残基のトリメチル化に注目して解析を行った.
ヒストンH3の9番目と14番目のリジン残基のアセチル化,また,ヒストンH3の4番目のリジン残基のトリメチル化をそれぞれ認識する抗体を用いてクロマチン免疫沈降法を適用し,mRNAの発現が概日リズムを示しEボックス配列をもつ時計遺伝子dbpのヒストン修飾動態をマウス胎仔繊維芽細胞において解析した.その結果,dbp遺伝子のプロモーター領域におけるヒストンのアセチル化修飾,トリメチル化修飾ともに概日リズムが認められ,その転写活性が上昇する時間帯において修飾の度合いが最大であることが明らかになった.一方,dbp遺伝子の3’側非翻訳領域におけるヒストン修飾は1日をつうじて著しく低下していた.
2.MLL1はCLOCK-BMAL1ヘテロ2量体に依存的に時計遺伝子の転写活性を上昇させる
ショウジョウバエTrithorax遺伝子の哺乳類ホモログの産物であるMLL1(mixed lineage leukemia 1)は,多くのヒストンメチルトランスフェラーゼに共通するSETドメインをそのC末端にもちヒストンH3の4番目のリジン残基を特異的にメチル化する酵素活性をもつ7).そこで,MLL1の転写活性化能を時計遺伝子のプロモーターを用いたレポーター遺伝子アッセイにて評価したところ,MLL1はCLOCK-BMAL1ヘテロ2量体に依存して転写活性を約6~7倍も上昇させた.この転写促進は,MLL1の酵素活性部位欠損体や,同じくヒストンH3の4番目のリジン残基に特異的なメチルトランスフェラーゼ活性をもつSET1Aの共発現では認められないことから,MLL1が時計遺伝子のプロモーター領域におけるヒストンH3の4番目のリジン残基のメチル化を介して特異的に時計遺伝子の発現を上昇させていることが示された.
3.MLL1は時間依存的なヒストンのメチル化修飾および時計遺伝子の発現に必須である
そこで,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞を入手し,時計遺伝子であるper2遺伝子およびdbp遺伝子のプロモーター領域におけるヒストン修飾のレベルとmRNA量の日内変動を解析した.ヒストンH3の4番目のリジン残基のトリメチル化を認識する抗体を用いてクロマチン免疫沈降を行ったところ,野生型マウスに由来する胎仔繊維芽細胞では認められるトリメチル化の概日性の振動が,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞ではまったく認められず,このトリメチル化は1日を通じて著しく低下していた.興味深いことに,MLL1にはヒストンアセチルトランスフェラーゼ活性が認められないにもかかわらず,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞においては転写活性化の指標でもあるヒストンH3の9番目のリジン残基および14番目のリジン残基のアセチル化のレベルも低下していた.
つぎに,これらの細胞におけるper2遺伝子およびdbp遺伝子のmRNA量を測定したところ,ヒストン修飾の結果を反映するように,野生型マウスに由来する胎仔繊維芽細胞では認められるmRNAの概日性の発現量の変化がMLL1ノックアウトマウスに由来する胎仔繊維芽細胞では認められず,つねに低下していることが見い出された.
さらに,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞における遺伝子発現パターンを網羅的に解析すべくDNAマイクロアレイ解析を行ったが,野生型マウスに由来する胎仔繊維芽細胞で概日性の変動が認められた時計遺伝子のすべてにおいて発現量の変化は認められなかった.これらの結果は,時計遺伝子の発現にヒストンメチルトランスフェラーゼMLL1が必須であることを示したはじめての報告であった.
4.MLL1はCLOCK-BMAL1ヘテロ2量体と時間依存的に相互作用し時計遺伝子のプロモーター領域へとリクルートされる
つぎに,共免疫沈降実験によってMLL1がCLOCKおよびBMAL1と直接に相互作用することを見い出した.タグを付加した代表的な時計遺伝子の転写因子をMLL1とともにHEK293細胞において共発現させ,MLL1と直接に相互作用するタンパク質の同定を試みた.その結果,MLL1は生物時計の発振の正の制御因子であるCLOCK,BMAL1とは直接に相互作用したが,負の制御因子であるPER1,PER2やCRY1,CRY2とは結合しないことが示された.
さらに,MLL1とCLOCK-BMAL1ヘテロ2量体との相互作用は時間依存的であることも明らかになった.すなわち,細胞に血清刺激をほどこすことで概日時間を同調させ,さまざまな概日時間をもつ細胞からタンパク質抽出液を作製して,抗CLOCK抗体を用いてCLOCKと相互作用するタンパク質を解析したところ,CLOCKとともにヘテロ2量体を形成するBMAL1は1日をつうじて一定量の結合が確認されたのにもかかわらず,MLL1との結合は転写活性の開始時間から最大となる時間帯においてのみ認められた.
また,時計遺伝子のプロモーター領域におけるCLOCK,BMAL1,MLL1の結合量の時間変化をクロマチン免疫沈降法により解析した結果,野生型マウスに由来する胎仔繊維芽細胞ではMLL1はCLOCK,BMAL1とともに転写の活性化されている時間帯に結合量が上昇しているにもかかわらず,MLL1ノックアウトマウスに由来する胎仔繊維芽細胞ではいずれの時間においてもCLOCK,BMAL1の結合量が減少していた.すなわち,MLL1はCLOCK-BMAL1ヘテロ2量体と時間依存的に相互作用して時計遺伝子のプロモーター領域へとリクルートされ,転写因子複合体が安定的に結合するのに必須であることが明らかになった(図2a).
5.MLL1は概日リズム異常の起因となるCLOCKの変異体とは相互作用しない
今回の報告において特筆すべきは,MLL1がCLOCKΔ19変異体とは相互作用しないことが示されたことである.HEK293細胞を用いてさきに述べた共免疫沈降実験を行った際に,MLL1は野生型CLOCKとは強く結合するものの,CLOCKΔ19変異体とはまったく相互作用しなかった.
CLOCKΔ19変異体は哺乳類において最初の時計遺伝子として発見されたclock遺伝子のクローニングのきっかけともなった変異体である.CLOCKΔ19変異マウスではclock遺伝子の19番目のエキソンにコードされる51アミノ酸残基が欠失することで行動レベルにおいても顕著な概日リズムの異常を示す8).CLOCKΔ19変異体は野生型CLOCKと同様にBMAL1とヘテロ2量体を形成してEボックスに結合し9),また,野生型CLOCKと同じ程度のヒストンアセチルトランスフェラーゼ活性をもつことから,CLOCKΔ19変異体の転写活性化能の欠失,また,それに起因する概日リズムの異常というマウスの劇的な表現型を説明する分子機構は,clock遺伝子のクローニング以来,長年にわたって不明であった.しかし,今回の報告はこのCLOCKΔ19変異体の分子機構を解明するものとしても非常に新しいものであった(図2b).
最後に,クロマチン免疫沈降法をCLOCKΔ19変異マウスに由来する胎仔繊維芽細胞に適用することでMLL1とBMAL1の時計遺伝子のプロモーター領域への結合量を解析したが,MLL1がCLOCKΔ19変異体と相互作用できない事実からも予想されたように,これらの細胞ではMLL1およびBMAL1の結合量は著しく減少していた.
おわりに
筆者らの報告は,時計遺伝子の転写制御機構においてMLL1を介したクロマチンリモデリングが必須であることを示しただけでなく,哺乳類の最初の時計遺伝子として同定されたclock遺伝子の原因変異であるCLOCKΔ19変異の分子機構を十数年ごしに解明したという点においても非常にインパクトが高いものであった.
今回の報告により,CLOCK-BMALヘテロ2量体の結合による転写活性化の際のヒストン修飾状態および転写因子複合体の一端が解明されたが,今後は,転写抑制の際のクロマチンの動態に興味がもたれる.つまり,PER-CRYヘテロ2量体がプロモーター領域と相互作用する際にどのようなクロマチンリモデリング因子をリクルートするのか,また,転写活性化の指標となるヒストン修飾をどのように消去し転写抑制のためのクロマチン構造を形成するか,を明らかにすることが重要であろう.
哺乳類において概日リズムはほかの生物にみられないほど高度に発達しており,睡眠覚醒,体温上昇,ホルモン分泌,胃腸機能など,ほぼすべての生理現象が24時間のリズムを示す.したがって,薬物効果や代謝にも概日リズムが認められ,また,概日リズムの障害がさまざまなかたちで疾患とも密接に関連することが明らかにされつつある.概日リズムの研究は,成人病やがんなどの疾病との関連性を分子レベルで解明する研究にも波及効果をあたえることが期待される.
文 献
- Panda, S., Antoch, M. P., Miller, B. H. et al.: Coordinated transcription of key pathways in the mouse by the circadian clock. Cell, 109, 307-320 (2002)[PubMed]
- Dunlap, J. C.: Molecular bases for circadian clocks. Cell, 96, 271-290 (1999)[PubMed]
- Etchegaray, J. P., Lee, C., Wade, P. A. et al.: Rhythmic histone acetylation underlies transcription in the mammalian circadian clock. Nature, 421, 177-182 (2003)[PubMed]
- Doi, M., Hirayama, J. & Sassone-Corsi, P.: Circadian regulator CLOCK is a histone acetyltransferase. Cell, 125, 497-508 (2006)[PubMed]
- Nakahata, Y., Kaluzova, M., Grimaldi, B. et al.: The NAD+-dependent deacetylase SIRT1 modulates CLOCK mediated chromatin remodeling and circadian control. Cell, 134, 329-340 (2008)[PubMed]
- Ruthenburg, A. J., Li, H., Patel, D. J. et al.: Multivalent engagement of chromatin modifications by linked binding modules. Nat. Rev. Mol. Cell Biol., 8, 983-994 (2007)[PubMed]
- Milne, T. A., Briggs, S. D., Brock, H. W. et al.: MLL targets SET domain methyltransferase activity to Hox gene promoters. Mol. Cell, 10, 1107-1117 (2002)[PubMed]
- King, D. P., Zhao, Y., Sangoram, A. M. et al.: Positional cloning of the mouse circadian clock gene. Cell, 89, 641-653 (1997)[PubMed]
- Gekakis, N., Staknis, D., Nguyen, H. B. et al.: Role of the CLOCK protein in the mammalian circadian mechanism. Science, 280, 1564-1569 (1998)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,2007年より米国California大学Irvine校School of Medicinに留学中.
研究テーマ:クロマチンリモデリングによる時計遺伝子の発現制御機構の解明.
関心事:24時間を1周期として正確に遺伝子の発現量を調節する時計遺伝子の転写制御機構を解明することで,生物の発生や老化といった長期的に起こるさまざまな生命現象をどの程度まで普遍的に理解することができるのか興味深い.
Paolo Sassone-Corsi
米国California大学Irvine校School of MedicineにてDistinguished Professor.
© 2010 堅田明子・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本