利己的なDNAは紡錘体における非対称性を利用して次世代へ優先的に伝達される
明楽 隆志
(米国Pennsylvania大学Department of Biology)
email:明楽隆志
DOI: 10.7875/first.author.2017.118
Spindle asymmetry drives non-Mendelian chromosome segregation.
Takashi Akera, Lukáš Chmátal, Emily Trimm, Karren Yang, Chanat Aonbangkhen, David M. Chenoweth, Carsten Janke, Richard M. Schultz, Michael A. Lampson
Science, 358, 668-672 (2017)
メンデルの分離の法則により,減数分裂において1対の相同染色体は配偶子へランダムに分配されることが規定される.しかし,この法則に従わず,配偶子により分配されやすい性質を獲得したDNAの存在が報告されている.このような利己的なDNAは卵母細胞における非対称な細胞分裂を利用し次世代へ優先的に伝達される.卵母細胞の非対称分裂においては卵および極体が形成され,卵に分配された染色体のみが次世代へ伝達される.すなわち,利己的なDNAは卵に分配される側の紡錘体と結合する必要がある.この理論は紡錘体になんらかの非対称性のあることを前提とするが,その分子機構は未知であった.この研究において,筆者らは,GTPaseであるCDC42が紡錘体の片側において微小管のチロシン化を促進することにより非対称性をひき起こし,利己的なDNAが卵に分配されるための道しるべとなることを解明した.利己的なDNAが哺乳動物の減数分裂をハイジャックする分子機構がはじめて明らかにされた.
2倍体が1倍体となる減数分裂においては,相同染色体どうしが次世代への伝達をかけて争う.メンデルの分離の法則により,減数分裂において1対の相同染色体(あるいは,遺伝子座)はランダムに分配されることが規定されるが,この法則に従わず,配偶子により分配されやすい性質を獲得したDNAが酵母,昆虫,植物,哺乳動物など真核生物において広く報告されている1).この現象は減数分裂における分離比のひずみ(meiotic drive)として70年以上もまえから知られていたが,その分子機構は未知であった.利己的なDNAは競合する配偶子を排除すること,あるいは,卵母細胞の非対称分裂を利用することにより次世代に優先的に伝達される.これにより,利己的なDNAは最終的に集団において固定されるため,減数分裂における分離比のひずみは染色体の進化をひき起こす.
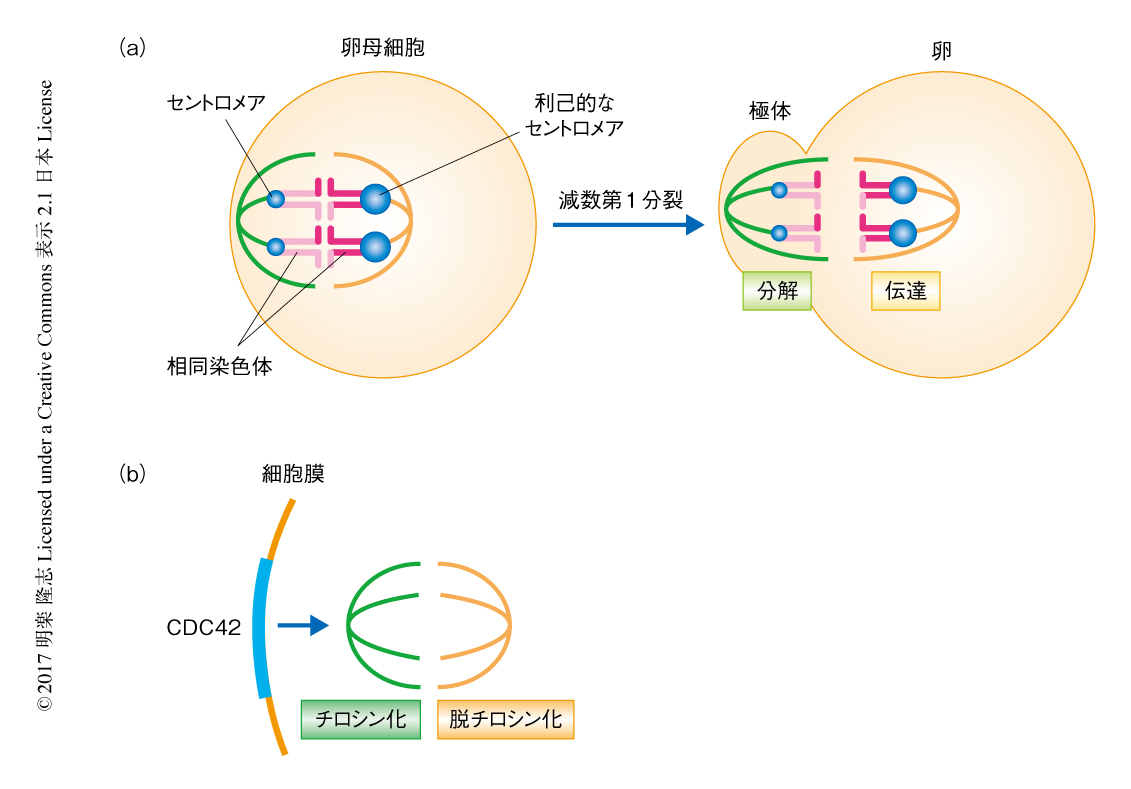
卵母細胞においては,卵に分配された染色体のみが次世代に伝達され,極体に放出された染色体は分解される(図1a).したがって,この非対称な運命は利己的なDNAが次世代に優先的に伝達するのに絶好の機会をあたえる.卵母細胞での減数分裂における分離比のひずみは,非対称な運命をともなう細胞分裂,相同染色体の分配を制御する領域の非対称性,紡錘体における非対称性2),の3つの非対称性をみたした際に発動する.非対称な細胞分裂は卵母細胞において自明であり,相同染色体の分配を制御する領域の非対称性については,筆者らの研究室において,染色体分配を担うセントロメアDNAおよびそこに局在するセントロメアタンパク質の非対称性が重要であることが示されている3,4).しかし,紡錘体における非対称性についてはこれまでほとんど知見がなく,その分子機構は未知であった.
卵母細胞の紡錘体は片側の極が細胞膜につなぎとめられた配置をとる(図1a).そして,細胞膜の側の極が極体に,逆の側の極が卵に分配される.利己的なDNAが卵の側の極に結合するためには,卵の側の極のみがもつなんらかの目印を道しるべにする必要がある.紡錘体が非対称性をもたない場合,利己的なDNAはどちらの側が卵に分配するのか判別できないからである.紡錘体は微小管からなるダイナミックな構造体である.すでに複数の研究グループにより報告されていたように,微小管を構成するチューブリンを染色しただけでは非対称性はみられなかったため,チューブリンの翻訳後修飾に注目した5).チューブリンの翻訳後修飾は微小管のダイナミクスを変化させ染色体との結合の様式に影響をおよぼすことが知られている6).マウスの卵母細胞においてチューブリンの翻訳後修飾の局在を観察したところ,チロシン化されたαチューブリンは極体の側に,脱チロシン化されたαチューブリンは卵の側により多く局在し,紡錘体において非対称な局在を示していた(図1b).これにより,未知であった紡錘体における非対称性の分子的な実体がはじめて明らかにされた.
マウスの卵母細胞では紡錘体は細胞の中央において形成され,そののち,細胞膜の近傍へと移動する.細胞の中央に位置する紡錘体および細胞膜の近傍の紡錘体において,チロシン化されたαチューブリンおよび脱チロシン化されたαチューブリンの局在を観察したところ,細胞膜の近傍の紡錘体においてのみ非対称な局在が確認された.したがって,紡錘体が細胞膜の近傍に位置することは非対称性を獲得するために必須であることがわかった.
チロシン化されたαチューブリンは極体の側の紡錘体により局在したことから,細胞膜に局在するなんらかのタンパク質がαチューブリンのチロシン化を促進する可能性が考えられた.そこで,この時期に特異的に細胞膜に集積するGTPaseであるCDC42およびRACをその候補として検討した.すると,CDC42のドミナントネガティブ変異体を発現させてCDC42の機能を阻害すると,チロシン化されたαチューブリンの局在は全体的に低下し非対称性も失われた.一方で,RACのドミナントネガティブ変異体を発現させた場合には紡錘体における非対称性に変化はみられなかった.したがって,細胞膜に局在するCDC42が極体の側の紡錘体においてαチューブリンのチロシン化を促進し,紡錘体において非対称性をひき起こすことがわかった(図1b).
CDC42の活性が紡錘体に非対称性をひき起こすのに十分であるかどうかを検討するため,細胞の中央に位置する紡錘体に人工的に非対称性を導入することを試みた.具体的には,筆者らの研究室において開発された,光によるタンパク質の二量体化の系を卵母細胞に適用し7,8),CDC42を紡錘体の片側の極においてのみ局在化させてαチューブリンのチロシン化を促進し人工的に非対称性をつくりだした.その結果,紡錘体に対してCDC42が非対称に局在することが非対称性の根幹であることがわかった.
減数分裂における分離比のひずみに対する紡錘体の非対称性の重要性について検討するため,減数分裂における分離比のひずみを観察する系を構築した.利己的なセントロメアDNAをもつマウスともたないマウスとを交配させハイブリッドマウスを作製した.筆者らの研究室における先行研究により,利己的なセントロメアDNAはペアを組むセントロメアDNAと比べ多くのセントロメアタンパク質が局在することがわかっていたことから3,4),セントロメアタンパク質を可視化することにより利己的なセントロメアDNAを判別し,減数分裂の際に紡錘体において卵の側を向く頻度を測定した.すると,利己的なセントロメアDNAは卵の側を優先的に向くことがわかった.CDC42のドミナントネガティブ変異体を発現させて紡錘体における非対称性を失わせた卵母細胞において同様に測定したところ,利己的なセントロメアDNAはランダムな向きを示した.これらの結果から,紡錘体における非対称性は利己的なセントロメアDNAが減数分裂における分離比のひずみを示すにあたり必須であることが実験的に示された.
紡錘体における非対称性により,どのように利己的なセントロメアDNAは卵の側に向くのだろうか.利己的なセントロメアDNAと紡錘体との結合を詳細に観察したところ,利己的なセントロメアDNAはチロシン化された微小管が集積する極体の側の紡錘体とは安定した結合を形成しないことがわかった.したがって,利己的なセントロメアDNAが極体の側を向いた場合には紡錘体との結合は解除されやすく,紡錘体のうえでひっくり返り卵の側を優先的に向くと考えられた(図2).このモデルを支持する結果として,減数分裂における分離比のひずみを観察する系において,しばしば相同染色体がひっくり返るのが観察された.また,微小管はチロシン化により不安定化されセントロメアとの結合は解除されやすくなることがわかった.
今回の研究により,紡錘体の非対称性が減数分裂における分離比のひずみの必須の要素であることがはじめて実験的に示された.また,細胞膜からのシグナルが微小管を直接に制御して紡錘体に非対称性をつくりだすことが明らかにされた.細胞膜の側の紡錘体は必ず極体に放出される.したがって,この分子機構は紡錘体における非対称性を細胞の運命にそった正しい向きに確立することも保証する.
これまで,進化学的な研究や遺伝学的な研究により,利己性を示す染色体の領域が多く同定されていた.今回の研究においては,細胞生物学的なアプローチを用いて,減数分裂の際に実際にどのようにして利己的なDNAが配偶子にたどり着くかが明らかにされた.今後は,セントロメアDNAやほかのDNAがどのように利己性を獲得するのか,その分子機構にせまっていきたい.
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,東京大学分子細胞生物学研究所 ポスドクを経て,2015年より米国Pennsylvania大学 ポスドク.
研究テーマ:染色体の分配および進化.
抱負:サイエンスを楽しむ.
© 2017 明楽 隆志 Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学Department of Biology)
email:明楽隆志
DOI: 10.7875/first.author.2017.118
Spindle asymmetry drives non-Mendelian chromosome segregation.
Takashi Akera, Lukáš Chmátal, Emily Trimm, Karren Yang, Chanat Aonbangkhen, David M. Chenoweth, Carsten Janke, Richard M. Schultz, Michael A. Lampson
Science, 358, 668-672 (2017)
要 約
メンデルの分離の法則により,減数分裂において1対の相同染色体は配偶子へランダムに分配されることが規定される.しかし,この法則に従わず,配偶子により分配されやすい性質を獲得したDNAの存在が報告されている.このような利己的なDNAは卵母細胞における非対称な細胞分裂を利用し次世代へ優先的に伝達される.卵母細胞の非対称分裂においては卵および極体が形成され,卵に分配された染色体のみが次世代へ伝達される.すなわち,利己的なDNAは卵に分配される側の紡錘体と結合する必要がある.この理論は紡錘体になんらかの非対称性のあることを前提とするが,その分子機構は未知であった.この研究において,筆者らは,GTPaseであるCDC42が紡錘体の片側において微小管のチロシン化を促進することにより非対称性をひき起こし,利己的なDNAが卵に分配されるための道しるべとなることを解明した.利己的なDNAが哺乳動物の減数分裂をハイジャックする分子機構がはじめて明らかにされた.
はじめに
2倍体が1倍体となる減数分裂においては,相同染色体どうしが次世代への伝達をかけて争う.メンデルの分離の法則により,減数分裂において1対の相同染色体(あるいは,遺伝子座)はランダムに分配されることが規定されるが,この法則に従わず,配偶子により分配されやすい性質を獲得したDNAが酵母,昆虫,植物,哺乳動物など真核生物において広く報告されている1).この現象は減数分裂における分離比のひずみ(meiotic drive)として70年以上もまえから知られていたが,その分子機構は未知であった.利己的なDNAは競合する配偶子を排除すること,あるいは,卵母細胞の非対称分裂を利用することにより次世代に優先的に伝達される.これにより,利己的なDNAは最終的に集団において固定されるため,減数分裂における分離比のひずみは染色体の進化をひき起こす.
卵母細胞においては,卵に分配された染色体のみが次世代に伝達され,極体に放出された染色体は分解される(図1a).したがって,この非対称な運命は利己的なDNAが次世代に優先的に伝達するのに絶好の機会をあたえる.卵母細胞での減数分裂における分離比のひずみは,非対称な運命をともなう細胞分裂,相同染色体の分配を制御する領域の非対称性,紡錘体における非対称性2),の3つの非対称性をみたした際に発動する.非対称な細胞分裂は卵母細胞において自明であり,相同染色体の分配を制御する領域の非対称性については,筆者らの研究室において,染色体分配を担うセントロメアDNAおよびそこに局在するセントロメアタンパク質の非対称性が重要であることが示されている3,4).しかし,紡錘体における非対称性についてはこれまでほとんど知見がなく,その分子機構は未知であった.
1.マウスの卵母細胞の紡錘体は細胞膜につなぎとめられる際に非対称性を獲得する
卵母細胞の紡錘体は片側の極が細胞膜につなぎとめられた配置をとる(図1a).そして,細胞膜の側の極が極体に,逆の側の極が卵に分配される.利己的なDNAが卵の側の極に結合するためには,卵の側の極のみがもつなんらかの目印を道しるべにする必要がある.紡錘体が非対称性をもたない場合,利己的なDNAはどちらの側が卵に分配するのか判別できないからである.紡錘体は微小管からなるダイナミックな構造体である.すでに複数の研究グループにより報告されていたように,微小管を構成するチューブリンを染色しただけでは非対称性はみられなかったため,チューブリンの翻訳後修飾に注目した5).チューブリンの翻訳後修飾は微小管のダイナミクスを変化させ染色体との結合の様式に影響をおよぼすことが知られている6).マウスの卵母細胞においてチューブリンの翻訳後修飾の局在を観察したところ,チロシン化されたαチューブリンは極体の側に,脱チロシン化されたαチューブリンは卵の側により多く局在し,紡錘体において非対称な局在を示していた(図1b).これにより,未知であった紡錘体における非対称性の分子的な実体がはじめて明らかにされた.
マウスの卵母細胞では紡錘体は細胞の中央において形成され,そののち,細胞膜の近傍へと移動する.細胞の中央に位置する紡錘体および細胞膜の近傍の紡錘体において,チロシン化されたαチューブリンおよび脱チロシン化されたαチューブリンの局在を観察したところ,細胞膜の近傍の紡錘体においてのみ非対称な局在が確認された.したがって,紡錘体が細胞膜の近傍に位置することは非対称性を獲得するために必須であることがわかった.
2.細胞膜に局在するCDC42が紡錘体に非対称性をひき起こす
チロシン化されたαチューブリンは極体の側の紡錘体により局在したことから,細胞膜に局在するなんらかのタンパク質がαチューブリンのチロシン化を促進する可能性が考えられた.そこで,この時期に特異的に細胞膜に集積するGTPaseであるCDC42およびRACをその候補として検討した.すると,CDC42のドミナントネガティブ変異体を発現させてCDC42の機能を阻害すると,チロシン化されたαチューブリンの局在は全体的に低下し非対称性も失われた.一方で,RACのドミナントネガティブ変異体を発現させた場合には紡錘体における非対称性に変化はみられなかった.したがって,細胞膜に局在するCDC42が極体の側の紡錘体においてαチューブリンのチロシン化を促進し,紡錘体において非対称性をひき起こすことがわかった(図1b).
CDC42の活性が紡錘体に非対称性をひき起こすのに十分であるかどうかを検討するため,細胞の中央に位置する紡錘体に人工的に非対称性を導入することを試みた.具体的には,筆者らの研究室において開発された,光によるタンパク質の二量体化の系を卵母細胞に適用し7,8),CDC42を紡錘体の片側の極においてのみ局在化させてαチューブリンのチロシン化を促進し人工的に非対称性をつくりだした.その結果,紡錘体に対してCDC42が非対称に局在することが非対称性の根幹であることがわかった.
3.紡錘体の非対称性は減数分裂における分離比のひずみに必須である
減数分裂における分離比のひずみに対する紡錘体の非対称性の重要性について検討するため,減数分裂における分離比のひずみを観察する系を構築した.利己的なセントロメアDNAをもつマウスともたないマウスとを交配させハイブリッドマウスを作製した.筆者らの研究室における先行研究により,利己的なセントロメアDNAはペアを組むセントロメアDNAと比べ多くのセントロメアタンパク質が局在することがわかっていたことから3,4),セントロメアタンパク質を可視化することにより利己的なセントロメアDNAを判別し,減数分裂の際に紡錘体において卵の側を向く頻度を測定した.すると,利己的なセントロメアDNAは卵の側を優先的に向くことがわかった.CDC42のドミナントネガティブ変異体を発現させて紡錘体における非対称性を失わせた卵母細胞において同様に測定したところ,利己的なセントロメアDNAはランダムな向きを示した.これらの結果から,紡錘体における非対称性は利己的なセントロメアDNAが減数分裂における分離比のひずみを示すにあたり必須であることが実験的に示された.
4.チロシン化された微小管は利己的なDNAを卵へと導く
紡錘体における非対称性により,どのように利己的なセントロメアDNAは卵の側に向くのだろうか.利己的なセントロメアDNAと紡錘体との結合を詳細に観察したところ,利己的なセントロメアDNAはチロシン化された微小管が集積する極体の側の紡錘体とは安定した結合を形成しないことがわかった.したがって,利己的なセントロメアDNAが極体の側を向いた場合には紡錘体との結合は解除されやすく,紡錘体のうえでひっくり返り卵の側を優先的に向くと考えられた(図2).このモデルを支持する結果として,減数分裂における分離比のひずみを観察する系において,しばしば相同染色体がひっくり返るのが観察された.また,微小管はチロシン化により不安定化されセントロメアとの結合は解除されやすくなることがわかった.
おわりに
今回の研究により,紡錘体の非対称性が減数分裂における分離比のひずみの必須の要素であることがはじめて実験的に示された.また,細胞膜からのシグナルが微小管を直接に制御して紡錘体に非対称性をつくりだすことが明らかにされた.細胞膜の側の紡錘体は必ず極体に放出される.したがって,この分子機構は紡錘体における非対称性を細胞の運命にそった正しい向きに確立することも保証する.
これまで,進化学的な研究や遺伝学的な研究により,利己性を示す染色体の領域が多く同定されていた.今回の研究においては,細胞生物学的なアプローチを用いて,減数分裂の際に実際にどのようにして利己的なDNAが配偶子にたどり着くかが明らかにされた.今後は,セントロメアDNAやほかのDNAがどのように利己性を獲得するのか,その分子機構にせまっていきたい.
文 献
- Lindholm, A. K., Dyer, K. A., Firman, R. C. et al.: The ecology and evolutionary dynamics of meiotic drive. Trends Ecol. Evol., 31, 315-326 (2016)[PubMed]
- Pardo-Manuel de Villena, F. & Sapienza, C.: Nonrandom segregation during meiosis: the unfairness of females. Mamm. Genome, 12, 331-339 (2001)[PubMed]
- Iwata-Otsubo, A., Dawicki-McKenna, J. M., Akera, T. et al.: Expanded satellite repeats amplify a discrete CENP-A nucleosome assembly site on chromosomes that drive in female meiosis. Curr. Biol., 27, 2365-2373.e8 (2017)[PubMed]
- Chmatal, L., Gabriel, S. I., Mitsainas, G. P. et al.: Centromere strength provides the cell biological basis for meiotic drive and karyotype evolution in mice. Curr. Biol., 24, 2295-2300 (2014)[PubMed]
- Janke, C.: The tubulin code: molecular components, readout mechanisms, functions. J. Cell Biol., 206, 461-472 (2014)[PubMed]
- Barisic, M., Silva e Sousa, R., Tripathy, S. K. et al.: Microtubule detyrosination guides chromosomes during mitosis. Science, 348, 799-803 (2015)[PubMed]
- Ballister, E. R., Aonbangkhen, C., Mayo, A. M. et al.: Localized light-induced protein dimerization in living cells using a photocaged dimerizer. Nat. Commun., 5, 5475 (2014)[PubMed]
- Zhang, H., Aonbangkhen, C., Tarasovetc, E. et al.: Optogenetic control of kinetochore function. Nat. Chem. Biol., 13, 1096-1101 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,東京大学分子細胞生物学研究所 ポスドクを経て,2015年より米国Pennsylvania大学 ポスドク.
研究テーマ:染色体の分配および進化.
抱負:サイエンスを楽しむ.
© 2017 明楽 隆志 Licensed under CC 表示 2.1 日本