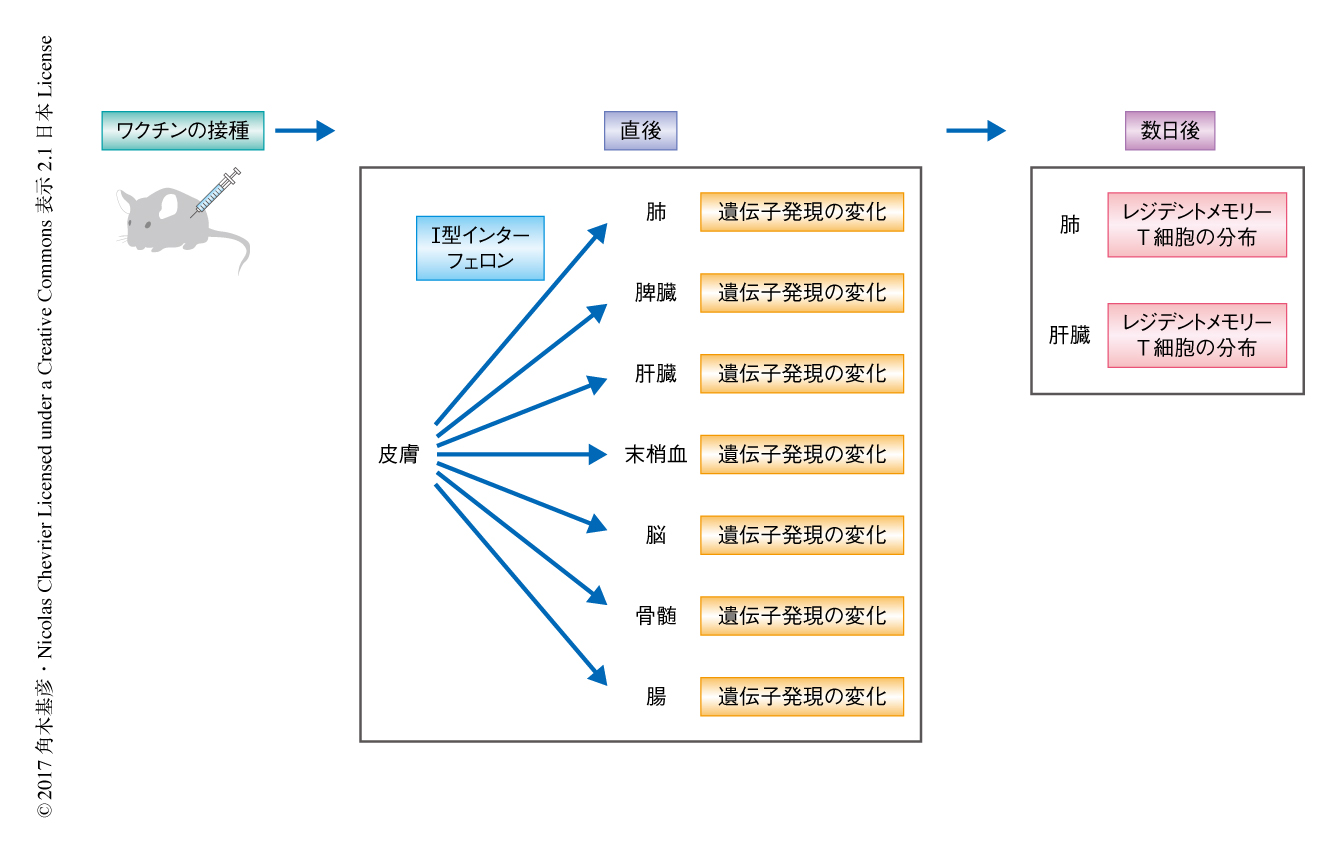
個体レベルでの遺伝子発現の網羅的な解析から明らかにされたワクチンによる生体防御における臓器間のネットワーク
角木基彦・Nicolas Chevrier
(米国Harvard大学Faculty of Arts & Sciences Center for Systems Biology)
email:角木基彦
DOI: 10.7875/first.author.2017.113
Organism-level analysis of vaccination reveals networks of protection across tissues.
Motohiko Kadoki, Ashwini Patil, Cornelius C. Thaiss, Donald J. Brooks, Surya Pandey, Deeksha Deep, David Alvarez, Ulrich H. von Andrian, Amy J. Wagers, Kenta Nakai, Tarjei S. Mikkelsen, Magali Soumillon, Nicolas Chevrier
Cell, 171, 398-413.e21 (2017)
多細胞生物は分子レベル,細胞レベル,臓器レベルでの多様な相互作用を介して恒常性を維持しており,これら重層的な相互作用の統合的な理解は個体としての生物の応答を知るうえで重要である.この研究において,筆者らは,マウスを用いたワクチンの接種およびウイルスの感染に対する免疫応答をモデルとして,遺伝子発現の網羅的な解析から個体の生体防御における分子レベル,細胞レベル,臓器レベルにおける時空間的な相互作用を明らかにし,個体レベルでの免疫応答にかかわる分泌性のタンパク質および細胞の移動を介した臓器間の相互作用を見い出した.リガンドと受容体との関係に注目することにより,局所から分泌されるI型インターフェロンが全身に伝播し抗ウイルス遺伝子の発現を誘導することが,ワクチンの接種による早期の免疫応答にかかわることが示された.また,遺伝子発現を指標にした細胞種の解析により,レジデントメモリーT細胞がワクチンの接種ののち数日で遠位の臓器に到達し,これが全身性の感染に対する長期間にわたる効率的な免疫応答にかかわることが明らかにされた.このように,個体において臓器をくまなく解析することにより新たな免疫機序が見い出され,ワクチンによる生体防御の戦略に新たな方向性が示された.
ヒトを含む多細胞生物は外界からの種々の刺激に対し適切に応答することにより生体の恒常性を維持する.生物は臓器→細胞→分子と階層化してとらえられるが,個体の応答は個々の要素の多層にわたる相互作用によるものであり,おのおのが単独で存在することはない1).たとえば,食欲は消化管,中枢神経,脂肪組織の臓器間のコミュニケーションにより制御され,免疫記憶はリンパ節とよばれる臓器において樹状細胞,T細胞,B細胞の細胞間のコミュニケーションによりひき起こされる.
これまで,免疫応答についてはリンパ節,脾臓,骨髄,胸腺といったリンパ組織と個々の応答に直接的にかかわる肺,腸,皮膚などの臓器との1対1の相互作用に注目して研究されてきたが,免疫応答がいかにして個体の全体として制御されるかについてはほとんどが手つかずであった.これは,マウスなどの高等動物を用いることによる操作性の困難,従来の方法論において同時に解析の可能な分子の数の制限,過去の知見にもとづく研究者の先入観などに起因する.筆者らは,個体における免疫応答を分子レベル,細胞レベル,臓器レベルにて俯瞰すること,これまで知られていなかった臓器間の相互作用を予測すること,予測された臓器間の相互作用を検証すること,を目的として研究した.
マウスを用いたワクシニアウイルス感染モデルを用いた.ワクシニアウイルスはヒト天然痘ウイルスの近縁種であり,ウイルスに対するワクチンによる生体防御を模した系が存在する.ワクチン株としてModified Vaccinia Ankara(MVA)株の皮下投与,病原性株としてWestern Reserve(WR)株の経鼻投与の系を用いることにより,ヒトにおけるワクチンの接種およびウイルスの感染を模した.
病原性株の投与により,数日後から体重が顕著に減少し最終的にはすべての個体が死亡したが,事前にワクチン株を投与することによりすべて個体は生存することが確認された.この実験条件において,病原性株あるいはワクチン株の単独の投与あるいは共投与の際のウイルスの体内における動態を経時的に観察した.マウスから脳,骨髄,胸腺,肺,心臓,肝臓,脾臓,腎臓,小腸,皮膚(2箇所),リンパ節(5箇所),末梢血を回収し,ウイルスの量の変化をウイルス遺伝子RNAの発現量を指標に経時的に測定した.その結果,病原性株は脳,肺,脾臓,肝臓をはじめほぼすべての臓器に分布したのに対し,ワクチン株は投与部位である皮膚および所属リンパ節のみにとどまり,ほかの臓器には分布しなかった.また,事前のワクチン株の投与は病原性株の全身への伝播をふせぐ効果があった.同様の結果は,ウイルスゲノムDNAおよびウイルス粒子のプラークアッセイ,蛍光標識ウイルスを用いた臓器の画像解析からも示された.
宿主の臓器におけるウイルスに対する応答をRNA-seq法により遺伝子の発現を解析することにより分析した.病原性株あるいはワクチン株の伝播がみられた脳,骨髄,肺,肝臓,脾臓,皮膚,リンパ節,末梢血,および,ウイルスの伝播はほとんど観察されなかったものの病原性株の投与により顕著な病理像を示した小腸において,病原性株の投与,ワクチン株の投与,ワクチン株の投与ののちの病原性株の投与により,合計で2018個の発現の変動した遺伝子が同定された.これらの遺伝子には,サイトカイン,ケモカイン,免疫細胞マーカーなど,免疫応答にかかわるタンパク質をコードする遺伝子や,病原性株の感染による組織の傷害を示唆する遺伝子が含まれていた.この臓器ごとのRNA-seq法による解析において,細胞の分取あるいは選別はまったくしていないにもかかわらず,特定の細胞種の移動を示唆する遺伝子発現の変化が認められ,このことはフローサイトメトリーにより確認された.これらの結果から,ワクチンを接種したとき,病原性のウイルスに感染したとき,ワクチンを接種したのち病原性のウイルスに感染したときの個々の臓器の免疫応答が遺伝子発現の変化というかたちで明らかにされた.
臓器ごとに同定された発現の変動した遺伝子のリストから,免疫応答にかかわる臓器間のコミュニケーションを探索した.病原性株の投与において,ウイルスは皮膚および所属リンパ節のみに分布したのに対し,発現の変動した遺伝子は脳,骨髄,肺,肝臓,脾臓,皮膚,リンパ節,末梢血において同定されたことから,ウイルスの侵入を感知した皮膚および所属リンパ節は,遠隔の臓器に対し伝令となる分子を放出することにより全身における免疫応答をひき起こすと考えた.そのような分子は分泌性であり,その受容体は細胞の表面に発現すると考え,データベース検索などにより独自に作成した2198ペアの“リガンド-受容体”リストを臓器ごとのRNA-seq法のデータと照合した.ウイルスの感染ののちリガンドが発現し,かつ,いずれかの臓器で受容体が発現するペアを探索したところ,92のペアについて,のべ452個の臓器内の相互作用および臓器間の相互作用が同定された.このうち,I型インターフェロンとI型インターフェロン受容体のペアの関与についてI型インターフェロン受容体ノックアウトマウスを用いて検証したところ,野生型のマウスと比較して,ワクチン株の病原性株に対する防御能が低下していた.これらの結果から,臓器ごとのRNA-seq法のデータとリガンドと受容体のペアのリストとを組み合わせることにより,分子レベルでの臓器間の相互作用の予測が可能なことが示された.
臓器間の相互作用を担う機構として,リガンドと受容体のペアによる分子レベルでの遠隔作用のほかに,細胞の移動を介した機構が考えられる.臓器ごとのRNA-seq法により同定された発現の変動した遺伝子のアノテーションの過程において,ワクチン株の投与の3週間後に病原性株を投与したときの肺および肝臓において発現の変動した遺伝子が,レジデントメモリーT細胞が活性化した組織において発現の変動する遺伝子2) と酷似することが見い出された.レジデントメモリーT細胞はメモリーT細胞のサブタイプで,セントラルメモリーT細胞やエフェクターメモリーT細胞とは異なり,遊走能をもたず特定の臓器の実質に常在し,その結果,病原体の2次性の侵入に対し迅速かつ強力に応答することにより病原体の侵入を組織レベルにてふせぐことが知られている3,4).しかしながら,これまで,レジデントメモリーT細胞が病原体の最初に侵入した臓器に局在することは知られていたが,抗原が存在しない遠隔の臓器にも分布するという確たる証拠はなく,ワクチンを皮下投与したときにはレジデントメモリーT細胞は皮膚に存在し,遠隔の臓器である肺や肝臓には存在しないと考えられていた.
肺および肝臓におけるレジデントメモリーT細胞の存在を示唆するデータが,真にレジデントメモリーT細胞に由来するのかどうか,種々の方法により検証した.経静脈抗体染色5) により臓器に混在する血液と実質とを区別した結果,肺および肝臓の実質に抗原に特異的なメモリーT細胞の存在することが確認された.また,そのような肺および肝臓の実質に由来するメモリーT細胞は,血液に由来するメモリーT細胞と比較してレジデントメモリーT細胞のマーカー遺伝子の発現量が有意に高いことが示された.さらに,1細胞RNA-seq法により,肺および肝臓にはレジデントメモリーT細胞のマーカーを高レベルで発現する細胞の集団の存在することが示された.
ワクチン株の皮下投与により遠隔の臓器に存在したレジデントメモリーT細胞が病原性株の経鼻投与に対する免疫応答にどのくらい関与するのか,パラバイオーシス法により検証した.ワクチン株を皮下投与したマウスと未処理のマウスとを結合し,血液の成分を十分に共有させ平衡化したのち分離し,両方のマウスに病原性株を経鼻投与し防御能を比較したところ,ワクチン株を投与したマウスは未処理のマウスと比較して有意に高い防御能を示した.このことから,ワクチン株の投与による長期にわたる生体防御においては,血中を循環する抗体やメモリーT細胞よりレジデントメモリーT細胞のほうが有効であることが示された.これらの結果から,細胞レベルでの臓器間の相互作用として,皮膚におけるワクチンの局所的な接種が全身におけるレジデントメモリーT細胞の分布をひき起こし,そのような多くの臓器のあいだのネットワークにより種々の感染経路からのウイルスの侵入が水際でふせがれることが明らかにされた.
レジデントメモリーT細胞はこれまで考えられていた以上の柔軟性をもち,ワクチンを接種した部位のみならず遠隔の臓器へも分布することが明らかにされた.1細胞RNA-seq法のデータから,これらの細胞はレジデントメモリーT細胞に共通する遺伝子の発現パターンを示す一方,定着した臓器に特異的な遺伝子の発現パターンをもつことが明らかにされた.そこで,これら臓器に特異的なメモリーT細胞の特徴と臓器に特異的な免疫応答との関連について調べた.メモリーT細胞における1細胞RNA-seq法により,病原性株を投与したとき,肺および肝臓においてインターフェロンγ,肺においてインターロイキン22,肝臓においてCSF2が,特異的に発現する分泌性タンパク質として同定された.これらのタンパク質が臓器に特異的な免疫応答におよぼす影響について明らかにするため,野生型のマウスあるいはそれぞれのノックアウトマウスにワクチン株を投与し,3週間後に病原性株を投与して,臓器RNA-seq法により肺および肝臓における免疫応答について調べた.その結果,インターフェロンγノックアウトマウスにおいては肺および肝臓に,インターロイキン22ノックアウトマウスにおいてはおもに肺に特異的に,CSF2ノックアウトマウスにおいてはおもに肝臓に特異的に,野生型のマウスにおいて観察された臓器に特異的な遺伝子発現の変化が減少した.以上の結果から,レジデントメモリーT細胞は共通の特徴をもちながらも,定着した臓器に応じた免疫応答をひき起こす可塑性をもち,これが個体レベルでの免疫応答を適切に制御することが明らかにされた.
ジェンナーの種痘法から,病原体に対する生体防御にワクチンが有効であることが知られており,これまで,これにかかわる多くの因子が同定されてきた.この研究において,筆者らは,免疫応答の際の個体レベルでのダイナミクスを,臓器ごとに遺伝子発現を解析することにより,個々の分子,細胞,臓器がどのように相互作用するのか,その一端を明らかにした.その結果,分子レベルおよび細胞レベルでの新たな臓器間の相互作用が見い出され,それらの相互作用がワクチンによる免疫応答において必須の役割を担うことが明らかにされた(図1).このようなアプローチは,これまでみのがされてきた多くの臓器間の相互作用およびその役割を明らかにする強力な手段であり,ヒトをはじめとした高等生物を個として理解する“個体のシステム生物学”ともいえる.近年,ヒトの臓器においても大規模な遺伝子発現データベースの構築が進んでおり6,7),蓄積された大量のビッグデータを統合することにより,生物としてのヒトの理解,新たな疾患の分子機序の探索,医療への応用などが進むと期待される.この研究においては遺伝子の発現に注目したが,臓器間の相互作用を担うのは遺伝子にコードされたタンパク質だけではない.転写後制御,非タンパク質性の小分子,エクソソームなどの小胞,あるいは,神経ネットワークを介した臓器間のコミュニケーションも重要な役割をはたすことは想像にかたくない.今後,個としての生物の理解がどのように発展していくのか期待したい.
略歴:2010年 東京大学大学院理学系研究科にて博士号取得,同年 東京大学医科学研究所 特任研究員,2012年 東京理科大学生命医科学研究所 ポストドクトラル研究員,2014年 米国Harvard大学Postdoctoral Fellowを経て,2017年より米国Massachusetts General HospitalにてResearch Fellow.
研究テーマ:システム生物学の手法を用いた個体レベルでの免疫反応の理解.
関心事:“ヒトがなぜヒトであるのか?”という問いに科学的な解答をあたえたい.
Nicolas Chevrier
米国Chicago大学にてAssistant Professor.
© 2017 角木基彦・Nicolas Chevrier Licensed under CC 表示 2.1 日本
(米国Harvard大学Faculty of Arts & Sciences Center for Systems Biology)
email:角木基彦
DOI: 10.7875/first.author.2017.113
Organism-level analysis of vaccination reveals networks of protection across tissues.
Motohiko Kadoki, Ashwini Patil, Cornelius C. Thaiss, Donald J. Brooks, Surya Pandey, Deeksha Deep, David Alvarez, Ulrich H. von Andrian, Amy J. Wagers, Kenta Nakai, Tarjei S. Mikkelsen, Magali Soumillon, Nicolas Chevrier
Cell, 171, 398-413.e21 (2017)
要 約
多細胞生物は分子レベル,細胞レベル,臓器レベルでの多様な相互作用を介して恒常性を維持しており,これら重層的な相互作用の統合的な理解は個体としての生物の応答を知るうえで重要である.この研究において,筆者らは,マウスを用いたワクチンの接種およびウイルスの感染に対する免疫応答をモデルとして,遺伝子発現の網羅的な解析から個体の生体防御における分子レベル,細胞レベル,臓器レベルにおける時空間的な相互作用を明らかにし,個体レベルでの免疫応答にかかわる分泌性のタンパク質および細胞の移動を介した臓器間の相互作用を見い出した.リガンドと受容体との関係に注目することにより,局所から分泌されるI型インターフェロンが全身に伝播し抗ウイルス遺伝子の発現を誘導することが,ワクチンの接種による早期の免疫応答にかかわることが示された.また,遺伝子発現を指標にした細胞種の解析により,レジデントメモリーT細胞がワクチンの接種ののち数日で遠位の臓器に到達し,これが全身性の感染に対する長期間にわたる効率的な免疫応答にかかわることが明らかにされた.このように,個体において臓器をくまなく解析することにより新たな免疫機序が見い出され,ワクチンによる生体防御の戦略に新たな方向性が示された.
はじめに
ヒトを含む多細胞生物は外界からの種々の刺激に対し適切に応答することにより生体の恒常性を維持する.生物は臓器→細胞→分子と階層化してとらえられるが,個体の応答は個々の要素の多層にわたる相互作用によるものであり,おのおのが単独で存在することはない1).たとえば,食欲は消化管,中枢神経,脂肪組織の臓器間のコミュニケーションにより制御され,免疫記憶はリンパ節とよばれる臓器において樹状細胞,T細胞,B細胞の細胞間のコミュニケーションによりひき起こされる.
これまで,免疫応答についてはリンパ節,脾臓,骨髄,胸腺といったリンパ組織と個々の応答に直接的にかかわる肺,腸,皮膚などの臓器との1対1の相互作用に注目して研究されてきたが,免疫応答がいかにして個体の全体として制御されるかについてはほとんどが手つかずであった.これは,マウスなどの高等動物を用いることによる操作性の困難,従来の方法論において同時に解析の可能な分子の数の制限,過去の知見にもとづく研究者の先入観などに起因する.筆者らは,個体における免疫応答を分子レベル,細胞レベル,臓器レベルにて俯瞰すること,これまで知られていなかった臓器間の相互作用を予測すること,予測された臓器間の相互作用を検証すること,を目的として研究した.
1.ワクチンの接種およびウイルスの感染の際のウイルスの動態および宿主の応答
マウスを用いたワクシニアウイルス感染モデルを用いた.ワクシニアウイルスはヒト天然痘ウイルスの近縁種であり,ウイルスに対するワクチンによる生体防御を模した系が存在する.ワクチン株としてModified Vaccinia Ankara(MVA)株の皮下投与,病原性株としてWestern Reserve(WR)株の経鼻投与の系を用いることにより,ヒトにおけるワクチンの接種およびウイルスの感染を模した.
病原性株の投与により,数日後から体重が顕著に減少し最終的にはすべての個体が死亡したが,事前にワクチン株を投与することによりすべて個体は生存することが確認された.この実験条件において,病原性株あるいはワクチン株の単独の投与あるいは共投与の際のウイルスの体内における動態を経時的に観察した.マウスから脳,骨髄,胸腺,肺,心臓,肝臓,脾臓,腎臓,小腸,皮膚(2箇所),リンパ節(5箇所),末梢血を回収し,ウイルスの量の変化をウイルス遺伝子RNAの発現量を指標に経時的に測定した.その結果,病原性株は脳,肺,脾臓,肝臓をはじめほぼすべての臓器に分布したのに対し,ワクチン株は投与部位である皮膚および所属リンパ節のみにとどまり,ほかの臓器には分布しなかった.また,事前のワクチン株の投与は病原性株の全身への伝播をふせぐ効果があった.同様の結果は,ウイルスゲノムDNAおよびウイルス粒子のプラークアッセイ,蛍光標識ウイルスを用いた臓器の画像解析からも示された.
宿主の臓器におけるウイルスに対する応答をRNA-seq法により遺伝子の発現を解析することにより分析した.病原性株あるいはワクチン株の伝播がみられた脳,骨髄,肺,肝臓,脾臓,皮膚,リンパ節,末梢血,および,ウイルスの伝播はほとんど観察されなかったものの病原性株の投与により顕著な病理像を示した小腸において,病原性株の投与,ワクチン株の投与,ワクチン株の投与ののちの病原性株の投与により,合計で2018個の発現の変動した遺伝子が同定された.これらの遺伝子には,サイトカイン,ケモカイン,免疫細胞マーカーなど,免疫応答にかかわるタンパク質をコードする遺伝子や,病原性株の感染による組織の傷害を示唆する遺伝子が含まれていた.この臓器ごとのRNA-seq法による解析において,細胞の分取あるいは選別はまったくしていないにもかかわらず,特定の細胞種の移動を示唆する遺伝子発現の変化が認められ,このことはフローサイトメトリーにより確認された.これらの結果から,ワクチンを接種したとき,病原性のウイルスに感染したとき,ワクチンを接種したのち病原性のウイルスに感染したときの個々の臓器の免疫応答が遺伝子発現の変化というかたちで明らかにされた.
2.免疫応答の際の分子レベルでの臓器間の相互作用
臓器ごとに同定された発現の変動した遺伝子のリストから,免疫応答にかかわる臓器間のコミュニケーションを探索した.病原性株の投与において,ウイルスは皮膚および所属リンパ節のみに分布したのに対し,発現の変動した遺伝子は脳,骨髄,肺,肝臓,脾臓,皮膚,リンパ節,末梢血において同定されたことから,ウイルスの侵入を感知した皮膚および所属リンパ節は,遠隔の臓器に対し伝令となる分子を放出することにより全身における免疫応答をひき起こすと考えた.そのような分子は分泌性であり,その受容体は細胞の表面に発現すると考え,データベース検索などにより独自に作成した2198ペアの“リガンド-受容体”リストを臓器ごとのRNA-seq法のデータと照合した.ウイルスの感染ののちリガンドが発現し,かつ,いずれかの臓器で受容体が発現するペアを探索したところ,92のペアについて,のべ452個の臓器内の相互作用および臓器間の相互作用が同定された.このうち,I型インターフェロンとI型インターフェロン受容体のペアの関与についてI型インターフェロン受容体ノックアウトマウスを用いて検証したところ,野生型のマウスと比較して,ワクチン株の病原性株に対する防御能が低下していた.これらの結果から,臓器ごとのRNA-seq法のデータとリガンドと受容体のペアのリストとを組み合わせることにより,分子レベルでの臓器間の相互作用の予測が可能なことが示された.
3.免疫応答の際の細胞レベルでの臓器間の相互作用
臓器間の相互作用を担う機構として,リガンドと受容体のペアによる分子レベルでの遠隔作用のほかに,細胞の移動を介した機構が考えられる.臓器ごとのRNA-seq法により同定された発現の変動した遺伝子のアノテーションの過程において,ワクチン株の投与の3週間後に病原性株を投与したときの肺および肝臓において発現の変動した遺伝子が,レジデントメモリーT細胞が活性化した組織において発現の変動する遺伝子2) と酷似することが見い出された.レジデントメモリーT細胞はメモリーT細胞のサブタイプで,セントラルメモリーT細胞やエフェクターメモリーT細胞とは異なり,遊走能をもたず特定の臓器の実質に常在し,その結果,病原体の2次性の侵入に対し迅速かつ強力に応答することにより病原体の侵入を組織レベルにてふせぐことが知られている3,4).しかしながら,これまで,レジデントメモリーT細胞が病原体の最初に侵入した臓器に局在することは知られていたが,抗原が存在しない遠隔の臓器にも分布するという確たる証拠はなく,ワクチンを皮下投与したときにはレジデントメモリーT細胞は皮膚に存在し,遠隔の臓器である肺や肝臓には存在しないと考えられていた.
肺および肝臓におけるレジデントメモリーT細胞の存在を示唆するデータが,真にレジデントメモリーT細胞に由来するのかどうか,種々の方法により検証した.経静脈抗体染色5) により臓器に混在する血液と実質とを区別した結果,肺および肝臓の実質に抗原に特異的なメモリーT細胞の存在することが確認された.また,そのような肺および肝臓の実質に由来するメモリーT細胞は,血液に由来するメモリーT細胞と比較してレジデントメモリーT細胞のマーカー遺伝子の発現量が有意に高いことが示された.さらに,1細胞RNA-seq法により,肺および肝臓にはレジデントメモリーT細胞のマーカーを高レベルで発現する細胞の集団の存在することが示された.
ワクチン株の皮下投与により遠隔の臓器に存在したレジデントメモリーT細胞が病原性株の経鼻投与に対する免疫応答にどのくらい関与するのか,パラバイオーシス法により検証した.ワクチン株を皮下投与したマウスと未処理のマウスとを結合し,血液の成分を十分に共有させ平衡化したのち分離し,両方のマウスに病原性株を経鼻投与し防御能を比較したところ,ワクチン株を投与したマウスは未処理のマウスと比較して有意に高い防御能を示した.このことから,ワクチン株の投与による長期にわたる生体防御においては,血中を循環する抗体やメモリーT細胞よりレジデントメモリーT細胞のほうが有効であることが示された.これらの結果から,細胞レベルでの臓器間の相互作用として,皮膚におけるワクチンの局所的な接種が全身におけるレジデントメモリーT細胞の分布をひき起こし,そのような多くの臓器のあいだのネットワークにより種々の感染経路からのウイルスの侵入が水際でふせがれることが明らかにされた.
4.メモリーT細胞の臓器への適応および臓器に特異的な免疫応答への寄与
レジデントメモリーT細胞はこれまで考えられていた以上の柔軟性をもち,ワクチンを接種した部位のみならず遠隔の臓器へも分布することが明らかにされた.1細胞RNA-seq法のデータから,これらの細胞はレジデントメモリーT細胞に共通する遺伝子の発現パターンを示す一方,定着した臓器に特異的な遺伝子の発現パターンをもつことが明らかにされた.そこで,これら臓器に特異的なメモリーT細胞の特徴と臓器に特異的な免疫応答との関連について調べた.メモリーT細胞における1細胞RNA-seq法により,病原性株を投与したとき,肺および肝臓においてインターフェロンγ,肺においてインターロイキン22,肝臓においてCSF2が,特異的に発現する分泌性タンパク質として同定された.これらのタンパク質が臓器に特異的な免疫応答におよぼす影響について明らかにするため,野生型のマウスあるいはそれぞれのノックアウトマウスにワクチン株を投与し,3週間後に病原性株を投与して,臓器RNA-seq法により肺および肝臓における免疫応答について調べた.その結果,インターフェロンγノックアウトマウスにおいては肺および肝臓に,インターロイキン22ノックアウトマウスにおいてはおもに肺に特異的に,CSF2ノックアウトマウスにおいてはおもに肝臓に特異的に,野生型のマウスにおいて観察された臓器に特異的な遺伝子発現の変化が減少した.以上の結果から,レジデントメモリーT細胞は共通の特徴をもちながらも,定着した臓器に応じた免疫応答をひき起こす可塑性をもち,これが個体レベルでの免疫応答を適切に制御することが明らかにされた.
おわりに
ジェンナーの種痘法から,病原体に対する生体防御にワクチンが有効であることが知られており,これまで,これにかかわる多くの因子が同定されてきた.この研究において,筆者らは,免疫応答の際の個体レベルでのダイナミクスを,臓器ごとに遺伝子発現を解析することにより,個々の分子,細胞,臓器がどのように相互作用するのか,その一端を明らかにした.その結果,分子レベルおよび細胞レベルでの新たな臓器間の相互作用が見い出され,それらの相互作用がワクチンによる免疫応答において必須の役割を担うことが明らかにされた(図1).このようなアプローチは,これまでみのがされてきた多くの臓器間の相互作用およびその役割を明らかにする強力な手段であり,ヒトをはじめとした高等生物を個として理解する“個体のシステム生物学”ともいえる.近年,ヒトの臓器においても大規模な遺伝子発現データベースの構築が進んでおり6,7),蓄積された大量のビッグデータを統合することにより,生物としてのヒトの理解,新たな疾患の分子機序の探索,医療への応用などが進むと期待される.この研究においては遺伝子の発現に注目したが,臓器間の相互作用を担うのは遺伝子にコードされたタンパク質だけではない.転写後制御,非タンパク質性の小分子,エクソソームなどの小胞,あるいは,神経ネットワークを介した臓器間のコミュニケーションも重要な役割をはたすことは想像にかたくない.今後,個としての生物の理解がどのように発展していくのか期待したい.
文 献
- Droujinine, I. A. & Perrimon, N.: Interorgan communication pathways in physiology: focus on Drosophila. Annu. Rev. Genet., 50, 539-570 (2016)[PubMed]
- Ariotti, S., Hogenbirk, M. A., Dijkgraaf, F. E. et al.: Skin-resident memory CD8+ T cells trigger a state of tissue-wide pathogen alert. Science, 346, 101-105 (2014)[PubMed]
- Muller, S. N. & Mackay, L. K.: Tissue-resident memory T cells: local specialists in immune defence. Nat. Rev. Immunol., 16, 79-89 (2016)[PubMed]
- Schenkel, J. M. & Masopust, D.: Tissue-resident memory T cells. Immunity, 41, 886-897 (2014)[PubMed]
- Anderson, K. G., Sung, H., Skon, C. N. et al.: Cutting edge: intravascular staining redefines lung CD8 T cell responses. J. Immunol., 189, 2702-2706 (2012)[PubMed]
- Mele, M., Ferreira, P. G., Reverter, F. et al.: The human transcriptome across tissues and individuals. Science, 348, 660-665 (2015)[PubMed]
- GTEx Consortium: Genetic effects on gene expression across human tissues. Nature, 550, 204-213 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京大学大学院理学系研究科にて博士号取得,同年 東京大学医科学研究所 特任研究員,2012年 東京理科大学生命医科学研究所 ポストドクトラル研究員,2014年 米国Harvard大学Postdoctoral Fellowを経て,2017年より米国Massachusetts General HospitalにてResearch Fellow.
研究テーマ:システム生物学の手法を用いた個体レベルでの免疫反応の理解.
関心事:“ヒトがなぜヒトであるのか?”という問いに科学的な解答をあたえたい.
Nicolas Chevrier
米国Chicago大学にてAssistant Professor.
© 2017 角木基彦・Nicolas Chevrier Licensed under CC 表示 2.1 日本