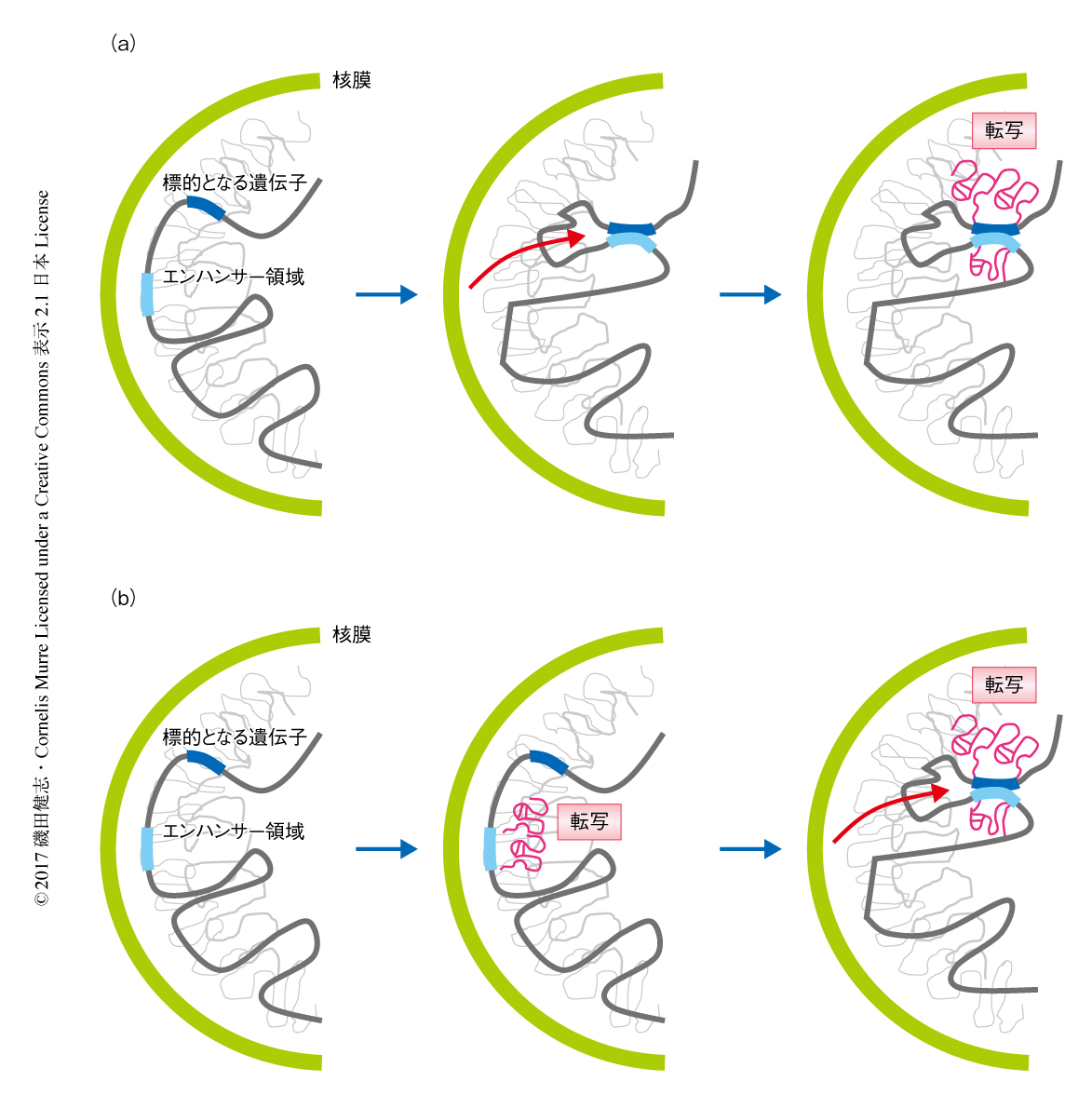
非コードRNAの転写によりゲノムの相互作用および配置の転換がひき起こされT細胞への分化が決定される
磯田健志・Cornelis Murre
(米国California大学San Diego校Department of Molecular Biology)
email:磯田健志
DOI: 10.7875/first.author.2017.112
Non-coding transcription instructs chromatin folding and compartmentalization to dictate enhancer-promoter communication and T cell fate.
Takeshi Isoda, Amanda J. Moore, Zhaoren He, Vivek Chandra, Masatoshi Aida, Matthew Denholtz, Jan Piet van Hamburg, Kathleen M. Fisch, Aaron N. Chang, Shawn P. Fahl, David L. Wiest, Cornelis Murre
Cell, 171, 103-119.e18 (2017)
長鎖非コードRNAあるいはエンハンサーRNAの具体的な機能についての報告はかぎられているが,それらは転写されることにより機能を発揮すると考えられていた.筆者らは,T細胞への分化の決定にかかわる転写因子BCL11bをコードする遺伝子において,そのエンハンサー領域にコードされるThymoDと名づけた長鎖非コードRNAの転写が,エンハンサー領域の抑制区分からの解放に必須であることを見い出した.ThymoDの転写を阻害したマウスにおいてはT細胞への分化が障害され,T細胞系のリンパ腫あるいは白血病を発症した.ThymoDの転写は,その領域のDNA脱メチル化,クロマチンの修飾,転写因子CTCFの結合,コヒーシンのリクルートを促進し,エンハンサー領域とプロモーター領域との新たな相互作用を促進した.これらの結果より,先行する非コードRNAの転写により細胞の分化の決定にかかわる遺伝子の発現が制御される可能性が示唆された.また,長鎖非コードRNAあるいはエンハンサーRNAの転写の破綻が,各種の発がんにおけるクローンの形成においてもさまざまな段階において関与する可能性があり,その探索が必要であると考えられた.
B細胞およびT細胞は獲得免疫において中心的な役割をはたし,その分化は細胞系列に特異的に作用する転写因子により制御される.以前に,筆者らの研究室は,B細胞への分化において,B細胞への分化の決定にかかわる転写因子EBF1をコードする遺伝子は抑制区分から核の転写領域へと配置が転換されるが,T細胞への分化の決定にかかわる転写因子BCL11bをコードする遺伝子は抑制区分にとどまることを報告した1).この配置の転換した領域に転写因子やメディエーターがリクルートされることから,ゲノムの配置の転換が先行し,のちに転写が起こるというモデルが提案されている2)(図1a).近年,細胞において多くの長鎖非コードRNAが検出されているが,その多くについて具体的な機能は不明である.一方で,細胞の分化の決定にかかわる転写因子をコードする遺伝子のエンハンサー領域には長鎖非コードRNAあるいはエンハンサーRNAがコードされているが,同様に,それらの機能についての報告はかぎられており,転写が先行し,のちにゲノムの配置の転換が起こるというモデルが提案されている2)(図1b).筆者らは,この機構を確認するため,BCL11b遺伝子のエンハンサー領域に注目した3,4).BCL11b遺伝子のエンハンサー領域はプロモーター領域から850 kb下流の遺伝子がほとんどコードされていない領域に位置し,一部のドメインについてはエンハンサー活性をもつことが示されている5).そこで,筆者らは,BCL11b遺伝子のエンハンサー領域において転写を阻害したマウスを作製し,表現型および転写の役割について検討した.
BCL11b遺伝子のエンハンサー領域において最初に転写の起こる領域を同定するため,T細胞の分化の段階であるDN1期からT細胞への分化が決定されるDN2期までの報告されているRNA-seq法のデータを用いて6),転写を阻害する最適な位置について検討した.くわえて,クロマチンの凝集の状態を確認するためATAC-seq法を実施し,DN2期においてクロマチンが開いた構造をとり転写開始点となりうる位置を確認した.この解析により,長鎖非コードRNAをコードする50 kbの領域をThymoDと名づけ,DN2期において,ThymoDにクロマチンが開いた構造をとる4箇所の制御領域が確認された.T細胞への分化が決定された細胞株であるSCIDadh細胞を用い,制御領域1および制御領域2のプロモーター領域からの転写を阻害するため,それぞれにポリAカセットを挿入した.その結果,制御領域1の下流にポリAカセットを挿入してもThymoDの転写およびBCL11b遺伝子の発現は変化しなかったものの,制御領域2の下流にポリAカセットを挿入するとThymoDの転写およびBCL11b遺伝子の発現が低下した.これらの検討により,ThymoDの転写は制御領域2に存在するプロモーター領域によりもっとも初期に起こることが確認されたことから,CRISPR-Cas9系を用いたゲノム編集法により制御領域2の下流にポリAカセットを挿入したマウスを作製した.
BCL11bのノックアウトマウスは運動神経が脊髄まで伸長しないため,生まれたマウスは運動麻痺を生じ哺乳ができずに致死となる.ポリAカセットの挿入により両方のアレルでThymoDの転写を阻害したマウスについて,詳細な中枢神経系の解析は実施していないものの,形態学的に異常はなく長期にわたり生存し妊孕性が保たれていた.5週齢において胸腺を観察したところ,T細胞の分化はDN2期において部分的に障害されていた.また,造血幹細胞からT細胞への分化を誘導したところ,DN2期において分化は完全に停止した.野生型のマウスおよび両方のアレルでThymoDの転写を阻害したマウスについて,DN2期における遺伝子発現プロファイルをRNA-seq法により比較したところ,野生型のマウスにおいてはT細胞の分化に必要な遺伝子の発現が上昇していたのに対し,ThymoDの転写を阻害したマウスにおいては,NK細胞,樹状細胞,ミエロイド系細胞,γδT細胞への細胞系列において発現する遺伝子の発現が抑制されておらず,BCL11bノックアウトマウスにおいて認められる遺伝子発現パターンが再現されていた.
ヒトの急性リンパ性白血病の約10%においてBCL11b遺伝子の変異あるいは欠失の生じることが報告されており,BCL11b遺伝子はがん抑制遺伝子としての機能をもつことが知られていた7,8).両方のアレルでThymoDの転写を阻害したマウスは生後3カ月以降にT細胞性のリンパ腫あるいは白血病を自然発症し,このことから,ThymoDとBCL11bとの相互作用の破綻は発がんへのドライバー変異であることが示唆された.
野生型のマウスおよび両方のアレルでの転写を阻害したマウスの造血幹細胞からT細胞への分化を誘導し,DN2期において細胞を回収してHi-C法を用いてゲノムの構造の変化をゲノムワイドに解析したところ,ThymoDの転写を阻害したマウスにおいてBCL11b遺伝子およびそのエンハンサー領域は抑制区分にあり,下流の抑制区分との相互作用が強まっていた.一方,野生型のマウスにおいてはBCL11b遺伝子およびそのエンハンサー領域は活動性のある転写領域に転換されていた.また,区画の変化をゲノムワイドに比較したところ,とくに著明な変化はBCL11b遺伝子からそのエンハンサー領域に位置する遺伝子に集中しており,ThymoDの転写はBCL11b遺伝子に特異的に区画の変化をもたらすことが確認された.また,ThymoDを含むエンハンサー領域に相補的なプローブを用いてDN2期においてDNA蛍光in situハイブリダイゼーション法を実施したところ,野生型のマウスにおいては両方のアレルともに核へと移行していたのに対し,両方のアレルでThymoDの転写を阻害したマウスにおいては両方のアレルとも核膜の抑制区分に位置していた.さらには,片方のアレルでThymoDの転写を阻害したマウスにおいては,野生型のアレルは核に,ポリAカセットの挿入されたアレルは核膜にあり,野生型のアレルから転写されたThymoDにトランスの作用はなく,ThymoDの転写はおもにシスに作用することが確認された.
野生型のマウス,片方のアレルでThymoDの転写を阻害したマウス,両方のアレルでThymoDの転写を阻害したマウスのDN2期の細胞を用いて,転写因子CTCFの結合,コヒーシンの結合,クロマチンの修飾についてChIP-seq法により,また,DNAメチル化について全ゲノムバイスルファイトシークエンス法により解析した.その結果,ThymoDの転写が抑制されるとその領域のDNAメチル化が亢進され,そこにはCTCFあるいはコヒーシンは結合しないことが確認された.また,クロマチンの修飾もみられず,エンハンサーは活性化していなかった.
近年,出芽酵母において転写にともないコヒーシンが転写開始点にリクルートされること,ヒトにおける解析により,転写伸長因子複合体,コヒーシンの構成タンパク質,RNAポリメラーゼIIに相互作用のあること,また,転写によりコヒーシンがDNAのうえを移動すること,といった報告が蓄積されてきた9-11).転写の阻害によるコヒーシンのリクルートあるいはDNAのうえの移動について検討するため,ThymoDの転写がみられるDN2期の野生型のマウスの細胞に2本鎖DNAと結合し転写を阻害するアクチノマイシンDを添加し,コヒーシンとDNAとの結合をChIP-seq法によりゲノムワイドに解析した.その結果,とくに転写開始点においてコヒーシンのリクルートが低下し,ThymoDにおいてもコヒーシンのリクルートおよびDNAのうえの移動ともに障害されていた.これらの結果より,先行するThymoDの転写によりDNA脱メチル化が起こり,そこへCTCFおよびコヒーシンが結合し,エンハンサー領域が抑制区分より解放されてプロモーター領域との相互作用を生じ,BCL11b遺伝子の発現が制御されることが示された.
当初は,両方のアレルでThymoDの転写を阻害したマウスに発生した腫瘍は,ThymoDの転写の低下にともなうBCL11b遺伝子の発現の低下の影響により生じた腫瘍として変異タンパク質の同定および分類に使用できると考えていた.しかし,発生した腫瘍のRNA-seq法による解析において,ThymoDの転写が抑制された腫瘍だけでなく,おそらくはクローンの形成の過程において生じた変異タンパク質の影響をうけてThymoDの転写の亢進した腫瘍が確認された.ThymoDの転写の亢進した腫瘍においては,コヒーシンのリクルートおよび移動が亢進しておりBCL11b遺伝子の発現は回復していた.一方,ThymoDの転写が抑制された腫瘍においてThymoDは抑制区分に近接していたが,ThymoDの転写の亢進した腫瘍においてThymoDは転写領域に転換されていた.このことから,ThymoDの下流にポリAカセットの影響を回避するセンス方向およびアンチセンス方向の転写が生じると,ThymoDは抑制区分から解放され,エンハンサー領域とプロモーター領域との相互作用が回復することが示された.
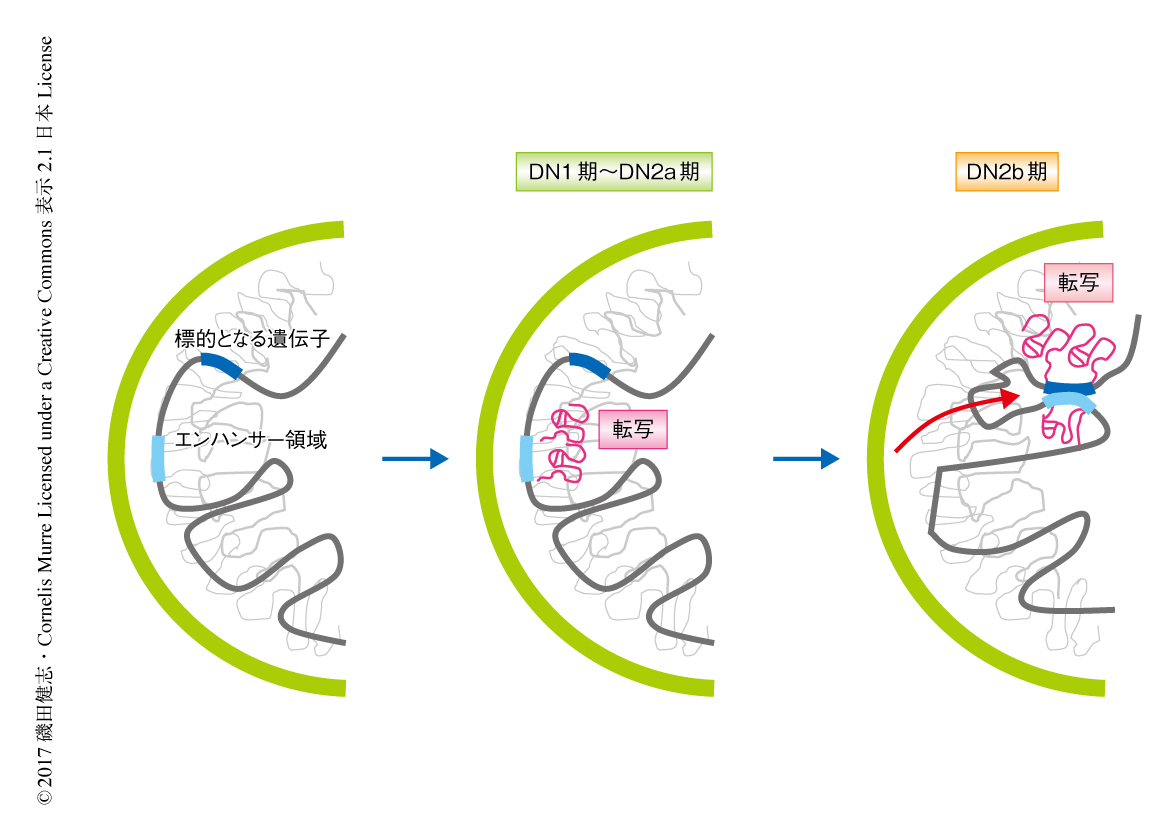
エンハンサー領域における長鎖非コードRNAあるいはエンハンサーRNAの先行する転写は,それらをコードする領域におけるクロマチンの修飾およびDNAメチル化の状態を変化させ,CTCFなどの転写因子の結合を促進する.また,RNAポリメラーゼIIはコヒーシンを転写開始点からリクルートし,エンハンサー領域とプロモーター領域との新たな相互作用を生み出すことを示した.この研究により,非コードRNAの転写の進行はエンハンサーの解放の初期に貢献するモデルが支持されたと考えている.また,この機構の破綻はT細胞の分化に影響し発がんにも寄与することが示された(図2).この機構がほかの細胞の分化の決定にも組み込まれている可能性があり,その破綻による疾患もあると想定される.エンハンサー領域における転写の障害により発症したがんにおいては,異常の原因となった領域がのちの変異により修飾される可能性のあることが示され,ThymoDの転写を阻害したマウスに発症した腫瘍において発がんに寄与する2次的な変異を同定し,そこからはエンハンサー領域の配置の転換に貢献する変異が見い出されると考えている.
略歴:2012年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 米国California大学San Diego校 ポストドクトラルフェローを経て,2017年よりJAとりで総合医療センター.
研究テーマ:非コードRNAの転写の障害による先天性免疫不全症および腫瘍の同定.
Cornelis Murre
米国California大学San Diego校 特別教授.
研究室URL:http://labs.biology.ucsd.edu/murre/
© 2017 磯田健志・Cornelis Murre Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Molecular Biology)
email:磯田健志
DOI: 10.7875/first.author.2017.112
Non-coding transcription instructs chromatin folding and compartmentalization to dictate enhancer-promoter communication and T cell fate.
Takeshi Isoda, Amanda J. Moore, Zhaoren He, Vivek Chandra, Masatoshi Aida, Matthew Denholtz, Jan Piet van Hamburg, Kathleen M. Fisch, Aaron N. Chang, Shawn P. Fahl, David L. Wiest, Cornelis Murre
Cell, 171, 103-119.e18 (2017)
要 約
長鎖非コードRNAあるいはエンハンサーRNAの具体的な機能についての報告はかぎられているが,それらは転写されることにより機能を発揮すると考えられていた.筆者らは,T細胞への分化の決定にかかわる転写因子BCL11bをコードする遺伝子において,そのエンハンサー領域にコードされるThymoDと名づけた長鎖非コードRNAの転写が,エンハンサー領域の抑制区分からの解放に必須であることを見い出した.ThymoDの転写を阻害したマウスにおいてはT細胞への分化が障害され,T細胞系のリンパ腫あるいは白血病を発症した.ThymoDの転写は,その領域のDNA脱メチル化,クロマチンの修飾,転写因子CTCFの結合,コヒーシンのリクルートを促進し,エンハンサー領域とプロモーター領域との新たな相互作用を促進した.これらの結果より,先行する非コードRNAの転写により細胞の分化の決定にかかわる遺伝子の発現が制御される可能性が示唆された.また,長鎖非コードRNAあるいはエンハンサーRNAの転写の破綻が,各種の発がんにおけるクローンの形成においてもさまざまな段階において関与する可能性があり,その探索が必要であると考えられた.
はじめに
B細胞およびT細胞は獲得免疫において中心的な役割をはたし,その分化は細胞系列に特異的に作用する転写因子により制御される.以前に,筆者らの研究室は,B細胞への分化において,B細胞への分化の決定にかかわる転写因子EBF1をコードする遺伝子は抑制区分から核の転写領域へと配置が転換されるが,T細胞への分化の決定にかかわる転写因子BCL11bをコードする遺伝子は抑制区分にとどまることを報告した1).この配置の転換した領域に転写因子やメディエーターがリクルートされることから,ゲノムの配置の転換が先行し,のちに転写が起こるというモデルが提案されている2)(図1a).近年,細胞において多くの長鎖非コードRNAが検出されているが,その多くについて具体的な機能は不明である.一方で,細胞の分化の決定にかかわる転写因子をコードする遺伝子のエンハンサー領域には長鎖非コードRNAあるいはエンハンサーRNAがコードされているが,同様に,それらの機能についての報告はかぎられており,転写が先行し,のちにゲノムの配置の転換が起こるというモデルが提案されている2)(図1b).筆者らは,この機構を確認するため,BCL11b遺伝子のエンハンサー領域に注目した3,4).BCL11b遺伝子のエンハンサー領域はプロモーター領域から850 kb下流の遺伝子がほとんどコードされていない領域に位置し,一部のドメインについてはエンハンサー活性をもつことが示されている5).そこで,筆者らは,BCL11b遺伝子のエンハンサー領域において転写を阻害したマウスを作製し,表現型および転写の役割について検討した.
1.BCL11b遺伝子のエンハンサー領域にポリAカセットを挿入したマウスの作製
BCL11b遺伝子のエンハンサー領域において最初に転写の起こる領域を同定するため,T細胞の分化の段階であるDN1期からT細胞への分化が決定されるDN2期までの報告されているRNA-seq法のデータを用いて6),転写を阻害する最適な位置について検討した.くわえて,クロマチンの凝集の状態を確認するためATAC-seq法を実施し,DN2期においてクロマチンが開いた構造をとり転写開始点となりうる位置を確認した.この解析により,長鎖非コードRNAをコードする50 kbの領域をThymoDと名づけ,DN2期において,ThymoDにクロマチンが開いた構造をとる4箇所の制御領域が確認された.T細胞への分化が決定された細胞株であるSCIDadh細胞を用い,制御領域1および制御領域2のプロモーター領域からの転写を阻害するため,それぞれにポリAカセットを挿入した.その結果,制御領域1の下流にポリAカセットを挿入してもThymoDの転写およびBCL11b遺伝子の発現は変化しなかったものの,制御領域2の下流にポリAカセットを挿入するとThymoDの転写およびBCL11b遺伝子の発現が低下した.これらの検討により,ThymoDの転写は制御領域2に存在するプロモーター領域によりもっとも初期に起こることが確認されたことから,CRISPR-Cas9系を用いたゲノム編集法により制御領域2の下流にポリAカセットを挿入したマウスを作製した.
2.ThymoDの転写の阻害によりT細胞の分化は障害される
BCL11bのノックアウトマウスは運動神経が脊髄まで伸長しないため,生まれたマウスは運動麻痺を生じ哺乳ができずに致死となる.ポリAカセットの挿入により両方のアレルでThymoDの転写を阻害したマウスについて,詳細な中枢神経系の解析は実施していないものの,形態学的に異常はなく長期にわたり生存し妊孕性が保たれていた.5週齢において胸腺を観察したところ,T細胞の分化はDN2期において部分的に障害されていた.また,造血幹細胞からT細胞への分化を誘導したところ,DN2期において分化は完全に停止した.野生型のマウスおよび両方のアレルでThymoDの転写を阻害したマウスについて,DN2期における遺伝子発現プロファイルをRNA-seq法により比較したところ,野生型のマウスにおいてはT細胞の分化に必要な遺伝子の発現が上昇していたのに対し,ThymoDの転写を阻害したマウスにおいては,NK細胞,樹状細胞,ミエロイド系細胞,γδT細胞への細胞系列において発現する遺伝子の発現が抑制されておらず,BCL11bノックアウトマウスにおいて認められる遺伝子発現パターンが再現されていた.
ヒトの急性リンパ性白血病の約10%においてBCL11b遺伝子の変異あるいは欠失の生じることが報告されており,BCL11b遺伝子はがん抑制遺伝子としての機能をもつことが知られていた7,8).両方のアレルでThymoDの転写を阻害したマウスは生後3カ月以降にT細胞性のリンパ腫あるいは白血病を自然発症し,このことから,ThymoDとBCL11bとの相互作用の破綻は発がんへのドライバー変異であることが示唆された.
3.ThymoDの転写が先行しのちにゲノムの配置の転換が起こる
野生型のマウスおよび両方のアレルでの転写を阻害したマウスの造血幹細胞からT細胞への分化を誘導し,DN2期において細胞を回収してHi-C法を用いてゲノムの構造の変化をゲノムワイドに解析したところ,ThymoDの転写を阻害したマウスにおいてBCL11b遺伝子およびそのエンハンサー領域は抑制区分にあり,下流の抑制区分との相互作用が強まっていた.一方,野生型のマウスにおいてはBCL11b遺伝子およびそのエンハンサー領域は活動性のある転写領域に転換されていた.また,区画の変化をゲノムワイドに比較したところ,とくに著明な変化はBCL11b遺伝子からそのエンハンサー領域に位置する遺伝子に集中しており,ThymoDの転写はBCL11b遺伝子に特異的に区画の変化をもたらすことが確認された.また,ThymoDを含むエンハンサー領域に相補的なプローブを用いてDN2期においてDNA蛍光in situハイブリダイゼーション法を実施したところ,野生型のマウスにおいては両方のアレルともに核へと移行していたのに対し,両方のアレルでThymoDの転写を阻害したマウスにおいては両方のアレルとも核膜の抑制区分に位置していた.さらには,片方のアレルでThymoDの転写を阻害したマウスにおいては,野生型のアレルは核に,ポリAカセットの挿入されたアレルは核膜にあり,野生型のアレルから転写されたThymoDにトランスの作用はなく,ThymoDの転写はおもにシスに作用することが確認された.
野生型のマウス,片方のアレルでThymoDの転写を阻害したマウス,両方のアレルでThymoDの転写を阻害したマウスのDN2期の細胞を用いて,転写因子CTCFの結合,コヒーシンの結合,クロマチンの修飾についてChIP-seq法により,また,DNAメチル化について全ゲノムバイスルファイトシークエンス法により解析した.その結果,ThymoDの転写が抑制されるとその領域のDNAメチル化が亢進され,そこにはCTCFあるいはコヒーシンは結合しないことが確認された.また,クロマチンの修飾もみられず,エンハンサーは活性化していなかった.
近年,出芽酵母において転写にともないコヒーシンが転写開始点にリクルートされること,ヒトにおける解析により,転写伸長因子複合体,コヒーシンの構成タンパク質,RNAポリメラーゼIIに相互作用のあること,また,転写によりコヒーシンがDNAのうえを移動すること,といった報告が蓄積されてきた9-11).転写の阻害によるコヒーシンのリクルートあるいはDNAのうえの移動について検討するため,ThymoDの転写がみられるDN2期の野生型のマウスの細胞に2本鎖DNAと結合し転写を阻害するアクチノマイシンDを添加し,コヒーシンとDNAとの結合をChIP-seq法によりゲノムワイドに解析した.その結果,とくに転写開始点においてコヒーシンのリクルートが低下し,ThymoDにおいてもコヒーシンのリクルートおよびDNAのうえの移動ともに障害されていた.これらの結果より,先行するThymoDの転写によりDNA脱メチル化が起こり,そこへCTCFおよびコヒーシンが結合し,エンハンサー領域が抑制区分より解放されてプロモーター領域との相互作用を生じ,BCL11b遺伝子の発現が制御されることが示された.
4.両方のアレルでThymoDの転写を阻害したマウスに発生した腫瘍におけるエンハンサー領域の配置の転換
当初は,両方のアレルでThymoDの転写を阻害したマウスに発生した腫瘍は,ThymoDの転写の低下にともなうBCL11b遺伝子の発現の低下の影響により生じた腫瘍として変異タンパク質の同定および分類に使用できると考えていた.しかし,発生した腫瘍のRNA-seq法による解析において,ThymoDの転写が抑制された腫瘍だけでなく,おそらくはクローンの形成の過程において生じた変異タンパク質の影響をうけてThymoDの転写の亢進した腫瘍が確認された.ThymoDの転写の亢進した腫瘍においては,コヒーシンのリクルートおよび移動が亢進しておりBCL11b遺伝子の発現は回復していた.一方,ThymoDの転写が抑制された腫瘍においてThymoDは抑制区分に近接していたが,ThymoDの転写の亢進した腫瘍においてThymoDは転写領域に転換されていた.このことから,ThymoDの下流にポリAカセットの影響を回避するセンス方向およびアンチセンス方向の転写が生じると,ThymoDは抑制区分から解放され,エンハンサー領域とプロモーター領域との相互作用が回復することが示された.
おわりに
エンハンサー領域における長鎖非コードRNAあるいはエンハンサーRNAの先行する転写は,それらをコードする領域におけるクロマチンの修飾およびDNAメチル化の状態を変化させ,CTCFなどの転写因子の結合を促進する.また,RNAポリメラーゼIIはコヒーシンを転写開始点からリクルートし,エンハンサー領域とプロモーター領域との新たな相互作用を生み出すことを示した.この研究により,非コードRNAの転写の進行はエンハンサーの解放の初期に貢献するモデルが支持されたと考えている.また,この機構の破綻はT細胞の分化に影響し発がんにも寄与することが示された(図2).この機構がほかの細胞の分化の決定にも組み込まれている可能性があり,その破綻による疾患もあると想定される.エンハンサー領域における転写の障害により発症したがんにおいては,異常の原因となった領域がのちの変異により修飾される可能性のあることが示され,ThymoDの転写を阻害したマウスに発症した腫瘍において発がんに寄与する2次的な変異を同定し,そこからはエンハンサー領域の配置の転換に貢献する変異が見い出されると考えている.
文 献
- Lin, Y. C., Benner, C., Mansson, R. et al.: Global changes in the nuclear positioning of genes and intra- and interdomain genomic interactions that orchestrate B cell fate. Nat. Immunol., 13, 1196-1204 (2012)[PubMed]
- Mele, M. and Rinn, J. L.: "Cat's cradling" the 3D genome by the act of lncRNA transcription. Mol. Cell, 62, 657-664 (2016)[PubMed]
- Ikawa, T., Hirose, S., Masuda, K. et al.: An essential developmental checkpoint for production of the T cell lineage. Science, 329, 93-96 (2010)[PubMed]
- Li, L., Leid, M. & Rothenberg, E. V.: An early T cell lineage commitment checkpoint dependent on the transcription factor Bcl11b. Science, 329, 89-93 (2010)[PubMed]
- Li, L., Zhang, J. A., Dose, M. et al.: A far downstream enhancer for murine Bcl11b controls its T-cell specific expression. Blood, 122, 902-911 (2013)[PubMed]
- Zhang, J. A., Mortazavi, A., Williams, B. A. et al.: Dynamic transformations of genome-wide epigenetic marking and transcriptional control establish T cell identity. Cell, 149, 467-482 (2012)[PubMed]
- Gutierrez, A., Kentsis, A., Sanda, T. et al.: The BCL11B tumor suppressor is mutated across the major molecular subtypes of T-cell acute lymphoblastic leukemia. Blood, 118, 4169-4173 (2011)[PubMed]
- Kamimura, K., Ohi, H., Kubota, T. et al.: Haploinsufficiency of Bcl11b for suppression of lymphomagenesis and thymocyte development. Biochem. Biophys. Res. Commun., 355, 538-542 (2007)[PubMed]
- Bhardwaj, S., Schlackow, M., Rabajdova, M. et al.: Transcription facilitates sister chromatid cohesion on chromosomal arms. Nucleic Acids Res., 44, 6672-6692 (2016)[PubMed]
- Izumi, K., Nakato, R., Zhang, A. et al.: Gemrline gain-of-function mutations in AFF4 cause a developmental syndrome functionally linking the super elongation complex and cohesin. Nat. Genet., 47, 338-347 (2015)[PubMed] [新着論文レビュー]
- Busslinger, G. A., Stocsits, R. R., van der Lelij, P. et al.: Cohesin is positioned in mammalian genomes by transcription, CTCF and Wapl. Nature, 544, 503-507 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 米国California大学San Diego校 ポストドクトラルフェローを経て,2017年よりJAとりで総合医療センター.
研究テーマ:非コードRNAの転写の障害による先天性免疫不全症および腫瘍の同定.
Cornelis Murre
米国California大学San Diego校 特別教授.
研究室URL:http://labs.biology.ucsd.edu/murre/
© 2017 磯田健志・Cornelis Murre Licensed under CC 表示 2.1 日本