EphBシグナルは成体において神経幹細胞ニッチ細胞の細胞運命を制御する
野村 真・Jonas Frisén
(スウェーデンKarolinska Institute,Department of Cell and Molecular Biology)
email:野村 真
DOI: 10.7875/first.author.2010.069
EphB signaling controls lineage plasticity of adult neural stem cell niche cells.
Tadashi Nomura, Christian Göritz, Timothy Catchpole, Mark Henkemeyer, Jonas Frisén
Cell Stem Cell, 7, 730-743 (2010)
組織特異的な幹細胞は成体の組織再生や恒常性の維持に重要な役割をはたす.組織特異的な幹細胞は特殊な微小環境(幹細胞ニッチ)によって保持されているが,この幹細胞ニッチがどのような分子細胞生物学的な機構により維持されているのかはいまだ不明である.筆者らは今回,成体マウス脳の側脳質壁において,神経幹細胞ニッチを構成する2つの細胞集団である上衣細胞とアストログリア細胞とが互いに細胞運命を転換しうることを発見した.脳に局所的な障害をあたえた場合,アストログリア細胞は上衣細胞となり,上衣細胞はアストログリア細胞へとその表現型を変化させた.筆者らは,こうした細胞の運命転換に細胞膜に存在する受容体型チロシンキナーゼEphB2のシグナルが重要な役割をはたすことを見い出した.さらに,同じく細胞膜に存在し細胞運命の決定を行っているNotchのシグナルがEphB2の発現を制御していることを証明した.したがって,生理的な条件下ではこのシグナルカスケードが側脳室における上衣細胞とアストログリア細胞との運命転換を抑制しているものと考えられた.この実験結果により,生体において幹細胞ニッチの細胞運命は能動的に維持されていること,また同時に,幹細胞ニッチに存在する細胞が高い分化可塑性を備えていることが明らかになった.
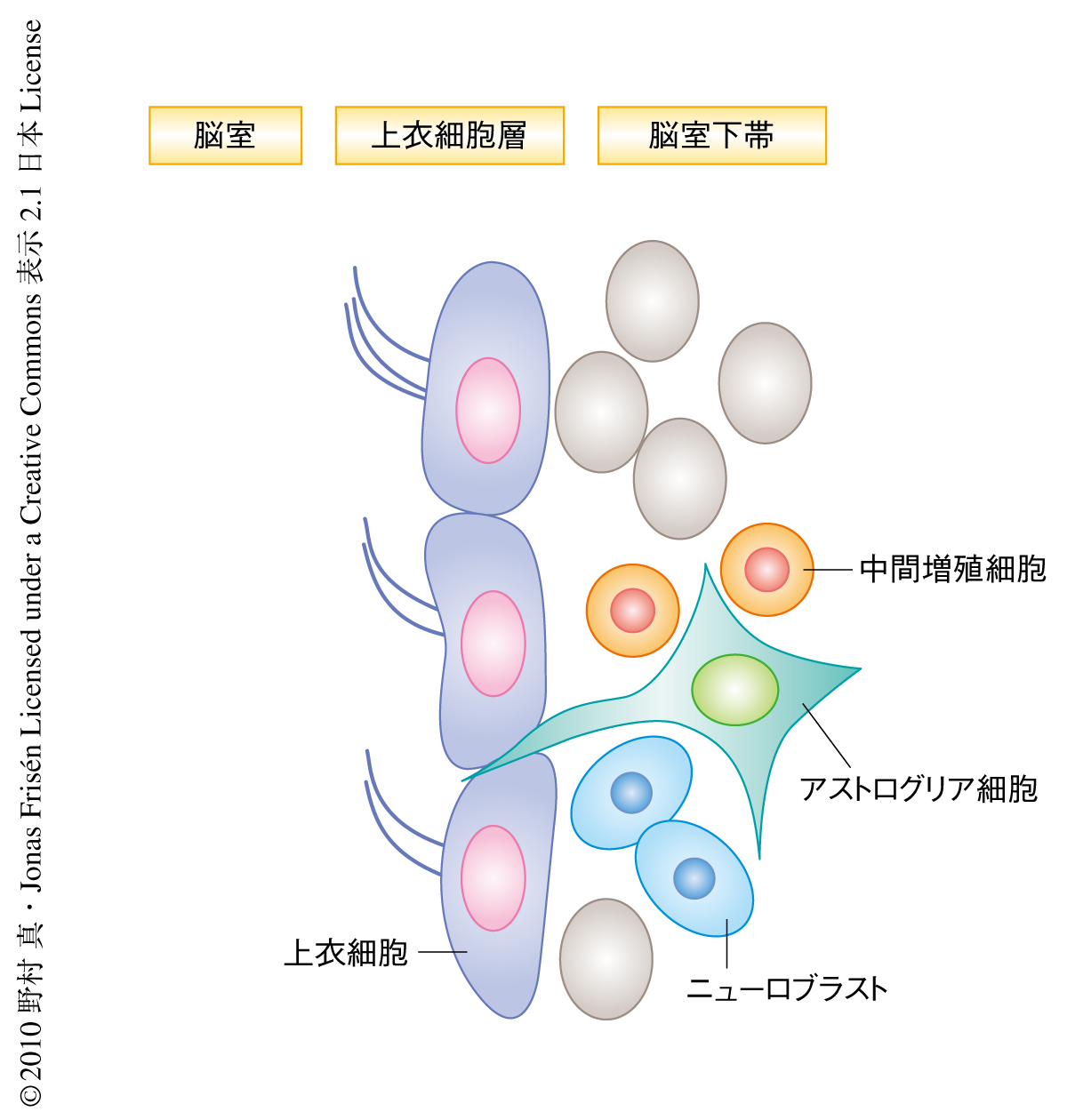
幹細胞の最大の特性のひとつである自己複製能は,幹細胞自体に備わっている細胞自律的な分子機構と,幹細胞の周囲の特殊な微小環境(幹細胞ニッチ)に依存した非自律的な分子機構とに依存している.近年の研究により,幹細胞に備わっている細胞運命の転換能力(可塑性)が幹細胞自体の維持に重要な役割をはたしていることが見い出されている.一方,幹細胞ニッチを構成する細胞がどのような分子機構によって維持されているのかは不明であった.哺乳類の成体脳においては,実験的な操作をくわえた場合,神経幹細胞ニッチの変化と再構築の起こることが報告されている.成体脳の側脳質壁および脳質下帯は神経幹細胞を保持するニッチ細胞の存在する領域として重要である.この領域において,脳質壁を構成する主要な細胞が上衣細胞とアストログリア細胞である(図1).上衣細胞は繊毛をもつ上皮細胞であり,通常状態では細胞増殖を停止している1).一方,アストログリア細胞の一群は神経幹細胞として増殖し多分化能を示すが,そのほかのアストログリア細胞は幹細胞ニッチ細胞としてふるまうことが知られている2).こうした細胞集団は細胞接着分子を介して互いに密着することで神経幹細胞ニッチの構造を維持している3).
Ephは膜貫通型の受容体型チロシンキナーゼであり,細胞の増殖や分化,移動といったさまざまな組織構築のイベントに重要な役割をはたす4).Ephはその構造からAタイプとBタイプとに区別され,それぞれ特異的なリガンド(ephrinAおよびephrinB)と結合することにより細胞内にシグナルを伝達する.以前の研究により,Eph/ephrinシグナルが成体の組織特異的な幹細胞の増殖と分化を制御していることが報告されている5,6).
今回,筆者らは,EphB2を介したシグナルが成体脳の側脳質の幹細胞ニッチ細胞の運命転換に重要な役割をはたすことを見い出した.上衣細胞層に特異的な障害をあたえた場合,上衣細胞はアストログリア細胞に,アストログリア細胞は上衣細胞へと変化することが明らかになった.この運命転換はEphBシグナルを阻害することにより誘導された.さらに,EphBシグナルはNotchシグナルの下流で機能していることが明らかになった.したがって,生理的な条件下では,このシグナルカスケードによりおのおのの幹細胞ニッチ細胞の運命が能動的に維持されているものと考えられた.一方,さまざまな組織の障害により幹細胞ニッチ細胞が失われた場合,残った幹細胞ニッチ細胞は高い分化可塑性を発揮し,失われた細胞を補填することによって幹細胞ニッチの恒常性を維持しているものと推測された.
脳組織の障害にともなう神経幹細胞ニッチ細胞のふるまいを追跡するため,おのおのの細胞集団を特異的に標識することを試みた.まず,アストログリア細胞の特異的な標識を行うため,アストログリア細胞において発現するConnexin30遺伝子のプロモーターの下流でCreリコンビナーゼを発現するトランスジェニックマウスを使用した.このトランスジェニックマウスとYFPレポータートランスジェニックマウスとを掛け合わせた個体にエストロゲンの誘導体であるタモキシフェンを投与することにより,時期特異的にアストログリア細胞とその子孫細胞とを標識することが可能となる.成体脳でアストログリア細胞を標識したのち,側脳室壁に障害をあたえる目的で脳室にノイラミ二ダーゼを注入した.この薬物はノイラミニン酸を切断する酵素で,この酵素を脳室に投与すると脳室壁を構成する上衣細胞の脱落の起こることが報告されている7).ノイラミ二ダーゼを投与して1週間後にマウスを固定し標識細胞の運命を解析した結果,上衣細胞の脱落にともないYFPで標識されたアストログリア細胞の系譜に由来する細胞が上衣細胞へと変化していることが見い出された.
つぎに,上衣細胞のふるまいを追跡するため,Creリコンビナーゼを発現するアデノウイルス,および,上衣細胞に特異的なプロモーターの下流でCreリコンビナーゼを発現するプラスミドを側脳室に導入し,さらに,ノイラミ二ダーゼを投与した.その結果,ノイラミ二ダーゼの投与によって上衣細胞がアストログリア細胞様に変化することが見い出された.したがって,脳局所的に障害をあたえた場合,上衣細胞とアストログリア細胞とのあいだで運命転換の起こることが明らかになった.この運命転換は細胞分裂をともなってはおらず,細胞の直接的な分化転換であると推測された.
つぎに,上衣細胞とアストログリア細胞との運命転換がどのような分子機構に依存しているのかを調べた.受容体型チロシンキナーゼであるEphとそのリガンドであるephrinは,成体組織の特異的な幹細胞の増殖,分化,移動に必須の役割をはたしていることが知られている4).特異的な抗体およびレポーターマウスの解析から,成体の側脳室の周囲ではとくにEphB1,EphB2が上衣細胞に,ephrinB1,ephrinB2が上衣細胞とアストログリア細胞に発現していることが明らかになった.そこで,側脳室の周囲のEphB/ephrinBシグナルの機能を解析するため,側脳室に可溶性のEphB2を浸透圧ポンプによって注入し,内在性の受容体およびリガンドによるシグナルを阻害することを試みた.その結果,EphB/ephrinBシグナルの阻害により,アストログリア細胞は上衣細胞に,また,上衣細胞はアストログリア細胞に運命転換することが明らかになった.
Ephシグナルは受容体に依存性の順方向のシグナルと,リガンドに依存性の逆方向のシグナルの2つのシグナルを細胞内に伝達しうることが報告されている4).このニッチ細胞の運命転換がどちらのシグナルに依存しているのかを解析するため,ドミナントネガティブ型のEphBおよびephrinBを発現するベクターを作製し,これらのベクターをエレクトロポレーション法により上衣細胞に導入した.その結果,受容体であるEphBのドミナントネガティブ体のベクターを導入したときのみ,上衣細胞においてアストログリア細胞のマーカーの発現の上昇が確認された.さらに,EphB2ノックアウトマウスおよびephrinB2ノックアウトマウスの解析より,EphB2の順方向のシグナルが欠損した場合に上衣細胞がアストログリア細胞様に変化することが明らかになった.
ノイラミ二ダーゼによるアストログリア細胞と上衣細胞とのあいだの運命転換がEphシグナルに依存しているのかどうかを解析するため,ノイラミ二ダーゼ投与ののちの脳におけるEphの発現を解析した.その結果,ノイラミ二ダーゼの投与によって側脳室の周囲のEphB2の発現が有意に低下することを見い出した.さらに,EphB2の強制発現によって上衣細胞のアストログリア細胞への運命転換を抑制することができた.したがって,脳の局所的な障害によるニッチ細胞の運命転換はEphB2のシグナルの低下によりひき起こされていることが明らかになった.
以前に筆者の研究グループは,Notchシグナルが側脳室の上衣細胞の運命維持に必須の役割をはたしていることを見い出している8).上衣細胞において特異的にNotchシグナルを欠損させたマウスでは上衣細胞が脱上皮化し神経細胞へと運命転換する.そこで,上衣細胞におけるEphシグナルとNotchシグナルとの関係を明らかにするため,上衣細胞においてNotchシグナルを阻害もしくは亢進させた場合のEphB2の発現を解析した.Notchのシグナルは転写因子であるRBPJによって伝達される.そこで,マウスの側脳室の上衣細胞において特異的にRBPJの機能を阻害した.このような上衣細胞ではEphB2の発現が顕著に低下することが明らかになった.さらに,Notchシグナルの機能亢進型コンストラクトを上衣細胞に強制発現するとEphB2の発現の上昇することも確認された.
さらに,EphB2がNotchシグナルの下流で機能しているのかどうかを表現型救済実験によって検討した.ドミナントネガティブ型のRBPJを上衣細胞において発現させると上衣細胞に特異的な遺伝子の発現が消失する.このとき,同時にEphB2の発現ベクターを共導入すると上衣細胞の遺伝子発現の維持されることがわかった.したがって,上衣細胞においてEphB2はNotchシグナルの下流で上衣細胞の運命維持に必要であることが明らかになった.
最後に,アストログリア細胞から上衣細胞への運命転換にNotchシグナルがかかわっているのかどうかを検討した.アストログリア細胞において特異的にNotchシグナルを欠損させたマウスにおいてアストログリア細胞の系譜を追跡したところ,興味深いことに,アストログリア細胞に由来する細胞が上衣細胞に運命転換していることが明らかになった.したがって,正常状態ではアストログリア細胞が分化運命を維持するためNotchシグナルが必須の役割をはたしていることが明らかになった.
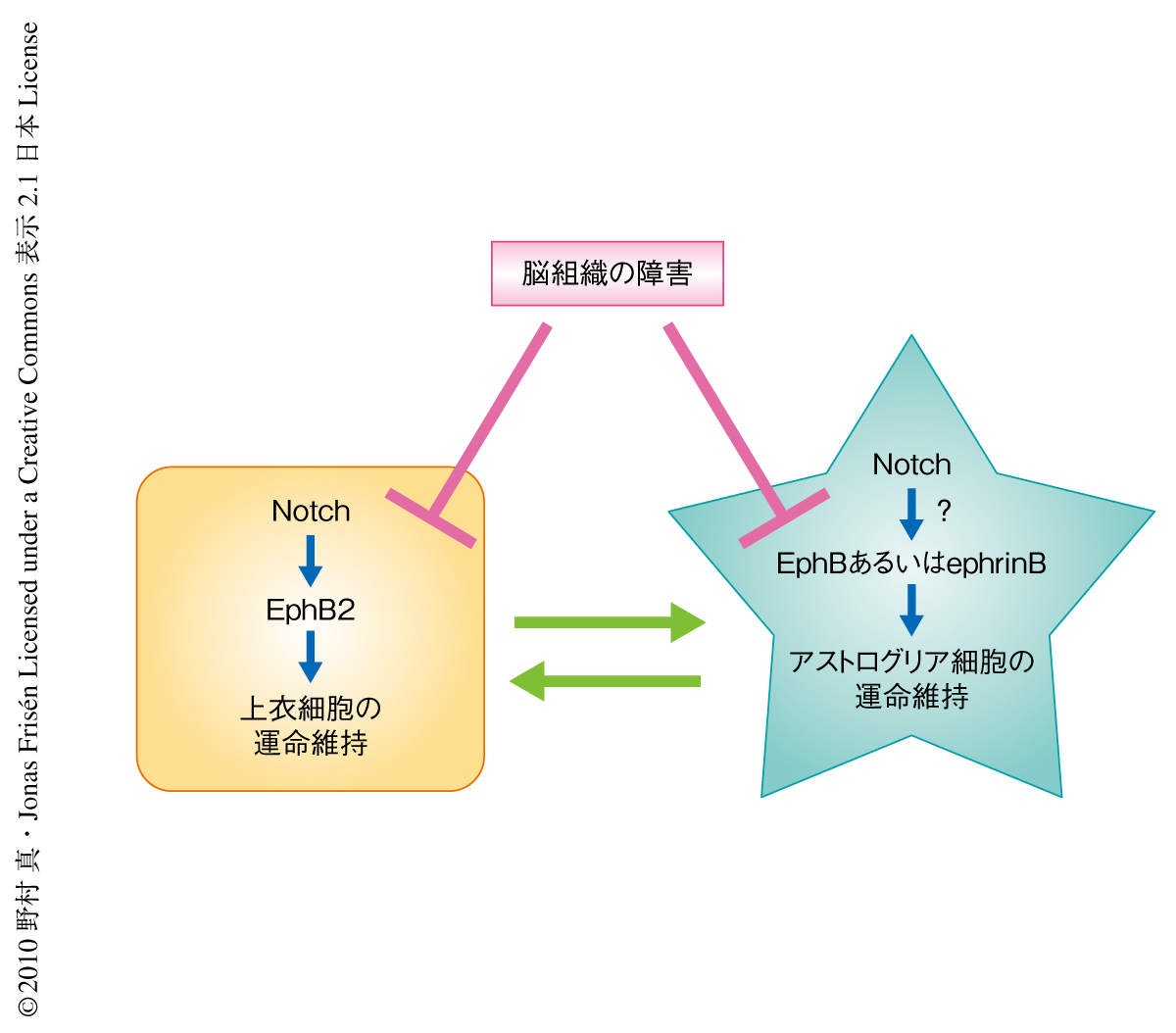
組織特異的な幹細胞の維持には幹細胞ニッチの存在が不可欠である.これまで,幹細胞と幹細胞ニッチとのあいだのシグナルに関しては多くの研究がなされてきたが,幹細胞ニッチを構成する細胞がどのような機構で維持されているのかはほとんど研究がなされていなかった.今回,筆者らは,遺伝学的な手法にもとづく細胞標識法を駆使することにより幹細胞ニッチ細胞の分化運命が可塑性に富んでいることを示した.これは,さまざまな組織障害によって幹細胞ニッチに障害の生じた場合に失われた幹細胞ニッチ細胞をおぎなう機構として機能しているものと推測された.正常状態ではこうした幹細胞ニッチ細胞の分化可塑性は抑制されており,側脳室の幹細胞ニッチ細胞の場合はNotch-EphB2シグナルが重要な役割をはたしていることが明らかになった9)(図2).細胞の分化運命がこのような細胞膜に存在するタンパク質によって制御されていることは興味深く,分化運命の決定と維持における細胞間コミュニケーションの重要性を示唆している.今後,幹細胞だけでなく幹細胞ニッチ細胞の運命制御の機構をさらに解析することにより,中枢神経系の再生戦略にも新たな指針を示すことのできるものと期待される.
略歴:2000年 名古屋大学大学院理学研究科博士課程 修了,同年 東北大学大学院医学系研究科 助手(助教),2007年 スウェーデンKarolinska Institute博士研究員を経て,2010年より同 上級研究員.
研究テーマ:成体の神経幹細胞の維持機構.
関心事:胎生期から成体までの神経幹細胞のふるまい,また,神経幹細胞の変化と脳の形態進化に興味をもっています.
Jonas Frisén
スウェーデンKarolinska Institute教授.
© 2010 野村 真・Jonas Frisén Licensed under CC 表示 2.1 日本
(スウェーデンKarolinska Institute,Department of Cell and Molecular Biology)
email:野村 真
DOI: 10.7875/first.author.2010.069
EphB signaling controls lineage plasticity of adult neural stem cell niche cells.
Tadashi Nomura, Christian Göritz, Timothy Catchpole, Mark Henkemeyer, Jonas Frisén
Cell Stem Cell, 7, 730-743 (2010)
要 約
組織特異的な幹細胞は成体の組織再生や恒常性の維持に重要な役割をはたす.組織特異的な幹細胞は特殊な微小環境(幹細胞ニッチ)によって保持されているが,この幹細胞ニッチがどのような分子細胞生物学的な機構により維持されているのかはいまだ不明である.筆者らは今回,成体マウス脳の側脳質壁において,神経幹細胞ニッチを構成する2つの細胞集団である上衣細胞とアストログリア細胞とが互いに細胞運命を転換しうることを発見した.脳に局所的な障害をあたえた場合,アストログリア細胞は上衣細胞となり,上衣細胞はアストログリア細胞へとその表現型を変化させた.筆者らは,こうした細胞の運命転換に細胞膜に存在する受容体型チロシンキナーゼEphB2のシグナルが重要な役割をはたすことを見い出した.さらに,同じく細胞膜に存在し細胞運命の決定を行っているNotchのシグナルがEphB2の発現を制御していることを証明した.したがって,生理的な条件下ではこのシグナルカスケードが側脳室における上衣細胞とアストログリア細胞との運命転換を抑制しているものと考えられた.この実験結果により,生体において幹細胞ニッチの細胞運命は能動的に維持されていること,また同時に,幹細胞ニッチに存在する細胞が高い分化可塑性を備えていることが明らかになった.
はじめに
幹細胞の最大の特性のひとつである自己複製能は,幹細胞自体に備わっている細胞自律的な分子機構と,幹細胞の周囲の特殊な微小環境(幹細胞ニッチ)に依存した非自律的な分子機構とに依存している.近年の研究により,幹細胞に備わっている細胞運命の転換能力(可塑性)が幹細胞自体の維持に重要な役割をはたしていることが見い出されている.一方,幹細胞ニッチを構成する細胞がどのような分子機構によって維持されているのかは不明であった.哺乳類の成体脳においては,実験的な操作をくわえた場合,神経幹細胞ニッチの変化と再構築の起こることが報告されている.成体脳の側脳質壁および脳質下帯は神経幹細胞を保持するニッチ細胞の存在する領域として重要である.この領域において,脳質壁を構成する主要な細胞が上衣細胞とアストログリア細胞である(図1).上衣細胞は繊毛をもつ上皮細胞であり,通常状態では細胞増殖を停止している1).一方,アストログリア細胞の一群は神経幹細胞として増殖し多分化能を示すが,そのほかのアストログリア細胞は幹細胞ニッチ細胞としてふるまうことが知られている2).こうした細胞集団は細胞接着分子を介して互いに密着することで神経幹細胞ニッチの構造を維持している3).
Ephは膜貫通型の受容体型チロシンキナーゼであり,細胞の増殖や分化,移動といったさまざまな組織構築のイベントに重要な役割をはたす4).Ephはその構造からAタイプとBタイプとに区別され,それぞれ特異的なリガンド(ephrinAおよびephrinB)と結合することにより細胞内にシグナルを伝達する.以前の研究により,Eph/ephrinシグナルが成体の組織特異的な幹細胞の増殖と分化を制御していることが報告されている5,6).
今回,筆者らは,EphB2を介したシグナルが成体脳の側脳質の幹細胞ニッチ細胞の運命転換に重要な役割をはたすことを見い出した.上衣細胞層に特異的な障害をあたえた場合,上衣細胞はアストログリア細胞に,アストログリア細胞は上衣細胞へと変化することが明らかになった.この運命転換はEphBシグナルを阻害することにより誘導された.さらに,EphBシグナルはNotchシグナルの下流で機能していることが明らかになった.したがって,生理的な条件下では,このシグナルカスケードによりおのおのの幹細胞ニッチ細胞の運命が能動的に維持されているものと考えられた.一方,さまざまな組織の障害により幹細胞ニッチ細胞が失われた場合,残った幹細胞ニッチ細胞は高い分化可塑性を発揮し,失われた細胞を補填することによって幹細胞ニッチの恒常性を維持しているものと推測された.
1.上衣細胞層の障害にともないアストログリア細胞と上衣細胞とが運命転換する
脳組織の障害にともなう神経幹細胞ニッチ細胞のふるまいを追跡するため,おのおのの細胞集団を特異的に標識することを試みた.まず,アストログリア細胞の特異的な標識を行うため,アストログリア細胞において発現するConnexin30遺伝子のプロモーターの下流でCreリコンビナーゼを発現するトランスジェニックマウスを使用した.このトランスジェニックマウスとYFPレポータートランスジェニックマウスとを掛け合わせた個体にエストロゲンの誘導体であるタモキシフェンを投与することにより,時期特異的にアストログリア細胞とその子孫細胞とを標識することが可能となる.成体脳でアストログリア細胞を標識したのち,側脳室壁に障害をあたえる目的で脳室にノイラミ二ダーゼを注入した.この薬物はノイラミニン酸を切断する酵素で,この酵素を脳室に投与すると脳室壁を構成する上衣細胞の脱落の起こることが報告されている7).ノイラミ二ダーゼを投与して1週間後にマウスを固定し標識細胞の運命を解析した結果,上衣細胞の脱落にともないYFPで標識されたアストログリア細胞の系譜に由来する細胞が上衣細胞へと変化していることが見い出された.
つぎに,上衣細胞のふるまいを追跡するため,Creリコンビナーゼを発現するアデノウイルス,および,上衣細胞に特異的なプロモーターの下流でCreリコンビナーゼを発現するプラスミドを側脳室に導入し,さらに,ノイラミ二ダーゼを投与した.その結果,ノイラミ二ダーゼの投与によって上衣細胞がアストログリア細胞様に変化することが見い出された.したがって,脳局所的に障害をあたえた場合,上衣細胞とアストログリア細胞とのあいだで運命転換の起こることが明らかになった.この運命転換は細胞分裂をともなってはおらず,細胞の直接的な分化転換であると推測された.
2.Eph/ephrinシグナルの阻害により神経幹細胞ニッチ細胞の運命転換がひき起こされる
つぎに,上衣細胞とアストログリア細胞との運命転換がどのような分子機構に依存しているのかを調べた.受容体型チロシンキナーゼであるEphとそのリガンドであるephrinは,成体組織の特異的な幹細胞の増殖,分化,移動に必須の役割をはたしていることが知られている4).特異的な抗体およびレポーターマウスの解析から,成体の側脳室の周囲ではとくにEphB1,EphB2が上衣細胞に,ephrinB1,ephrinB2が上衣細胞とアストログリア細胞に発現していることが明らかになった.そこで,側脳室の周囲のEphB/ephrinBシグナルの機能を解析するため,側脳室に可溶性のEphB2を浸透圧ポンプによって注入し,内在性の受容体およびリガンドによるシグナルを阻害することを試みた.その結果,EphB/ephrinBシグナルの阻害により,アストログリア細胞は上衣細胞に,また,上衣細胞はアストログリア細胞に運命転換することが明らかになった.
Ephシグナルは受容体に依存性の順方向のシグナルと,リガンドに依存性の逆方向のシグナルの2つのシグナルを細胞内に伝達しうることが報告されている4).このニッチ細胞の運命転換がどちらのシグナルに依存しているのかを解析するため,ドミナントネガティブ型のEphBおよびephrinBを発現するベクターを作製し,これらのベクターをエレクトロポレーション法により上衣細胞に導入した.その結果,受容体であるEphBのドミナントネガティブ体のベクターを導入したときのみ,上衣細胞においてアストログリア細胞のマーカーの発現の上昇が確認された.さらに,EphB2ノックアウトマウスおよびephrinB2ノックアウトマウスの解析より,EphB2の順方向のシグナルが欠損した場合に上衣細胞がアストログリア細胞様に変化することが明らかになった.
3.脳の局所的な障害によるニッチ細胞の運命転換はEphB2シグナルの低下に依存している
ノイラミ二ダーゼによるアストログリア細胞と上衣細胞とのあいだの運命転換がEphシグナルに依存しているのかどうかを解析するため,ノイラミ二ダーゼ投与ののちの脳におけるEphの発現を解析した.その結果,ノイラミ二ダーゼの投与によって側脳室の周囲のEphB2の発現が有意に低下することを見い出した.さらに,EphB2の強制発現によって上衣細胞のアストログリア細胞への運命転換を抑制することができた.したがって,脳の局所的な障害によるニッチ細胞の運命転換はEphB2のシグナルの低下によりひき起こされていることが明らかになった.
4.EphB2はNotchシグナルの下流で上衣細胞の運命維持に機能している
以前に筆者の研究グループは,Notchシグナルが側脳室の上衣細胞の運命維持に必須の役割をはたしていることを見い出している8).上衣細胞において特異的にNotchシグナルを欠損させたマウスでは上衣細胞が脱上皮化し神経細胞へと運命転換する.そこで,上衣細胞におけるEphシグナルとNotchシグナルとの関係を明らかにするため,上衣細胞においてNotchシグナルを阻害もしくは亢進させた場合のEphB2の発現を解析した.Notchのシグナルは転写因子であるRBPJによって伝達される.そこで,マウスの側脳室の上衣細胞において特異的にRBPJの機能を阻害した.このような上衣細胞ではEphB2の発現が顕著に低下することが明らかになった.さらに,Notchシグナルの機能亢進型コンストラクトを上衣細胞に強制発現するとEphB2の発現の上昇することも確認された.
さらに,EphB2がNotchシグナルの下流で機能しているのかどうかを表現型救済実験によって検討した.ドミナントネガティブ型のRBPJを上衣細胞において発現させると上衣細胞に特異的な遺伝子の発現が消失する.このとき,同時にEphB2の発現ベクターを共導入すると上衣細胞の遺伝子発現の維持されることがわかった.したがって,上衣細胞においてEphB2はNotchシグナルの下流で上衣細胞の運命維持に必要であることが明らかになった.
5.Notchシグナルはアストログリア細胞の表現型の維持にも必要である
最後に,アストログリア細胞から上衣細胞への運命転換にNotchシグナルがかかわっているのかどうかを検討した.アストログリア細胞において特異的にNotchシグナルを欠損させたマウスにおいてアストログリア細胞の系譜を追跡したところ,興味深いことに,アストログリア細胞に由来する細胞が上衣細胞に運命転換していることが明らかになった.したがって,正常状態ではアストログリア細胞が分化運命を維持するためNotchシグナルが必須の役割をはたしていることが明らかになった.
おわりに
組織特異的な幹細胞の維持には幹細胞ニッチの存在が不可欠である.これまで,幹細胞と幹細胞ニッチとのあいだのシグナルに関しては多くの研究がなされてきたが,幹細胞ニッチを構成する細胞がどのような機構で維持されているのかはほとんど研究がなされていなかった.今回,筆者らは,遺伝学的な手法にもとづく細胞標識法を駆使することにより幹細胞ニッチ細胞の分化運命が可塑性に富んでいることを示した.これは,さまざまな組織障害によって幹細胞ニッチに障害の生じた場合に失われた幹細胞ニッチ細胞をおぎなう機構として機能しているものと推測された.正常状態ではこうした幹細胞ニッチ細胞の分化可塑性は抑制されており,側脳室の幹細胞ニッチ細胞の場合はNotch-EphB2シグナルが重要な役割をはたしていることが明らかになった9)(図2).細胞の分化運命がこのような細胞膜に存在するタンパク質によって制御されていることは興味深く,分化運命の決定と維持における細胞間コミュニケーションの重要性を示唆している.今後,幹細胞だけでなく幹細胞ニッチ細胞の運命制御の機構をさらに解析することにより,中枢神経系の再生戦略にも新たな指針を示すことのできるものと期待される.
文 献
- Spassky, N., Merkle, F. T., Flames, N. et al.: Adult ependymal cells are postmitotic and are derived from radial glial cells during embryogenesis. J. Neurosci., 25, 10-18 (2005)[PubMed]
- Doetsch, F., Callle, I., Lim, D. A. et al.: Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell, 97, 703-716 (1999)[PubMed]
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M. et al.: Neural stem cells confer unieque pinwheel architecture to the ventriclar surface in neurogenic regions in the adult brain. Cell Stem Cell, 3, 265-278 (2008)[PubMed]
- Pasquale, E. B.: Eph-ephrin bidirectional signaling in physiology and disease. Cell, 133, 38-52 (2008)[PubMed]
- Holmberg, J., Armulik, A., Senti, K. -A. et al.: Ephrin-A2 reverse signaling negatively regulates neural progenitor proliferation and neurogenesis. Genes Dev., 19, 462-471 (2005)[PubMed]
- Genander, M. & Frisen, J.: Ephrins and Eph receptors in stem cells and cancer. Curr. Opin. Cell Biol., 22, 611-616 (2010)[PubMed]
- Luo, J., Shook, B. A., Daniels, S. B. et al.: Subventricular zone-mediated ependyma repair in the adult mammalian brain. J. Neurosci., 28, 3804-3813 (2008)[PubMed]
- Carlen, M., Meletis, K., Goritz, C. et al.: Forebrain ependymal cells are Notch-dependent and generate neuroblasts and astrocytes after stroke. Nat. Neurosci., 12, 259-267 (2009)[PubMed]
- Murai, K. K. & Pasquale, E. B.: Restraining stem cell niche plasticity: a new talent of Eph receptors. Cell Stem Cell, 7, 647-648 (2010)[PubMed]
著者プロフィール
略歴:2000年 名古屋大学大学院理学研究科博士課程 修了,同年 東北大学大学院医学系研究科 助手(助教),2007年 スウェーデンKarolinska Institute博士研究員を経て,2010年より同 上級研究員.
研究テーマ:成体の神経幹細胞の維持機構.
関心事:胎生期から成体までの神経幹細胞のふるまい,また,神経幹細胞の変化と脳の形態進化に興味をもっています.
Jonas Frisén
スウェーデンKarolinska Institute教授.
© 2010 野村 真・Jonas Frisén Licensed under CC 表示 2.1 日本