天然物の生合成においてS-アデノシルメチオニンに依存性の酵素により触媒されるペリ環状反応
大橋雅生・渡辺賢二
(静岡県立大学大学院薬学研究院 生薬学講座)
email:渡辺賢二
DOI: 10.7875/first.author.2017.105
SAM-dependent enzyme-catalysed pericyclic reactions in natural product biosynthesis.
Masao Ohashi, Fang Liu, Yang Hai, Mengbin Chen, Man-cheng Tang, Zhongyue Yang, Michio Sato, Kenji Watanabe, K. N. Houk, Yi Tang
Nature, 549, 502-506 (2017)
ペリ環状反応は位置選択的および立体選択的に炭素-炭素結合を形成するためもっとも強力な反応のひとつとして知られ,複雑な構造をもつ数多くの天然物の全合成において幅広く応用されてきた.しかしながら,ペリ環状反応を触媒する酵素は天然物の生合成においては非常にまれである.この研究において,筆者らは,糸状菌Aspergillus属の生産する天然物leporinの生合成遺伝子クラスターからペリ環状反応を触媒する新規の酵素LepIを同定した.LepIは,当初は典型的なS-アデノシルメチオニンに依存性のO-メチルトランスフェラーゼと推測されたが,実際にはメチル化反応は触媒せず,S-アデノシルメチオニンを補酵素として駆使し脱水反応および3種のペリ環状反応を触媒する先例のない多機能性の酵素であることが明らかにされた.この研究は,天然に存在する酵素にはいまだ同定されていない酵素的なペリ環状反応が存在することを想起させるとともに,万能な補酵素であるS-アデノシルメチオニンの新たな役割が酵素反応のほかにも見い出される可能性を期待させるものである.
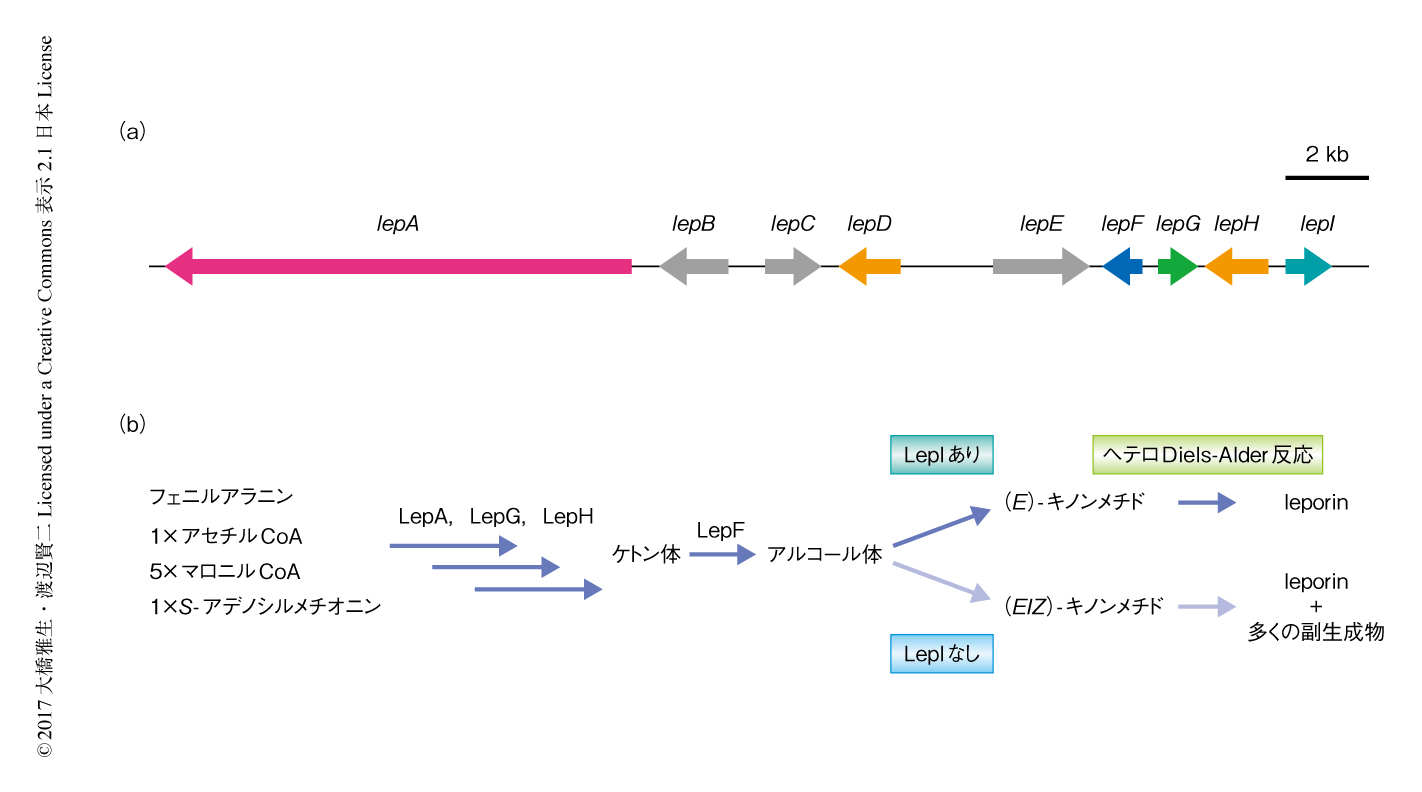
天然に存在する酵素的なペリ環状反応は非常にまれな反応として知られてきた.実際に,ペリ環状反応は数多くの多環性天然物の生合成にかかわる重要な反応と示唆されてきたものの,これまで,ペリ環状反応を触媒する酵素はひとにぎりしか同定されていない1).筆者らは,天然物の生合成においていまだ同定されていない酵素的なペリ環状反応のうち,天然物のヘテロ芳香環を構築するために重要なヘテロDiels-Alder反応に着目して研究を展開してきた.ヘテロDiels-Alder反応はジヒドロピラン環を形成するための重要な生合成反応と示唆されており,ジヒドロピラン環は糸状菌Aspergillus属の生産するleporinをはじめとする数多くの天然物において頻繁にみられる構造のひとつである2).アルコール体の脱水反応により生じる不安定な中間体を用いたleporinのジヒドロピラン環の生合成を模倣した反応においては,ヘテロDiels-Alder反応の生成物である少量のleporinと,その位置異性体あるいは立体異性体である分子内Diels-Alder反応およびヘテロDiels-Alder反応の副生成物の混合物が得られる3).したがって,ジヒドロピラン環を構築するためには酵素による反応の制御が必要不可欠である4).すなわち,leporinの生合成遺伝子クラスターにはヘテロDiels-Alder反応を触媒する酵素がコードされることが強く示唆された.この研究においては,ヘテロDiels-Alder反応を触媒する酵素の同定およびその機能の解析をめざした.
leporinの生合成遺伝子クラスターはAspergillus flavusのゲノムにおいてすでに同定されていたが5),環化酵素や機能が未知の酵素といったヘテロDiels-Alder反応を触媒する酵素の候補をコードする遺伝子の存在は確認されていなかった.そこで,Aspergillus nidulansを異種発現用の宿主として用いてleporinの生合成経路を再構築した.その結果,ポリケチド合成酵素-非リボソームペプチド合成酵素であるLepA,そのパートナーとしてはたらくエノイルレダクターゼLepG,環拡大反応を触媒するP450 LepHの発現により6),ケトン体が生合成された(図1).さらに,ケトン体をアルコール体へと還元すると推測される短鎖型デヒドロゲナーゼ/レダクターゼLepFの発現により,leporinだけでなく,副生成物としてヘテロDiels-Alder反応ジアステレオマーおよび3つの分子内Diels-Alder反応生成物が得られた.これらの化合物のうち,leporinおよび分子内Diels-Alder反応生成物のひとつは (E)-キノンメチドをへて生成し,ほかの化合物は (Z)-キノンメチドを介して生成すると考えられた.これらの結果は,ジヒドロピラン環の生合成を模倣した合成から得られた知見と一致しており,ペリ環状反応の生成物としてleporinを生合成するためには,アルコール体から (E)-キノンメチドへの脱水だけでなく,つづくペリ環状反応も酵素による反応の制御が必要なことが示された.
このleporinの生合成遺伝子クラスターには,leporinの生合成には不要であるのにもかかわらず強く保存されたS-アデノシルメチオニン結合モチーフをもつO-メチルトランスフェラーゼと推測されたLepIをコードする遺伝子が残った.また,アルコール体の還元に由来するさまざまなペリ環状反応の生成物を生産するA. nidulans株においてLepIを発現させたところ,副生成物を生成することなくleporinが支配的に生成された.以上のことから,O-メチルトランスフェラーゼ様の酵素LepIはアルコール体からleporinへの変換を触媒する重要な酵素であることが示唆された.
LepIの基質はアルコール体であることを確認するため,in vitroにおいてアルコール体にLepIを反応させた.LepIの非存在下ではアルコール体の自発的な脱水反応により分子内Diels-Alder反応およびヘテロDiels-Alder反応の混合生成物が得られたのに対し,LepIの存在下ではS-アデノシルメチオニンなどの補酵素の添加なしにアルコール体からleporinへ完全に変換された.このことから,LepIは単独でアルコール体から (E)-キノンメチドへの脱水反応,および,つづくヘテロDiels-Alder反応を触媒する多機能性の酵素であることが示された.
さらに詳細な反応機構を理解するため,アルコール体を基質として用い,LepIの反応を時間に依存的に解析した.その結果,アルコール体からleporinへの変換の過程において分子内Diels-Alder反応生成物の生成および消失がみられた.この結果から,LepIの存在下にもかかわらず (E)-キノンメチドから分子内Diels-Alder反応生成物およびヘテロDiels-Alder反応生成物であるleporinが同時に生成する,すなわち,LepIによるヘテロDiels-Alder反応の制御は不完全であることが示唆された.さらに,LepIは副生成物として生じた分子内Diels-Alder反応生成物をleporinへと変換するため,これまで酵素反応として先例のないレトロClaisen転位を触媒することが示唆された.このことを確認するため,分子内Diels-Alder反応生成物にLepIを反応させたところ,分子内Diels-Alder反応生成物からleporinへの自発的な変換は非常に遅いが,LepIの存在下ではその反応は18万倍も加速された.以上のことから,LepIは脱水反応,分子内Diels-Alder反応およびヘテロDiels-Alder反応にくわえ,レトロClaisen転位を触媒する多機能性の酵素であることが明らかにされた.
ほかの典型的なメチルトランスフェラーゼと同様に7),LepIにはS-アデノシルメチオニン結合モチーフが強く保存されていたことから,LepIが触媒する反応にS-アデノシルメチオニンが関与するかどうか検討した.これまでのin vitroにおけるLepIの反応においてS-アデノシルメチオニンの添加なしに反応は進行したことから,LepIがS-アデノシルメチオニンを保持した状態で精製されている可能性がうたがわれた.変性したLepIの上清からはS-アデノシルメチオニンが検出され,精製されたLepIのうち約8~9割はS-アデノシルメチオニンを保持することが示唆された.そこで,S-アデノシルメチオニンの競合的な阻害剤として知られるS-アデノシルホモシステインの存在下においてLepIを反応させたところ,アルコール体の脱水反応および分子内Diels-Alder反応生成物のレトロClaisen転位が強く阻害されたが,S-アデノシルメチオニンの添加によりS-アデノシルホモシステインによる阻害はほぼ完全に消失した.このことから,S-アデノシルメチオニンがLepIの触媒活性に必須の因子であることが示されたとともに,S-アデノシルホモシステインにはなくS-アデノシルメチオニンのみがもつ正電荷がこれらの反応に要求されると考えられた.そこで,S-アデノシルホモシステインの存在下においてS-アデノシルメチオニンの正電荷アナログを添加してLepIを反応させたところ,脱水反応およびレトロClaisen転位のS-アデノシルホモシステインによる阻害は消失した.
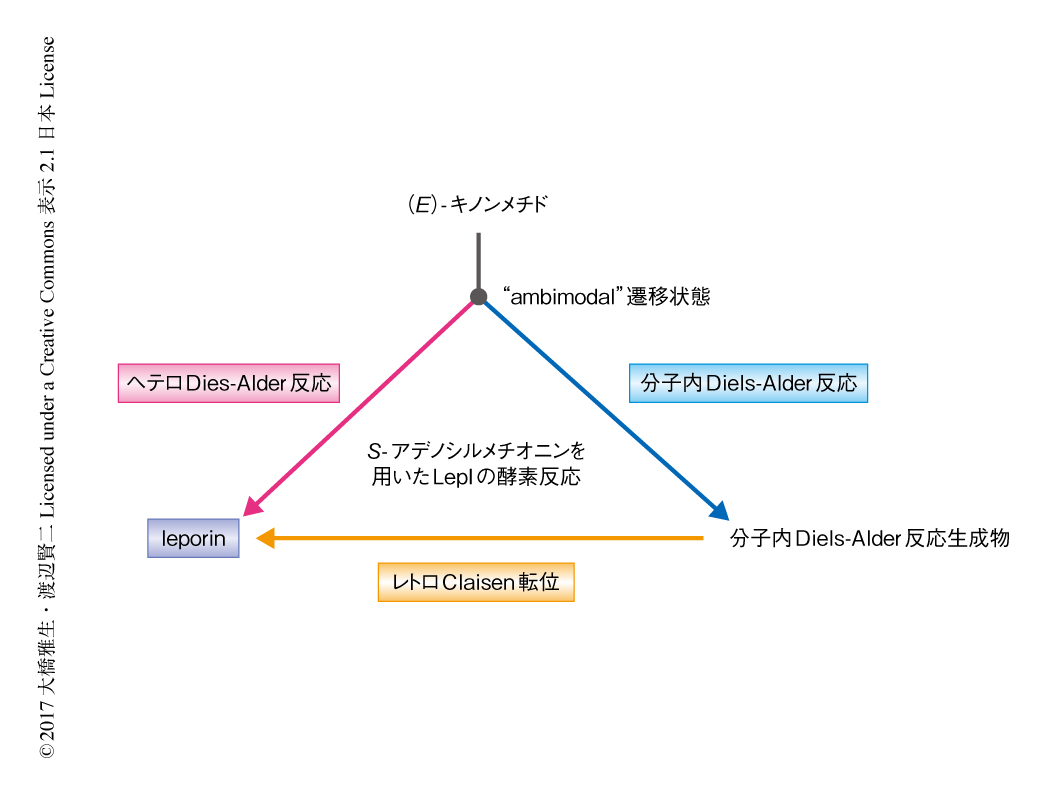
なぜ酵素反応であるのにもかかわらず,(E)-キノンメチドから分子内Diels-Alder反応生成物およびヘテロDiels-Alder反応生成物であるleporinが同時に生成するのか,また,S-アデノシルメチオニンは反応にどのように関与するのかについて理解を深めるため,密度汎関数理論計算を行った.その結果,(E)-キノンメチドから分子内Diels-Alder反応生成物およびleporinへの遷移状態は同一で,いわゆる,“ambimodal”遷移状態にあることが明らかにされた.“ambimodal”遷移状態の場合,遷移状態から生成物へと進む過程において反応経路が枝分かれするため2つの異なる生成物が得られる8).非酵素反応の場合は (E)-キノンメチドからの分子内Diels-Alder反応生成物とleporinの生成比はおおよそ94対6であるが酵素反応の場合はおおよそ50対50であることから,LepIは遷移状態ののちのダイナミクスを制御すると考えられた.実際に,分子動力学計算により,非酵素反応の場合には分子内Diels-Alder反応への経路が支配的であるのに対し,S-アデノシルメチオニンのモデル分子を作用させた場合には約8割がヘテロDiels-Alder反応への経路を選択することが示された.さらに,分子内Diels-Alder反応生成物とS-アデノシルメチオニンあるいはその正電荷アナログとの相互作用により,分子内Diels-Alder反応生成物からleporinへのレトロClaisen転位の活性化エネルギーが大きく低下すると推測され,これらの計算により,正電荷をもつS-アデノシルメチオニンの触媒的な役割が強く支持された.
この研究において,S-アデノシルメチオニンに依存性の酵素であるLepIは,1)アルコール体から (E)-キノンメチドへの立体選択的な脱水反応,2)(E)-キノンメチドから分子内Diels-Alder反応生成物およびleporinへの“ambimodal”分子内Diels-Alder反応およびヘテロDiels-Alder反応,3)分子内Diels-Alder反応生成物からleporinへのレトロClaisen転位,を触媒する多機能性の酵素であることが明らかにされた(図2).LepIは遷移状態ののちの活性化エネルギーを変化させることにより,遷移状態ののち分岐する経路をヘテロDiels-Alder反応が有利になるよう制御する.しかし,“ambimodal”遷移状態の性質から分子内Diels-Alder反応生成物の生成を完全には抑制することができないため,LepIはレトロClaisen転位を触媒することにより分子内Diels-Alder反応生成物をleporinへと変換する.このように,LepIは生合成の最終生産物へと到達させるため副生成物の合理的なリサイクル経路を発展させていた.この研究における先例のないS-アデノシルメチオニンに依存性の多機能性の酵素の発見は,S-アデノシルメチオニンの万能性および重要性を示すのみならず,既存のS-アデノシルメチオニンに依存性の酵素をペリ環状反応を触媒する酵素へと進化させるための重要な知見をあたえるものである.
略歴:2015年 岡山大学大学院医歯薬学総合研究科 修了,同年 静岡県立大学薬学部 特任助教,2016年 米国California大学Los Angeles校 客員研究員を経て,2017年より静岡県立大学薬学部 博士研究員.
研究テーマ:ペリ環状反応を触媒する酵素の発見およびその精密な機能の解析.
関心事:天然物創薬の現状,Los Angeles市の家賃,円相場(ドル).
渡辺 賢二(Kenji Watanabe)
静岡県立大学薬学部 教授.
研究室URL:http://sweb.u-shizuoka-ken.ac.jp/~kenji55-lab/
© 2017 大橋雅生・渡辺賢二 Licensed under CC 表示 2.1 日本
(静岡県立大学大学院薬学研究院 生薬学講座)
email:渡辺賢二
DOI: 10.7875/first.author.2017.105
SAM-dependent enzyme-catalysed pericyclic reactions in natural product biosynthesis.
Masao Ohashi, Fang Liu, Yang Hai, Mengbin Chen, Man-cheng Tang, Zhongyue Yang, Michio Sato, Kenji Watanabe, K. N. Houk, Yi Tang
Nature, 549, 502-506 (2017)
要 約
ペリ環状反応は位置選択的および立体選択的に炭素-炭素結合を形成するためもっとも強力な反応のひとつとして知られ,複雑な構造をもつ数多くの天然物の全合成において幅広く応用されてきた.しかしながら,ペリ環状反応を触媒する酵素は天然物の生合成においては非常にまれである.この研究において,筆者らは,糸状菌Aspergillus属の生産する天然物leporinの生合成遺伝子クラスターからペリ環状反応を触媒する新規の酵素LepIを同定した.LepIは,当初は典型的なS-アデノシルメチオニンに依存性のO-メチルトランスフェラーゼと推測されたが,実際にはメチル化反応は触媒せず,S-アデノシルメチオニンを補酵素として駆使し脱水反応および3種のペリ環状反応を触媒する先例のない多機能性の酵素であることが明らかにされた.この研究は,天然に存在する酵素にはいまだ同定されていない酵素的なペリ環状反応が存在することを想起させるとともに,万能な補酵素であるS-アデノシルメチオニンの新たな役割が酵素反応のほかにも見い出される可能性を期待させるものである.
はじめに
天然に存在する酵素的なペリ環状反応は非常にまれな反応として知られてきた.実際に,ペリ環状反応は数多くの多環性天然物の生合成にかかわる重要な反応と示唆されてきたものの,これまで,ペリ環状反応を触媒する酵素はひとにぎりしか同定されていない1).筆者らは,天然物の生合成においていまだ同定されていない酵素的なペリ環状反応のうち,天然物のヘテロ芳香環を構築するために重要なヘテロDiels-Alder反応に着目して研究を展開してきた.ヘテロDiels-Alder反応はジヒドロピラン環を形成するための重要な生合成反応と示唆されており,ジヒドロピラン環は糸状菌Aspergillus属の生産するleporinをはじめとする数多くの天然物において頻繁にみられる構造のひとつである2).アルコール体の脱水反応により生じる不安定な中間体を用いたleporinのジヒドロピラン環の生合成を模倣した反応においては,ヘテロDiels-Alder反応の生成物である少量のleporinと,その位置異性体あるいは立体異性体である分子内Diels-Alder反応およびヘテロDiels-Alder反応の副生成物の混合物が得られる3).したがって,ジヒドロピラン環を構築するためには酵素による反応の制御が必要不可欠である4).すなわち,leporinの生合成遺伝子クラスターにはヘテロDiels-Alder反応を触媒する酵素がコードされることが強く示唆された.この研究においては,ヘテロDiels-Alder反応を触媒する酵素の同定およびその機能の解析をめざした.
1.S-アデノシルメチオニンに依存性の酵素LepIの同定
leporinの生合成遺伝子クラスターはAspergillus flavusのゲノムにおいてすでに同定されていたが5),環化酵素や機能が未知の酵素といったヘテロDiels-Alder反応を触媒する酵素の候補をコードする遺伝子の存在は確認されていなかった.そこで,Aspergillus nidulansを異種発現用の宿主として用いてleporinの生合成経路を再構築した.その結果,ポリケチド合成酵素-非リボソームペプチド合成酵素であるLepA,そのパートナーとしてはたらくエノイルレダクターゼLepG,環拡大反応を触媒するP450 LepHの発現により6),ケトン体が生合成された(図1).さらに,ケトン体をアルコール体へと還元すると推測される短鎖型デヒドロゲナーゼ/レダクターゼLepFの発現により,leporinだけでなく,副生成物としてヘテロDiels-Alder反応ジアステレオマーおよび3つの分子内Diels-Alder反応生成物が得られた.これらの化合物のうち,leporinおよび分子内Diels-Alder反応生成物のひとつは (E)-キノンメチドをへて生成し,ほかの化合物は (Z)-キノンメチドを介して生成すると考えられた.これらの結果は,ジヒドロピラン環の生合成を模倣した合成から得られた知見と一致しており,ペリ環状反応の生成物としてleporinを生合成するためには,アルコール体から (E)-キノンメチドへの脱水だけでなく,つづくペリ環状反応も酵素による反応の制御が必要なことが示された.
このleporinの生合成遺伝子クラスターには,leporinの生合成には不要であるのにもかかわらず強く保存されたS-アデノシルメチオニン結合モチーフをもつO-メチルトランスフェラーゼと推測されたLepIをコードする遺伝子が残った.また,アルコール体の還元に由来するさまざまなペリ環状反応の生成物を生産するA. nidulans株においてLepIを発現させたところ,副生成物を生成することなくleporinが支配的に生成された.以上のことから,O-メチルトランスフェラーゼ様の酵素LepIはアルコール体からleporinへの変換を触媒する重要な酵素であることが示唆された.
2.LepIの基質の同定
LepIの基質はアルコール体であることを確認するため,in vitroにおいてアルコール体にLepIを反応させた.LepIの非存在下ではアルコール体の自発的な脱水反応により分子内Diels-Alder反応およびヘテロDiels-Alder反応の混合生成物が得られたのに対し,LepIの存在下ではS-アデノシルメチオニンなどの補酵素の添加なしにアルコール体からleporinへ完全に変換された.このことから,LepIは単独でアルコール体から (E)-キノンメチドへの脱水反応,および,つづくヘテロDiels-Alder反応を触媒する多機能性の酵素であることが示された.
3.LepIが触媒する反応
さらに詳細な反応機構を理解するため,アルコール体を基質として用い,LepIの反応を時間に依存的に解析した.その結果,アルコール体からleporinへの変換の過程において分子内Diels-Alder反応生成物の生成および消失がみられた.この結果から,LepIの存在下にもかかわらず (E)-キノンメチドから分子内Diels-Alder反応生成物およびヘテロDiels-Alder反応生成物であるleporinが同時に生成する,すなわち,LepIによるヘテロDiels-Alder反応の制御は不完全であることが示唆された.さらに,LepIは副生成物として生じた分子内Diels-Alder反応生成物をleporinへと変換するため,これまで酵素反応として先例のないレトロClaisen転位を触媒することが示唆された.このことを確認するため,分子内Diels-Alder反応生成物にLepIを反応させたところ,分子内Diels-Alder反応生成物からleporinへの自発的な変換は非常に遅いが,LepIの存在下ではその反応は18万倍も加速された.以上のことから,LepIは脱水反応,分子内Diels-Alder反応およびヘテロDiels-Alder反応にくわえ,レトロClaisen転位を触媒する多機能性の酵素であることが明らかにされた.
4.LepIのS-アデノシルメチオニンへの依存性
ほかの典型的なメチルトランスフェラーゼと同様に7),LepIにはS-アデノシルメチオニン結合モチーフが強く保存されていたことから,LepIが触媒する反応にS-アデノシルメチオニンが関与するかどうか検討した.これまでのin vitroにおけるLepIの反応においてS-アデノシルメチオニンの添加なしに反応は進行したことから,LepIがS-アデノシルメチオニンを保持した状態で精製されている可能性がうたがわれた.変性したLepIの上清からはS-アデノシルメチオニンが検出され,精製されたLepIのうち約8~9割はS-アデノシルメチオニンを保持することが示唆された.そこで,S-アデノシルメチオニンの競合的な阻害剤として知られるS-アデノシルホモシステインの存在下においてLepIを反応させたところ,アルコール体の脱水反応および分子内Diels-Alder反応生成物のレトロClaisen転位が強く阻害されたが,S-アデノシルメチオニンの添加によりS-アデノシルホモシステインによる阻害はほぼ完全に消失した.このことから,S-アデノシルメチオニンがLepIの触媒活性に必須の因子であることが示されたとともに,S-アデノシルホモシステインにはなくS-アデノシルメチオニンのみがもつ正電荷がこれらの反応に要求されると考えられた.そこで,S-アデノシルホモシステインの存在下においてS-アデノシルメチオニンの正電荷アナログを添加してLepIを反応させたところ,脱水反応およびレトロClaisen転位のS-アデノシルホモシステインによる阻害は消失した.
5.LepIが制御する“ambimodal”分子内Diels-Alder反応およびヘテロDiels-Alder反応
なぜ酵素反応であるのにもかかわらず,(E)-キノンメチドから分子内Diels-Alder反応生成物およびヘテロDiels-Alder反応生成物であるleporinが同時に生成するのか,また,S-アデノシルメチオニンは反応にどのように関与するのかについて理解を深めるため,密度汎関数理論計算を行った.その結果,(E)-キノンメチドから分子内Diels-Alder反応生成物およびleporinへの遷移状態は同一で,いわゆる,“ambimodal”遷移状態にあることが明らかにされた.“ambimodal”遷移状態の場合,遷移状態から生成物へと進む過程において反応経路が枝分かれするため2つの異なる生成物が得られる8).非酵素反応の場合は (E)-キノンメチドからの分子内Diels-Alder反応生成物とleporinの生成比はおおよそ94対6であるが酵素反応の場合はおおよそ50対50であることから,LepIは遷移状態ののちのダイナミクスを制御すると考えられた.実際に,分子動力学計算により,非酵素反応の場合には分子内Diels-Alder反応への経路が支配的であるのに対し,S-アデノシルメチオニンのモデル分子を作用させた場合には約8割がヘテロDiels-Alder反応への経路を選択することが示された.さらに,分子内Diels-Alder反応生成物とS-アデノシルメチオニンあるいはその正電荷アナログとの相互作用により,分子内Diels-Alder反応生成物からleporinへのレトロClaisen転位の活性化エネルギーが大きく低下すると推測され,これらの計算により,正電荷をもつS-アデノシルメチオニンの触媒的な役割が強く支持された.
おわりに
この研究において,S-アデノシルメチオニンに依存性の酵素であるLepIは,1)アルコール体から (E)-キノンメチドへの立体選択的な脱水反応,2)(E)-キノンメチドから分子内Diels-Alder反応生成物およびleporinへの“ambimodal”分子内Diels-Alder反応およびヘテロDiels-Alder反応,3)分子内Diels-Alder反応生成物からleporinへのレトロClaisen転位,を触媒する多機能性の酵素であることが明らかにされた(図2).LepIは遷移状態ののちの活性化エネルギーを変化させることにより,遷移状態ののち分岐する経路をヘテロDiels-Alder反応が有利になるよう制御する.しかし,“ambimodal”遷移状態の性質から分子内Diels-Alder反応生成物の生成を完全には抑制することができないため,LepIはレトロClaisen転位を触媒することにより分子内Diels-Alder反応生成物をleporinへと変換する.このように,LepIは生合成の最終生産物へと到達させるため副生成物の合理的なリサイクル経路を発展させていた.この研究における先例のないS-アデノシルメチオニンに依存性の多機能性の酵素の発見は,S-アデノシルメチオニンの万能性および重要性を示すのみならず,既存のS-アデノシルメチオニンに依存性の酵素をペリ環状反応を触媒する酵素へと進化させるための重要な知見をあたえるものである.
文 献
- Lin, C. I., McCarty, R. M. & Liu, H. W.: The enzymology of organic transformations: a survey of name reactions in biological systems. Angew. Chem. Intl. Ed. Engl., 44, 3446-3489 (2017)[PubMed]
- Stocking, E. M. & Williams, R. M.: Chemistry and biology of biosynthetic Diels-Alder reactions. Angew. Chem. Intl. Ed. Engl., 42, 3078-3115 (2003)[PubMed]
- Snider, B. B. & Lu, Q.: Total synthesis of (±)-leporin A. J. Org. Chem., 61, 2839-2844 (1996)[PubMed]
- Tang, M. C., Zou, Y., Watanabe, K. et al.: Oxidative cyclization in natural product biosynthesis. Chem. Rev., 117, 5226-5333 (2017)[PubMed]
- Cary, J. W., Uka, V., Han, Z. et al.: An Aspergillus flavus secondary metabolic gene cluster containing a hybrid PKS-NRPS is necessary for synthesis of the 2-pyridones, leporins. Fungal. Genet. Biol., 81, 88-97 (2015)[PubMed]
- Halo, L. M., Heneghan, M. N., Yakasai, A. A. et al.: Late stage oxidations during the biosynthesis of the 2-pyridone tenellin in the entomopathogenic fungus Beauveria bassiana. J. Am. Chem. Soc., 130, 17988-17996 (2008)[PubMed]
- Jansson, A., Koskiniemi, H., Erola, A. et al.: Aclacinomycin 10-hydroxylase is a novel substrate-assisted hydroxylase requiring S-adenosyl-L-methionine as cofactor. J. Biol. Chem., 280, 3636-3644 (2005)[PubMed]
- Patel, A., Chen, Z., Yang, Z. et al.: Dynamically complex [6+4] and [4+2] cycloadditions in the biosynthesis of spinosyn A. J. Am. Chem. Soc., 138, 3631-3634 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 岡山大学大学院医歯薬学総合研究科 修了,同年 静岡県立大学薬学部 特任助教,2016年 米国California大学Los Angeles校 客員研究員を経て,2017年より静岡県立大学薬学部 博士研究員.
研究テーマ:ペリ環状反応を触媒する酵素の発見およびその精密な機能の解析.
関心事:天然物創薬の現状,Los Angeles市の家賃,円相場(ドル).
渡辺 賢二(Kenji Watanabe)
静岡県立大学薬学部 教授.
研究室URL:http://sweb.u-shizuoka-ken.ac.jp/~kenji55-lab/
© 2017 大橋雅生・渡辺賢二 Licensed under CC 表示 2.1 日本