テロメラーゼのサブユニットをコードするTERT遺伝子のプロモーター領域における点変異は腫瘍の形成に2段階で寄与する
千葉 国俊
(米国California大学Berkeley校Department of Molecular and Cell Biology)
email:千葉国俊
DOI: 10.7875/first.author.2017.103
Mutations in the promoter of the telomerase gene TERT contribute to tumorigenesis by a two-step mechanism.
Kunitoshi Chiba, Franziska K. Lorbeer, A. Hunter Shain, David T. McSwiggen, Eva Schruf, Areum Oh, Jekwan Ryu, Xavier Darzacq, Boris C. Bastian, Dirk Hockemeyer
Science, 357, 1416-1420 (2017)
テロメラーゼのサブユニットをコードするTERT遺伝子のプロモーター領域における点変異は,がんにおける非コード領域の変異としてもっとも頻繁にみられる.しかし,変異の生じるタイミングおよびそれにともなう結果については,いまだよくわかっていない.この研究において,筆者らは,TERT遺伝子のプロモーター領域における点変異により,良性母斑から悪性黒色腫への遷移のあいだ,テロメアの長さは維持されないことを示した.また,培養細胞を用いた長期的な実験において,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮はふせがれず,テロメアは極端に短くなって染色体の末端は完全には保護されなくなることが示された.さらに,TERT遺伝子のプロモーター領域における点変異による細胞の不死化において,テロメラーゼの活性が徐々に上昇することが必要であり,活性の上昇のタイミングはテロメアの融合が検出された時点と一致した.これらの結果から,TERT遺伝子のプロモーター領域における点変異は,腫瘍の形成において細胞の不死化およびゲノムの不安定化の促進という2段階で寄与することが示唆された.第1段階においては,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮の大部分はふせがれないが,もっとも短いテロメアを選択的に伸長することにより増殖の限界はひき延ばされる.そして,第2段階においては,極端に短くなったテロメアが融合することによりゲノムの不安定性が増加し,それと同じ時期にテロメラーゼの発現量が徐々に増加して,細胞の不死化のためのさらなる増殖が担保されていた.
染色体の末端はテロメアとよばれるくり返し配列により保護されている.テロメアはDNA複製にともない短縮する.染色体の末端を保護する機能を失ったテロメアはDNA損傷部位と認識され,DNA傷害チェックポイントが活性化して細胞周期が不可逆的に停止される.このため,テロメアの短縮は腫瘍を抑制する機構としてはたらく.幹細胞など一部の細胞においては,このテロメアの短縮に対し染色体を保護するため逆転写酵素であるテロメラーゼが発現する1).多くの体細胞は分化にともないテロメラーゼのサブユニットをコードするTERT遺伝子の発現が抑制されることによりテロメラーゼの活性をもたなくなる.しかし,がん細胞の約90%においてはTERT遺伝子が再発現することにより細胞が増殖してもテロメアは維持される.しかし,このTERT遺伝子の再発現の機構についてはよくわかっていなかった.
近年のゲノムワイドな解析において,さまざまなタイプのがんにおいてTERT遺伝子のプロモーター領域に高い頻度で点変異が見い出された2-4).この点変異は早期あるいは後期のどちらの段階のがんにおいても検出されたことから5),腫瘍の形成の早期において重要な役割をはたす可能性がある.一方で,TERT遺伝子のプロモーター領域における点変異をもつ黒色腫瘍は,テロメラーゼの発現量が増加しているにもかかわらず,この点変異をもたない腫瘍に比べテロメアの長さが短い6).このことから,TERT遺伝子のプロモーター領域における点変異はテロメアが短小化してから重要な役割を担うとも解釈される.テロメアの短縮はDNA傷害応答および複製老化をひき起こすことにより腫瘍を抑制する機構としてはたらく.腫瘍の形成においてはDNA傷害チェックポイントの欠失によりこれらの障害をのりこえる.DNA傷害チェックポイントを欠失した細胞はそのまま増殖しつづけ,クライシス期とよばれる段階に突入する.クライシス期においてテロメアは正常に機能せず染色体の末端どうしの融合を起こし細胞死をひき起こす.しかし,がん化した一部の細胞はテロメラーゼを再発現することによりクライシス期から脱する.短いテロメアはクライシス期においてゲノムの不安定化をひき起こすため,がん化を促進する.しかしながら,短いテロメアをもつヒトはがんのリスクが低下するという報告がある7).この事実は,クライシス期においてテロメラーゼが再発現するという現在のモデルでは説明されない.そこで,TERT遺伝子のプロモーター領域における点変異によるがん化の機構およびテロメアの維持の挙動について解明するため,黒色腫の患者に由来する培養細胞系,および,ゲノム編集技術を用いて遺伝学的に規定された培養細胞系を用いて長期的な解析をした.
皮膚性の黒色腫においてTERT遺伝子のプロモーター領域における点変異は60~85%という非常に高い頻度で生じる.なかでも,隣接する良性母斑などの前腫瘍病変から生じる種類のヒトの黒色腫に着目した5).これらの試料は前腫瘍病変とがん組織とが近接するため,同一の切片においてテロメアの長さと遺伝学的な変化とを照らし合わせて比較することができる.4つのケースにおいて,良性母斑から黒色腫へと進行するあいだにTERT遺伝子のプロモーター領域における点変異の生じたことを確認し,テロメアの長さを構造化照明法を利用した超解像顕微鏡を用いて測定した.その結果,すべてのケースにおいて,黒色腫におけるテロメアのシグナルは良性母斑より低下した.このことから,生体における腫瘍の形成において,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮に対抗するのに十分なテロメラーゼの発現量が担保されなくなることが示唆された.
テロメアの長さの制御におけるTERT遺伝子のプロモーター領域における点変異の機能を遺伝学的に規定された状態にてより詳細に解析するため,in vitroの培養系において長期的な実験を行った.以前に,筆者らは,ゲノム編集技術を用いて新規にTERT遺伝子のプロモーター領域における点変異を導入したヒトのES細胞を作製し,これを体細胞に分化させるとテロメラーゼの発現が抑制されなくなることを示した8).そこで,このTERT遺伝子のプロモーター領域に点変異をもつES細胞を通常はテロメラーゼを発現しない線維芽細胞へと分化させた.TERT遺伝子のプロモーター領域における点変異の有無のほか,SV40 T抗原によるpRBおよびp53の不活性化,細胞周期およびDNA傷害チェックポイントの欠失,正常な細胞周期およびDNA傷害チェックポイント,の3つの条件において解析した.その結果,どの条件においてもTERT遺伝子のプロモーター領域における点変異をもたない線維芽細胞はテロメアの短縮とともに増殖を停止したが,点変異を導入した線維芽細胞はその限界をはるかにこえて増殖した.これにより,TERT遺伝子のプロモーター領域における点変異により細胞は不死化することが示された.
細胞の不死化においてはテロメアの維持が不可欠である.そこで,TERT遺伝子のプロモーター領域における点変異の導入により不死化した線維芽細胞のテロメアの長さを時系列にそって測定した.その結果,TERT遺伝子のプロモーター領域における点変異をもたない野生型の線維芽細胞において,予想どおりテロメアの短縮がみられた.TERT遺伝子のプロモーター領域における点変異をもつ線維芽細胞も,はじめは同様にテロメアの短縮が起こったが,増殖につれて野生型の線維芽細胞が増殖を停止したときより短い長さでテロメアの長さが安定化し,そののちもテロメアの長さは維持された.テロメアの長さの分布を解析したところ,短くなったテロメアがテロメラーゼにより優先的に伸長され,長いテロメアは短縮していることが示唆された.
テロメアの短小化により保護されなくなったテロメアの末端は融合しゲノムの不安定化をひき起こす9).TERT遺伝子のプロモーター領域における点変異を導入した線維芽細胞においてテロメアは短い長さで安定化したが,その染色体の末端は保護されているのかどうか調べた.その結果,テロメアの長さが安定化されるタイミングと同じ時期に,テロメアの融合が検出された.このことから,TERT遺伝子のプロモーター領域における点変異は細胞を不死化するだけでなく,染色体の末端が保護されていないテロメアによるゲノムの不安定化をひき起こし,腫瘍の形成を促進しうることが示唆された.
TERT遺伝子のプロモーター領域における点変異のテロメラーゼの発現量に対する継時的な影響について調べた.点変異をもつES細胞から分化した直後の線維芽細胞はテロメラーゼの活性をもつが,すぐに検出限界より低下した.しかし,テロメアが短い長さで安定化しテロメアの融合が起こるタイミングにおいて,ふたたびテロメラーゼの活性が検出された.このテロメラーゼの活性の上昇はTERT mRNAの発現量の増加に起因した.テロメラーゼの活性の上昇するまえに1細胞に由来するクローンを単離し,おのおののクローンにおいてテロメラーゼの活性を継時的に測定したところ,どのクローンにおいても同様に,テロメアが短い長さで安定化するタイミングにおいてテロメラーゼの活性が上昇した.このことから,高いテロメラーゼの活性をもつ一部の細胞が選択的に増殖しているわけではないことが示され,TERT遺伝子のプロモーター領域における点変異による細胞の不死化においては,テロメアの短縮およびゲノムの不安定化にともなうなんらかの変化により,TERT遺伝子の発現のさらなる上昇が必要であることが示唆された.
ここまでに,TERT遺伝子のプロモーター領域における点変異が生じたのちにもテロメアは短縮することが示された.TERT遺伝子のプロモーター領域における点変異が生じてからテロメアの長さを安定化するテロメラーゼの発現量の増加までに必要な時間差は,短いテロメアが腫瘍の形成に対し抑制的であるという,いっけん逆に思える事象を説明するのではないかと考えた.仮説として,1)TERT遺伝子のプロモーター領域における点変異が生じた際のテロメアの長さに応じて,保護されないテロメアの長さにいたるまで細胞が分裂できる回数が規定される,2)TERT遺伝子のプロモーター領域における点変異の生じた細胞はテロメアの長さが極度に短くなった際にテロメラーゼの発現量を増加させ,テロメアの長さが維持されるかどうかにより不死化あるいは増殖の停止を決定する,という2つを考えた.これらの仮説を検証するため,TERT遺伝子のプロモーター領域における点変異をもつ細胞においてTERT遺伝子の発現を低下させ,テロメアの長さが短い状態からの不死化の過程を同様に解析した.TERT遺伝子のプロモーター領域における点変異により新規のETS結合配列が形成され,転写因子GABPαおよびGABPβがTERT遺伝子のプロモーター領域に存在する既存のETS結合配列と協調してヘテロ二量体を形成することにより,TERT遺伝子の発現を上昇させることが提唱されている10).ヒトのES細胞においてGABPαは必須であったため,TERT遺伝子のプロモーター領域にある内在性のETS結合配列にゲノム編集技術を用いて変異を導入し,GABPαの二量体化を阻害することによりTERT遺伝子のプロモーター領域に点変異が存在する状態においてTERT遺伝子の発現を低下させた.その結果,TERT遺伝子のプロモーター領域において点変異およびETS結合配列の変異をもつ細胞のテロメアはTERT遺伝子のプロモーター領域において点変異のみをもつ細胞に比べ短かった.これらの細胞においては早い段階において高い頻度のテロメアの融合が検出されたことから,仮説1)が支持された.また,TERT遺伝子のプロモーター領域において点変異およびETS結合配列の変異をもつ細胞においてテロメラーゼの活性は低かったが,しばらく増殖したのちクライシス期に突入して増殖を停止し,テロメラーゼの活性を上昇させ不死化することはなかったことから,仮説2)が支持された.
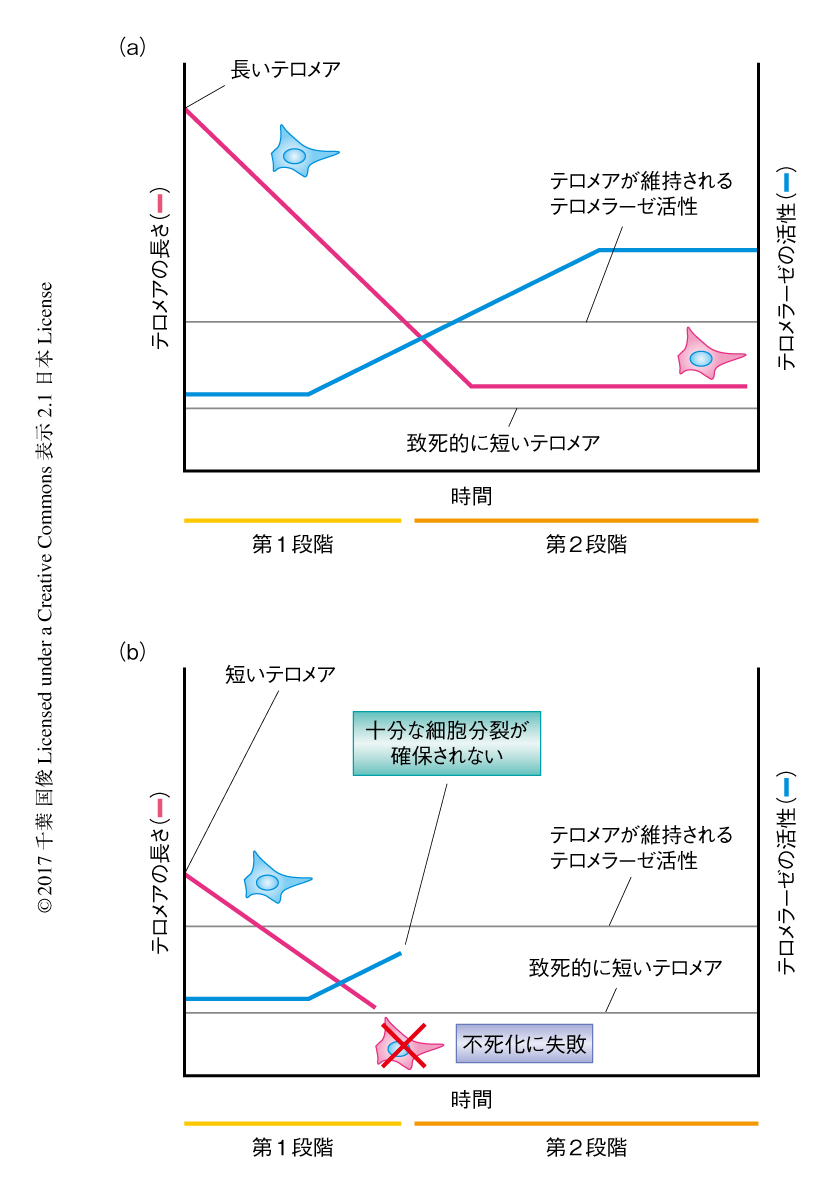
従来の“クライシスモデル”による細胞の不死化の過程においては,DNA傷害チェックポイントの欠失にともない細胞はクライシス期に突入しゲノムが不安定化することによりテロメラーゼが再発現すると考えられた.しかしながら,このモデルでは,短いテロメアが腫瘍に抑制的にはたらくことや,いくつかのがんにおいてTERT遺伝子のプロモーター領域における点変異はDNA傷害チェックポイントの欠失よりまえに起こりうるという観察が説明されなかった.筆者らは,TERT遺伝子のプロモーター領域における点変異による細胞の不死化は“2段階モデル”によると提唱した(図1).第1段階において,TERT遺伝子のプロモーター領域における点変異は腫瘍の形成の早い段階で生じ細胞にテロメラーゼの活性をもたらすが,テロメアの短縮をすべてふせぐことはできず,もっとも短いテロメアを選択的に伸長することにより複製老化を遅らせる.第2段階において,さらに細胞分裂が進み,短いテロメアの数が増加してTERT遺伝子のプロモーター領域における点変異によりもたらされるテロメラーゼの活性が律速になる.それにより,保護されていないテロメアが融合をひき起こし,ゲノムの不安定性が増加しテロメラーゼの発現量の増加へと選択圧がはたらく.クライシスモデルにおいてゲノムの不安定化は急性的な事象として起こるが,TERT遺伝子のプロモーター領域における点変異をもつ細胞は継続的にゲノムの不安定化にさらされる.そのため,TERT遺伝子のプロモーター領域における点変異は腫瘍の形成においてテロメラーゼの発現により細胞を不死化するにとどまらず,さらにゲノムの不安定化をひき起こし,がん化を促進するという2つの役割をもつと考えられる.
今回の研究により,TERT遺伝子のプロモーター領域における点変異は細胞の不死化において必要条件ではあるが十分条件ではなく,未知の機構によるテロメラーゼの発現のさらなる上昇が必要であることが明らかにされた.そして,初期のテロメアの長さに応じて細胞分裂の回数が規定されることから,短いテロメアはがん化への障壁になることが示された(図1).また,TERT遺伝子のプロモーター領域における点変異による細胞の不死化の2段階モデルにより,なぜ長いテロメアをもつヒトはがんのリスクが上昇するのかという,いっけん矛盾に思える事象が説明された.これらの結果は,黒色腫の患者に由来する培養細胞系,そして,ゲノム編集技術を用いた遺伝学的に規定された培養細胞系において不死化への過程を長期にわたり解析することにより得られ,これまでのがん細胞株などの系では解明のむずかしかった事象をテクノロジーの進歩により扱うことのできたよい例である.しかし,TERT遺伝子のプロモーター領域における点変異によるがんの促進の機構において何がテロメラーゼの発現を上昇させるのかなど,未解決の問いは多く存在しており,今後のさらなる解析が期待される.
略歴:米国California大学Berkeley校博士課程 在学中.
研究テーマ:ヒトのES細胞およびがん細胞におけるテロメラーゼの制御.
関心事:国立公園めぐり.
© 2017 千葉 国俊 Licensed under CC 表示 2.1 日本
(米国California大学Berkeley校Department of Molecular and Cell Biology)
email:千葉国俊
DOI: 10.7875/first.author.2017.103
Mutations in the promoter of the telomerase gene TERT contribute to tumorigenesis by a two-step mechanism.
Kunitoshi Chiba, Franziska K. Lorbeer, A. Hunter Shain, David T. McSwiggen, Eva Schruf, Areum Oh, Jekwan Ryu, Xavier Darzacq, Boris C. Bastian, Dirk Hockemeyer
Science, 357, 1416-1420 (2017)
要 約
テロメラーゼのサブユニットをコードするTERT遺伝子のプロモーター領域における点変異は,がんにおける非コード領域の変異としてもっとも頻繁にみられる.しかし,変異の生じるタイミングおよびそれにともなう結果については,いまだよくわかっていない.この研究において,筆者らは,TERT遺伝子のプロモーター領域における点変異により,良性母斑から悪性黒色腫への遷移のあいだ,テロメアの長さは維持されないことを示した.また,培養細胞を用いた長期的な実験において,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮はふせがれず,テロメアは極端に短くなって染色体の末端は完全には保護されなくなることが示された.さらに,TERT遺伝子のプロモーター領域における点変異による細胞の不死化において,テロメラーゼの活性が徐々に上昇することが必要であり,活性の上昇のタイミングはテロメアの融合が検出された時点と一致した.これらの結果から,TERT遺伝子のプロモーター領域における点変異は,腫瘍の形成において細胞の不死化およびゲノムの不安定化の促進という2段階で寄与することが示唆された.第1段階においては,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮の大部分はふせがれないが,もっとも短いテロメアを選択的に伸長することにより増殖の限界はひき延ばされる.そして,第2段階においては,極端に短くなったテロメアが融合することによりゲノムの不安定性が増加し,それと同じ時期にテロメラーゼの発現量が徐々に増加して,細胞の不死化のためのさらなる増殖が担保されていた.
はじめに
染色体の末端はテロメアとよばれるくり返し配列により保護されている.テロメアはDNA複製にともない短縮する.染色体の末端を保護する機能を失ったテロメアはDNA損傷部位と認識され,DNA傷害チェックポイントが活性化して細胞周期が不可逆的に停止される.このため,テロメアの短縮は腫瘍を抑制する機構としてはたらく.幹細胞など一部の細胞においては,このテロメアの短縮に対し染色体を保護するため逆転写酵素であるテロメラーゼが発現する1).多くの体細胞は分化にともないテロメラーゼのサブユニットをコードするTERT遺伝子の発現が抑制されることによりテロメラーゼの活性をもたなくなる.しかし,がん細胞の約90%においてはTERT遺伝子が再発現することにより細胞が増殖してもテロメアは維持される.しかし,このTERT遺伝子の再発現の機構についてはよくわかっていなかった.
近年のゲノムワイドな解析において,さまざまなタイプのがんにおいてTERT遺伝子のプロモーター領域に高い頻度で点変異が見い出された2-4).この点変異は早期あるいは後期のどちらの段階のがんにおいても検出されたことから5),腫瘍の形成の早期において重要な役割をはたす可能性がある.一方で,TERT遺伝子のプロモーター領域における点変異をもつ黒色腫瘍は,テロメラーゼの発現量が増加しているにもかかわらず,この点変異をもたない腫瘍に比べテロメアの長さが短い6).このことから,TERT遺伝子のプロモーター領域における点変異はテロメアが短小化してから重要な役割を担うとも解釈される.テロメアの短縮はDNA傷害応答および複製老化をひき起こすことにより腫瘍を抑制する機構としてはたらく.腫瘍の形成においてはDNA傷害チェックポイントの欠失によりこれらの障害をのりこえる.DNA傷害チェックポイントを欠失した細胞はそのまま増殖しつづけ,クライシス期とよばれる段階に突入する.クライシス期においてテロメアは正常に機能せず染色体の末端どうしの融合を起こし細胞死をひき起こす.しかし,がん化した一部の細胞はテロメラーゼを再発現することによりクライシス期から脱する.短いテロメアはクライシス期においてゲノムの不安定化をひき起こすため,がん化を促進する.しかしながら,短いテロメアをもつヒトはがんのリスクが低下するという報告がある7).この事実は,クライシス期においてテロメラーゼが再発現するという現在のモデルでは説明されない.そこで,TERT遺伝子のプロモーター領域における点変異によるがん化の機構およびテロメアの維持の挙動について解明するため,黒色腫の患者に由来する培養細胞系,および,ゲノム編集技術を用いて遺伝学的に規定された培養細胞系を用いて長期的な解析をした.
1.TERT遺伝子のプロモーター領域における点変異は良性母斑から悪性黒色腫への遷移のあいだテロメアの短縮をふせがない
皮膚性の黒色腫においてTERT遺伝子のプロモーター領域における点変異は60~85%という非常に高い頻度で生じる.なかでも,隣接する良性母斑などの前腫瘍病変から生じる種類のヒトの黒色腫に着目した5).これらの試料は前腫瘍病変とがん組織とが近接するため,同一の切片においてテロメアの長さと遺伝学的な変化とを照らし合わせて比較することができる.4つのケースにおいて,良性母斑から黒色腫へと進行するあいだにTERT遺伝子のプロモーター領域における点変異の生じたことを確認し,テロメアの長さを構造化照明法を利用した超解像顕微鏡を用いて測定した.その結果,すべてのケースにおいて,黒色腫におけるテロメアのシグナルは良性母斑より低下した.このことから,生体における腫瘍の形成において,TERT遺伝子のプロモーター領域における点変異によりテロメアの短縮に対抗するのに十分なテロメラーゼの発現量が担保されなくなることが示唆された.
2.TERT遺伝子のプロモーター領域における点変異により細胞は不死化するがテロメアは短縮する
テロメアの長さの制御におけるTERT遺伝子のプロモーター領域における点変異の機能を遺伝学的に規定された状態にてより詳細に解析するため,in vitroの培養系において長期的な実験を行った.以前に,筆者らは,ゲノム編集技術を用いて新規にTERT遺伝子のプロモーター領域における点変異を導入したヒトのES細胞を作製し,これを体細胞に分化させるとテロメラーゼの発現が抑制されなくなることを示した8).そこで,このTERT遺伝子のプロモーター領域に点変異をもつES細胞を通常はテロメラーゼを発現しない線維芽細胞へと分化させた.TERT遺伝子のプロモーター領域における点変異の有無のほか,SV40 T抗原によるpRBおよびp53の不活性化,細胞周期およびDNA傷害チェックポイントの欠失,正常な細胞周期およびDNA傷害チェックポイント,の3つの条件において解析した.その結果,どの条件においてもTERT遺伝子のプロモーター領域における点変異をもたない線維芽細胞はテロメアの短縮とともに増殖を停止したが,点変異を導入した線維芽細胞はその限界をはるかにこえて増殖した.これにより,TERT遺伝子のプロモーター領域における点変異により細胞は不死化することが示された.
細胞の不死化においてはテロメアの維持が不可欠である.そこで,TERT遺伝子のプロモーター領域における点変異の導入により不死化した線維芽細胞のテロメアの長さを時系列にそって測定した.その結果,TERT遺伝子のプロモーター領域における点変異をもたない野生型の線維芽細胞において,予想どおりテロメアの短縮がみられた.TERT遺伝子のプロモーター領域における点変異をもつ線維芽細胞も,はじめは同様にテロメアの短縮が起こったが,増殖につれて野生型の線維芽細胞が増殖を停止したときより短い長さでテロメアの長さが安定化し,そののちもテロメアの長さは維持された.テロメアの長さの分布を解析したところ,短くなったテロメアがテロメラーゼにより優先的に伸長され,長いテロメアは短縮していることが示唆された.
3.TERT遺伝子のプロモーター領域における点変異をもつ細胞のテロメアは完全には保護されておらずテロメラーゼの発現量は徐々に増加する
テロメアの短小化により保護されなくなったテロメアの末端は融合しゲノムの不安定化をひき起こす9).TERT遺伝子のプロモーター領域における点変異を導入した線維芽細胞においてテロメアは短い長さで安定化したが,その染色体の末端は保護されているのかどうか調べた.その結果,テロメアの長さが安定化されるタイミングと同じ時期に,テロメアの融合が検出された.このことから,TERT遺伝子のプロモーター領域における点変異は細胞を不死化するだけでなく,染色体の末端が保護されていないテロメアによるゲノムの不安定化をひき起こし,腫瘍の形成を促進しうることが示唆された.
TERT遺伝子のプロモーター領域における点変異のテロメラーゼの発現量に対する継時的な影響について調べた.点変異をもつES細胞から分化した直後の線維芽細胞はテロメラーゼの活性をもつが,すぐに検出限界より低下した.しかし,テロメアが短い長さで安定化しテロメアの融合が起こるタイミングにおいて,ふたたびテロメラーゼの活性が検出された.このテロメラーゼの活性の上昇はTERT mRNAの発現量の増加に起因した.テロメラーゼの活性の上昇するまえに1細胞に由来するクローンを単離し,おのおののクローンにおいてテロメラーゼの活性を継時的に測定したところ,どのクローンにおいても同様に,テロメアが短い長さで安定化するタイミングにおいてテロメラーゼの活性が上昇した.このことから,高いテロメラーゼの活性をもつ一部の細胞が選択的に増殖しているわけではないことが示され,TERT遺伝子のプロモーター領域における点変異による細胞の不死化においては,テロメアの短縮およびゲノムの不安定化にともなうなんらかの変化により,TERT遺伝子の発現のさらなる上昇が必要であることが示唆された.
4.短いテロメアおよび低いテロメラーゼの活性はTERT遺伝子のプロモーター領域における点変異による不死化から細胞を保護する
ここまでに,TERT遺伝子のプロモーター領域における点変異が生じたのちにもテロメアは短縮することが示された.TERT遺伝子のプロモーター領域における点変異が生じてからテロメアの長さを安定化するテロメラーゼの発現量の増加までに必要な時間差は,短いテロメアが腫瘍の形成に対し抑制的であるという,いっけん逆に思える事象を説明するのではないかと考えた.仮説として,1)TERT遺伝子のプロモーター領域における点変異が生じた際のテロメアの長さに応じて,保護されないテロメアの長さにいたるまで細胞が分裂できる回数が規定される,2)TERT遺伝子のプロモーター領域における点変異の生じた細胞はテロメアの長さが極度に短くなった際にテロメラーゼの発現量を増加させ,テロメアの長さが維持されるかどうかにより不死化あるいは増殖の停止を決定する,という2つを考えた.これらの仮説を検証するため,TERT遺伝子のプロモーター領域における点変異をもつ細胞においてTERT遺伝子の発現を低下させ,テロメアの長さが短い状態からの不死化の過程を同様に解析した.TERT遺伝子のプロモーター領域における点変異により新規のETS結合配列が形成され,転写因子GABPαおよびGABPβがTERT遺伝子のプロモーター領域に存在する既存のETS結合配列と協調してヘテロ二量体を形成することにより,TERT遺伝子の発現を上昇させることが提唱されている10).ヒトのES細胞においてGABPαは必須であったため,TERT遺伝子のプロモーター領域にある内在性のETS結合配列にゲノム編集技術を用いて変異を導入し,GABPαの二量体化を阻害することによりTERT遺伝子のプロモーター領域に点変異が存在する状態においてTERT遺伝子の発現を低下させた.その結果,TERT遺伝子のプロモーター領域において点変異およびETS結合配列の変異をもつ細胞のテロメアはTERT遺伝子のプロモーター領域において点変異のみをもつ細胞に比べ短かった.これらの細胞においては早い段階において高い頻度のテロメアの融合が検出されたことから,仮説1)が支持された.また,TERT遺伝子のプロモーター領域において点変異およびETS結合配列の変異をもつ細胞においてテロメラーゼの活性は低かったが,しばらく増殖したのちクライシス期に突入して増殖を停止し,テロメラーゼの活性を上昇させ不死化することはなかったことから,仮説2)が支持された.
5.TERT遺伝子のプロモーター領域における点変異による細胞の不死化の2段階モデル
従来の“クライシスモデル”による細胞の不死化の過程においては,DNA傷害チェックポイントの欠失にともない細胞はクライシス期に突入しゲノムが不安定化することによりテロメラーゼが再発現すると考えられた.しかしながら,このモデルでは,短いテロメアが腫瘍に抑制的にはたらくことや,いくつかのがんにおいてTERT遺伝子のプロモーター領域における点変異はDNA傷害チェックポイントの欠失よりまえに起こりうるという観察が説明されなかった.筆者らは,TERT遺伝子のプロモーター領域における点変異による細胞の不死化は“2段階モデル”によると提唱した(図1).第1段階において,TERT遺伝子のプロモーター領域における点変異は腫瘍の形成の早い段階で生じ細胞にテロメラーゼの活性をもたらすが,テロメアの短縮をすべてふせぐことはできず,もっとも短いテロメアを選択的に伸長することにより複製老化を遅らせる.第2段階において,さらに細胞分裂が進み,短いテロメアの数が増加してTERT遺伝子のプロモーター領域における点変異によりもたらされるテロメラーゼの活性が律速になる.それにより,保護されていないテロメアが融合をひき起こし,ゲノムの不安定性が増加しテロメラーゼの発現量の増加へと選択圧がはたらく.クライシスモデルにおいてゲノムの不安定化は急性的な事象として起こるが,TERT遺伝子のプロモーター領域における点変異をもつ細胞は継続的にゲノムの不安定化にさらされる.そのため,TERT遺伝子のプロモーター領域における点変異は腫瘍の形成においてテロメラーゼの発現により細胞を不死化するにとどまらず,さらにゲノムの不安定化をひき起こし,がん化を促進するという2つの役割をもつと考えられる.
おわりに
今回の研究により,TERT遺伝子のプロモーター領域における点変異は細胞の不死化において必要条件ではあるが十分条件ではなく,未知の機構によるテロメラーゼの発現のさらなる上昇が必要であることが明らかにされた.そして,初期のテロメアの長さに応じて細胞分裂の回数が規定されることから,短いテロメアはがん化への障壁になることが示された(図1).また,TERT遺伝子のプロモーター領域における点変異による細胞の不死化の2段階モデルにより,なぜ長いテロメアをもつヒトはがんのリスクが上昇するのかという,いっけん矛盾に思える事象が説明された.これらの結果は,黒色腫の患者に由来する培養細胞系,そして,ゲノム編集技術を用いた遺伝学的に規定された培養細胞系において不死化への過程を長期にわたり解析することにより得られ,これまでのがん細胞株などの系では解明のむずかしかった事象をテクノロジーの進歩により扱うことのできたよい例である.しかし,TERT遺伝子のプロモーター領域における点変異によるがんの促進の機構において何がテロメラーゼの発現を上昇させるのかなど,未解決の問いは多く存在しており,今後のさらなる解析が期待される.
文 献
- Greider, C. W. & Blackburn, E. H.: Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell, 43, 405-413 (1985)[PubMed]
- Horn, S., Figl, A., Rachakonda, P. S. et al.: TERT promoter mutations in familial and sporadic melanoma. Science, 339, 959-961 (2013)[PubMed]
- Huang, F. W., Hodis, E., Xu,. M. J. et al.: Highly recurrent TERT promoter mutations in human melanoma. Science, 339, 957-959 (2013)[PubMed]
- Killela, P. J., Reitman, Z. J., Jiao, Y. et al.: TERT promoter mutations occur frequently in gliomas and a subset of tumors derived from cells with low rates of self-renewal. Proc. Natl. Acad. Sci. USA, 110, 6021-6026 (2013)[PubMed]
- Shain, A. H., Yeh, I., Kovalyshyn, I. et al.: The genetic evolution of melanoma from precursor lesions. N. Engl. J. Med., 373, 1926-1936 (2015)[PubMed]
- Hayward, N. K., Wilmott, J. S., Waddell, N. et al.: Whole-genome landscapes of major melanoma subtypes. Nature, 545, 175-180 (2017)[PubMed]
- Iles, M. M., Bishop, D. T., Taylor, J. C. et al.: The effect on melanoma risk of genes previously associated with telomere length. J. Natl. Cancer Inst., 106, dju267 (2014)[PubMed]
- Chiba, K., Johnson, J. Z., Vogan, J. M. et al.: Cancer-associated TERT promoter mutations abrogate telomerase silencing. Elife, 4, e07918 (2015)[PubMed]
- Maciejowski, J. & de Lange, T.: Telomeres in cancer: tumour suppression and genome instability. Nat. Rev. Mol. Cell Biol., 18, 175-186 (2017)[PubMed]
- Bell, R. J., Rube, H. T., Kreig, A. et al.: The transcription factor GABP selectively binds and activates the mutant TERT promoter in cancer. Science, 348, 1036-1039 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:米国California大学Berkeley校博士課程 在学中.
研究テーマ:ヒトのES細胞およびがん細胞におけるテロメラーゼの制御.
関心事:国立公園めぐり.
© 2017 千葉 国俊 Licensed under CC 表示 2.1 日本