温度に依存的な基質および生成物との結合が概日時計の温度補償されたリン酸化反応の基盤である
篠原雄太・小山洋平・上田泰己
(理化学研究所生命システム研究センター 合成生物学研究グループ)
email:篠原雄太,小山洋平,上田泰己
DOI: 10.7875/first.author.2017.102
Temperature-sensitive substrate and product binding underlie temperature-compensated phosphorylation in the clock.
Yuta Shinohara, Yohei M. Koyama, Maki Ukai-Tadenuma, Takatsugu Hirokawa, Masaki Kikuchi, Rikuhiro G. Yamada, Hideki Ukai, Hiroshi Fujishima, Takashi Umehara, Kazuki Tainaka, Hiroki R. Ueda
Molecular Cell, 67, 783-798.e20 (2017)
地球上の多くの生物種には約24時間を周期とする概日時計が備わるが,概日時計にはその周期が温度にほとんど依存しないという温度補償性がある.この研究においては,概日時計の温度補償性と関係の深い,CKIδの温度に依存しないリン酸化反応機構について生化学的な実験および数理モデルにより検討した.その結果,CKIδ-ATP複合体と基質との結合が高温において弱くなること,および,CKIδ-ADP複合体と生成物との結合が高温において強くなることの2つの機構が重要であることが示された.さらに,CKIδの脱リン酸化活性を阻害する小分子化合物のケミカルスクリーニングにより同定されたアウリントリカルボン酸は,温度に依存的にリン酸化を活性化させた.ドッキングシミュレーションによりアウリントリカルボン酸はCKIδのLys224の付近に結合することが示され,Lys224がAspに置換したCKIδ変異体はマウスの行動の概日リズムを短周期化し,視交叉上核の概日リズムにおいて周期の温度依存性を変化させた.CKIδのLys224の付近の進化的に保存されたアミノ酸配列を,温度依存性をもつリン酸化酵素TTBK1に挿入すると,リン酸化反応に温度補償性が付与された.この研究より,温度に依存的な基質との結合および生成物との結合が温度補償性の基盤であることが明らかにされた.
地球上の多くの生物種には約24時間を周期とする概日時計が備わっている.概日時計の特徴のひとつとして,周期の長さが温度に依存せずつねに一定であるという温度補償性があげられるが,これは,ショウジョウバエの羽化リズム1) や渦鞭毛藻の発光リズム2) が温度に依存しないことから見い出された.
2009年,筆者らの研究グループは,リン酸化酵素の一種であるCKIδによるリン酸化反応が哺乳類の概日時計において周期の長さを決定することを発見し,そのリン酸化反応が温度に依存せずつねに一定であることを示した3).生体における一般的な生化学反応は,温度が10℃上がると反応速度は2~3倍速くなる.しかし,CKIδのリン酸化反応は一般的な生化学反応とは異なり温度に依存しなかった.このことから,CKIδの温度に依存しないリン酸化反応の機構を明らかにするとともに,概日時計における温度補償性の機構を解明することをめざした.
概日時計ネットワークにおいて,CKIδの基質である時計タンパク質であるPER1あるいはPER2にはリン酸化されうる複数のSerやThrが含まれるため,多段階なリン酸化反応の解析は困難であった.そのため,CKIδの基質となるペプチドをスクリーニングしたところ,1残基のSerを含む単純なペプチドでも温度に依存しないリン酸化反応が起こることを見い出した.この反応において,酵素と基質との親和性を示すミカエリス定数をもとめたところ,高温においてミカエリス定数の上昇が確認された.この結果から,基質とCKIδ-ATP複合体との結合が高温において弱くなることがわかった.
CKIδと2残基のSerのうち一方がリン酸化されているペプチドを用いて,2個目のリン酸化反応を速度論的に解析した.その結果,kcat値の温度依存性が小さく,とくに基質の濃度が高いときリン酸化反応が温度補償性をもつことがわかった.等温滴定型カロリメトリーを用い,2個のリン酸基が付加された生成物,CKIδ,ADPを共存させて結合定数を測定したところ,CKIδは高温において生成物との結合が強くなった.また,質量分析によりCKIδによるADPに依存的な脱リン酸化活性が確認された.さらに,CKIδは基質の存在しない環境においてもATPを加水分解してADPに変換させ,リン酸化反応中はATPとADPが混在していることがわかった.これらの結果を総合的に考えると,多段階なリン酸化反応において,温度に依存的な生成物との結合が温度補償性に重要な過程であると考えられた.
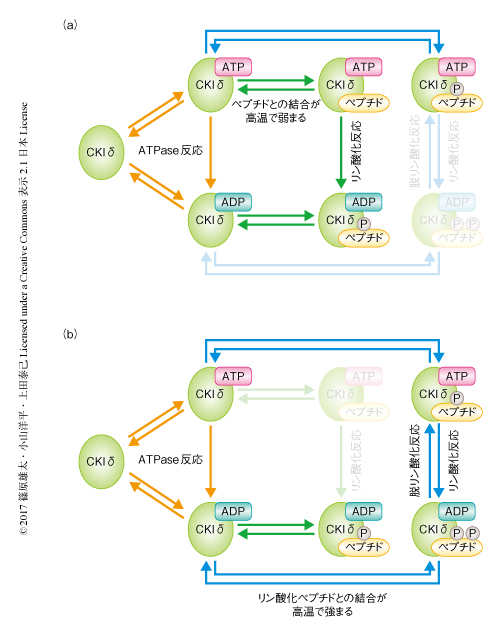
リン酸化反応機構のうち,どの素過程が温度補償性に重要であるかを明らかにするため,おのおのの素過程を変化させたときに温度補償性が保たれるかを検証する数理モデルを構築した(図1).Markov連鎖モンテカルロ法を用いたシミュレーションの結果,基質であるペプチドに1個目のリン酸基が付加するリン酸化の温度補償性にはCKIδ-ATP複合体と基質とのあいだの結合が高温において弱くなることが重要であることが示された.また,2個目のリン酸基が付加するリン酸化(とくに,リン酸基が1個付加されたペプチドの量が多いとき)の温度補償性にはCKIδ-ADP複合体とリン酸基が2個付加された生成物とのあいだの結合が高温において強くなることが重要であることが明らかにされた.
温度に依存的な生成物との結合の過程を低分子化合物により阻害することで,温度に依存しないリン酸化反応に温度依存性をもたせることを試みた.CKIδの脱リン酸化活性を阻害する小分子化合物のケミカルスクリーニングにより,生成物との結合を特異的に阻害する化合物としてアウリントリカルボン酸が同定された.実際に,リン酸化反応にアウリントリカルボン酸をくわえるとリン酸化活性が向上し,リン酸化反応に温度依存性をもたせることができた.
アウリントリカルボン酸がCKIδのどの部位に結合しているかを明らかにするためドッキングシミュレーションを行った.その結果,アウリントリカルボン酸はCKIδのLys224の付近にもっとも強く結合すると予測された.アウリントリカルボン酸はリン酸基が2個付加されたペプチドとCKIδとの結合を阻害するため,このようなペプチドもLys224の付近に結合すると考えられた.
これまでに,リン酸基と構造の似ているタングステン酸イオンおよび硫酸イオンについては,CKIδと結合した立体構造がX線結晶構造解析によりそれぞれ報告されている4,5).これらの構造においては4カ所の結合部位が知られているが,このうちひとつはアウリントリカルボン酸が結合すると予測されたLys224を含む部位だった.
CKIδのLys224を変異させたコンストラクトをもつプラスミドを導入して細胞においてPER2とルシフェラーゼとの融合タンパク質に対するリン酸化活性を調べたところ,AspあるいはGluに置換した変異体が温度補償性を示すパラメーターであるQ10値を上昇させた.つまり,アウリントリカルボン酸が結合すると強く示唆されたCKIδのLys224の付近は,ウェットな実験においても温度補償性に重要な部位であることが示された.
Lys224がAspに置換したCKIδ変異体をコードする遺伝子をES細胞の染色体に導入し,マウスの発生の初期の胚に移植することにより遺伝子改変マウスを作製した6).この遺伝子改変マウスの概日リズムの周期の長さを測定したところ,野生型のマウスは23.7時間なのに対し19.6時間と短周期化していた.周期の長さが変化するCKIδあるいはCKIεの変異体としてはtau変異体などが報告されているが7),このCKIδ変異体はこれまででもっとも周期の長さが短かった.
マウスの概日時計の中枢組織である視交叉上核を摘出ののち培養し,組織レベルにおいて温度補償性を検証した.その結果,温度を7℃変化させたとき,野生型の視交叉上核の切片において周期の長さは0.3時間だけ変化したのに対し,Lys224をAspに置換したCKIδ変異体の視交叉上核の切片においては1.2時間も変化した.このことから,温度に依存的な生成物との結合は温度補償性を保持するために必要な素過程であることがわかった.
CKIは多くの生物種において進化的に保存されており,代謝リズムの周期にもかかわるといわれている8).そこで,マウス以外の生物種においても温度に依存しないリン酸化反応が保存されているという仮説をたてた.出芽酵母に由来するCKI homolog 1において温度の変化に応じたリン酸化反応を測定したところ,マウスのCKIδと同様に,リン酸化反応に温度依存性はなかった.そこで,アミノ酸配列をCKIδあるいはCKIδにきわめて類似したアミノ酸配列をもつCKIファミリーとほかのリン酸化酵素とで比較したところ,CKIファミリーにおいてCKIδのLys224に対応する付近には,ほかのリン酸化酵素にはない固有の領域が存在することがわかった.
この領域について原子レベルでの役割を明らかにするため,CKIδの立体構造を用いた分子動力学シミュレーションを行った.その結果,Lys224の付近はほかの領域に比べ構造のゆらぎが大きく,25℃と35℃とでゆらぎの大きさには変化がみられた.さらに,X線結晶構造解析により新たにCKIδとADPとが結合した複合体の立体構造を決定したところ,CKIδのLys224の付近の領域はゆらぎが大きいことがわかった.このように,CKIファミリーに固有の領域を含むCKIδのLys224の周辺の領域は構造のゆらぎが大きく,このゆらぎが温度により変化することによりCKIδと基質あるいは生成物との結合の強さが制御されると考えられた.
温度依存性をもつリン酸化反応を示すヒトに由来するTTBK1 9) に温度補償性を付与することを試みた.出芽酵母などに進化的に保存されているCKIファミリーに固有の領域を含むアミノ酸配列をTTBK1に挿入した結果,リン酸化反応の温度依存性が大幅に小さくなり,温度に依存しないリン酸化反応を再構成することに成功した.このことから,CKIファミリーに固有の領域は温度補償性において十分であることがわかった.
この研究においては,温度補償されたリン酸化反応機構について,CKIδ-ATP複合体と基質との結合が高温において弱くなること,および,CKIδ-ADP複合体と生成物との結合が高温において強くなることの2つの機構が重要であることが示された.時計タンパク質であるPER2やCRY1はCKIδにより複数の部位がリン酸化される.とくに,CKIδによりリン酸化されるPER2のβTrCP領域やFASPS領域は,温度補償性に重要であることが示されている10).この研究において明らかにされた温度補償されたリン酸化反応は,概日時計の中心となるPER2のリン酸化反応機構と相関性があるため,概日時計の温度補償性の根底にある機構が明らかにされたと考えている.
略歴:2015年 大阪大学大学院生命機能研究科 修了,同年より理化学研究所生命システム研究センター 研究員.
研究テーマ:哺乳類の概日時計の構成的な理解.
抱負:生命現象を“創る”ことにより理解したい.
小山 洋平(Yohei M. Koyama)
略歴:2009年 東京大学大学院総合文化研究科 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2011年より理化学研究所生命システム研究センター 研究員.
研究テーマ:分子動力学シミュレーションのデータ解析手法の開発.
抱負:分子の機能を原子レベルから理解したい.
上田 泰己(Hiroki R. Ueda)
理化学研究所生命システム研究センター グループディレクター,東京大学大学院医学系研究科 教授 兼任.
研究室URL:http://www.qbic.riken.jp/syn-bio/jpn/index.html
© 2017 篠原雄太・小山洋平・上田泰己 Licensed under CC 表示 2.1 日本
(理化学研究所生命システム研究センター 合成生物学研究グループ)
email:篠原雄太,小山洋平,上田泰己
DOI: 10.7875/first.author.2017.102
Temperature-sensitive substrate and product binding underlie temperature-compensated phosphorylation in the clock.
Yuta Shinohara, Yohei M. Koyama, Maki Ukai-Tadenuma, Takatsugu Hirokawa, Masaki Kikuchi, Rikuhiro G. Yamada, Hideki Ukai, Hiroshi Fujishima, Takashi Umehara, Kazuki Tainaka, Hiroki R. Ueda
Molecular Cell, 67, 783-798.e20 (2017)
要 約
地球上の多くの生物種には約24時間を周期とする概日時計が備わるが,概日時計にはその周期が温度にほとんど依存しないという温度補償性がある.この研究においては,概日時計の温度補償性と関係の深い,CKIδの温度に依存しないリン酸化反応機構について生化学的な実験および数理モデルにより検討した.その結果,CKIδ-ATP複合体と基質との結合が高温において弱くなること,および,CKIδ-ADP複合体と生成物との結合が高温において強くなることの2つの機構が重要であることが示された.さらに,CKIδの脱リン酸化活性を阻害する小分子化合物のケミカルスクリーニングにより同定されたアウリントリカルボン酸は,温度に依存的にリン酸化を活性化させた.ドッキングシミュレーションによりアウリントリカルボン酸はCKIδのLys224の付近に結合することが示され,Lys224がAspに置換したCKIδ変異体はマウスの行動の概日リズムを短周期化し,視交叉上核の概日リズムにおいて周期の温度依存性を変化させた.CKIδのLys224の付近の進化的に保存されたアミノ酸配列を,温度依存性をもつリン酸化酵素TTBK1に挿入すると,リン酸化反応に温度補償性が付与された.この研究より,温度に依存的な基質との結合および生成物との結合が温度補償性の基盤であることが明らかにされた.
はじめに
地球上の多くの生物種には約24時間を周期とする概日時計が備わっている.概日時計の特徴のひとつとして,周期の長さが温度に依存せずつねに一定であるという温度補償性があげられるが,これは,ショウジョウバエの羽化リズム1) や渦鞭毛藻の発光リズム2) が温度に依存しないことから見い出された.
2009年,筆者らの研究グループは,リン酸化酵素の一種であるCKIδによるリン酸化反応が哺乳類の概日時計において周期の長さを決定することを発見し,そのリン酸化反応が温度に依存せずつねに一定であることを示した3).生体における一般的な生化学反応は,温度が10℃上がると反応速度は2~3倍速くなる.しかし,CKIδのリン酸化反応は一般的な生化学反応とは異なり温度に依存しなかった.このことから,CKIδの温度に依存しないリン酸化反応の機構を明らかにするとともに,概日時計における温度補償性の機構を解明することをめざした.
1.温度に依存しないリン酸化反応の定量的な理解
概日時計ネットワークにおいて,CKIδの基質である時計タンパク質であるPER1あるいはPER2にはリン酸化されうる複数のSerやThrが含まれるため,多段階なリン酸化反応の解析は困難であった.そのため,CKIδの基質となるペプチドをスクリーニングしたところ,1残基のSerを含む単純なペプチドでも温度に依存しないリン酸化反応が起こることを見い出した.この反応において,酵素と基質との親和性を示すミカエリス定数をもとめたところ,高温においてミカエリス定数の上昇が確認された.この結果から,基質とCKIδ-ATP複合体との結合が高温において弱くなることがわかった.
CKIδと2残基のSerのうち一方がリン酸化されているペプチドを用いて,2個目のリン酸化反応を速度論的に解析した.その結果,kcat値の温度依存性が小さく,とくに基質の濃度が高いときリン酸化反応が温度補償性をもつことがわかった.等温滴定型カロリメトリーを用い,2個のリン酸基が付加された生成物,CKIδ,ADPを共存させて結合定数を測定したところ,CKIδは高温において生成物との結合が強くなった.また,質量分析によりCKIδによるADPに依存的な脱リン酸化活性が確認された.さらに,CKIδは基質の存在しない環境においてもATPを加水分解してADPに変換させ,リン酸化反応中はATPとADPが混在していることがわかった.これらの結果を総合的に考えると,多段階なリン酸化反応において,温度に依存的な生成物との結合が温度補償性に重要な過程であると考えられた.
リン酸化反応機構のうち,どの素過程が温度補償性に重要であるかを明らかにするため,おのおのの素過程を変化させたときに温度補償性が保たれるかを検証する数理モデルを構築した(図1).Markov連鎖モンテカルロ法を用いたシミュレーションの結果,基質であるペプチドに1個目のリン酸基が付加するリン酸化の温度補償性にはCKIδ-ATP複合体と基質とのあいだの結合が高温において弱くなることが重要であることが示された.また,2個目のリン酸基が付加するリン酸化(とくに,リン酸基が1個付加されたペプチドの量が多いとき)の温度補償性にはCKIδ-ADP複合体とリン酸基が2個付加された生成物とのあいだの結合が高温において強くなることが重要であることが明らかにされた.
2.生成物との結合の阻害による温度補償性の制御
温度に依存的な生成物との結合の過程を低分子化合物により阻害することで,温度に依存しないリン酸化反応に温度依存性をもたせることを試みた.CKIδの脱リン酸化活性を阻害する小分子化合物のケミカルスクリーニングにより,生成物との結合を特異的に阻害する化合物としてアウリントリカルボン酸が同定された.実際に,リン酸化反応にアウリントリカルボン酸をくわえるとリン酸化活性が向上し,リン酸化反応に温度依存性をもたせることができた.
アウリントリカルボン酸がCKIδのどの部位に結合しているかを明らかにするためドッキングシミュレーションを行った.その結果,アウリントリカルボン酸はCKIδのLys224の付近にもっとも強く結合すると予測された.アウリントリカルボン酸はリン酸基が2個付加されたペプチドとCKIδとの結合を阻害するため,このようなペプチドもLys224の付近に結合すると考えられた.
これまでに,リン酸基と構造の似ているタングステン酸イオンおよび硫酸イオンについては,CKIδと結合した立体構造がX線結晶構造解析によりそれぞれ報告されている4,5).これらの構造においては4カ所の結合部位が知られているが,このうちひとつはアウリントリカルボン酸が結合すると予測されたLys224を含む部位だった.
CKIδのLys224を変異させたコンストラクトをもつプラスミドを導入して細胞においてPER2とルシフェラーゼとの融合タンパク質に対するリン酸化活性を調べたところ,AspあるいはGluに置換した変異体が温度補償性を示すパラメーターであるQ10値を上昇させた.つまり,アウリントリカルボン酸が結合すると強く示唆されたCKIδのLys224の付近は,ウェットな実験においても温度補償性に重要な部位であることが示された.
Lys224がAspに置換したCKIδ変異体をコードする遺伝子をES細胞の染色体に導入し,マウスの発生の初期の胚に移植することにより遺伝子改変マウスを作製した6).この遺伝子改変マウスの概日リズムの周期の長さを測定したところ,野生型のマウスは23.7時間なのに対し19.6時間と短周期化していた.周期の長さが変化するCKIδあるいはCKIεの変異体としてはtau変異体などが報告されているが7),このCKIδ変異体はこれまででもっとも周期の長さが短かった.
マウスの概日時計の中枢組織である視交叉上核を摘出ののち培養し,組織レベルにおいて温度補償性を検証した.その結果,温度を7℃変化させたとき,野生型の視交叉上核の切片において周期の長さは0.3時間だけ変化したのに対し,Lys224をAspに置換したCKIδ変異体の視交叉上核の切片においては1.2時間も変化した.このことから,温度に依存的な生成物との結合は温度補償性を保持するために必要な素過程であることがわかった.
3.温度に依存しないリン酸化反応の再構成
CKIは多くの生物種において進化的に保存されており,代謝リズムの周期にもかかわるといわれている8).そこで,マウス以外の生物種においても温度に依存しないリン酸化反応が保存されているという仮説をたてた.出芽酵母に由来するCKI homolog 1において温度の変化に応じたリン酸化反応を測定したところ,マウスのCKIδと同様に,リン酸化反応に温度依存性はなかった.そこで,アミノ酸配列をCKIδあるいはCKIδにきわめて類似したアミノ酸配列をもつCKIファミリーとほかのリン酸化酵素とで比較したところ,CKIファミリーにおいてCKIδのLys224に対応する付近には,ほかのリン酸化酵素にはない固有の領域が存在することがわかった.
この領域について原子レベルでの役割を明らかにするため,CKIδの立体構造を用いた分子動力学シミュレーションを行った.その結果,Lys224の付近はほかの領域に比べ構造のゆらぎが大きく,25℃と35℃とでゆらぎの大きさには変化がみられた.さらに,X線結晶構造解析により新たにCKIδとADPとが結合した複合体の立体構造を決定したところ,CKIδのLys224の付近の領域はゆらぎが大きいことがわかった.このように,CKIファミリーに固有の領域を含むCKIδのLys224の周辺の領域は構造のゆらぎが大きく,このゆらぎが温度により変化することによりCKIδと基質あるいは生成物との結合の強さが制御されると考えられた.
温度依存性をもつリン酸化反応を示すヒトに由来するTTBK1 9) に温度補償性を付与することを試みた.出芽酵母などに進化的に保存されているCKIファミリーに固有の領域を含むアミノ酸配列をTTBK1に挿入した結果,リン酸化反応の温度依存性が大幅に小さくなり,温度に依存しないリン酸化反応を再構成することに成功した.このことから,CKIファミリーに固有の領域は温度補償性において十分であることがわかった.
おわりに
この研究においては,温度補償されたリン酸化反応機構について,CKIδ-ATP複合体と基質との結合が高温において弱くなること,および,CKIδ-ADP複合体と生成物との結合が高温において強くなることの2つの機構が重要であることが示された.時計タンパク質であるPER2やCRY1はCKIδにより複数の部位がリン酸化される.とくに,CKIδによりリン酸化されるPER2のβTrCP領域やFASPS領域は,温度補償性に重要であることが示されている10).この研究において明らかにされた温度補償されたリン酸化反応は,概日時計の中心となるPER2のリン酸化反応機構と相関性があるため,概日時計の温度補償性の根底にある機構が明らかにされたと考えている.
文 献
- Pittendrigh, C. S.: On temperature independence in the clock system controlling emergence time in Drosophila. Proc. Natl. Acad. Sci. USA, 40, 1018-1029 (1954)[PubMed]
- Hastings, J. W. & Sweeney, B. M.: On the mechanism of temperature independence in a biological clock. Proc. Natl. Acad. Sci. USA, 43, 804-811 (1957)[PubMed]
- Isojima, Y., Nakajima, M., Ukai, H. et al.: CKIε/δ-dependent phosphorylation is a temperature-insensitive, period-determining process in the mammalian circadian clock. Proc. Natl. Acad. Sci. USA, 106, 15744-15749 (2009)[PubMed]
- Longenecker, K. L., Roach, P. J. & Hurley, T. D.: Three-dimensional structure of mammalian casein kinase I: molecular basis for phosphate recognition. J. Mol. Biol., 257, 618-631 (1996)[PubMed]
- Long, A., Zhao, H. & Huang, X.: Structural basis for the interaction between casein kinase 1 delta and a potent and selective inhibitor. J. Med. Chem., 55, 956-960 (2012)[PubMed]
- Ode, K. L., Ukai, H., Susaki, E. A. et al.: Knockout-rescue embryonic stem cell-derived mouse reveals circadian-period control by quality and quantity of CRY1. Mol. Cell, 65, 176-190 (2017)[PubMed]
- Meng, Q. J., Logunova, L., Mywood, E. S. et al.: Setting clock speed in mammals: the CK1ε tau mutation in mice accelerates circadian pacemakers by selectively destabilizing PERIOD proteins. Neuron, 58, 78-88 (2008)[PubMed]
- Causton, H. C., Feeney, K. A., Ziegler, C. A. et al.: Metabolic cycles in yeast share features conserved among circadian rhythms. Curr. Biol., 25, 1056-1062 (2015)[PubMed]
- Manning, G., Whyte, D. B., Martinez, R. et al.: The protein kinase complement of the human genome. Science, 298, 1912-1934 (2002)[PubMed]
- Zhou, M., Kim, J. K., Eng, G. W. et al.: A Period2 phosphoswitch regulates and temperature compensates circadian period. Mol. Cell, 60, 77-88 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 大阪大学大学院生命機能研究科 修了,同年より理化学研究所生命システム研究センター 研究員.
研究テーマ:哺乳類の概日時計の構成的な理解.
抱負:生命現象を“創る”ことにより理解したい.
小山 洋平(Yohei M. Koyama)
略歴:2009年 東京大学大学院総合文化研究科 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2011年より理化学研究所生命システム研究センター 研究員.
研究テーマ:分子動力学シミュレーションのデータ解析手法の開発.
抱負:分子の機能を原子レベルから理解したい.
上田 泰己(Hiroki R. Ueda)
理化学研究所生命システム研究センター グループディレクター,東京大学大学院医学系研究科 教授 兼任.
研究室URL:http://www.qbic.riken.jp/syn-bio/jpn/index.html
© 2017 篠原雄太・小山洋平・上田泰己 Licensed under CC 表示 2.1 日本