概日時計の機能の再編成が映す老化の代謝特性
佐藤章悟・Paolo Sassone-Corsi
(米国California大学Irvine校Center for Epigenetics and Metabolism)
email:佐藤章悟
DOI: 10.7875/first.author.2017.099
Circadian reprogramming in the liver identifies metabolic pathways of aging.
Shogo Sato, Guiomar Solanas, Francisca Oliveira Peixoto, Leonardo Bee, Aikaterini Symeonidi, Mark S. Schmidt, Charles Brenner, Selma Masri, Salvador Aznar Benitah, Paolo Sassone-Corsi
Cell, 170, 664-677.e11 (2017)
老化と概日リズムの劣化は水魚之交であるが,末梢組織において代謝を制御する概日時計に対し老化はどのように影響するのだろうか.また,カロリーの摂取の制限は代謝の改善および延命をもたらすが,概日時計と代謝との相互関係をどのように修飾するのだろうか.この研究においては,通常食あるいはカロリー制限食を負荷した若齢あるいは老齢のマウスの肝臓における概日リズムを示す転写産物のプロファイリングにより,老化に特有な代謝,とくに,タンパク質のアセチル化修飾に関与する代謝経路の再編成が進行することが明らかにされた.実際に,若齢のマウスの肝臓においてみられた全タンパク質のアセチル化修飾の概日リズムは,老齢のマウスにおいて消失していた.また,カロリーの摂取の制限はNAD+-SIRT1代謝経路において概日時計の制御を向上させ,タンパク質のアセチル化修飾を亢進することが示された.この研究により,末梢組織の概日時計がタンパク質のアセチル化修飾を中心とした肝臓の代謝と老化を仲介することが示唆された.
生物のもつ概日時計は,地球の自転がつくりだす明暗のサイクルに同調し行動や生理機能に概日リズムを生じさせる.概日リズムは24時間周期の転写-翻訳フィードバックループにより制御される.この分子機構の中心を担うコア時計遺伝子の産物であるBMAL1およびCLOCKは,転写因子として標的となる多くの遺伝子の発現の概日リズムも制御する.そのため,不規則なライフスタイルにともなう概日時計の機能の障害,あるいは,時計遺伝子そのものの遺伝的な変異により,代謝や免疫などの生理機能の概日リズムは破綻し,高血圧や糖尿病などの代謝性あるいは慢性炎症性の疾患の引き金にもなる.
生物学的な老化の特徴として,ミトコンドリアの機能の不全,インスリン抵抗性など代謝の恒常性を維持する機能の劣化,睡眠障害など概日リズムの減弱があげられる.しかし,老化が概日時計による代謝の制御におよぼす影響については不明である.また,アンチエイジングの鍵として有力なカロリーの摂取の制限は代謝の機能を劇的に改善し多くの生物種において延命をもたらす一方,時計遺伝子の発現を増強することが報告されている1).そのため,寿命を延長しうるカロリーの摂取の制限への適用を仲介する概日リズムを示す代謝の解明は重要な研究課題である.この研究においては,老化あるいはカロリーの摂取の制限と概日リズムとの相互作用にひそむ分子経路および代謝経路の特定をめざした.
肝臓における概日時計および概日時計により制御される代謝におよぼす老化の影響について検討するため,若齢および老齢のマウスを12時間-12時間の明暗サイクルにおき,4時間ごとに肝臓を摘出しトランスクリプトームを解析した.その結果,2626の遺伝子が若齢のマウスに特異的に概日リズムを示したのに対し,1664の遺伝子は老齢のマウスに特異的に概日リズムを示した.概日リズムの振幅は老齢のマウスにおいて減弱していた.また,コア時計遺伝子およびそれらの標的となる遺伝子の発現レベルを若齢のマウスと老齢のマウスとのあいだで比較したところ,老齢のマウスにおいて概日リズムの振幅の減弱がみられたものの大きな違いはなく,コア時計遺伝子を介した概日時計の制御は生涯をつうじ健全に維持されることが示唆された.
アンチエイジングに効果的であるとされるカロリーの摂取の制限が概日時計と代謝との相互作用におよぼす影響について明らかにするため,30%カロリー制限食あるいは通常食を若齢マウスあるいは老齢のマウスに6カ月にわたり負荷した.その結果,若齢のマウスの肝臓においてはカロリーの摂取の制限により新たに4070の遺伝子が概日リズムを示した.くわえて,カロリー制限食を負荷したマウスにおける概日リズムの振幅は,通常食を負荷したマウスに比べて顕著に大きかった.さらに,カロリーの摂取の制限によりコア時計遺伝子およびそれらの標的となる遺伝子の発現も著明に亢進した.同様に,老齢のマウスにおいてもカロリーの摂取の制限による肝臓における概日時計の制御の向上がみられた.
肝臓におけるトランスクリプトームのデータを用いて,遺伝子オントロジー解析により概日リズムを示す代謝経路や生物学的な機能の特定を試みた.ほかの組織におけるトランスクリプトームのデータ2) との比較により,肝臓に特有な概日リズムを示す代謝経路としてNAD+の代謝およびタンパク質のアセチル化修飾が見い出され,これらは老化により再編成されると推察された.そこで,12時間-12時間の明暗サイクルにおいたマウスの肝臓における全タンパク質のアセチル化修飾のレベルを比較したところ,通常食を負荷した若齢のマウスにおいては明期の後半にピークをもつ概日リズムがみられたが,この概日リズムは老齢のマウスにおいて完全に失われていた.一方で,カロリーの摂取の制限は全タンパク質のアセチル化修飾を劇的に亢進させた.以上の結果から,カロリーの摂取の制限は老化にともなうタンパク質のアセチル化修飾の制御の不全をふせぐ可能性が見い出された.
タンパク質のアセチル化修飾の変化はヒストンのアセチル化にも及ぶのかどうか検討した.その結果,コア時計遺伝子のプロモーター領域におけるヒストンH3のLys9,Lys14,Lys27のアセチル化は,若齢および老齢のマウスにおいてカロリーの摂取の制限により亢進した.さらに,コア時計遺伝子だけでなく,一部の代謝関連遺伝子のプロモーター領域におけるヒストンのアセチル化もカロリーの摂取の制限により亢進した.これらヒストンのアセチル化は遺伝子の発現における活性化のマークとして知られることにくわえ,ヒストンのアセチル化と遺伝子の発現の概日リズムは一致したため,カロリーの摂取の制限による遺伝子の発現の亢進および時計遺伝子の発現の制御には,ダイナミックなヒストンの修飾およびそれにともなうクロマチン構造の再編成が強く関与することが示唆された.
NAD+のレベルおよびニコチンアミドホスホリボシルトランスフェラーゼを介したNAD+の生合成経路は老化に直接的に寄与するだけでなく,NAD+のレベルの上昇は延命や老後の健康の維持に貢献すると報告されている3).とくに,NAD+に依存的な脱アセチル化酵素であるSIRTは老化の進行やカロリーの摂取の制限による延命の効果を仲介するタンパク質として大きく注目されている.NAD+のレベルは概日リズムを示すだけでなく,SIRTが肝臓における転写および代謝の概日リズムの制御を担うことから4,5),NAD+-SIRT代謝経路は概日時計,老化,カロリーの摂取の制限を結びつける重要な代謝経路であることがうかがえる.
そこで,老化あるいはカロリーの摂取の制限によるNAD+の代謝における概日リズムの制御への影響を明確にするため,12時間-12時間の明暗サイクルにおいたマウスの肝臓におけるNAD+およびNAD+に関連する代謝産物を定量した.その結果,NAD+はカロリーを制限したマウスの,とくに明期の開始時において顕著に増加した.同様に,ニコチンアミドアデニンジヌクレオチドリン酸も明期の開始時および暗期の開始時において有意に増加した.また,カロリーの摂取の制限による暗期の開始時に特異的なニコチンアミドリボシドおよびニコチンアミドモノヌクレオチドの激増により,これら代謝産物のシャープな概日リズムが生じた.対照的に,NAD+のde novo合成に利用されるニコチン酸アデニンジヌクレオチドはカロリーの摂取の制限により減少した.一方,NAD+の消費により生じるニコチンアミドやADPリボースは老齢のマウスにおいて増加していた.以上の結果から,老化はNAD+の代謝回転を促進する可能性が示された.一方で,カロリーの摂取の制限はNAD+の代謝における概日リズムの制御を鋭利にし,とくに,NAD+サルベージ経路に対する再編成を促進するものと考えられた.
カロリーの摂取の制限によるNAD+に関連する代謝産物のダイナミックな変化をうけ,NAD+に依存的な脱アセチル化酵素であるSIRT1の活性に注目した.そこで,肝臓に特異的なSIRT1ノックアウトマウスの肝臓におけるトランスクリプトームのデータ6) をもとにSIRT1の標的となる時計遺伝子を抽出し,この研究において得られたトランスクリプトームのデータと照らしあわせた.その結果,カロリー制限食を負荷した若齢および老齢のマウスの肝臓における時計遺伝子にしめるSIRT1の標的となる遺伝子は,通常食を負荷したマウスと比べて約5倍も多かった.このことから,カロリーの摂取の制限によりSIRT1が活性化されることが確認され,カロリーの摂取の制限によるNAD+-SIRT1代謝経路の活性化が肝臓における概日時計の再編成に寄与することが示唆された.
老化の進行にブレーキをかけるカロリーの摂取の制限により,肝臓における代謝の概日リズムがどのように変わるか検討した.とくに,カロリーを制限したマウスの肝臓においてみられたタンパク質のアセチル化修飾の劇的な亢進から,その基質として利用されるアセチルCoAの生合成にかかわる代謝経路に注目した.解糖系やTCA回路はアセチルCoAの供給源のひとつであるが,解糖系を担う酵素の発現はカロリーの摂取の制限により激減した.他方,クエン酸からアセチルCoAへの変換を担うATPクエン酸シンターゼは脂質のde novo合成の制御を担う転写因子SREBPにより制御され明確な概日リズムを示すが,その発現はカロリーの摂取の制限により完全に消失した.以上のことから,カロリーの摂取の制限により肝臓における糖の代謝経路および脂質の代謝経路の大規模な再編成が認められ,これらの代謝経路からのアセチルCoAの供給の断絶が示唆された.
アセチルCoAの供給にかかわるそのほかの代謝経路として,アセチルCoAシンターゼによる酢酸からアセチルCoAへの変換が考えられた.アセチルCoAシンターゼはSIRT1により直接的に脱アセチル化され,そのアセチル化と脱アセチル化のサイクルおよび活性は概日リズムを示す7).実際に,カロリーを制限したマウスの肝臓において酢酸の増加が観察された.アセチルCoAシンターゼのアセチル化のレベルは通常食を負荷したマウスの肝臓では12時間-12時間の明暗サイクルの明期の後半において鋭利なピークを示すが,カロリー制限食を負荷したマウスの肝臓においてはこのピークがみられなかったことから,すべての時点においてアセチルCoAシンターゼが活性化していると推察された.これまでにも,カロリーの摂取の制限による肝臓における酢酸およびアセチルCoAの増加が報告されているため8),最終的に,SIRT1によるアセチルCoAシンターゼの脱アセチル化が基質として多くのアセチルCoAの利用を可能にし,タンパク質のアセチル化修飾の亢進に関与すると結論づけられた.
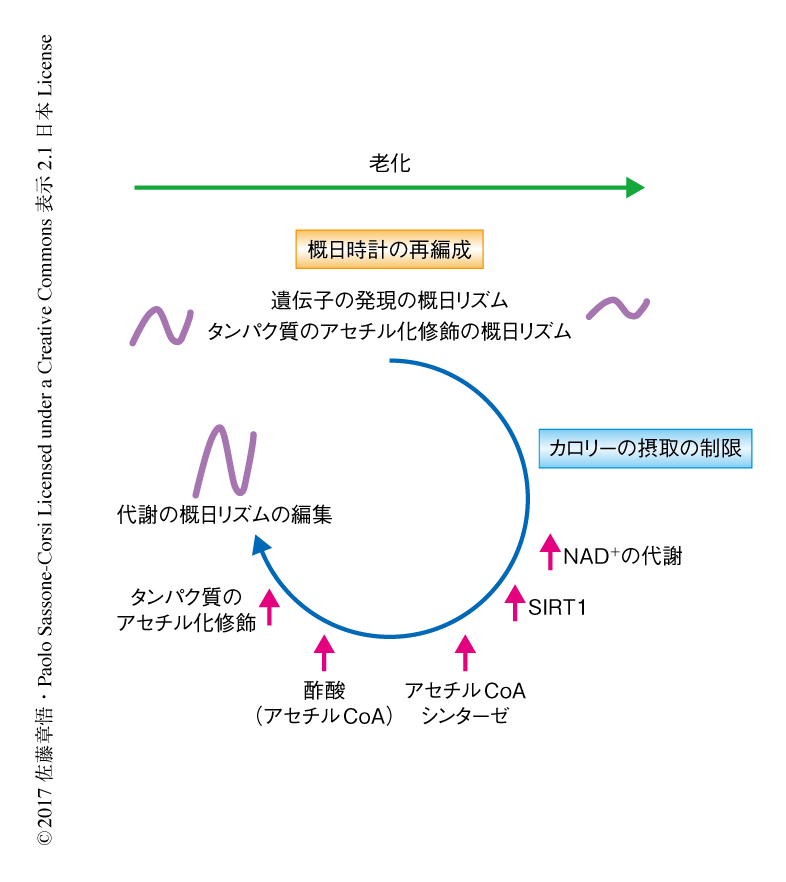
この研究により,肝臓の概日時計とリンクする代謝経路の大胆な再編成が老化により進行することが示された(図1).また,アンチエイジングに効果的とされるカロリーの摂取の制限は,NAD+-SIRT1代謝経路の概日リズムを活性化し,タンパク質のアセチル化修飾を中心とした代謝経路を再編成することがわかった(図1).とくに,種々の時計遺伝子や発現が概日リズムを示す遺伝子のプロモーター領域において観察されたカロリーの摂取の制限によるヒストンのアセチル化の亢進が,概日時計の制御を向上させる,あるいは,老化にともなう概日時計の変容を回復させることが示唆された.この研究により,アンチエイジングのための生物学的な概日時計の微調整になぞらえた規律的なライフスタイルが注視されることを望む.
略歴:2012年 早稲田大学大学院人間科学研究科博士課程 修了,同年 杏林大学医学部 博士研究員,2013年 米国Texas大学Southwestern Medical CenterにてPost-doctoral fellowを経て,2015年より米国California大学Irvine校Post-doctoral fellow.
研究テーマ:概日時計のマジックの種明かしおよび健康への利用.
抱負:社会的な時間にしばられない生活をおくる.生物学的な時間に身をゆだねた生活をおくる.
Paolo Sassone-Corsi
米国California大学Irvine校Professor.
© 2017 佐藤章悟・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本
(米国California大学Irvine校Center for Epigenetics and Metabolism)
email:佐藤章悟
DOI: 10.7875/first.author.2017.099
Circadian reprogramming in the liver identifies metabolic pathways of aging.
Shogo Sato, Guiomar Solanas, Francisca Oliveira Peixoto, Leonardo Bee, Aikaterini Symeonidi, Mark S. Schmidt, Charles Brenner, Selma Masri, Salvador Aznar Benitah, Paolo Sassone-Corsi
Cell, 170, 664-677.e11 (2017)
要 約
老化と概日リズムの劣化は水魚之交であるが,末梢組織において代謝を制御する概日時計に対し老化はどのように影響するのだろうか.また,カロリーの摂取の制限は代謝の改善および延命をもたらすが,概日時計と代謝との相互関係をどのように修飾するのだろうか.この研究においては,通常食あるいはカロリー制限食を負荷した若齢あるいは老齢のマウスの肝臓における概日リズムを示す転写産物のプロファイリングにより,老化に特有な代謝,とくに,タンパク質のアセチル化修飾に関与する代謝経路の再編成が進行することが明らかにされた.実際に,若齢のマウスの肝臓においてみられた全タンパク質のアセチル化修飾の概日リズムは,老齢のマウスにおいて消失していた.また,カロリーの摂取の制限はNAD+-SIRT1代謝経路において概日時計の制御を向上させ,タンパク質のアセチル化修飾を亢進することが示された.この研究により,末梢組織の概日時計がタンパク質のアセチル化修飾を中心とした肝臓の代謝と老化を仲介することが示唆された.
はじめに
生物のもつ概日時計は,地球の自転がつくりだす明暗のサイクルに同調し行動や生理機能に概日リズムを生じさせる.概日リズムは24時間周期の転写-翻訳フィードバックループにより制御される.この分子機構の中心を担うコア時計遺伝子の産物であるBMAL1およびCLOCKは,転写因子として標的となる多くの遺伝子の発現の概日リズムも制御する.そのため,不規則なライフスタイルにともなう概日時計の機能の障害,あるいは,時計遺伝子そのものの遺伝的な変異により,代謝や免疫などの生理機能の概日リズムは破綻し,高血圧や糖尿病などの代謝性あるいは慢性炎症性の疾患の引き金にもなる.
生物学的な老化の特徴として,ミトコンドリアの機能の不全,インスリン抵抗性など代謝の恒常性を維持する機能の劣化,睡眠障害など概日リズムの減弱があげられる.しかし,老化が概日時計による代謝の制御におよぼす影響については不明である.また,アンチエイジングの鍵として有力なカロリーの摂取の制限は代謝の機能を劇的に改善し多くの生物種において延命をもたらす一方,時計遺伝子の発現を増強することが報告されている1).そのため,寿命を延長しうるカロリーの摂取の制限への適用を仲介する概日リズムを示す代謝の解明は重要な研究課題である.この研究においては,老化あるいはカロリーの摂取の制限と概日リズムとの相互作用にひそむ分子経路および代謝経路の特定をめざした.
1.老化あるいはカロリーの摂取の制限による概日時計への影響
肝臓における概日時計および概日時計により制御される代謝におよぼす老化の影響について検討するため,若齢および老齢のマウスを12時間-12時間の明暗サイクルにおき,4時間ごとに肝臓を摘出しトランスクリプトームを解析した.その結果,2626の遺伝子が若齢のマウスに特異的に概日リズムを示したのに対し,1664の遺伝子は老齢のマウスに特異的に概日リズムを示した.概日リズムの振幅は老齢のマウスにおいて減弱していた.また,コア時計遺伝子およびそれらの標的となる遺伝子の発現レベルを若齢のマウスと老齢のマウスとのあいだで比較したところ,老齢のマウスにおいて概日リズムの振幅の減弱がみられたものの大きな違いはなく,コア時計遺伝子を介した概日時計の制御は生涯をつうじ健全に維持されることが示唆された.
アンチエイジングに効果的であるとされるカロリーの摂取の制限が概日時計と代謝との相互作用におよぼす影響について明らかにするため,30%カロリー制限食あるいは通常食を若齢マウスあるいは老齢のマウスに6カ月にわたり負荷した.その結果,若齢のマウスの肝臓においてはカロリーの摂取の制限により新たに4070の遺伝子が概日リズムを示した.くわえて,カロリー制限食を負荷したマウスにおける概日リズムの振幅は,通常食を負荷したマウスに比べて顕著に大きかった.さらに,カロリーの摂取の制限によりコア時計遺伝子およびそれらの標的となる遺伝子の発現も著明に亢進した.同様に,老齢のマウスにおいてもカロリーの摂取の制限による肝臓における概日時計の制御の向上がみられた.
2.老化あるいはカロリーの摂取の制限とタンパク質のアセチル化修飾
肝臓におけるトランスクリプトームのデータを用いて,遺伝子オントロジー解析により概日リズムを示す代謝経路や生物学的な機能の特定を試みた.ほかの組織におけるトランスクリプトームのデータ2) との比較により,肝臓に特有な概日リズムを示す代謝経路としてNAD+の代謝およびタンパク質のアセチル化修飾が見い出され,これらは老化により再編成されると推察された.そこで,12時間-12時間の明暗サイクルにおいたマウスの肝臓における全タンパク質のアセチル化修飾のレベルを比較したところ,通常食を負荷した若齢のマウスにおいては明期の後半にピークをもつ概日リズムがみられたが,この概日リズムは老齢のマウスにおいて完全に失われていた.一方で,カロリーの摂取の制限は全タンパク質のアセチル化修飾を劇的に亢進させた.以上の結果から,カロリーの摂取の制限は老化にともなうタンパク質のアセチル化修飾の制御の不全をふせぐ可能性が見い出された.
タンパク質のアセチル化修飾の変化はヒストンのアセチル化にも及ぶのかどうか検討した.その結果,コア時計遺伝子のプロモーター領域におけるヒストンH3のLys9,Lys14,Lys27のアセチル化は,若齢および老齢のマウスにおいてカロリーの摂取の制限により亢進した.さらに,コア時計遺伝子だけでなく,一部の代謝関連遺伝子のプロモーター領域におけるヒストンのアセチル化もカロリーの摂取の制限により亢進した.これらヒストンのアセチル化は遺伝子の発現における活性化のマークとして知られることにくわえ,ヒストンのアセチル化と遺伝子の発現の概日リズムは一致したため,カロリーの摂取の制限による遺伝子の発現の亢進および時計遺伝子の発現の制御には,ダイナミックなヒストンの修飾およびそれにともなうクロマチン構造の再編成が強く関与することが示唆された.
3.老化あるいはカロリーの摂取の制限とNAD+の代謝
NAD+のレベルおよびニコチンアミドホスホリボシルトランスフェラーゼを介したNAD+の生合成経路は老化に直接的に寄与するだけでなく,NAD+のレベルの上昇は延命や老後の健康の維持に貢献すると報告されている3).とくに,NAD+に依存的な脱アセチル化酵素であるSIRTは老化の進行やカロリーの摂取の制限による延命の効果を仲介するタンパク質として大きく注目されている.NAD+のレベルは概日リズムを示すだけでなく,SIRTが肝臓における転写および代謝の概日リズムの制御を担うことから4,5),NAD+-SIRT代謝経路は概日時計,老化,カロリーの摂取の制限を結びつける重要な代謝経路であることがうかがえる.
そこで,老化あるいはカロリーの摂取の制限によるNAD+の代謝における概日リズムの制御への影響を明確にするため,12時間-12時間の明暗サイクルにおいたマウスの肝臓におけるNAD+およびNAD+に関連する代謝産物を定量した.その結果,NAD+はカロリーを制限したマウスの,とくに明期の開始時において顕著に増加した.同様に,ニコチンアミドアデニンジヌクレオチドリン酸も明期の開始時および暗期の開始時において有意に増加した.また,カロリーの摂取の制限による暗期の開始時に特異的なニコチンアミドリボシドおよびニコチンアミドモノヌクレオチドの激増により,これら代謝産物のシャープな概日リズムが生じた.対照的に,NAD+のde novo合成に利用されるニコチン酸アデニンジヌクレオチドはカロリーの摂取の制限により減少した.一方,NAD+の消費により生じるニコチンアミドやADPリボースは老齢のマウスにおいて増加していた.以上の結果から,老化はNAD+の代謝回転を促進する可能性が示された.一方で,カロリーの摂取の制限はNAD+の代謝における概日リズムの制御を鋭利にし,とくに,NAD+サルベージ経路に対する再編成を促進するものと考えられた.
4.老化あるいはカロリーの摂取の制限とSIRT1
カロリーの摂取の制限によるNAD+に関連する代謝産物のダイナミックな変化をうけ,NAD+に依存的な脱アセチル化酵素であるSIRT1の活性に注目した.そこで,肝臓に特異的なSIRT1ノックアウトマウスの肝臓におけるトランスクリプトームのデータ6) をもとにSIRT1の標的となる時計遺伝子を抽出し,この研究において得られたトランスクリプトームのデータと照らしあわせた.その結果,カロリー制限食を負荷した若齢および老齢のマウスの肝臓における時計遺伝子にしめるSIRT1の標的となる遺伝子は,通常食を負荷したマウスと比べて約5倍も多かった.このことから,カロリーの摂取の制限によりSIRT1が活性化されることが確認され,カロリーの摂取の制限によるNAD+-SIRT1代謝経路の活性化が肝臓における概日時計の再編成に寄与することが示唆された.
老化の進行にブレーキをかけるカロリーの摂取の制限により,肝臓における代謝の概日リズムがどのように変わるか検討した.とくに,カロリーを制限したマウスの肝臓においてみられたタンパク質のアセチル化修飾の劇的な亢進から,その基質として利用されるアセチルCoAの生合成にかかわる代謝経路に注目した.解糖系やTCA回路はアセチルCoAの供給源のひとつであるが,解糖系を担う酵素の発現はカロリーの摂取の制限により激減した.他方,クエン酸からアセチルCoAへの変換を担うATPクエン酸シンターゼは脂質のde novo合成の制御を担う転写因子SREBPにより制御され明確な概日リズムを示すが,その発現はカロリーの摂取の制限により完全に消失した.以上のことから,カロリーの摂取の制限により肝臓における糖の代謝経路および脂質の代謝経路の大規模な再編成が認められ,これらの代謝経路からのアセチルCoAの供給の断絶が示唆された.
アセチルCoAの供給にかかわるそのほかの代謝経路として,アセチルCoAシンターゼによる酢酸からアセチルCoAへの変換が考えられた.アセチルCoAシンターゼはSIRT1により直接的に脱アセチル化され,そのアセチル化と脱アセチル化のサイクルおよび活性は概日リズムを示す7).実際に,カロリーを制限したマウスの肝臓において酢酸の増加が観察された.アセチルCoAシンターゼのアセチル化のレベルは通常食を負荷したマウスの肝臓では12時間-12時間の明暗サイクルの明期の後半において鋭利なピークを示すが,カロリー制限食を負荷したマウスの肝臓においてはこのピークがみられなかったことから,すべての時点においてアセチルCoAシンターゼが活性化していると推察された.これまでにも,カロリーの摂取の制限による肝臓における酢酸およびアセチルCoAの増加が報告されているため8),最終的に,SIRT1によるアセチルCoAシンターゼの脱アセチル化が基質として多くのアセチルCoAの利用を可能にし,タンパク質のアセチル化修飾の亢進に関与すると結論づけられた.
おわりに
この研究により,肝臓の概日時計とリンクする代謝経路の大胆な再編成が老化により進行することが示された(図1).また,アンチエイジングに効果的とされるカロリーの摂取の制限は,NAD+-SIRT1代謝経路の概日リズムを活性化し,タンパク質のアセチル化修飾を中心とした代謝経路を再編成することがわかった(図1).とくに,種々の時計遺伝子や発現が概日リズムを示す遺伝子のプロモーター領域において観察されたカロリーの摂取の制限によるヒストンのアセチル化の亢進が,概日時計の制御を向上させる,あるいは,老化にともなう概日時計の変容を回復させることが示唆された.この研究により,アンチエイジングのための生物学的な概日時計の微調整になぞらえた規律的なライフスタイルが注視されることを望む.
文 献
- Asher, G. & Sassone-Corsi, P.: Time for food: the intimate interplay between nutrition, metabolism, and the circadian clock. Cell, 161, 84-92 (2015)[PubMed]
- Solanas, G., Oliveira Peixoto, F., Perdiguero, E. et al.: Aged stem cells reprogram their daily rhythmic functions to adapt to stress. Cell, 170, 678-692 (2017)[PubMed]
- Zhang, H., Ryu, D., Wu, Y. et al.: NAD+ repletion improves mitochondrial and stem cell function and enhances life span in mice. Science, 352, 1436-1443 (2016)[PubMed]
- Nakahata, Y., Kaluzova, M., Grimaldi, B. et al.: The NAD+-dependent deacetylase SIRT1 modulates CLOCK-mediated chromatin remodeling and circadian control. Cell, 134, 329-340 (2008)[PubMed]
- Nakahata, Y., Sahar, S., Astarita, G. et al.: Circadian control of the NAD+ salvage pathway by CLOCK-SIRT1. Science, 324, 654-657 (2009)[PubMed]
- Masri, S., Rigor, P., Cervantes, M. et al.: Partitioning circadian transcription by SIRT6 leads to segregated control cellular metabolism. Cell, 158, 659-672 (2014)[PubMed]
- Sahar, S., Masubuchi, S., Eckel-Mahan, K. et al.: Circadian control of fatty acid elongation by SIRT1-mediated deacetylation of acetyl-CoA synthetase 1. J. Biol. Chem., 289, 6091-6097 (2014)[PubMed]
- Pietrocola, F., Galluzzi, L., Bravo-san Pedro, J. M. et al.: Acetyl coenzyme A: a central metabolite and second messenger. Cell Metab., 21, 805-821 (2015)[PubMed]
著者プロフィール
略歴:2012年 早稲田大学大学院人間科学研究科博士課程 修了,同年 杏林大学医学部 博士研究員,2013年 米国Texas大学Southwestern Medical CenterにてPost-doctoral fellowを経て,2015年より米国California大学Irvine校Post-doctoral fellow.
研究テーマ:概日時計のマジックの種明かしおよび健康への利用.
抱負:社会的な時間にしばられない生活をおくる.生物学的な時間に身をゆだねた生活をおくる.
Paolo Sassone-Corsi
米国California大学Irvine校Professor.
© 2017 佐藤章悟・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本