苔状細胞-顆粒細胞シナプスにおける長期増強は興奮と抑制とのバランスを変化させ歯状回からの出力を制御する
橋本谷 祐輝
(米国Albert Einstein College of Medicine,Dominick P. Purpura Department of Neuroscience)
email:橋本谷祐輝
DOI: 10.7875/first.author.2017.091
LTP at hilar mossy cell-dentate granule cell synapses modulates dentate gyrus output by increasing excitation/inhibition balance.
Yuki Hashimotodani, Kaoutsar Nasrallah, Kyle R. Jensen, Andrés E. Chávez, Daniel Carrera, Pablo E. Castillo
Neuron, 95, 928-943.e3 (2017)
海馬の歯状回門に存在する苔状細胞は,歯状回の主要な細胞である顆粒細胞から入力をうけ,出力を返すことにより正のフィードバックループを形成する.苔状細胞はさらに歯状回の抑制性ニューロンにも投射しており,その結果,顆粒細胞に対しフィードフォワード抑制も形成する.こういった苔状細胞と顆粒細胞により形成される歯状回における局所の神経回路が記憶の形成やてんかんにおいて重要な役割をはたす可能性が示唆されてきたが,くわしいことは明らかではない.さらに,神経活動に依存的なシナプス可塑性に関してはほとんど明らかにされていない.この研究において,筆者らは,苔状細胞-顆粒細胞シナプスにおいてシナプス前性にひき起こされる長期増強を見い出した.この長期増強は苔状細胞-顆粒細胞シナプスに選択的に起こり,抑制性ニューロンを介する神経回路においては起らなかった.その結果,苔状細胞からの入力による興奮の割合が上昇して顆粒細胞の発火の頻度が上昇した.以上の結果から,苔状細胞が歯状回における情報処理において重要な役割をはたすことが示唆された.
海馬は記憶および学習において重要な脳の領域であり,これまでさかんに研究されてきた.海馬は大きく分けて歯状回,CA3野,CA1野の3つの領域に分かれており,古典的な3シナプス性の神経回路において歯状回は嗅内皮質からの入力をうけたのちCA3野へと出力し,CA3野はCA1野へと出力する(図1).歯状回は嗅内皮質からの入力情報パターンを最初にうけとり,それをCA3野へとスパースな情報パターンとして出力することにより空間認知の弁別(パターン分離)に重要な役割をはたすと考えられている1).歯状回のなかでも主要な細胞である顆粒細胞とよばれる興奮性ニューロンは歯状回の入力および出力を担う.また,歯状回門に位置する苔状細胞は顆粒細胞と同様にグルタミン酸作動性の興奮性ニューロンであり,顆粒細胞から入力をうけとり,ふたたび顆粒細胞へと投射することにより正のフィードバックループを形成する(図1).苔状細胞から顆粒細胞への投射は,同側の海馬の長軸にそった方向に投射するだけでなく,対側の海馬にも投射する.したがって,苔状細胞は非常に広い範囲にわたり顆粒細胞の神経活動を制御すると考えられている2).さらに,苔状細胞は顆粒細胞のほか抑制性ニューロンへも投射する.抑制性ニューロンは顆粒細胞と密にシナプスを形成することから,この抑制性ニューロンを介した苔状細胞の出力は顆粒細胞に対しフィードフォワード抑制を起こす.
このように,苔状細胞と顆粒細胞の形成する神経回路は記憶および学習において重要なはたらきをする可能性が示唆されてきたが3),その役割はほとんどわかっていなかった.さらに,苔状細胞の神経活動が顆粒細胞に対し,結果として興奮(直接投射が優位)なのか抑制(フィードフォワード投射が優位)なのかについても意見の相違があった2).とくに,てんかんの研究において苔状細胞の脱落はフィードフォワード投射を失わせ顆粒細胞における過興奮をひき起こす原因と考えられており,抑制の効果が強調されてきた4).一方で,直接投射の興奮性の入力に関して,その役割はほとんど明らかではなかった.筆者らは,直接投射の苔状細胞-顆粒細胞シナプスが神経活動に依存的なシナプス可塑性をひき起こすことにより興奮と抑制とのバランスがダイナミックに変化するのではないかという仮説をたてた.
苔状細胞-顆粒細胞シナプスにおいて長期の可塑性がひき起こされるかどうか調べるため,ラットの海馬の急性スライス標本を用いて顆粒細胞から全細胞パッチクランプ記録を行い,細胞外の電気刺激により生じる興奮性シナプス後電流を記録した.苔状細胞の軸索は歯状回の分子層のうち顆粒細胞の細胞体に近い最内側部に投射することから,苔状細胞の軸索を選択的に刺激するため分子層の最内側部に刺激電極を設置した.この方法により苔状細胞の軸索を高頻度で刺激したところ,興奮性シナプス後電流の振幅が長時間にわたり増強する長期増強(long-term potentiation:LTP)が観察された.多くのシナプスにおいて長期増強はNMDA受容体を介しひき起こされることが知られているが,この長期増強はNMDA受容体に非依存的であった.さまざまな手法によりさらに解析したところ,この長期増強はシナプス前部における変化によりひき起こされること,すなわち,シナプス前部のグルタミン酸の放出される確率が長期にわたり増強されることがわかった.
これまでの報告から,苔状細胞-顆粒細胞シナプスには神経栄養因子のひとつであるBDNFとその受容体TrkBが豊富に存在することが知られていた.BDNF-TrkBシグナルがさまざまなシナプス可塑性に寄与することはよく知られている5).そこで,苔状細胞-顆粒細胞シナプスの長期増強がBDNF-TrkBシグナルに依存的であるかどうか調べた.その結果,TrkBを薬理学的に阻害すると長期増強は起こらなくなり,BDNFを阻害しても同様に長期増強は起らなかった.逆に,BDNFを苔状細胞-顆粒細胞シナプスに人工的に投与するとシナプス伝達が増強した.この増強は長期増強と同様にシナプス前部における変化により起こることがわかった.TrkBはシナプス前部あるいはシナプス後部のどちらではたらくのかを調べるため,アデノ随伴ウイルスおよびトランスジェニックマウスを用いたCre-loxP系により,シナプス後部に相当する顆粒細胞でのみ特異的にTrkBをノックアウトしたところ.このマウスにおいては高頻度の刺激により長期増強はひき起こされなかった.以上の結果から,BDNFを介したシナプス後部におけるTrkBの活性化が長期増強に必須であることが明らかにされた.
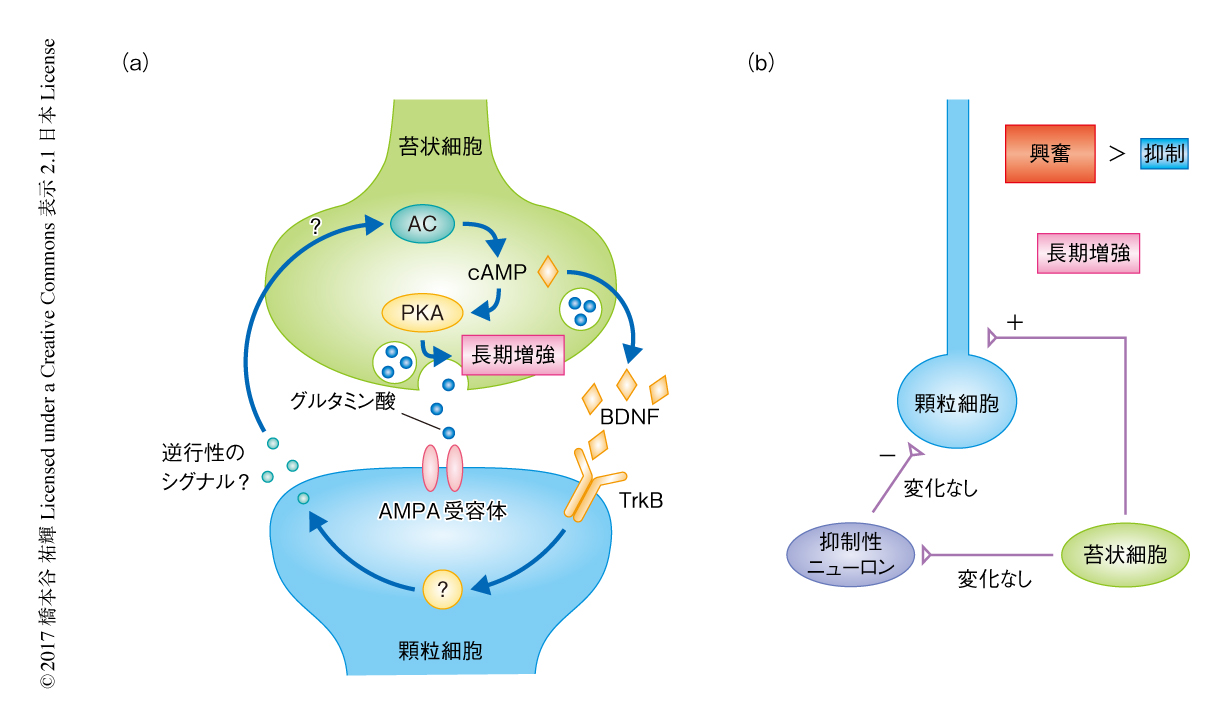
シナプス前性にひき起こされる長期増強の多くはシナプス前部におけるcAMP-プロテインキナーゼAカスケードが必須であることが知られている6).そこで,このカスケードが苔状細胞-顆粒細胞シナプスの長期増強にも必要であるかどうか調べた.その結果,海馬スライスの全体においてプロテインキナーゼAを薬理学的に阻害すると長期増強は起らなくなった.一方,シナプス後部でのみプロテインキナーゼAを阻害した場合には長期増強は正常であった.すなわち,シナプス前部のプロテインキナーゼAが長期増強に必須であることが示唆された.cAMP-プロテインキナーゼAカスケードを直接的に活性化させるため,このカスケードを活性化させるフォルスコリンを投与したところ,BDNFの投与と同様にシナプス伝達が増強し,この増強もやはりシナプス前部における変化が原因であった.そこで,シナプス後部のBDNF-TrkBシグナルとシナプス前部のcAMP-プロテインキナーゼAカスケードがどのように相互作用するのか検証したところ,BDNFの直接的な投与によりみられたシナプス伝達の増強はプロテインキナーゼAの阻害剤の存在のもとでは消失し,さらに,顆粒細胞においてTrkBをノックアウトしてもフォルスコリンの投与によりひき起こされるシナプス伝達の増強は正常に起こった.以上の結果を総合すると,cAMP-プロテインキナーゼAカスケードはBDNF-TrkBシグナルの下流に位置し,苔状細胞-顆粒細胞シナプスにおける長期増強に必須であることが示唆された(図2a).
ここまでのような細胞外の電気刺激により苔状細胞の軸索を刺激する方法では,苔状細胞-顆粒細胞シナプスの応答と抑制性ニューロンを介したフィードフォワード抑制の応答とを同時に記録することは困難であった.この問題を克服するため,光遺伝学的な手法を用いて,苔状細胞の軸索のみをより選択的に刺激する手法を採用した.苔状細胞が対側の海馬の歯状回にも投射することを利用し,チャネルロドプシン-2を発現するアデノ随伴ウイルスを片側の歯状回門に注入し対側の海馬の急性スライス標本を実験に使用した.この手法により,波長473 nmの青色光を照射することでチャネルロドプシン-2を発現する苔状細胞の軸索のみを刺激することに成功した.
膜電位を-60 mVに固定し青色光を照射すると,内向きの興奮性シナプス後電流が生じたのち,外向きの抑制性シナプス後電流が生じる,2相性のシナプス電流が記録された.この応答を解析したところ,興奮性シナプス後電流は苔状細胞から顆粒細胞への直接投射であり,抑制性シナプス後電流は苔状細胞から抑制性ニューロンを介したフィードフォワード抑制であった.直接および間接の2つの神経回路を同時に記録する系が確立されたので,連続的に光を照射することにより長期増強をひき起こした.電気刺激と同様に,はじめに生じる興奮性シナプス後電流(苔状細胞から顆粒細胞への直接投射)では長期増強がひき起こされた.しかし,興奮性シナプス後電流のあとに生じる外向きの抑制性シナプス後電流(フィードフォワード抑制)では変化はなかった.さらに,抑制性ニューロンからパッチクランプして苔状細胞-抑制性ニューロンシナプスの応答を記録したが,同じ高頻度の刺激により長期増強は起こらないことが確認された.以上の結果から,長期増強は苔状細胞-顆粒細胞シナプスに選択的であり,苔状細胞-抑制性ニューロンシナプスにおいては起こらないことがわかった.このことから,長期増強が起こると苔状細胞から顆粒細胞への入力による興奮と抑制とのバランスが変化し,顆粒細胞がより興奮しやすくなることが示唆された(図2b).
この可能性をさらに検証するため,苔状細胞の軸索を電気刺激して顆粒細胞を発火させ,それが長期増強によりどう変化するのか調べた.長期増強の起こるまえは刺激をかなり強くしても顆粒細胞はまったく発火せず,この結果は,苔状細胞のフィードフォワード投射による強い抑制によることがわかった.このような状態から長期増強を起こすと,顆粒細胞は長時間にわたり発火した.このような増強はプロテインキナーゼAの阻害剤やTrkBの阻害剤により長期増強を起こらなくする条件においてはみられなかった.以上の結果から,苔状細胞-顆粒細胞シナプスの長期増強は興奮と抑制とのバランスを変化させ,歯状回からの出力を上昇させることが示唆された.
この研究においてはじめて,これまで知られていなかった苔状細胞-顆粒細胞シナプスの神経活動に依存的な長期のシナプス可塑性が明らかにされた.苔状細胞-顆粒細胞シナプスの長期増強はシナプス後部のBDNF-TrkBシグナルおよびシナプス前部のcAMP-プロテインキナーゼAカスケードを必要とし,シナプス前性にひき起こされることがわかった(図2a).このことから,BDNF-TrkBシグナルの下流においてなんらかの逆行性のシグナルが生じ,それがシナプス前部のcAMP-プロテインキナーゼAカスケードを活性化させることが示唆された.今後,どのような分子が逆行性シグナルとしてはたらくのかを明らかにする必要がある.
これまで問題であった,苔状細胞の発火は顆粒細胞に対し,結果として興奮なのか抑制なのかという議論に関して,この研究は,それがダイナミックに変化しうることを提唱した.すなわち,通常の苔状細胞の神経活動のレベルでは抑制のほうが強く顆粒細胞の発火は抑えられているが,苔状細胞が高い頻度で興奮すると長期増強がひき起こされ抑制と興奮とのバランスが逆転し,顆粒細胞が発火しやすくなる.どのような行動パターンのときに苔状細胞が一過性に高い頻度で興奮するのかは,今後,明らかにすべき課題である.これと関連し,in vivoにおける苔状細胞の生理的なふるまいに関してはこれまでほとんど謎であったが,2017年になり,ようやく3つの独立した研究グループから,苔状細胞の神経活動を行動しているマウスからin vivoにおいて記録した研究が報告された7-9).これらの研究によると,苔状細胞は顆粒細胞に比べ高い頻度で発火しており,複数の場所情報をコードしていることがわかった.さらに,苔状細胞がパターン分離に寄与する可能性も強く示唆された.これらの先行する革新的な研究,および,この研究により,その解剖学的な素性がはっきりしているにもかかわらずこれまで謎めいた存在であった苔状細胞の研究において,2017年は当たり年になったといえる10).今後,さらなる研究の進展により,苔状細胞が歯状回,さらには,海馬における情報処理にはたす役割がますます明らかにされることが期待される.
略歴:2005年 金沢大学大学院医学系研究科博士課程 修了,同年 同 特任研究員,2009年 東京大学大学院医学系研究科 特任研究員,2011年 米国Albert Einstein College of Medicine研究員を経て,2015年より東京大学大学院医学系研究科 助教.
研究テーマ:海馬の局所の神経回路および皮質下からの入力のシナプス可塑性.
抱負:これまで陽のあたらなかったマイナーな神経回路に挑戦して,シナプスの機能を明らかにしていきたい.
© 2017 橋本谷 祐輝 Licensed under CC 表示 2.1 日本
(米国Albert Einstein College of Medicine,Dominick P. Purpura Department of Neuroscience)
email:橋本谷祐輝
DOI: 10.7875/first.author.2017.091
LTP at hilar mossy cell-dentate granule cell synapses modulates dentate gyrus output by increasing excitation/inhibition balance.
Yuki Hashimotodani, Kaoutsar Nasrallah, Kyle R. Jensen, Andrés E. Chávez, Daniel Carrera, Pablo E. Castillo
Neuron, 95, 928-943.e3 (2017)
要 約
海馬の歯状回門に存在する苔状細胞は,歯状回の主要な細胞である顆粒細胞から入力をうけ,出力を返すことにより正のフィードバックループを形成する.苔状細胞はさらに歯状回の抑制性ニューロンにも投射しており,その結果,顆粒細胞に対しフィードフォワード抑制も形成する.こういった苔状細胞と顆粒細胞により形成される歯状回における局所の神経回路が記憶の形成やてんかんにおいて重要な役割をはたす可能性が示唆されてきたが,くわしいことは明らかではない.さらに,神経活動に依存的なシナプス可塑性に関してはほとんど明らかにされていない.この研究において,筆者らは,苔状細胞-顆粒細胞シナプスにおいてシナプス前性にひき起こされる長期増強を見い出した.この長期増強は苔状細胞-顆粒細胞シナプスに選択的に起こり,抑制性ニューロンを介する神経回路においては起らなかった.その結果,苔状細胞からの入力による興奮の割合が上昇して顆粒細胞の発火の頻度が上昇した.以上の結果から,苔状細胞が歯状回における情報処理において重要な役割をはたすことが示唆された.
はじめに
海馬は記憶および学習において重要な脳の領域であり,これまでさかんに研究されてきた.海馬は大きく分けて歯状回,CA3野,CA1野の3つの領域に分かれており,古典的な3シナプス性の神経回路において歯状回は嗅内皮質からの入力をうけたのちCA3野へと出力し,CA3野はCA1野へと出力する(図1).歯状回は嗅内皮質からの入力情報パターンを最初にうけとり,それをCA3野へとスパースな情報パターンとして出力することにより空間認知の弁別(パターン分離)に重要な役割をはたすと考えられている1).歯状回のなかでも主要な細胞である顆粒細胞とよばれる興奮性ニューロンは歯状回の入力および出力を担う.また,歯状回門に位置する苔状細胞は顆粒細胞と同様にグルタミン酸作動性の興奮性ニューロンであり,顆粒細胞から入力をうけとり,ふたたび顆粒細胞へと投射することにより正のフィードバックループを形成する(図1).苔状細胞から顆粒細胞への投射は,同側の海馬の長軸にそった方向に投射するだけでなく,対側の海馬にも投射する.したがって,苔状細胞は非常に広い範囲にわたり顆粒細胞の神経活動を制御すると考えられている2).さらに,苔状細胞は顆粒細胞のほか抑制性ニューロンへも投射する.抑制性ニューロンは顆粒細胞と密にシナプスを形成することから,この抑制性ニューロンを介した苔状細胞の出力は顆粒細胞に対しフィードフォワード抑制を起こす.
このように,苔状細胞と顆粒細胞の形成する神経回路は記憶および学習において重要なはたらきをする可能性が示唆されてきたが3),その役割はほとんどわかっていなかった.さらに,苔状細胞の神経活動が顆粒細胞に対し,結果として興奮(直接投射が優位)なのか抑制(フィードフォワード投射が優位)なのかについても意見の相違があった2).とくに,てんかんの研究において苔状細胞の脱落はフィードフォワード投射を失わせ顆粒細胞における過興奮をひき起こす原因と考えられており,抑制の効果が強調されてきた4).一方で,直接投射の興奮性の入力に関して,その役割はほとんど明らかではなかった.筆者らは,直接投射の苔状細胞-顆粒細胞シナプスが神経活動に依存的なシナプス可塑性をひき起こすことにより興奮と抑制とのバランスがダイナミックに変化するのではないかという仮説をたてた.
1.苔状細胞-顆粒細胞シナプスにおいてシナプス前性の長期増強が起こる
苔状細胞-顆粒細胞シナプスにおいて長期の可塑性がひき起こされるかどうか調べるため,ラットの海馬の急性スライス標本を用いて顆粒細胞から全細胞パッチクランプ記録を行い,細胞外の電気刺激により生じる興奮性シナプス後電流を記録した.苔状細胞の軸索は歯状回の分子層のうち顆粒細胞の細胞体に近い最内側部に投射することから,苔状細胞の軸索を選択的に刺激するため分子層の最内側部に刺激電極を設置した.この方法により苔状細胞の軸索を高頻度で刺激したところ,興奮性シナプス後電流の振幅が長時間にわたり増強する長期増強(long-term potentiation:LTP)が観察された.多くのシナプスにおいて長期増強はNMDA受容体を介しひき起こされることが知られているが,この長期増強はNMDA受容体に非依存的であった.さまざまな手法によりさらに解析したところ,この長期増強はシナプス前部における変化によりひき起こされること,すなわち,シナプス前部のグルタミン酸の放出される確率が長期にわたり増強されることがわかった.
2.苔状細胞-顆粒細胞シナプスの長期増強にはシナプス後部におけるBDNF-TrkBシグナルが必須である
これまでの報告から,苔状細胞-顆粒細胞シナプスには神経栄養因子のひとつであるBDNFとその受容体TrkBが豊富に存在することが知られていた.BDNF-TrkBシグナルがさまざまなシナプス可塑性に寄与することはよく知られている5).そこで,苔状細胞-顆粒細胞シナプスの長期増強がBDNF-TrkBシグナルに依存的であるかどうか調べた.その結果,TrkBを薬理学的に阻害すると長期増強は起こらなくなり,BDNFを阻害しても同様に長期増強は起らなかった.逆に,BDNFを苔状細胞-顆粒細胞シナプスに人工的に投与するとシナプス伝達が増強した.この増強は長期増強と同様にシナプス前部における変化により起こることがわかった.TrkBはシナプス前部あるいはシナプス後部のどちらではたらくのかを調べるため,アデノ随伴ウイルスおよびトランスジェニックマウスを用いたCre-loxP系により,シナプス後部に相当する顆粒細胞でのみ特異的にTrkBをノックアウトしたところ.このマウスにおいては高頻度の刺激により長期増強はひき起こされなかった.以上の結果から,BDNFを介したシナプス後部におけるTrkBの活性化が長期増強に必須であることが明らかにされた.
3.苔状細胞-顆粒細胞シナプスの長期増強にはシナプス前部におけるcAMP-プロテインキナーゼAカスケードが必須である
シナプス前性にひき起こされる長期増強の多くはシナプス前部におけるcAMP-プロテインキナーゼAカスケードが必須であることが知られている6).そこで,このカスケードが苔状細胞-顆粒細胞シナプスの長期増強にも必要であるかどうか調べた.その結果,海馬スライスの全体においてプロテインキナーゼAを薬理学的に阻害すると長期増強は起らなくなった.一方,シナプス後部でのみプロテインキナーゼAを阻害した場合には長期増強は正常であった.すなわち,シナプス前部のプロテインキナーゼAが長期増強に必須であることが示唆された.cAMP-プロテインキナーゼAカスケードを直接的に活性化させるため,このカスケードを活性化させるフォルスコリンを投与したところ,BDNFの投与と同様にシナプス伝達が増強し,この増強もやはりシナプス前部における変化が原因であった.そこで,シナプス後部のBDNF-TrkBシグナルとシナプス前部のcAMP-プロテインキナーゼAカスケードがどのように相互作用するのか検証したところ,BDNFの直接的な投与によりみられたシナプス伝達の増強はプロテインキナーゼAの阻害剤の存在のもとでは消失し,さらに,顆粒細胞においてTrkBをノックアウトしてもフォルスコリンの投与によりひき起こされるシナプス伝達の増強は正常に起こった.以上の結果を総合すると,cAMP-プロテインキナーゼAカスケードはBDNF-TrkBシグナルの下流に位置し,苔状細胞-顆粒細胞シナプスにおける長期増強に必須であることが示唆された(図2a).
4.苔状細胞-顆粒細胞シナプスに選択的な長期増強により顆粒細胞の出力が増大する
ここまでのような細胞外の電気刺激により苔状細胞の軸索を刺激する方法では,苔状細胞-顆粒細胞シナプスの応答と抑制性ニューロンを介したフィードフォワード抑制の応答とを同時に記録することは困難であった.この問題を克服するため,光遺伝学的な手法を用いて,苔状細胞の軸索のみをより選択的に刺激する手法を採用した.苔状細胞が対側の海馬の歯状回にも投射することを利用し,チャネルロドプシン-2を発現するアデノ随伴ウイルスを片側の歯状回門に注入し対側の海馬の急性スライス標本を実験に使用した.この手法により,波長473 nmの青色光を照射することでチャネルロドプシン-2を発現する苔状細胞の軸索のみを刺激することに成功した.
膜電位を-60 mVに固定し青色光を照射すると,内向きの興奮性シナプス後電流が生じたのち,外向きの抑制性シナプス後電流が生じる,2相性のシナプス電流が記録された.この応答を解析したところ,興奮性シナプス後電流は苔状細胞から顆粒細胞への直接投射であり,抑制性シナプス後電流は苔状細胞から抑制性ニューロンを介したフィードフォワード抑制であった.直接および間接の2つの神経回路を同時に記録する系が確立されたので,連続的に光を照射することにより長期増強をひき起こした.電気刺激と同様に,はじめに生じる興奮性シナプス後電流(苔状細胞から顆粒細胞への直接投射)では長期増強がひき起こされた.しかし,興奮性シナプス後電流のあとに生じる外向きの抑制性シナプス後電流(フィードフォワード抑制)では変化はなかった.さらに,抑制性ニューロンからパッチクランプして苔状細胞-抑制性ニューロンシナプスの応答を記録したが,同じ高頻度の刺激により長期増強は起こらないことが確認された.以上の結果から,長期増強は苔状細胞-顆粒細胞シナプスに選択的であり,苔状細胞-抑制性ニューロンシナプスにおいては起こらないことがわかった.このことから,長期増強が起こると苔状細胞から顆粒細胞への入力による興奮と抑制とのバランスが変化し,顆粒細胞がより興奮しやすくなることが示唆された(図2b).
この可能性をさらに検証するため,苔状細胞の軸索を電気刺激して顆粒細胞を発火させ,それが長期増強によりどう変化するのか調べた.長期増強の起こるまえは刺激をかなり強くしても顆粒細胞はまったく発火せず,この結果は,苔状細胞のフィードフォワード投射による強い抑制によることがわかった.このような状態から長期増強を起こすと,顆粒細胞は長時間にわたり発火した.このような増強はプロテインキナーゼAの阻害剤やTrkBの阻害剤により長期増強を起こらなくする条件においてはみられなかった.以上の結果から,苔状細胞-顆粒細胞シナプスの長期増強は興奮と抑制とのバランスを変化させ,歯状回からの出力を上昇させることが示唆された.
おわりに
この研究においてはじめて,これまで知られていなかった苔状細胞-顆粒細胞シナプスの神経活動に依存的な長期のシナプス可塑性が明らかにされた.苔状細胞-顆粒細胞シナプスの長期増強はシナプス後部のBDNF-TrkBシグナルおよびシナプス前部のcAMP-プロテインキナーゼAカスケードを必要とし,シナプス前性にひき起こされることがわかった(図2a).このことから,BDNF-TrkBシグナルの下流においてなんらかの逆行性のシグナルが生じ,それがシナプス前部のcAMP-プロテインキナーゼAカスケードを活性化させることが示唆された.今後,どのような分子が逆行性シグナルとしてはたらくのかを明らかにする必要がある.
これまで問題であった,苔状細胞の発火は顆粒細胞に対し,結果として興奮なのか抑制なのかという議論に関して,この研究は,それがダイナミックに変化しうることを提唱した.すなわち,通常の苔状細胞の神経活動のレベルでは抑制のほうが強く顆粒細胞の発火は抑えられているが,苔状細胞が高い頻度で興奮すると長期増強がひき起こされ抑制と興奮とのバランスが逆転し,顆粒細胞が発火しやすくなる.どのような行動パターンのときに苔状細胞が一過性に高い頻度で興奮するのかは,今後,明らかにすべき課題である.これと関連し,in vivoにおける苔状細胞の生理的なふるまいに関してはこれまでほとんど謎であったが,2017年になり,ようやく3つの独立した研究グループから,苔状細胞の神経活動を行動しているマウスからin vivoにおいて記録した研究が報告された7-9).これらの研究によると,苔状細胞は顆粒細胞に比べ高い頻度で発火しており,複数の場所情報をコードしていることがわかった.さらに,苔状細胞がパターン分離に寄与する可能性も強く示唆された.これらの先行する革新的な研究,および,この研究により,その解剖学的な素性がはっきりしているにもかかわらずこれまで謎めいた存在であった苔状細胞の研究において,2017年は当たり年になったといえる10).今後,さらなる研究の進展により,苔状細胞が歯状回,さらには,海馬における情報処理にはたす役割がますます明らかにされることが期待される.
文 献
- Jung, M. W. & McNaughton, B. L.: Spatial selectivity of unit activity in the hippocampal granular layer. Hippocampus, 3, 165-182 (1993)[PubMed]
- Scharfman, H. E. & Myers, C. E.: Hilar mossy cells of the dentate gyrus: a historical perspective. Front. Neural Circuits, 6, 106 (2012)[PubMed]
- Buckmaster, P. S. & Schwartzkroin, P. A.: Hippocampal mossy cell function: a speculative view. Hippocampus, 4, 393-402 (1994)[PubMed]
- Jinde, S., Zsiros, V. & Nakazawa, K.: Hilar mossy cell circuitry controlling dentate granule cell excitability. Front. Neural Circuits, 7, 14 (2013)[PubMed]
- Park, H. & Poo, M. M.: Neurotrophin regulation of neural circuit development and function. Nat. Rev. Neurosci., 14, 7-23 (2013)[PubMed]
- Castillo, P. E.: Presynaptic LTP and LTD of excitatory and inhibitory synapses. Cold Spring Harb. Perspect. Biol., 4, a005728 (2012)[PubMed]
- Senzai, Y. & Buzsaki, G.: Physiological properties and behavioral correlates of hippocampal granule cells and mossy cells. Neuron, 93, 691-704.e5 (2017)[PubMed]
- Danielson, N. B., Turi, G. F., Ladow, M. et al.: In vivo imaging of dentate gyrus mossy cells in behaving mice. Neuron, 93, 552-559.e4 (2017)[PubMed]
- GoodSmith, D., Chen, X., Wang, C. et al.: Spatial representations of granule cells and mossy cells of the dentate gyrus. Neuron, 93, 677-690.e5 (2017)[PubMed]
- Milstein, A. D. & Soltesz, I.: Hippocampal dentate mossy cells improve their CV and Trk into the limelight. Neuron, 95, 732-734 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 金沢大学大学院医学系研究科博士課程 修了,同年 同 特任研究員,2009年 東京大学大学院医学系研究科 特任研究員,2011年 米国Albert Einstein College of Medicine研究員を経て,2015年より東京大学大学院医学系研究科 助教.
研究テーマ:海馬の局所の神経回路および皮質下からの入力のシナプス可塑性.
抱負:これまで陽のあたらなかったマイナーな神経回路に挑戦して,シナプスの機能を明らかにしていきたい.
© 2017 橋本谷 祐輝 Licensed under CC 表示 2.1 日本