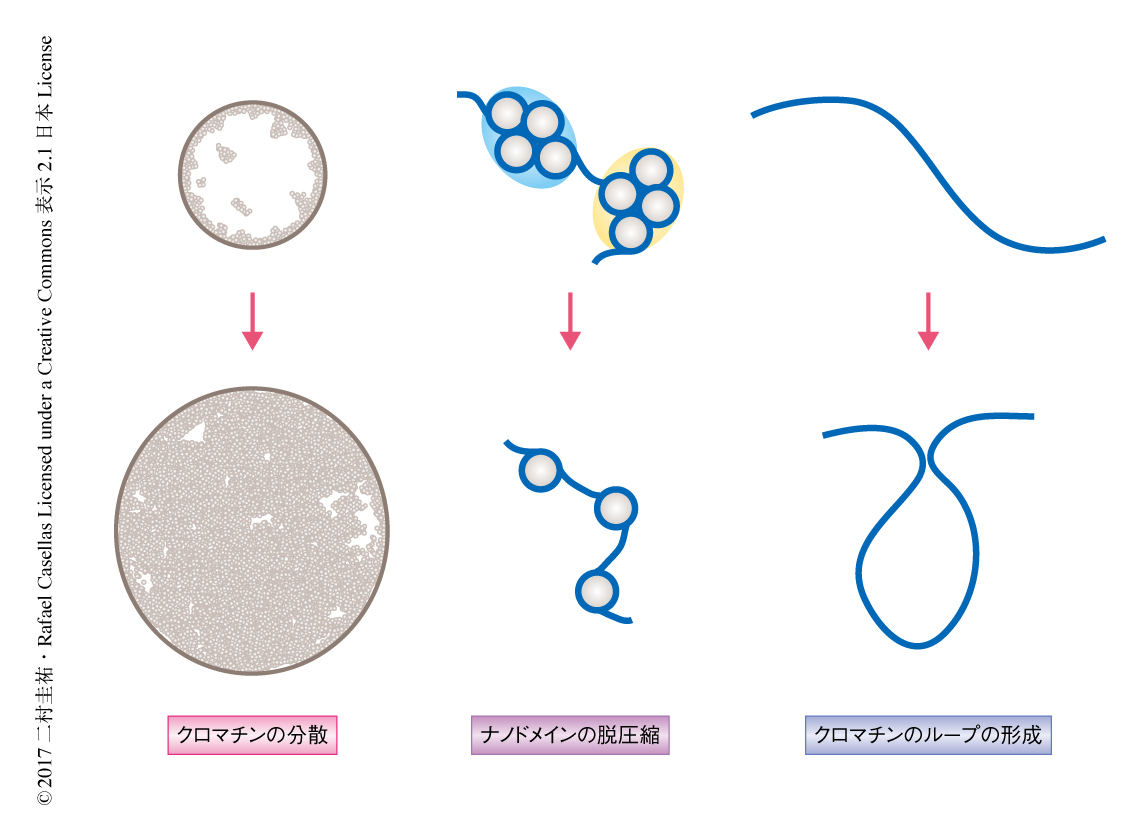
静止期のB細胞が活性化する過程におけるクロマチン構造の変化
二村圭祐・Rafael Casellas
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Lymphocyte Nuclear Biology)
email:二村圭祐
DOI: 10.7875/first.author.2017.089
Myc regulates chromatin decompaction and nuclear architecture during B cell activation.
Kyong-Rim Kieffer-Kwon, Keisuke Nimura, Suhas S. P. Rao, Jianliang Xu, Seolkyoung Jung, Aleksandra Pekowska, Marei Dose, Evan Stevens, Ewy Mathe, Peng Dong, Su-Chen Huang, Maria Aurelia Ricci, Laura Baranello, Ying Zheng, Francesco Tomassoni Ardori, Wolfgang Resch, Diana Stavreva, Steevenson Nelson, Michael McAndrew, Adriel Casellas, Elizabeth Finn, Charles Gregory, Brian Glenn St. Hilaire, Steven M. Johnson, Wendy Dubois, Maria Pia Cosma, Eric Batchelor, David Levens, Robert D. Phair, Tom Misteli, Lino Tessarollo, Gordon Hager, Melike Lakadamyali, Zhe Liu, Monique Floer, Hari Shroff, Erez Lieberman Aiden, Rafael Casellas
Molecular Cell, 67, 566-578.e10 (2017)
約50年前,白血球の活性化によりクロマチンが高度にアセチル化されることが見い出されたが,これまでに,このようなエピジェネティックな変化をひき起こす分子機構については明らかにされていない.この研究において,筆者らは,静止期のB細胞の活性化の過程において,クロマチンは3つの段階をへて脱凝集することを明らかにした.1)静止期のB細胞においてクロマチンは核膜の付近に存在するが,ヒストンのアセチル化にともない核の内部へと移動する.2)MycおよびATPの増加によりナノドメインとよばれるヒストンのクラスターがひとつずつのヌクレオソームにまで脱圧縮する.このとき,転写因子のDNAとの結合時間が低下することが見い出された.3)静止期のB細胞における長距離のクロマチンのあいだの結合は短距離のクロマチンのあいだの結合へと移行する.このクロマチン構造の変化により,ゲノムの制御領域どうしが近接する.これらの結果から,クロマチンの脱凝集が転写におよぼす影響,および,核のトポロジーの構築におけるMycの新規な機能が明らかにされた.
発生の過程において細胞の分化が進行するには,特定の遺伝子の発現をエピジェネティックに制御することが必要である.たとえば,幹細胞を三胚葉に分化させることにより未分化の維持に必要な遺伝子の発現が抑制される.このような分化の過程と比較して,B細胞がプラズマ細胞へと最終分化する過程は独特であり,個々の遺伝子の発現が上下するだけでなく,静止期のB細胞が細胞周期に移行するときに全体の遺伝子発現が上昇する1-3).この転写の増幅はRNAポリメラーゼIIの急速な結合により起こる.RNAポリメラーゼIIは静止期のB細胞においてすでに,免疫応答の際に活性化される遺伝子プロモーターと結合している.しかし,静止期のB細胞においてはMycやTFIIHの量が少ないためRNAポリメラーゼIIの活性は低い1,3).一方,B細胞が活性化すると,24時間以内にMycやTFIIHは約10倍に増加し転写は急激に亢進する.
リンパ球が活性化する過程においてクロマチンに劇的な変化の起こることは,ex vivoにおいてヒトのリンパ球にスーパー抗原を曝露する実験において見い出され,1960年代から1970年代にかけてはじめて報告された.これらの実験から,細胞の大きさ,RNAの合成,細胞の増殖が増加することが示された.さらに,白血球を活性化するとヒストンがアセチル化され,遺伝子の発現が上昇することが見い出された4).最近の塩基配列の決定や顕微鏡を用いた研究により,ヒストンのアセチル化の増加とクロマチン構造の変化がリンパ球への刺激により生じることが明らかにされた1,5).しかし,このような変化をひき起こす分子機構,および,遺伝子の発現におよぼす影響については不明であった.
B細胞の活性化の際に起こるヒストンのアセチル化の増加はエピジェネティックな修飾の全体の変化にともなうのかどうかを明らかにするため,34個のヒストン修飾,ヒストンバリアントH2AZ,CpGメチル化の変化を静止期のB細胞と活性化の24時間後のB細胞を用いて比較した.その結果,エピジェネティックな修飾の70%が1.5倍以上も変化し,とくに,ユークロマチンにおいて顕著であった.もっとも増加したのはヒストンH4のLys16のアセチル化で5.8倍に増加した.一方,低下したのはヒストンH3のLys9のジメチル化およびトリメチル化だけであり,これらは転写の抑制に関与することが明らかにされていた.これらの結果から,B細胞の活性化は転写の活性化につながるヒストンのアセチル化やヒストンのメチル化を増加させ,転写の抑制に関与するヒストンのメチル化を減少させることがわかった.
エピジェネティックな修飾の増加はクロマチン修飾タンパク質の結合の増加により起こる可能性がある.しかし,B細胞の活性化はヒストンアセチル化酵素であるp300やGCN5のクロマチンへの結合には影響しなかった.一方,ヒストン脱アセチル化酵素であるHDAC1はB細胞の活性化により顕著に減少した.HDAC1はB細胞の活性化に重要な役割を担うことが知られている6).ヒストン脱アセチル化酵素が静止期のB細胞においてヒストンのアセチル化の抑制に関与するのかどうかを確かめるため,ヒストン脱アセチル化酵素の阻害剤であるトリコスタチンAやHDAC1の特異的な阻害剤を添加したところ,ヒストン脱アセチル化酵素の阻害により静止期のB細胞においてヒストンのアセチル化が増加した.したがって,ヒストン脱アセチル化酵素が静止期のB細胞においてヒストンアセチル化酵素の活性を抑制すること,また,ヒストン脱アセチル化酵素の阻害によりB細胞は活性化することなくヒストンのアセチル化が亢進することがわかった.
クロマチンの脱凝集がヌクレオソームの構造におよぼす影響を可視化するため,超高解像度顕微鏡法のひとつであり20 nmの分解能をもつSTORM(stochastic optical reconstruction microscopy)によりヒストンを観察した.その結果,静止期のB細胞においてヒストンH2Bは核膜の近傍に集積し中央部には少なかったが,活性化したB細胞においてヒストンH2Bは均一に分布しており,B細胞の活性化によりクロマチン構造の劇的な再配置の起こることがわかった.さらに,ヒトの線維芽細胞やES細胞と同じように7),B細胞のヌクレオソームもナノドメインとよばれるヒストンのクラスターを形成していた.そして,B細胞の活性化によりナノドメインあたりのヌクレオソームの数が4つから1つに減少すると推定された.したがって,B細胞の活性化にともないヌクレオソームの構造が脱凝集することがわかった.また,これらの結果は,MNase-seq法により確認されたユークロマチンおよびヘテロクロマチンにおいて脱凝集が起こるという結果と一致した.
ヒストンのアセチル化がナノドメインの脱圧縮を制御するのかどうか明らかにするため,静止期のB細胞にトリコスタチンAを処理した.その結果,トリコスタチンAは静止期のB細胞においてクロマチンを分散させたが,ナノドメインの脱圧縮には影響しなかった.この結果から,ヒストンのアセチル化はB細胞の活性化の際のクロマチンの分散に重要であることがわかった.
がん原遺伝子産物であるMycはB細胞の細胞周期への移行において重要である3,8).Mycがヌクレオソームの脱凝集にも関与するのかどうか確かめるため,Mycを欠損した静止期のB細胞を作製した.これまでの報告と一致して3),このMyc欠損B細胞は大きくならずRNAの合成も亢進されなかった.しかし,ヒストンH3のLys27のアセチル化のレベルはMyc欠損B細胞と野生型のB細胞とで同様であった.このことから,MycはB細胞の活性化においてヒストンのアセチル化には関与しないことが示された.また,Mycの欠損によりクロマチンの分散は影響されなかったが,ナノドメインの脱圧縮は障害された.
B細胞の活性化においてMycはATP合成を上昇させる9).ATPの増加がクロマチンの脱凝集に関与するかどうか調べるため,オリゴマイシンを処理することにより活性化B細胞からATPを急速に除いた.その結果,クロマチンの分散はオリゴマイシンの処理により変化しなかったが,ナノドメインの脱圧縮は部分的に阻害された.これらの結果から,クロマチンの分散と脱凝集は別々に制御されており,クロマチンの分散はヒストンのアセチル化,クロマチンの脱凝集はMycおよびATPの増加を必要とすることがわかった.
クロマチンの脱凝集は転写因子のDNAへの結合を促進することにより転写に影響をおよぼすと考えられている10).ナノドメインの脱圧縮がこの過程におよぼす影響について調べるため,CRISPR-Cas9を用いたゲノム編集により2つの転写因子JunDおよびCTCFのC末端側にHaloタグをノックインし,活性化したB細胞においてこれら転写因子のダイナミクスを1分子追跡法により観察した.その結果,静止期のB細胞においてJunDはクロマチンに安定的に結合するまでに必要な時間が活性化したB細胞よりも長かった.同様に,CTCFがクロマチンに結合するまでに必要な時間も静止期のB細胞のほうが長かった.この変化の機序について調べたところ,転写因子の結合部位の探索に要する時間はクロマチンの分散よりもヌクレオソームの凝集に影響されることがわかった.
このヌクレオソームの凝集が転写因子のDNAとの結合時間に影響するかどうかを確かめるため,JunDのダイナミクスを解析した.静止期のB細胞においてJunDのDNAとの結合時間は24秒だったが,活性化したB細胞においては9秒に短縮した.Mycの欠損やATPの減少によりJunDのDNAとの結合時間は部分的に静止期のB細胞と同じレベルになったが,トリコスタチンAの処理は影響しなかった.
1分子追跡法は数分の単位の時間は測定できないため,CTCFのDNAとの結合時間をFRAP(fluorescence recovery after photobleaching,光退色後蛍光回復)法により測定した.その結果,JunDと同様に,CTCFのDNAとの結合時間はB細胞の活性化により53分から27分に低下した.また,CTCFのクロマチンへの結合はMycやATPに影響されたが,トリコスタチンAは無関係であった.したがって,ヌクレオソームの凝集が転写因子のダイナミクスに影響することがわかった.
B細胞の活性化した際に核の構造が変化しているかどうかをin situ Hi-C法により解析した.Hi-C法とは,3C(chromosome conformation capture)法を応用した手法で,in vivoにおいてゲノムのあいだの結合を網羅的に調べることができる.その結果,核の体積が小さいためかクロマチンの柔軟性が低いためかわからないが,静止期のB細胞においては長距離のクロマチンのあいだの結合が多かった.一方,活性化したB細胞において短距離のクロマチンのあいだの結合が増加した.したがって,B細胞の活性化により長距離のクロマチンのあいだの結合から短距離のクロマチンのあいだの結合に移行することがわかった.
クロマチンのループの形成にはそのアンカーの部分にCTCFやコヒーシンの結合が必要である.実際に,コヒーシンの構成タンパク質であるRad21のクロマチンへの結合はB細胞の活性化にともない全体的に増加した.また,クロマチンのループの形成が増強されるゲノムの領域において遺伝子の発現は高かった.
核の構造を形成する機序は,クロマチン構造を形成するタンパク質によるもののほかには知られていない.クロマチンの脱凝集によりクロマチン構造が制御されるのかどうか検討した.静止期のB細胞に対するトリコスタチンAの処理はヒストンのアセチル化を増加させたにもかかわらず,長距離のクロマチンのあいだの結合は変化しなかった.一方,活性化したB細胞からMycを欠損あるいはATPを減少させると,長距離のクロマチンのあいだの結合から短距離のクロマチンのあいだの結合への移行はみられなかった.したがって,この移行にはMycおよびATPが必要であることがわかった.
この研究により,クロマチンの脱凝集は少なくとも3つの機構によりB細胞において転写の増幅を促進することが明らかにされた(図1).第1に,染色体を核膜の近傍から核の中心部へ移動させ,核膜の付近に存在する核マトリックスによる転写の抑制から回避させる.第2に,ヒストンのナノドメインの脱圧縮は転写因子のクロマチンへのアクセスを亢進する.第3に,クロマチンのループを増加させその結合を増強することは,ゲノムの制御領域どうしを近接させる.また,これらのクロマチン構造の変化はMycにより支配される.したがって,Mycは免疫応答における転写の増幅のマスタータンパク質として機能する.しかし,Mycがどのようにクロマチンの構造を制御しているかは不明であり,クロマチン構造の制御におけるMycの機能を明らかにすることがつぎの課題である.
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同 助教,同 准教授,2014年 米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases博士研究員を経て,大阪大学大学院医学系研究科 准教授.
研究テーマ:遺伝子発現の制御の機構.
抱負:つねに新しいことに挑戦していきたい.
Rafael Casellas
米国NIH National Institute of Arthritis and Musculoskeletal and Skin DiseasesにてSenior Investigator.
研究室URL:http://casellaslab.github.io/
? 2017 二村圭祐・Rafael Casellas Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Lymphocyte Nuclear Biology)
email:二村圭祐
DOI: 10.7875/first.author.2017.089
Myc regulates chromatin decompaction and nuclear architecture during B cell activation.
Kyong-Rim Kieffer-Kwon, Keisuke Nimura, Suhas S. P. Rao, Jianliang Xu, Seolkyoung Jung, Aleksandra Pekowska, Marei Dose, Evan Stevens, Ewy Mathe, Peng Dong, Su-Chen Huang, Maria Aurelia Ricci, Laura Baranello, Ying Zheng, Francesco Tomassoni Ardori, Wolfgang Resch, Diana Stavreva, Steevenson Nelson, Michael McAndrew, Adriel Casellas, Elizabeth Finn, Charles Gregory, Brian Glenn St. Hilaire, Steven M. Johnson, Wendy Dubois, Maria Pia Cosma, Eric Batchelor, David Levens, Robert D. Phair, Tom Misteli, Lino Tessarollo, Gordon Hager, Melike Lakadamyali, Zhe Liu, Monique Floer, Hari Shroff, Erez Lieberman Aiden, Rafael Casellas
Molecular Cell, 67, 566-578.e10 (2017)
要 約
約50年前,白血球の活性化によりクロマチンが高度にアセチル化されることが見い出されたが,これまでに,このようなエピジェネティックな変化をひき起こす分子機構については明らかにされていない.この研究において,筆者らは,静止期のB細胞の活性化の過程において,クロマチンは3つの段階をへて脱凝集することを明らかにした.1)静止期のB細胞においてクロマチンは核膜の付近に存在するが,ヒストンのアセチル化にともない核の内部へと移動する.2)MycおよびATPの増加によりナノドメインとよばれるヒストンのクラスターがひとつずつのヌクレオソームにまで脱圧縮する.このとき,転写因子のDNAとの結合時間が低下することが見い出された.3)静止期のB細胞における長距離のクロマチンのあいだの結合は短距離のクロマチンのあいだの結合へと移行する.このクロマチン構造の変化により,ゲノムの制御領域どうしが近接する.これらの結果から,クロマチンの脱凝集が転写におよぼす影響,および,核のトポロジーの構築におけるMycの新規な機能が明らかにされた.
はじめに
発生の過程において細胞の分化が進行するには,特定の遺伝子の発現をエピジェネティックに制御することが必要である.たとえば,幹細胞を三胚葉に分化させることにより未分化の維持に必要な遺伝子の発現が抑制される.このような分化の過程と比較して,B細胞がプラズマ細胞へと最終分化する過程は独特であり,個々の遺伝子の発現が上下するだけでなく,静止期のB細胞が細胞周期に移行するときに全体の遺伝子発現が上昇する1-3).この転写の増幅はRNAポリメラーゼIIの急速な結合により起こる.RNAポリメラーゼIIは静止期のB細胞においてすでに,免疫応答の際に活性化される遺伝子プロモーターと結合している.しかし,静止期のB細胞においてはMycやTFIIHの量が少ないためRNAポリメラーゼIIの活性は低い1,3).一方,B細胞が活性化すると,24時間以内にMycやTFIIHは約10倍に増加し転写は急激に亢進する.
リンパ球が活性化する過程においてクロマチンに劇的な変化の起こることは,ex vivoにおいてヒトのリンパ球にスーパー抗原を曝露する実験において見い出され,1960年代から1970年代にかけてはじめて報告された.これらの実験から,細胞の大きさ,RNAの合成,細胞の増殖が増加することが示された.さらに,白血球を活性化するとヒストンがアセチル化され,遺伝子の発現が上昇することが見い出された4).最近の塩基配列の決定や顕微鏡を用いた研究により,ヒストンのアセチル化の増加とクロマチン構造の変化がリンパ球への刺激により生じることが明らかにされた1,5).しかし,このような変化をひき起こす分子機構,および,遺伝子の発現におよぼす影響については不明であった.
1.B細胞の活性化の過程におけるエピジェネティックな修飾の増加
B細胞の活性化の際に起こるヒストンのアセチル化の増加はエピジェネティックな修飾の全体の変化にともなうのかどうかを明らかにするため,34個のヒストン修飾,ヒストンバリアントH2AZ,CpGメチル化の変化を静止期のB細胞と活性化の24時間後のB細胞を用いて比較した.その結果,エピジェネティックな修飾の70%が1.5倍以上も変化し,とくに,ユークロマチンにおいて顕著であった.もっとも増加したのはヒストンH4のLys16のアセチル化で5.8倍に増加した.一方,低下したのはヒストンH3のLys9のジメチル化およびトリメチル化だけであり,これらは転写の抑制に関与することが明らかにされていた.これらの結果から,B細胞の活性化は転写の活性化につながるヒストンのアセチル化やヒストンのメチル化を増加させ,転写の抑制に関与するヒストンのメチル化を減少させることがわかった.
エピジェネティックな修飾の増加はクロマチン修飾タンパク質の結合の増加により起こる可能性がある.しかし,B細胞の活性化はヒストンアセチル化酵素であるp300やGCN5のクロマチンへの結合には影響しなかった.一方,ヒストン脱アセチル化酵素であるHDAC1はB細胞の活性化により顕著に減少した.HDAC1はB細胞の活性化に重要な役割を担うことが知られている6).ヒストン脱アセチル化酵素が静止期のB細胞においてヒストンのアセチル化の抑制に関与するのかどうかを確かめるため,ヒストン脱アセチル化酵素の阻害剤であるトリコスタチンAやHDAC1の特異的な阻害剤を添加したところ,ヒストン脱アセチル化酵素の阻害により静止期のB細胞においてヒストンのアセチル化が増加した.したがって,ヒストン脱アセチル化酵素が静止期のB細胞においてヒストンアセチル化酵素の活性を抑制すること,また,ヒストン脱アセチル化酵素の阻害によりB細胞は活性化することなくヒストンのアセチル化が亢進することがわかった.
2.クロマチンの脱凝集はクロマチンの分散およびナノドメインの脱圧縮により起こる
クロマチンの脱凝集がヌクレオソームの構造におよぼす影響を可視化するため,超高解像度顕微鏡法のひとつであり20 nmの分解能をもつSTORM(stochastic optical reconstruction microscopy)によりヒストンを観察した.その結果,静止期のB細胞においてヒストンH2Bは核膜の近傍に集積し中央部には少なかったが,活性化したB細胞においてヒストンH2Bは均一に分布しており,B細胞の活性化によりクロマチン構造の劇的な再配置の起こることがわかった.さらに,ヒトの線維芽細胞やES細胞と同じように7),B細胞のヌクレオソームもナノドメインとよばれるヒストンのクラスターを形成していた.そして,B細胞の活性化によりナノドメインあたりのヌクレオソームの数が4つから1つに減少すると推定された.したがって,B細胞の活性化にともないヌクレオソームの構造が脱凝集することがわかった.また,これらの結果は,MNase-seq法により確認されたユークロマチンおよびヘテロクロマチンにおいて脱凝集が起こるという結果と一致した.
3.クロマチンの分散にはヒストンのアセチル化の増加が必要でありナノドメインの脱圧縮にはMycおよびATPの増加が必要である
ヒストンのアセチル化がナノドメインの脱圧縮を制御するのかどうか明らかにするため,静止期のB細胞にトリコスタチンAを処理した.その結果,トリコスタチンAは静止期のB細胞においてクロマチンを分散させたが,ナノドメインの脱圧縮には影響しなかった.この結果から,ヒストンのアセチル化はB細胞の活性化の際のクロマチンの分散に重要であることがわかった.
がん原遺伝子産物であるMycはB細胞の細胞周期への移行において重要である3,8).Mycがヌクレオソームの脱凝集にも関与するのかどうか確かめるため,Mycを欠損した静止期のB細胞を作製した.これまでの報告と一致して3),このMyc欠損B細胞は大きくならずRNAの合成も亢進されなかった.しかし,ヒストンH3のLys27のアセチル化のレベルはMyc欠損B細胞と野生型のB細胞とで同様であった.このことから,MycはB細胞の活性化においてヒストンのアセチル化には関与しないことが示された.また,Mycの欠損によりクロマチンの分散は影響されなかったが,ナノドメインの脱圧縮は障害された.
B細胞の活性化においてMycはATP合成を上昇させる9).ATPの増加がクロマチンの脱凝集に関与するかどうか調べるため,オリゴマイシンを処理することにより活性化B細胞からATPを急速に除いた.その結果,クロマチンの分散はオリゴマイシンの処理により変化しなかったが,ナノドメインの脱圧縮は部分的に阻害された.これらの結果から,クロマチンの分散と脱凝集は別々に制御されており,クロマチンの分散はヒストンのアセチル化,クロマチンの脱凝集はMycおよびATPの増加を必要とすることがわかった.
4.ナノドメインの脱圧縮は転写因子の探索時間を低下させる
クロマチンの脱凝集は転写因子のDNAへの結合を促進することにより転写に影響をおよぼすと考えられている10).ナノドメインの脱圧縮がこの過程におよぼす影響について調べるため,CRISPR-Cas9を用いたゲノム編集により2つの転写因子JunDおよびCTCFのC末端側にHaloタグをノックインし,活性化したB細胞においてこれら転写因子のダイナミクスを1分子追跡法により観察した.その結果,静止期のB細胞においてJunDはクロマチンに安定的に結合するまでに必要な時間が活性化したB細胞よりも長かった.同様に,CTCFがクロマチンに結合するまでに必要な時間も静止期のB細胞のほうが長かった.この変化の機序について調べたところ,転写因子の結合部位の探索に要する時間はクロマチンの分散よりもヌクレオソームの凝集に影響されることがわかった.
このヌクレオソームの凝集が転写因子のDNAとの結合時間に影響するかどうかを確かめるため,JunDのダイナミクスを解析した.静止期のB細胞においてJunDのDNAとの結合時間は24秒だったが,活性化したB細胞においては9秒に短縮した.Mycの欠損やATPの減少によりJunDのDNAとの結合時間は部分的に静止期のB細胞と同じレベルになったが,トリコスタチンAの処理は影響しなかった.
1分子追跡法は数分の単位の時間は測定できないため,CTCFのDNAとの結合時間をFRAP(fluorescence recovery after photobleaching,光退色後蛍光回復)法により測定した.その結果,JunDと同様に,CTCFのDNAとの結合時間はB細胞の活性化により53分から27分に低下した.また,CTCFのクロマチンへの結合はMycやATPに影響されたが,トリコスタチンAは無関係であった.したがって,ヌクレオソームの凝集が転写因子のダイナミクスに影響することがわかった.
5.活性化したB細胞は遺伝子の発現を促進するようなクロマチン構造を形成する
B細胞の活性化した際に核の構造が変化しているかどうかをin situ Hi-C法により解析した.Hi-C法とは,3C(chromosome conformation capture)法を応用した手法で,in vivoにおいてゲノムのあいだの結合を網羅的に調べることができる.その結果,核の体積が小さいためかクロマチンの柔軟性が低いためかわからないが,静止期のB細胞においては長距離のクロマチンのあいだの結合が多かった.一方,活性化したB細胞において短距離のクロマチンのあいだの結合が増加した.したがって,B細胞の活性化により長距離のクロマチンのあいだの結合から短距離のクロマチンのあいだの結合に移行することがわかった.
クロマチンのループの形成にはそのアンカーの部分にCTCFやコヒーシンの結合が必要である.実際に,コヒーシンの構成タンパク質であるRad21のクロマチンへの結合はB細胞の活性化にともない全体的に増加した.また,クロマチンのループの形成が増強されるゲノムの領域において遺伝子の発現は高かった.
核の構造を形成する機序は,クロマチン構造を形成するタンパク質によるもののほかには知られていない.クロマチンの脱凝集によりクロマチン構造が制御されるのかどうか検討した.静止期のB細胞に対するトリコスタチンAの処理はヒストンのアセチル化を増加させたにもかかわらず,長距離のクロマチンのあいだの結合は変化しなかった.一方,活性化したB細胞からMycを欠損あるいはATPを減少させると,長距離のクロマチンのあいだの結合から短距離のクロマチンのあいだの結合への移行はみられなかった.したがって,この移行にはMycおよびATPが必要であることがわかった.
おわりに
この研究により,クロマチンの脱凝集は少なくとも3つの機構によりB細胞において転写の増幅を促進することが明らかにされた(図1).第1に,染色体を核膜の近傍から核の中心部へ移動させ,核膜の付近に存在する核マトリックスによる転写の抑制から回避させる.第2に,ヒストンのナノドメインの脱圧縮は転写因子のクロマチンへのアクセスを亢進する.第3に,クロマチンのループを増加させその結合を増強することは,ゲノムの制御領域どうしを近接させる.また,これらのクロマチン構造の変化はMycにより支配される.したがって,Mycは免疫応答における転写の増幅のマスタータンパク質として機能する.しかし,Mycがどのようにクロマチンの構造を制御しているかは不明であり,クロマチン構造の制御におけるMycの機能を明らかにすることがつぎの課題である.
文 献
- Kouzine, F., Wojtowicz, D., Yamane, A. et al.: Global regulation of promoter melting in naive lymphocytes. Cell, 153, 988-999 (2013)[PubMed]
- Loven, J., Orlando, D. A., Sigova, A. A. et al.: Revisiting global gene expression analysis. Cell, 151, 476-482 (2012)[PubMed]
- Nie, Z., Hu, G., Wei, G. et al.: c-Myc is a universal amplifier of expressed genes in lymphocytes and embryonic stem cells. Cell, 151, 68-79 (2012)[PubMed]
- Pogo, B. G., Allfrey, V. G. & Mirsky, A. E.: RNA synthesis and histone acetylation during the course of gene activation in lymphocytes. Proc. Natl. Acad. Sci. USA, 55, 805-812 (1966)[PubMed]
- Rawlings, J. S., Gatzka, M., Thomas, P. G. et al.: Chromatin condensation via the condensin II complex is required for peripheral T-cell quiescence. EMBO J., 30, 263-276 (2011)[PubMed]
- Yamaguchi, T., Cubizolles, F., Zhang, Y. et al.: Histone deacetylases 1 and 2 act in concert to promote the G1-to-S progression. Genes Dev., 24, 455-469 (2010)[PubMed]
- Ricci, M. A., Manzo, C., Garcia-Parajo, M. F. et al.: Chromatin fibers are formed by heterogeneous groups of nucleosomes in vivo. Cell, 160, 1145-1158 (2015)[PubMed]
- Lin, C. Y., Loven, J., Rahl, P. B. et al.: Transcriptional amplification in tumor cells with elevated c-Myc. Cell, 151, 56-67 (2012)[PubMed]
- Wang, R., Dillon, C. P., Shi, L. Z. et al.: The transcription factor Myc controls metabolic reprogramming upon T lymphocyte activation. Immunity, 35, 871-882 (2011)[PubMed]
- Chen, J., Zhang, Z., Li, L. et al.: Single-molecule dynamics of enhanceosome assembly in embryonic stem cells. Cell, 156, 1274-1285 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同 助教,同 准教授,2014年 米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases博士研究員を経て,大阪大学大学院医学系研究科 准教授.
研究テーマ:遺伝子発現の制御の機構.
抱負:つねに新しいことに挑戦していきたい.
Rafael Casellas
米国NIH National Institute of Arthritis and Musculoskeletal and Skin DiseasesにてSenior Investigator.
研究室URL:http://casellaslab.github.io/
? 2017 二村圭祐・Rafael Casellas Licensed under CC 表示 2.1 日本