リゾホスファチジン酸受容体LPA6によるリガンドの認識の構造基盤
谷口怜哉・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:谷口怜哉,濡木 理
DOI: 10.7875/first.author.2017.088
Structural insights into ligand recognition by the lysophosphatidic acid receptor LPA6.
Reiya Taniguchi, Asuka Inoue, Misa Sayama, Akiharu Uwamizu, Keitaro Yamashita, Kunio Hirata, Masahito Yoshida, Yoshiki Tanaka, Hideaki E. Kato, Yoshiko Nakada-Nakura, Yuko Otani, Tomohiro Nishizawa, Takayuki Doi, Tomohiko Ohwada, Ryuichiro Ishitani, Junken Aoki, Osamu Nureki
Nature, 548, 356-360 (2017)
リゾホスファチジン酸はシグナル伝達にかかわる脂質メディエーターのひとつであり,6種類のGタンパク質共役型受容体LPA1~LPA6により受容される.今回,筆者らは,ゼブラフィッシュに由来するリゾホスファチジン酸受容体LPA6の結晶構造を3.2Å分解能で決定した.LPA6のリガンド結合ポケットは脂質二重膜にむかって大きく開いており,脂質環境に面した領域にリゾホスファチジン酸の炭化水素鎖が結合すると推定された.この特徴的な構造と,ドッキングシミュレーション,変異体の解析にもとづき,リガンドの認識に重要なアミノ酸残基が特定され,LPA6によるリゾホスファチジン酸の認識機構のモデルが提唱された.
リゾホスファチジン酸はリン酸基とグリセロール骨格からなる親水性の頭部および1本の炭化水素鎖により構成される,シンプルな分子構造をもつ脂質メディエーターである.6種類のGタンパク質共役型受容体LPA1~LPA6がリゾホスファチジン酸受容体として同定されており1),これらの受容体がリゾホスファチジン酸と結合して活性化されることにより細胞の外から細胞の内へとシグナルが伝達される.リゾホスファチジン酸を介するシグナル伝達は細胞の増殖や遊走などさまざまな応答をひき起こし,肺線維症やがんなどの疾患とのかかわりも深い2).そのため,リゾホスファチジン酸受容体は創薬の標的となるタンパク質としても注目されてきた.
6種類のリゾホスファチジン酸受容体はアミノ酸配列の違いから,LPA1,LPA2,LPA3からなるEDGファミリーと,LPA4,LPA5,LPA6からなる非EDGファミリーに分けられる3).2つのファミリーのあいだのアミノ酸配列の保存性は約20%であり,立体構造およびリゾホスファチジン酸の認識機構は2つのファミリーのあいだで大きく異なるものと予想された.また,実際に,生理的な機能や阻害剤に対する応答性もEDGファミリーと非EDGファミリーとでは異なる3).ゆえに,リゾホスファチジン酸によるシグナル伝達を理解するうえで,それぞれのファミリーに属するリゾホスファチジン酸受容体について立体構造やリガンドの認識機構を理解することが不可欠であった.しかし,2015年にLPA1の立体構造が報告された一方4),現在まで非EDGファミリーに属するリゾホスファチジン酸受容体の立体構造は明らかにされておらず,リガンドの認識機構は未解明であった.そこで,筆者らは,非EDGファミリーに属するリゾホスファチジン酸受容体のなかでもとくにLPA6に着目し,その立体構造を決定することによりリガンドの認識機構を解明することをめざした.
異なる生物種に由来する非EDGファミリーに属するリゾホスファチジン酸受容体のうち,ゼブラフィッシュに由来するLPA6が高い発現量と安定性を示したことから,これを構造解析の標的とした.結晶化に際しては,モノオレインとよばれる脂質のなかにタンパク質を再構成し,脂質にうまった状態で結晶を得る脂質キュービック相法5) を適用した.リゾホスファチジン酸あるいはそのアナログをくわえない条件において結晶が得られ,最終的に3.2Åの分解能でゼブラフィッシュLPA6の結晶構造が決定された(PDB ID:5XSZ ).
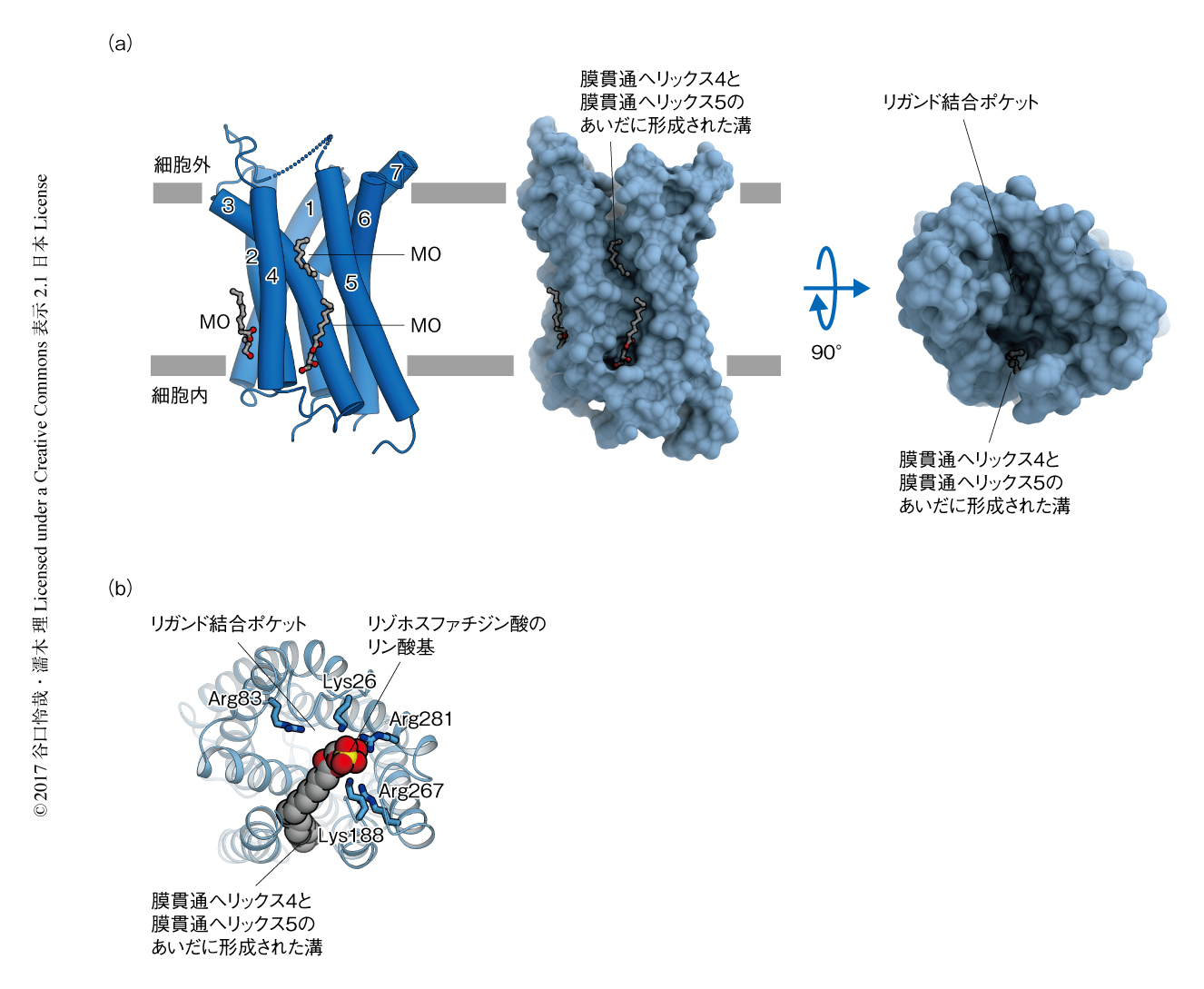
ゼブラフィッシュLPA6は一般的なGタンパク質共役型受容体と同様に7本の膜貫通ヘリックスが束になった形状をとり,それらの膜貫通ヘリックスのとりかこむ中央の部分に,細胞の外側にむかって開いたリガンド結合ポケットが形成されていた(図1a).ポケットの内部はTyrやPheといった芳香族アミノ酸残基により構成され,脂質であるリゾホスファチジン酸を収容するのに適した疎水的な環境が形成されていた.一方で,ポケットの周縁の部分にはArgやLysといった正電荷をもつアミノ酸残基が存在し,これらのアミノ酸残基がリゾホスファチジン酸のもつ負電荷をもつリン酸基の認識にかかわることが予想された.
このリガンド結合ポケットは側面,すなわち,脂質二重膜の側にむいても大きく開いていた(図1a).これまでに立体構造の報告されているGタンパク質共役型受容体の大半において,中央に形成されるリガンド結合ポケットは膜貫通ヘリックスにより脂質二重膜から完全に隔絶されていた.一方で,ゼブラフィッシュLPA6の場合は膜貫通ヘリックス4と膜貫通ヘリックス5とのあいだに隙間があり,脂質二重膜の中央の付近から細胞の外側へとつづく縦に長い溝が形成されていた(図1a).中央のリガンド結合ポケットはこの溝とつながっており,リガンド結合ポケットは溝の部分を開口部として脂質二重膜の側にむかって開いていた.この溝にそった位置にはValやIleといった疎水的なアミノ酸残基がならび,疎水的な環境が形成されていた.さらに,この溝のなかにはまり込むかたちで,結晶化に用いたモノオレインの炭化水素鎖に由来する細長い電子密度も観測された.以上の構造的な特徴から,この縦に細長い溝の内部にリゾホスファチジン酸の炭化水素鎖が収容されると予想された.
得られた立体構造を用いたリガンドドッキングシミュレーションにおいても,この予想と合致するリゾホスファチジン酸の結合モデルが得られた(図1b).このモデルより,リゾホスファチジン酸の認識に関与すると予想されるアミノ酸残基がしぼりこまれた.
リガンドの結合様式について実験的に検証するため,リゾホスファチジン酸の認識に関与すると予想されたアミノ酸残基の変異体を作製し,それらの受容体活性およびリゾホスファチジン酸に対する結合能を測定した.リゾホスファチジン酸のリン酸基を認識すると予想されたArgやLysについて,これらをAlaあるいはGluに置換して正電荷を失わせた変異体を作製したところ,膜貫通ヘリックス1,膜貫通ヘリックス2,膜貫通ヘリックス6,膜貫通ヘリックス7に存在するLys26,Arg83,Arg267,Arg281の変異体において受容体活性が大幅に低下した.一方で,これらのアミノ酸残基を同様に正電荷をもつアミノ酸残基と置換した場合(LysをArgに,あるいは,ArgをLysに),受容体活性の低下は比較的軽度であった.これら4つのアミノ酸残基のAla置換体においては,リゾホスファチジン酸に対する結合能も低下していた.以上より,Lys26,Arg83,Arg267,Arg281の4つのアミノ酸残基のもつ正電荷が,リゾホスファチジン酸の負電荷をもつリン酸基の部分の認識に関与することが裏づけられた.
リゾホスファチジン酸の炭化水素鎖を収容すると予想された細長い溝について,溝にそった領域に位置するVal195およびIle198の変異体を作製した.その結果,これらの残基をAlaと置換することにより溝を広げた場合,および,Pheと置換することにより溝を狭めた場合の両方において,受容体活性の低下およびリゾホスファチジン酸の結合能の低下がみられた.溝を広げる方向に変異を導入した場合にもリゾホスファチジン酸が結合しにくくなったことから,溝の形状に対しリゾホスファチジン酸の炭化水素鎖が適切な配向ではまり込み十分に疎水性の相互作用が形成されることがリゾホスファチジン酸の認識において重要であると考えられた.
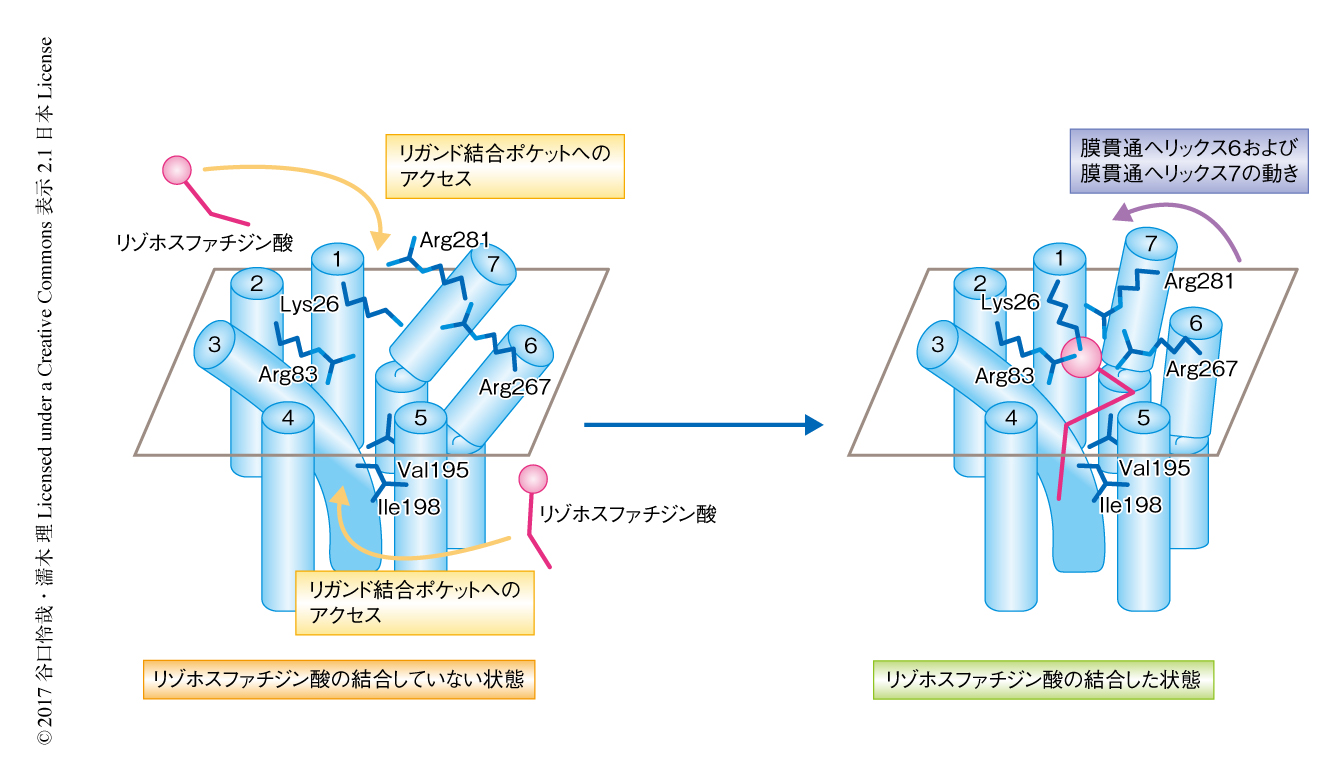
以上の実験の結果にもとづき,ゼブラフィッシュLPA6はリゾホスファチジン酸のリン酸基の部分を膜貫通ヘリックス1,膜貫通ヘリックス2,膜貫通ヘリックス6,膜貫通ヘリックス7に存在するLys26,Arg83,Arg267,Arg281により認識し,炭化水素鎖の部分を膜貫通ヘリックス4と膜貫通ヘリックス5のあいだに形成された細長い溝の形状により認識すると考えられた(図2).非EDGファミリーに属するリゾホスファチジン酸受容体に近縁なGタンパク質共役型受容体であるP2Yファミリー受容体の場合,リガンドの結合により誘起される膜貫通ヘリックス6と膜貫通ヘリックス7の動きが受容体の活性化に重要であることが,過去に報告された立体構造にもとづき明らかにされている6).構造の類似性,および,リン酸基を認識するArgの位置にもとづき,ゼブラフィッシュLPA6の場合も膜貫通ヘリックス6と膜貫通ヘリックス7がリゾホスファチジン酸との結合にともない動くことにより受容体の活性化がもたらされると予想された(図2).想定されるリゾホスファチジン酸の結合様式や受容体の活性化の機構はLPA1について明らかにされていたものとは大きく異なり4),EDGファミリーと非EDGファミリーのリゾホスファチジン酸受容体のあいだの性質や機能の違いの構造基盤が明らかにされた.
脂質性のリガンドは疎水性が高いため脂質二重膜にささった状態で多く存在すると考えられる.そのため,これらのリガンドが受容体の側方から脂質二重膜をとおってリガンド結合ポケットに入り込むのではないかという仮説が,脂質受容体の立体構造についての先行研究より提唱されていた7).ゼブラフィッシュLPA6が脂質二重膜にむかって大きく開いたリガンド結合ポケットをもつことから,この側方からのリガンドのアクセスの仮説が強く支持された(図2).くわえて,今回の実験において,リゾホスファチジン酸産生酵素とヒトLPA6の共発現下においては産生されたリゾホスファチジン酸が脂質二重膜に蓄積し,これにともない,リガンドを添加していない状態においてもLPA6の活性化が起こることが明らかにされた.これは,ヒトLPA6は脂質二重膜のなかに存在するリゾホスファチジン酸をリガンドとして受容することを示唆しており,実験的にも側方からのリガンドのアクセスの仮説が支持された.
この研究において,ゼブラフィッシュに由来するLPA6の特徴的な立体構造を足がかりとしてリゾホスファチジン酸の認識機構が推定された.このモデルにもとづくと,リゾホスファチジン酸の炭化水素鎖はLPA6の側面に形成された溝にはまり込み,その一部が脂質二重膜に露出した状態で認識されると考えられた.このような生理的なリガンドの認識機構は先行研究においてはまったく予想されておらず,Gタンパク質共役型受容体の立体構造の多様性やリガンドの認識機構の理解にとり有用な新規なアイディアを提示することができた点で,この研究は大きな意義をもつ.くわえて,ゼブラフィッシュLPA6の立体構造の情報は将来的なLPA6を標的とする創薬の基盤となると期待される.LPA6は毛髪の形成にかかわり8),LPA6にリガンドを供給するリゾホスファチジン酸産生酵素の先天的な欠損はヒトにおいて先天性乏毛症とよばれる遺伝性の疾患をひき起こす9).LPA6を活性化する薬剤はこの先天性乏毛症の治療薬となる可能性があり,今後,薬剤の候補となる化合物の探索が大きく進展することが期待される.
筆者らの当初の理想として,リゾホスファチジン酸の結合した状態でLPA6の立体構造を決定したいところであった.しかし,いろいろと手をつくしたものの共結晶構造は得られず,リガンドの認識機構の理解には苦慮した.さいわい,ゼブラフィッシュLPA6は解釈の比較的容易な構造的な特徴をもっていたため,そこを足がかりに網羅的な変異体の解析を展開することができた.その意味で,ゼブラフィッシュLPA6がユニークな構造をもっていたことは筆者らにとり非常に幸運であった.そもそも,今回の立体構造の決定は,大型放射光施設SPring-8におけるX線回折データの測定および解析の技術革新の賜物であった.また,手元にある立体構造の情報を最大限に活かして議論を構築できたのは,ドッキングシミュレーションや変異体の受容体活性の評価など,多角的なアプローチを用いて解析を進めたからにほかならない.このように,複数の研究グループそれぞれがもつ技術を活かし協調しながら研究に取り組むことの有用性を,この研究をとおし強く実感した.
現時点では,リゾホスファチジン酸の認識機構のモデルが提唱されたにすぎない.リガンドの認識機構の直接的な理解にむけて,リゾホスファチジン酸との共結晶構造の決定は依然として必要である.近年,充実しつつあるツールや実験手法を活用しながらひきつづきこの課題に取り組み,リガンドの認識機構の詳細な理解をめざしたい.
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:膜受容体および膜酵素の構造解析.
関心事:in situ構造生物学.各地の日本酒.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
? 2017 谷口怜哉・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:谷口怜哉,濡木 理
DOI: 10.7875/first.author.2017.088
Structural insights into ligand recognition by the lysophosphatidic acid receptor LPA6.
Reiya Taniguchi, Asuka Inoue, Misa Sayama, Akiharu Uwamizu, Keitaro Yamashita, Kunio Hirata, Masahito Yoshida, Yoshiki Tanaka, Hideaki E. Kato, Yoshiko Nakada-Nakura, Yuko Otani, Tomohiro Nishizawa, Takayuki Doi, Tomohiko Ohwada, Ryuichiro Ishitani, Junken Aoki, Osamu Nureki
Nature, 548, 356-360 (2017)
要 約
リゾホスファチジン酸はシグナル伝達にかかわる脂質メディエーターのひとつであり,6種類のGタンパク質共役型受容体LPA1~LPA6により受容される.今回,筆者らは,ゼブラフィッシュに由来するリゾホスファチジン酸受容体LPA6の結晶構造を3.2Å分解能で決定した.LPA6のリガンド結合ポケットは脂質二重膜にむかって大きく開いており,脂質環境に面した領域にリゾホスファチジン酸の炭化水素鎖が結合すると推定された.この特徴的な構造と,ドッキングシミュレーション,変異体の解析にもとづき,リガンドの認識に重要なアミノ酸残基が特定され,LPA6によるリゾホスファチジン酸の認識機構のモデルが提唱された.
はじめに
リゾホスファチジン酸はリン酸基とグリセロール骨格からなる親水性の頭部および1本の炭化水素鎖により構成される,シンプルな分子構造をもつ脂質メディエーターである.6種類のGタンパク質共役型受容体LPA1~LPA6がリゾホスファチジン酸受容体として同定されており1),これらの受容体がリゾホスファチジン酸と結合して活性化されることにより細胞の外から細胞の内へとシグナルが伝達される.リゾホスファチジン酸を介するシグナル伝達は細胞の増殖や遊走などさまざまな応答をひき起こし,肺線維症やがんなどの疾患とのかかわりも深い2).そのため,リゾホスファチジン酸受容体は創薬の標的となるタンパク質としても注目されてきた.
6種類のリゾホスファチジン酸受容体はアミノ酸配列の違いから,LPA1,LPA2,LPA3からなるEDGファミリーと,LPA4,LPA5,LPA6からなる非EDGファミリーに分けられる3).2つのファミリーのあいだのアミノ酸配列の保存性は約20%であり,立体構造およびリゾホスファチジン酸の認識機構は2つのファミリーのあいだで大きく異なるものと予想された.また,実際に,生理的な機能や阻害剤に対する応答性もEDGファミリーと非EDGファミリーとでは異なる3).ゆえに,リゾホスファチジン酸によるシグナル伝達を理解するうえで,それぞれのファミリーに属するリゾホスファチジン酸受容体について立体構造やリガンドの認識機構を理解することが不可欠であった.しかし,2015年にLPA1の立体構造が報告された一方4),現在まで非EDGファミリーに属するリゾホスファチジン酸受容体の立体構造は明らかにされておらず,リガンドの認識機構は未解明であった.そこで,筆者らは,非EDGファミリーに属するリゾホスファチジン酸受容体のなかでもとくにLPA6に着目し,その立体構造を決定することによりリガンドの認識機構を解明することをめざした.
1.ゼブラフィッシュに由来するLPA6の結晶構造の決定
異なる生物種に由来する非EDGファミリーに属するリゾホスファチジン酸受容体のうち,ゼブラフィッシュに由来するLPA6が高い発現量と安定性を示したことから,これを構造解析の標的とした.結晶化に際しては,モノオレインとよばれる脂質のなかにタンパク質を再構成し,脂質にうまった状態で結晶を得る脂質キュービック相法5) を適用した.リゾホスファチジン酸あるいはそのアナログをくわえない条件において結晶が得られ,最終的に3.2Åの分解能でゼブラフィッシュLPA6の結晶構造が決定された(PDB ID:5XSZ ).
2.ゼブラフィッシュLPA6の全体の構造とリガンド結合ポケットの形状
ゼブラフィッシュLPA6は一般的なGタンパク質共役型受容体と同様に7本の膜貫通ヘリックスが束になった形状をとり,それらの膜貫通ヘリックスのとりかこむ中央の部分に,細胞の外側にむかって開いたリガンド結合ポケットが形成されていた(図1a).ポケットの内部はTyrやPheといった芳香族アミノ酸残基により構成され,脂質であるリゾホスファチジン酸を収容するのに適した疎水的な環境が形成されていた.一方で,ポケットの周縁の部分にはArgやLysといった正電荷をもつアミノ酸残基が存在し,これらのアミノ酸残基がリゾホスファチジン酸のもつ負電荷をもつリン酸基の認識にかかわることが予想された.
このリガンド結合ポケットは側面,すなわち,脂質二重膜の側にむいても大きく開いていた(図1a).これまでに立体構造の報告されているGタンパク質共役型受容体の大半において,中央に形成されるリガンド結合ポケットは膜貫通ヘリックスにより脂質二重膜から完全に隔絶されていた.一方で,ゼブラフィッシュLPA6の場合は膜貫通ヘリックス4と膜貫通ヘリックス5とのあいだに隙間があり,脂質二重膜の中央の付近から細胞の外側へとつづく縦に長い溝が形成されていた(図1a).中央のリガンド結合ポケットはこの溝とつながっており,リガンド結合ポケットは溝の部分を開口部として脂質二重膜の側にむかって開いていた.この溝にそった位置にはValやIleといった疎水的なアミノ酸残基がならび,疎水的な環境が形成されていた.さらに,この溝のなかにはまり込むかたちで,結晶化に用いたモノオレインの炭化水素鎖に由来する細長い電子密度も観測された.以上の構造的な特徴から,この縦に細長い溝の内部にリゾホスファチジン酸の炭化水素鎖が収容されると予想された.
得られた立体構造を用いたリガンドドッキングシミュレーションにおいても,この予想と合致するリゾホスファチジン酸の結合モデルが得られた(図1b).このモデルより,リゾホスファチジン酸の認識に関与すると予想されるアミノ酸残基がしぼりこまれた.
3.変異体の解析による機能的に重要なアミノ酸残基の特定
リガンドの結合様式について実験的に検証するため,リゾホスファチジン酸の認識に関与すると予想されたアミノ酸残基の変異体を作製し,それらの受容体活性およびリゾホスファチジン酸に対する結合能を測定した.リゾホスファチジン酸のリン酸基を認識すると予想されたArgやLysについて,これらをAlaあるいはGluに置換して正電荷を失わせた変異体を作製したところ,膜貫通ヘリックス1,膜貫通ヘリックス2,膜貫通ヘリックス6,膜貫通ヘリックス7に存在するLys26,Arg83,Arg267,Arg281の変異体において受容体活性が大幅に低下した.一方で,これらのアミノ酸残基を同様に正電荷をもつアミノ酸残基と置換した場合(LysをArgに,あるいは,ArgをLysに),受容体活性の低下は比較的軽度であった.これら4つのアミノ酸残基のAla置換体においては,リゾホスファチジン酸に対する結合能も低下していた.以上より,Lys26,Arg83,Arg267,Arg281の4つのアミノ酸残基のもつ正電荷が,リゾホスファチジン酸の負電荷をもつリン酸基の部分の認識に関与することが裏づけられた.
リゾホスファチジン酸の炭化水素鎖を収容すると予想された細長い溝について,溝にそった領域に位置するVal195およびIle198の変異体を作製した.その結果,これらの残基をAlaと置換することにより溝を広げた場合,および,Pheと置換することにより溝を狭めた場合の両方において,受容体活性の低下およびリゾホスファチジン酸の結合能の低下がみられた.溝を広げる方向に変異を導入した場合にもリゾホスファチジン酸が結合しにくくなったことから,溝の形状に対しリゾホスファチジン酸の炭化水素鎖が適切な配向ではまり込み十分に疎水性の相互作用が形成されることがリゾホスファチジン酸の認識において重要であると考えられた.
4.リゾホスファチジン酸の認識機構のモデル
以上の実験の結果にもとづき,ゼブラフィッシュLPA6はリゾホスファチジン酸のリン酸基の部分を膜貫通ヘリックス1,膜貫通ヘリックス2,膜貫通ヘリックス6,膜貫通ヘリックス7に存在するLys26,Arg83,Arg267,Arg281により認識し,炭化水素鎖の部分を膜貫通ヘリックス4と膜貫通ヘリックス5のあいだに形成された細長い溝の形状により認識すると考えられた(図2).非EDGファミリーに属するリゾホスファチジン酸受容体に近縁なGタンパク質共役型受容体であるP2Yファミリー受容体の場合,リガンドの結合により誘起される膜貫通ヘリックス6と膜貫通ヘリックス7の動きが受容体の活性化に重要であることが,過去に報告された立体構造にもとづき明らかにされている6).構造の類似性,および,リン酸基を認識するArgの位置にもとづき,ゼブラフィッシュLPA6の場合も膜貫通ヘリックス6と膜貫通ヘリックス7がリゾホスファチジン酸との結合にともない動くことにより受容体の活性化がもたらされると予想された(図2).想定されるリゾホスファチジン酸の結合様式や受容体の活性化の機構はLPA1について明らかにされていたものとは大きく異なり4),EDGファミリーと非EDGファミリーのリゾホスファチジン酸受容体のあいだの性質や機能の違いの構造基盤が明らかにされた.
5.リガンドのアクセスの機構についての示唆
脂質性のリガンドは疎水性が高いため脂質二重膜にささった状態で多く存在すると考えられる.そのため,これらのリガンドが受容体の側方から脂質二重膜をとおってリガンド結合ポケットに入り込むのではないかという仮説が,脂質受容体の立体構造についての先行研究より提唱されていた7).ゼブラフィッシュLPA6が脂質二重膜にむかって大きく開いたリガンド結合ポケットをもつことから,この側方からのリガンドのアクセスの仮説が強く支持された(図2).くわえて,今回の実験において,リゾホスファチジン酸産生酵素とヒトLPA6の共発現下においては産生されたリゾホスファチジン酸が脂質二重膜に蓄積し,これにともない,リガンドを添加していない状態においてもLPA6の活性化が起こることが明らかにされた.これは,ヒトLPA6は脂質二重膜のなかに存在するリゾホスファチジン酸をリガンドとして受容することを示唆しており,実験的にも側方からのリガンドのアクセスの仮説が支持された.
おわりに
この研究において,ゼブラフィッシュに由来するLPA6の特徴的な立体構造を足がかりとしてリゾホスファチジン酸の認識機構が推定された.このモデルにもとづくと,リゾホスファチジン酸の炭化水素鎖はLPA6の側面に形成された溝にはまり込み,その一部が脂質二重膜に露出した状態で認識されると考えられた.このような生理的なリガンドの認識機構は先行研究においてはまったく予想されておらず,Gタンパク質共役型受容体の立体構造の多様性やリガンドの認識機構の理解にとり有用な新規なアイディアを提示することができた点で,この研究は大きな意義をもつ.くわえて,ゼブラフィッシュLPA6の立体構造の情報は将来的なLPA6を標的とする創薬の基盤となると期待される.LPA6は毛髪の形成にかかわり8),LPA6にリガンドを供給するリゾホスファチジン酸産生酵素の先天的な欠損はヒトにおいて先天性乏毛症とよばれる遺伝性の疾患をひき起こす9).LPA6を活性化する薬剤はこの先天性乏毛症の治療薬となる可能性があり,今後,薬剤の候補となる化合物の探索が大きく進展することが期待される.
筆者らの当初の理想として,リゾホスファチジン酸の結合した状態でLPA6の立体構造を決定したいところであった.しかし,いろいろと手をつくしたものの共結晶構造は得られず,リガンドの認識機構の理解には苦慮した.さいわい,ゼブラフィッシュLPA6は解釈の比較的容易な構造的な特徴をもっていたため,そこを足がかりに網羅的な変異体の解析を展開することができた.その意味で,ゼブラフィッシュLPA6がユニークな構造をもっていたことは筆者らにとり非常に幸運であった.そもそも,今回の立体構造の決定は,大型放射光施設SPring-8におけるX線回折データの測定および解析の技術革新の賜物であった.また,手元にある立体構造の情報を最大限に活かして議論を構築できたのは,ドッキングシミュレーションや変異体の受容体活性の評価など,多角的なアプローチを用いて解析を進めたからにほかならない.このように,複数の研究グループそれぞれがもつ技術を活かし協調しながら研究に取り組むことの有用性を,この研究をとおし強く実感した.
現時点では,リゾホスファチジン酸の認識機構のモデルが提唱されたにすぎない.リガンドの認識機構の直接的な理解にむけて,リゾホスファチジン酸との共結晶構造の決定は依然として必要である.近年,充実しつつあるツールや実験手法を活用しながらひきつづきこの課題に取り組み,リガンドの認識機構の詳細な理解をめざしたい.
文 献
- Kihara, Y., Maceyka, M., Spiegel, S. et al.: Lysophospholipid receptor nomenclature review: IUPHAR Review 8. Br. J. Pharmacol., 171, 3575-3594 (2014)[PubMed]
- Choi, J. W., Herr, D. R., Noguchi, K. et al.: LPA receptors: subtypes and biological actions. Annu. Rev. Pharmacol. Toxicol., 50, 157-186 (2010)[PubMed]
- Yanagida, K., Kurikawa, Y., Shimizu, T. et al.: Current progress in non-Edg family LPA receptor research. Biochim. Biophys. Acta, 1831, 33-41 (2013)[PubMed]
- Chrencik, J. E., Roth, C. B., Terakado, M. et al.: Crystal structure of antagonist bound human lysophosphatidic acid receptor 1. Cell, 161, 1633-1643 (2015)[PubMed]
- Caffrey, M. & Cherezov, V.: Crystallizing membrane proteins using lipidic mesophases. Nat. Protoc., 4, 706-731 (2009)[PubMed]
- Zhang, J., Zhang, K., Gao, Z. G. et al.: Agonist-bound structure of the human P2Y12 receptor. Nature, 509, 119-122 (2014)[PubMed]
- Hanson, M. A., Roth, C. B., Jo, E. et al.: Crystal structure of a lipid G protein-coupled receptor. Science, 335, 851-855 (2012)[PubMed]
- Inoue, A., Arima, N., Ishiguro, J. et al.: LPA-producing enzyme PA-PLA1α regulates hair follicle development by modulating EGFR signalling. EMBO J., 30, 4248-4260 (2011)[PubMed]
- Kazantseva, A., Goltsov, A., Zinchenko, R. et al.: Human hair growth deficiency is linked to a genetic defect in the phospholipase gene LIPH. Science, 314, 982-985 (2006)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:膜受容体および膜酵素の構造解析.
関心事:in situ構造生物学.各地の日本酒.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
? 2017 谷口怜哉・濡木 理 Licensed under CC 表示 2.1 日本