抗精神病薬による5-HT2A受容体の遮断はNF-κBの活性化を介しHDAC2の発現を上昇させることにより認知機能を障害する
衣斐 大祐
(米国Icahn School of Medicine at Mount Sinai,Department of Psychiatry)
email:衣斐大祐
DOI: 10.7875/first.author.2017.087
Antipsychotic-induced Hdac2 transcription via NF-κB leads to synaptic and cognitive side effects.
Daisuke Ibi, Mario de la Fuente Revenga, Nebojsa Kezunovic, Carolina Muguruza, Justin M. Saunders, Supriya A. Gaitonde, José L. Moreno, Maryum K. Ijaz, Vishaka Santosh, Alexey Kozlenkov, Terrell Holloway, Jeremy Seto, Aintzane García-Bea, Mitsumasa Kurita, Grace E. Mosley, Yan Jiang, Daniel J. Christoffel, Luis F. Callado, Scott J. Russo, Stella Dracheva, Juan F. López-Giménez, Yongchao Ge, Carlos R. Escalante, J. Javier Meana, Schahram Akbarian, George W. Huntley, Javier González-Maeso
Nature Neuroscience, 20, 1247-1259 (2017)
統合失調症の患者において認められる認知機能の障害は社会活動の全般に支障をきたすことから予後を決定する重要な因子のひとつである.これまで,抗精神病薬の慢性的な処置にもかかわらず認知機能が改善されないことが報告されていた.この研究においては,第2世代の抗精神病薬である非定型の抗精神病薬の慢性的な処置は,セロトニン受容体である5-HT2A受容体の遮断を介して転写因子NF-κBの核への移行をひき起こすことが明らかにされた.さらに,核へと移行したNF-κBが,ヒストン脱アセチル化酵素のひとつHDAC2をコードするHdac2遺伝子の転写を活性化することが見い出され,非定型の抗精神病薬の慢性的な処置による認知機能の低下,シナプスの再形成および可塑性の障害は,NF-κB-HDAC2経路に依存してひき起こされることが確認された.以上から,非定型の抗精神病薬の慢性的な処置は,治療的な効果とは別のNF-κB-HDAC2経路を代償的に活性化させることにより,統合失調症における認知機能の障害の治療をさまたげることが考えられた.
統合失調症の有病率は約1%であり,多くの場合,生活の質はいちじるしく低下する.第1世代の抗精神病薬であるハロペリドールなどの定型の抗精神病薬はおもにドーパミン受容体を遮断する.また,第2世代の抗精神病薬であるクロザピンなどの非定型の抗精神病薬はドーパミン受容体を遮断するにくわえセロトニン受容体も遮断する1).これらの抗精神病薬の慢性的な処置は,幻覚や妄想のような精神病症状には有効であるが,統合失調症の患者の多くに認められる認知機能の障害に対してはあまり有効性が認められず,場合によっては,長期にわたる抗精神病薬の処置により認知機能の障害がさらに悪化することも示唆されている2-5).これらの臨床研究と同様の結果は,実験動物を用いた研究においても報告されている6-8).認知機能の低下が統合失調症の患者の社会生活における大きな支障になることを考えると,抗精神病薬の慢性的な処置によりひき起こされる認知機能の低下の分子機構を明らかにする必要がある.
ヒストン脱アセチル化酵素によるヒストンからのアセチル基の除去はクロマチン構造の凝集をひき起こし転写を抑制する9).脳に存在するヒストン脱アセチル化酵素のひとつHDAC2は認知機能において重要な役割をはたしており,機能的および構造的にシナプスの可塑性を抑制する9).これまでに,筆者らの研究グループは,認知機能など脳の高次機能において重要な部位である前頭皮質において非定型の抗精神病薬の慢性的な処置によりHDAC2の発現が上昇することを患者の死後脳およびマウスを用いた実験から明らかにした10).しかしながら,非定型の抗精神病薬によるHDAC2の発現の上昇が抗精神病薬の作用にどのようにかかわるかについてはわかっていなかった.さらに,HDAC2の発現の上昇にいたるシグナル伝達経路についても不明であった.
定型の抗精神病薬であるハロペリドール,あるいは,非定型の抗精神病薬のクロザピンあるいはリスペリドンをマウスに対し慢性的に処置したところ,非定型の抗精神病薬の処置によりグルタミン酸ニューロンにおけるHDAC2の過剰な発現が認められた.セロトニン受容体のひとつ5-HT2A受容体のノックアウトマウスにおいてはそのような抗精神病薬の影響は認められなかった.HDAC2の発現の上昇が遺伝子の発現におよぼす影響について調べるため,野生型のマウスおよびグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスに慢性的にクロザピンを処置し,前頭皮質におけるRNAの発現をRNA-seq法により網羅的に解析した.その結果,野生型のマウスにおいてはクロザピンの慢性的な処置により後シナプスの構造にかかわる遺伝子の発現の低下が認められたが,HDAC2コンディショナルノックアウトマウスにおいてはそのような変化は認められなかった.そこで,前頭皮質の第II層/第III層の錐体細胞においてGFPによりスパインを可視化したところ,野生型のマウスに対するクロザピンの慢性的な処置は成熟したスパインの数の低下をひき起こした.さらに,認知機能について調べたところ,クロザピンの慢性的な処置は認知機能の低下をひき起こした.一方,HDAC2コンディショナルノックアウトマウスにおいてはそのようなスパインの変化および認知機能の低下は認められなかった.以上から,クロザピンの慢性的な処置による成熟したスパインの減少および認知機能の低下がHDAC2に依存して生じることが示唆された.
これまで,筆者らの研究グループは,5-HT2A受容体の下流にいくつかの転写因子の存在することを明らかにしている11).その結果をふまえ,さらに,データベースを用いて調べたところ,IκBα-NF-κB経路がHdac2遺伝子の発現の制御に関与する可能性が考えられた.NF-κBの活性化の古典的な経路としては,IKK複合体がIκBαをリン酸化することによりIκBαの分解が起こり,それにより抑制されていたNF-κBが活性化され,核へと移行し転写因子としてはたらくことが知られている12).そこで,マウスの前頭皮質においてIκBαおよびNF-κBの発現について調べたところ,クロザピンの慢性的な処置によりIκBαの発現の低下およびNF-κBの核への移行が認められたが,NF-κBの発現そのものに影響はなかった.そこで,核へと移行したNF-κBとHdac2遺伝子のプロモーターとの相互作用について調べたところ,蛍光異方性測定法およびプロモーター解析によりNF-κBがHdac2遺伝子のプロモーターと直接に結合しこれを活性化すること,さらに,クロマチン免疫沈降法によりクロザピンの慢性的な処置によりHdac2遺伝子のプロモーターへのNF-κBの結合が高まることがわかった.しかし,5-HT2Aノックアウトマウスにおいてはクロザピンの慢性的な処置によるIκBα-NF-κB経路の活性化およびHdac2遺伝子のプロモーターへのNF-κBの結合の変化は認められなかった.さらに,非定型の抗精神病薬を処置されていた統合失調症の患者の死後脳と無処置の患者の死後脳とを比較したところ,処置されていた患者の前頭皮質においてIκBαの発現の低下およびNF-κBの核への移行の増加が確認され,マウスにおける結果と一致した.以上から,5-HT2A受容体に依存的なIκBα-NF-κB経路の活性化によりHdac2遺伝子の転写が活性化されることが明らかにされた.
5-HT2A受容体の刺激薬を野生型のマウスに処置したところ前頭皮質においてIκBαの発現の上昇が認められたが,5-HT2Aノックアウトマウスおよびクロザピンを前処置したマウスにおいてはそのような変化は認められなかった.さらに,ERKの阻害薬によっても5-HT2A受容体の刺激薬の効果は抑制されたため,慢性的にクロザピンを処置したマウスの前頭皮質においてERK1/ERK2の発現を調べたところ,リン酸化したERK1/ERK2の発現量は減少していたが,5-HT2Aノックアウトマウスにおいてはそのような変化は認められなかった.同様に,培養細胞を用いた実験系においても5-HT2A受容体への刺激に依存してERK経路を介しIκBαの発現が上昇することが示された.この応答には5-HT2A受容体と共役するGq/11タンパク質が必須であることもわかった.
さらに,5-HT2A受容体を遮断する薬物の慢性的な処置により,前頭皮質において5-HT2A受容体の密度が低下することも明らかにされた.このことからも,5-HT2A受容体の慢性的な遮断によりその下流の経路が強力に抑制されることが考えられた.
クロザピンの作用におけるNF-κBの機能的な役割について明らかにするため,NF-κBの核への移行を抑制するIκBαのドミナントネガティブ体を作製しアデノ随伴ウイルスを用いて前頭皮質のグルタミン酸ニューロンにおいて特異的に発現させたところ,クロザピンの慢性的な処置によるNF-κBの核への移行,HDAC2の発現の上昇,認知機能の低下が抑制された.前頭皮質におけるNF-κBの機能そのものを抑制するため,大脳皮質のグルタミン酸ニューロンにおいて特異的にNF-κBサブユニットのひとつであるp65を欠損するコンディショナルノックアウトマウスを作出した.このp65コンディショナルノックアウトマウスに対し慢性的にクロザピンを処置したところ,野生型のマウスにおいて認められたHDAC2の発現の上昇および認知機能の低下は認められなかったが,その上流に位置すると考えられるIκBαの発現の低下が確認された.さらに,微量のNF-κBの抑制薬を脳に投与しても,p65コンディショナルノックアウトマウスと同様の結果が得られた.以上より,非定型の抗精神病薬によるHDAC2の発現の上昇および認知機能の低下においては,前頭皮質のグルタミン酸ニューロンにおけるNF-κBの核への移行が必須であると考えられた.
非定型の抗精神病薬の長期間にわたる処置によりひき起こされるNF-κB経路の活性化そのものが脳の機能におよぼす影響について調べるため,NF-κBの核への移行を促進する活性化IKKβをアデノ随伴ウイルスを用いて前頭皮質のグルタミン酸ニューロンにおいて特異的に発現させたところ,対照のマウスと比較してNF-κBの核への移行およびHDAC2の発現の上昇が確認された.また,活性化したIKKβを発現させた前頭皮質のグルタミン酸ニューロンにおいてパッチクランプ法により長期増強について観察したところ,長期増強の低下および成熟したスパインの減少が確認された.しかし,これらの現象はグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスにおいては観察されなかった.
前頭皮質のグルタミン酸ニューロンに活性化したIKKβを発現させたマウスにおいては,認知機能の低下,薬物により誘発される多動,首振り行動の悪化,さらに,社会性行動の異常も認められたが,いずれの異常もグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスにおいては認められなかった.また,活性化したIKKβによる成熟したスパインの減少と認知機能の低下とのあいだには正の相関関係が確認された.以上から,NF-κBの活性化によるシナプスの再形成および可塑性の障害,および,行動の異常はHDAC2を介してひき起こされることが明らかにされた.
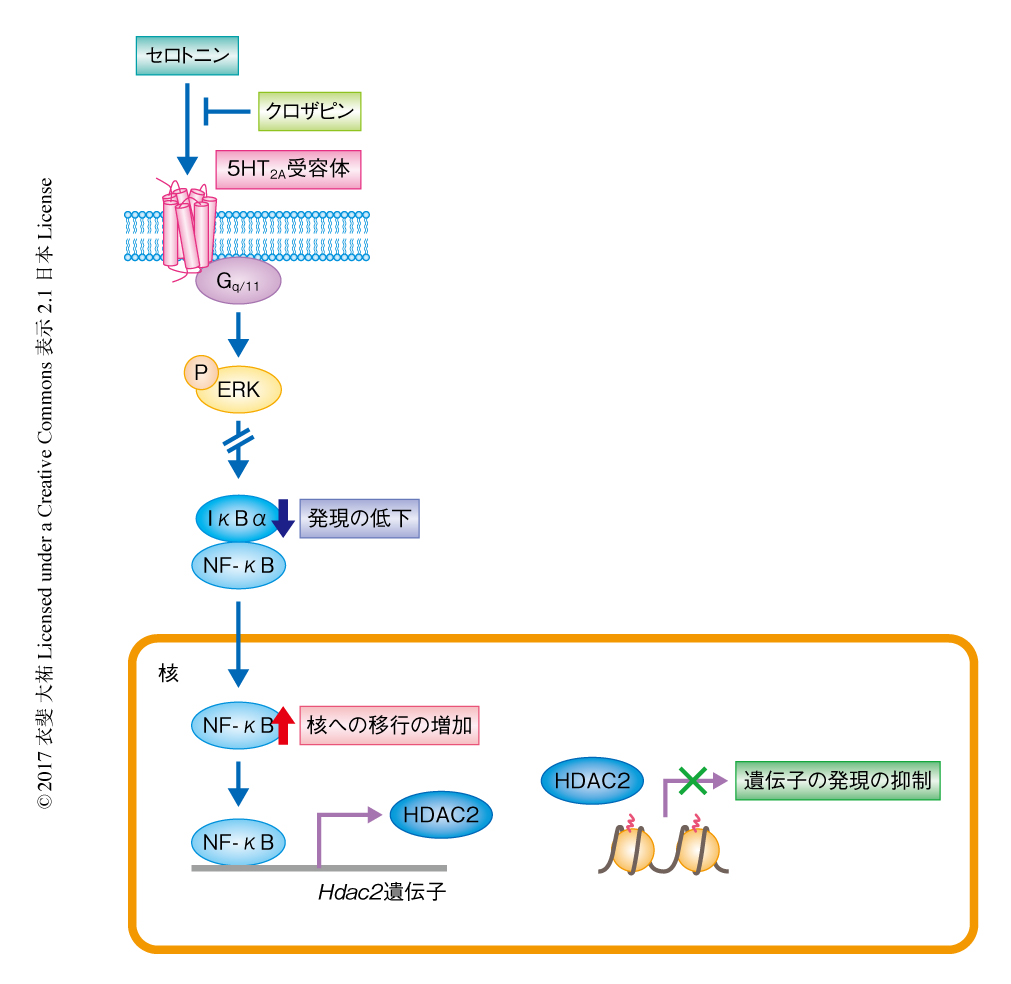
この研究により,非定型の抗精神病薬などによる長期にわたる5-HT2A受容体の遮断は,5-HT2A受容体の密度の低下をひき起こし,ERK経路を抑制してIκBαの発現の低下をひき起こす.それにより核へと移行したNF-κBはHdac2遺伝子のプロモーターと結合し,Hdac2遺伝子の転写の活性化により発現の上昇したHDAC2がシナプスの成熟や機能を抑制し,認知機能を障害する経路が明らかにされた(図1).以上から,非定型の抗精神病薬の慢性的な処置は,治療的な効果とは別のNF-κB-HDAC2経路を活性化することにより統合失調症における認知機能の障害の治療をさまたげることが考えられ,NF-κB-HDAC2経路を薬理学的に抑制することができれば,抗精神病薬の薬効の改善につながると期待される.また,この研究からは,長期間にわたる慢性的な薬物の曝露により,主作用ではない代償的な作用がエピジェネティックな制御を介し出現する可能性が提唱された.
略歴:2010年 名古屋大学大学院医学系研究科 修了,同年 名城大学薬学部 研究員,2012年 米国Icahn School of Medicine at Mount Sinai博士研究員を経て,2015年より名城大学薬学部 助教.
研究テーマ:精神疾患における異常な免疫応答およびエピジェネティックな制御の関与.
抱負:既存の薬物の再評価により新たな治療の戦略を探っていきたい.
© 2017 衣斐 大祐 Licensed under CC 表示 2.1 日本
(米国Icahn School of Medicine at Mount Sinai,Department of Psychiatry)
email:衣斐大祐
DOI: 10.7875/first.author.2017.087
Antipsychotic-induced Hdac2 transcription via NF-κB leads to synaptic and cognitive side effects.
Daisuke Ibi, Mario de la Fuente Revenga, Nebojsa Kezunovic, Carolina Muguruza, Justin M. Saunders, Supriya A. Gaitonde, José L. Moreno, Maryum K. Ijaz, Vishaka Santosh, Alexey Kozlenkov, Terrell Holloway, Jeremy Seto, Aintzane García-Bea, Mitsumasa Kurita, Grace E. Mosley, Yan Jiang, Daniel J. Christoffel, Luis F. Callado, Scott J. Russo, Stella Dracheva, Juan F. López-Giménez, Yongchao Ge, Carlos R. Escalante, J. Javier Meana, Schahram Akbarian, George W. Huntley, Javier González-Maeso
Nature Neuroscience, 20, 1247-1259 (2017)
要 約
統合失調症の患者において認められる認知機能の障害は社会活動の全般に支障をきたすことから予後を決定する重要な因子のひとつである.これまで,抗精神病薬の慢性的な処置にもかかわらず認知機能が改善されないことが報告されていた.この研究においては,第2世代の抗精神病薬である非定型の抗精神病薬の慢性的な処置は,セロトニン受容体である5-HT2A受容体の遮断を介して転写因子NF-κBの核への移行をひき起こすことが明らかにされた.さらに,核へと移行したNF-κBが,ヒストン脱アセチル化酵素のひとつHDAC2をコードするHdac2遺伝子の転写を活性化することが見い出され,非定型の抗精神病薬の慢性的な処置による認知機能の低下,シナプスの再形成および可塑性の障害は,NF-κB-HDAC2経路に依存してひき起こされることが確認された.以上から,非定型の抗精神病薬の慢性的な処置は,治療的な効果とは別のNF-κB-HDAC2経路を代償的に活性化させることにより,統合失調症における認知機能の障害の治療をさまたげることが考えられた.
はじめに
統合失調症の有病率は約1%であり,多くの場合,生活の質はいちじるしく低下する.第1世代の抗精神病薬であるハロペリドールなどの定型の抗精神病薬はおもにドーパミン受容体を遮断する.また,第2世代の抗精神病薬であるクロザピンなどの非定型の抗精神病薬はドーパミン受容体を遮断するにくわえセロトニン受容体も遮断する1).これらの抗精神病薬の慢性的な処置は,幻覚や妄想のような精神病症状には有効であるが,統合失調症の患者の多くに認められる認知機能の障害に対してはあまり有効性が認められず,場合によっては,長期にわたる抗精神病薬の処置により認知機能の障害がさらに悪化することも示唆されている2-5).これらの臨床研究と同様の結果は,実験動物を用いた研究においても報告されている6-8).認知機能の低下が統合失調症の患者の社会生活における大きな支障になることを考えると,抗精神病薬の慢性的な処置によりひき起こされる認知機能の低下の分子機構を明らかにする必要がある.
ヒストン脱アセチル化酵素によるヒストンからのアセチル基の除去はクロマチン構造の凝集をひき起こし転写を抑制する9).脳に存在するヒストン脱アセチル化酵素のひとつHDAC2は認知機能において重要な役割をはたしており,機能的および構造的にシナプスの可塑性を抑制する9).これまでに,筆者らの研究グループは,認知機能など脳の高次機能において重要な部位である前頭皮質において非定型の抗精神病薬の慢性的な処置によりHDAC2の発現が上昇することを患者の死後脳およびマウスを用いた実験から明らかにした10).しかしながら,非定型の抗精神病薬によるHDAC2の発現の上昇が抗精神病薬の作用にどのようにかかわるかについてはわかっていなかった.さらに,HDAC2の発現の上昇にいたるシグナル伝達経路についても不明であった.
1.非定型の抗精神病薬の慢性的な処置により大脳皮質において発現が上昇するHDAC2の役割
定型の抗精神病薬であるハロペリドール,あるいは,非定型の抗精神病薬のクロザピンあるいはリスペリドンをマウスに対し慢性的に処置したところ,非定型の抗精神病薬の処置によりグルタミン酸ニューロンにおけるHDAC2の過剰な発現が認められた.セロトニン受容体のひとつ5-HT2A受容体のノックアウトマウスにおいてはそのような抗精神病薬の影響は認められなかった.HDAC2の発現の上昇が遺伝子の発現におよぼす影響について調べるため,野生型のマウスおよびグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスに慢性的にクロザピンを処置し,前頭皮質におけるRNAの発現をRNA-seq法により網羅的に解析した.その結果,野生型のマウスにおいてはクロザピンの慢性的な処置により後シナプスの構造にかかわる遺伝子の発現の低下が認められたが,HDAC2コンディショナルノックアウトマウスにおいてはそのような変化は認められなかった.そこで,前頭皮質の第II層/第III層の錐体細胞においてGFPによりスパインを可視化したところ,野生型のマウスに対するクロザピンの慢性的な処置は成熟したスパインの数の低下をひき起こした.さらに,認知機能について調べたところ,クロザピンの慢性的な処置は認知機能の低下をひき起こした.一方,HDAC2コンディショナルノックアウトマウスにおいてはそのようなスパインの変化および認知機能の低下は認められなかった.以上から,クロザピンの慢性的な処置による成熟したスパインの減少および認知機能の低下がHDAC2に依存して生じることが示唆された.
2.非定型の抗精神病薬によるNF-κBを介するHdac2遺伝子の転写の活性化
これまで,筆者らの研究グループは,5-HT2A受容体の下流にいくつかの転写因子の存在することを明らかにしている11).その結果をふまえ,さらに,データベースを用いて調べたところ,IκBα-NF-κB経路がHdac2遺伝子の発現の制御に関与する可能性が考えられた.NF-κBの活性化の古典的な経路としては,IKK複合体がIκBαをリン酸化することによりIκBαの分解が起こり,それにより抑制されていたNF-κBが活性化され,核へと移行し転写因子としてはたらくことが知られている12).そこで,マウスの前頭皮質においてIκBαおよびNF-κBの発現について調べたところ,クロザピンの慢性的な処置によりIκBαの発現の低下およびNF-κBの核への移行が認められたが,NF-κBの発現そのものに影響はなかった.そこで,核へと移行したNF-κBとHdac2遺伝子のプロモーターとの相互作用について調べたところ,蛍光異方性測定法およびプロモーター解析によりNF-κBがHdac2遺伝子のプロモーターと直接に結合しこれを活性化すること,さらに,クロマチン免疫沈降法によりクロザピンの慢性的な処置によりHdac2遺伝子のプロモーターへのNF-κBの結合が高まることがわかった.しかし,5-HT2Aノックアウトマウスにおいてはクロザピンの慢性的な処置によるIκBα-NF-κB経路の活性化およびHdac2遺伝子のプロモーターへのNF-κBの結合の変化は認められなかった.さらに,非定型の抗精神病薬を処置されていた統合失調症の患者の死後脳と無処置の患者の死後脳とを比較したところ,処置されていた患者の前頭皮質においてIκBαの発現の低下およびNF-κBの核への移行の増加が確認され,マウスにおける結果と一致した.以上から,5-HT2A受容体に依存的なIκBα-NF-κB経路の活性化によりHdac2遺伝子の転写が活性化されることが明らかにされた.
3.5-HT2A受容体を介するIκBαの発現の変化におけるERK経路の関与
5-HT2A受容体の刺激薬を野生型のマウスに処置したところ前頭皮質においてIκBαの発現の上昇が認められたが,5-HT2Aノックアウトマウスおよびクロザピンを前処置したマウスにおいてはそのような変化は認められなかった.さらに,ERKの阻害薬によっても5-HT2A受容体の刺激薬の効果は抑制されたため,慢性的にクロザピンを処置したマウスの前頭皮質においてERK1/ERK2の発現を調べたところ,リン酸化したERK1/ERK2の発現量は減少していたが,5-HT2Aノックアウトマウスにおいてはそのような変化は認められなかった.同様に,培養細胞を用いた実験系においても5-HT2A受容体への刺激に依存してERK経路を介しIκBαの発現が上昇することが示された.この応答には5-HT2A受容体と共役するGq/11タンパク質が必須であることもわかった.
さらに,5-HT2A受容体を遮断する薬物の慢性的な処置により,前頭皮質において5-HT2A受容体の密度が低下することも明らかにされた.このことからも,5-HT2A受容体の慢性的な遮断によりその下流の経路が強力に抑制されることが考えられた.
4.NF-κBの機能の抑制がクロザピンの処置によるHDAC2の発現あるいは認知機能におよぼす影響
クロザピンの作用におけるNF-κBの機能的な役割について明らかにするため,NF-κBの核への移行を抑制するIκBαのドミナントネガティブ体を作製しアデノ随伴ウイルスを用いて前頭皮質のグルタミン酸ニューロンにおいて特異的に発現させたところ,クロザピンの慢性的な処置によるNF-κBの核への移行,HDAC2の発現の上昇,認知機能の低下が抑制された.前頭皮質におけるNF-κBの機能そのものを抑制するため,大脳皮質のグルタミン酸ニューロンにおいて特異的にNF-κBサブユニットのひとつであるp65を欠損するコンディショナルノックアウトマウスを作出した.このp65コンディショナルノックアウトマウスに対し慢性的にクロザピンを処置したところ,野生型のマウスにおいて認められたHDAC2の発現の上昇および認知機能の低下は認められなかったが,その上流に位置すると考えられるIκBαの発現の低下が確認された.さらに,微量のNF-κBの抑制薬を脳に投与しても,p65コンディショナルノックアウトマウスと同様の結果が得られた.以上より,非定型の抗精神病薬によるHDAC2の発現の上昇および認知機能の低下においては,前頭皮質のグルタミン酸ニューロンにおけるNF-κBの核への移行が必須であると考えられた.
5.NF-κBの活性化によるHDAC2の発現の上昇がシナプスの可塑性および成熟したスパインにおよぼす影響
非定型の抗精神病薬の長期間にわたる処置によりひき起こされるNF-κB経路の活性化そのものが脳の機能におよぼす影響について調べるため,NF-κBの核への移行を促進する活性化IKKβをアデノ随伴ウイルスを用いて前頭皮質のグルタミン酸ニューロンにおいて特異的に発現させたところ,対照のマウスと比較してNF-κBの核への移行およびHDAC2の発現の上昇が確認された.また,活性化したIKKβを発現させた前頭皮質のグルタミン酸ニューロンにおいてパッチクランプ法により長期増強について観察したところ,長期増強の低下および成熟したスパインの減少が確認された.しかし,これらの現象はグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスにおいては観察されなかった.
前頭皮質のグルタミン酸ニューロンに活性化したIKKβを発現させたマウスにおいては,認知機能の低下,薬物により誘発される多動,首振り行動の悪化,さらに,社会性行動の異常も認められたが,いずれの異常もグルタミン酸ニューロンにおいて特異的にHDAC2を欠損させたコンディショナルノックアウトマウスにおいては認められなかった.また,活性化したIKKβによる成熟したスパインの減少と認知機能の低下とのあいだには正の相関関係が確認された.以上から,NF-κBの活性化によるシナプスの再形成および可塑性の障害,および,行動の異常はHDAC2を介してひき起こされることが明らかにされた.
おわりに
この研究により,非定型の抗精神病薬などによる長期にわたる5-HT2A受容体の遮断は,5-HT2A受容体の密度の低下をひき起こし,ERK経路を抑制してIκBαの発現の低下をひき起こす.それにより核へと移行したNF-κBはHdac2遺伝子のプロモーターと結合し,Hdac2遺伝子の転写の活性化により発現の上昇したHDAC2がシナプスの成熟や機能を抑制し,認知機能を障害する経路が明らかにされた(図1).以上から,非定型の抗精神病薬の慢性的な処置は,治療的な効果とは別のNF-κB-HDAC2経路を活性化することにより統合失調症における認知機能の障害の治療をさまたげることが考えられ,NF-κB-HDAC2経路を薬理学的に抑制することができれば,抗精神病薬の薬効の改善につながると期待される.また,この研究からは,長期間にわたる慢性的な薬物の曝露により,主作用ではない代償的な作用がエピジェネティックな制御を介し出現する可能性が提唱された.
文 献
- Crilly, J.: The history of clozapine and its emergence in the US market: a review and analysis. Hist. Psychiatry, 18, 39-60 (2007)[PubMed]
- Husa, A. P., Rannikko, I., Moilanen, J. et al.: Lifetime use of antipsychotic medication and its relation to change of verbal learning and memory in midlife schizophrenia: an observational 9-year follow-up study. Schizophr. Res., 158, 134-141 (2014)[PubMed]
- Fervaha, G., Takeuchi, H., Lee, J. et al.: Antipsychotics and amotivation. Neuropsychopharmacology, 40, 1539-1548 (2015)[PubMed]
- Goldberg, T. E., Greenberg, R. D., Griffin, S. J. et al.: The effect of clozapine on cognition and psychiatric symptoms in patients with schizophrenia. Br. J. Psychiatry, 162, 43-48 (1993)[PubMed]
- Nielsen, R. E., Levander, S., Kjaersdam Telleus, G. et al.: Second-generation antipsychotic effect on cognition in patients with schizophrenia: a meta-analysis of randomized clinical trials. Acta Psychiatr. Scand., 131, 185-196 (2015)[PubMed]
- Schroder, N., de Lima, M. N., Quevedo, J. et al.: Impairing effects of chronic haloperidol and clozapine treatment on recognition memory: possible relation to oxidative stress. Schizophr. Res., 73, 377-378 (2005)[PubMed]
- Rosengarten, H. & Quartermain, D.: The effect of chronic treatment with typical and atypical antipsychotics on working memory and jaw movements in three- and eighteen month-old rats. Prog. Neuropsychopharmacol. Biol. Psychiatry, 26, 1047-1054 (2002)[PubMed]
- Hagan, J. J. & Jones, D. N.: Predicting drug efficacy for cognitive deficits in schizophrenia. Schizophr. Bull., 31, 830-853 (2005)[PubMed]
- Graff, J. & Tsai, L. H.: Histone acetylation: molecular mnemonics on the chromatin. Nat. Rev. Neurosci., 14, 97-111 (2013)[PubMed]
- Kurita, M., Holloway, T., Garcia-Bea, A. et al.: HDAC2 regulates atypical antipsychotic responses through the modulation of mGlu2 promoter activity. Nat. Neurosci., 15, 1245-1254 (2012)[PubMed]
- Gonzalez-Maeso, J., Weisstaub, N. V., Zhou, M. et al.: Hallucinogens recruit specific cortical 5-HT2A receptor-mediated signaling pathways to affect behavior. Neuron, 53, 439-452 (2007)[PubMed]
- Zhang, G., Li, J., Purkayastha, S. et al.: Hypothalamic programming of systemic ageing involving IKK-β, NF-κB and GnRH. Nature, 497, 211-216 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 名古屋大学大学院医学系研究科 修了,同年 名城大学薬学部 研究員,2012年 米国Icahn School of Medicine at Mount Sinai博士研究員を経て,2015年より名城大学薬学部 助教.
研究テーマ:精神疾患における異常な免疫応答およびエピジェネティックな制御の関与.
抱負:既存の薬物の再評価により新たな治療の戦略を探っていきたい.
© 2017 衣斐 大祐 Licensed under CC 表示 2.1 日本