エンドセリン受容体B型とその拮抗薬との複合体の結晶構造
志甫谷 渉・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:志甫谷 渉,濡木 理
DOI: 10.7875/first.author.2017.084
X-ray structures of endothelin ETB receptor bound to clinical antagonist bosentan and its analog.
Wataru Shihoya, Tomohiro Nishizawa, Keitaro Yamashita, Asuka Inoue, Kunio Hirata, Francois Marie Ngako Kadji, Akiko Okuta, Kazutoshi Tani, Junken Aoki, Yoshinori Fujiyoshi, Tomoko Doi, Osamu Nureki
Nature Structural & Molecular Biology, 24, 758-764 (2017)
エンドセリン受容体は血圧の調整において重要な機能をもつGタンパク質共役受容体であり,循環器系の疾患やがんに対する創薬の標的である.エンドセリン受容体に対する拮抗薬であるボセンタンは,最初の肺動脈性肺高血圧症に対する経口投与性の治療薬である.この研究において,筆者らは,ヒトに由来するエンドセリン受容体B型とボセンタンとの複合体,および,ボセンタンの高親和性誘導体であるK-8794との複合体の結晶構造を決定した.それらの構造情報から,エンドセリン受容体B型と拮抗薬との詳細な結合様式が明らかにされた.エンドセリン受容体B型とボセンタンとの複合体の構造を内在性の作動薬であるエンドセリン-1との複合体の構造と比較したところ,ボセンタンはエンドセリン-1を部分的に模倣するかたちでエンドセリン受容体B型と相互作用していた.しかし,ボセンタンはエンドセリン受容体B型の構造変化を立体障害によりさまたげることにより,作動薬ではなく拮抗薬として機能していた.こうしたボセンタンとエンドセリン受容体B型との構造活性の相関情報は,エンドセリン受容体に対する新規の薬剤の理論的な開発に役だつものと考えられる.
エンドセリン受容体は内在性のペプチドホルモンであるエンドセリン-1により活性化されるGタンパク質共役受容体である.エンドセリン受容体にはA型とB型があり,血圧の調整,塩分の排出,細胞の増殖などのさまざまな生理機能を担う1).エンドセリン-1の異常な亢進は肺動脈性肺高血圧症,うっ血性心不全,心室性不全,虚血性心疾患,慢性腎不全などの循環器系の疾患につながる.さらに,エンドセリン-1とその受容体を介したオートクリンやパラクリンのシグナルはがん細胞の増殖や生存にかかわる2).エンドセリン受容体はこうした疾患に対する創薬の標的として注目されており,長いあいだ,エンドセリン-1の作用を拮抗的に阻害するエンドセリン受容体の拮抗薬の開発がつづけられてきた.
その代表例が,エンドセリン受容体のサブタイプに非選択的な拮抗薬であるボセンタンである.ボセンタンはハイスループットスクリーニングにより選抜された低分子化合物で,最初に認可された肺動脈性肺高血圧症に対する経口投与性の治療薬である3).肺動脈性肺高血圧症それ自体は稀少疾患であるものの,全世界におけるボセンタンの売り上げは過去に年間1000億円をこえていたこともある4).しかし,エンドセリン受容体に対するボセンタンの結合能は低く解離も速いため,より薬効の高い薬剤の創出をめざしボセンタンをもとにして多数のエンドセリン受容体の拮抗薬が開発されてきた.しかし,ボセンタンあるいはその誘導体のエンドセリン受容体への結合様式については未知な点が多く,エンドセリン受容体の構造情報をもとにした拮抗薬の開発は困難であった.
これまでに,筆者らの研究グループは,ヒトに由来するエンドセリン受容体B型とその内在性の作動薬であるエンドセリン-1との複合体,および,リガンドの結合していないエンドセリン受容体B型の結晶構造を決定し,エンドセリン-1によるエンドセリン受容体B型の活性化の機構を明らかにしていた5)(新着論文レビュー でも掲載).しかし,低分子化合物であるボセンタンはペプチドホルモンであるエンドセリン-1とはまったく異なり,エンドセリン受容体B型とエンドセリン-1との複合体の構造情報からボセンタンの結合様式を類推することは不可能であった.そのため,エンドセリン受容体とボセンタンなど拮抗薬との複合体の構造情報が待ち望まれていた.
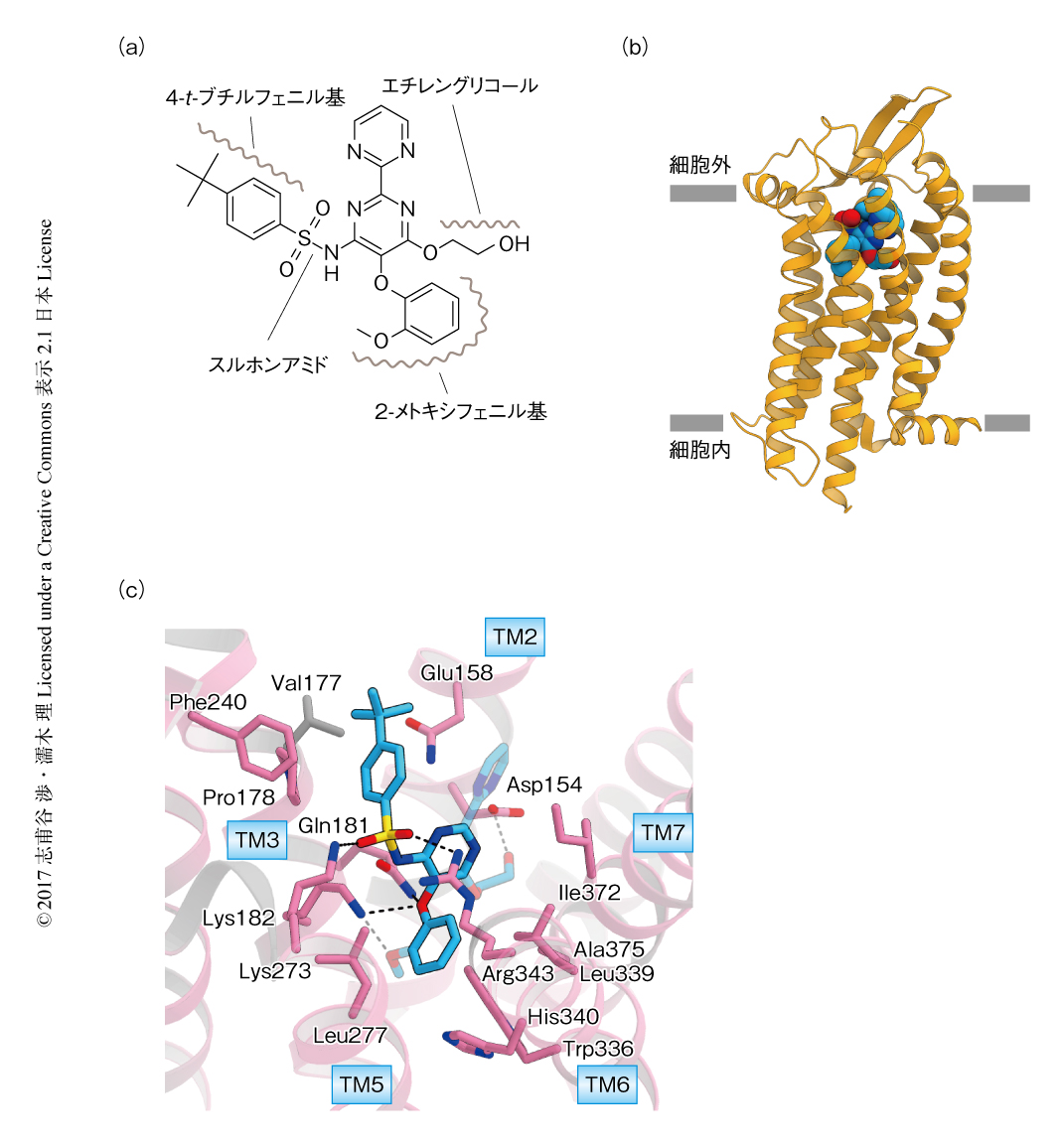
エンドセリン受容体B型と拮抗薬との複合体の結晶化に際しては,以前の研究において作製した,安定化のための変異を導入し細胞内第3ループにT4リゾチームを挿入した改変型のエンドセリン受容体B型を用いた6).この改変体とボセンタン(図1a),および,ボセンタンの高親和性の誘導体であるK-8794との共結晶化に成功し,それぞれ,分解能3.6Åおよび2.2Åで構造を決定した(PDB ID:5XPRおよびPDB ID:5X93).以下,エンドセリン受容体B型と実際に治療薬として使われているボセンタンとの複合体の構造(図1b)について述べる.
ボセンタンはヒトのようなかたちをしており,スルホンアミドを中心とした芳香族性の部分の多い化合物である.ボセンタンのスルホンアミドはエンドセリン受容体B型のLys181,Lys273,Arg343といった正電荷をもつ残基と電荷相補的な相互作用を形成していた(図1c).ボセンタンの4-t-ブチルフェニル基はエンドセリン受容体B型の細胞外第2ループのβシートの直下のPhe240,Val177,Pro178と疎水性相互作用を形成していた.ボセンタンはエンドセリン受容体B型のTrp336,Val185,His340,Leu277,Leu339にかこまれた疎水性のポケットにはまり込んでいた.さらに,ボセンタンのエーテル酸素原子とエンドセリン受容体B型のAsn181およびLys182が水素結合を形成していた.ボセンタンのエチレングリコール部分の水酸基はエンドセリン受容体B型のAsp154と水素結合を形成していた.全体としては,ボセンタンのスルホンアミドとエーテル酸素がエンドセリン受容体B型により水素結合を介し認識されており,ほかの芳香族性の部分が膜貫通部位のポケットをうめていた.こうしたボセンタンの結合様式は,エンドセリン受容体との結合に対するスルホンアミド部分の重要性を示した過去の研究と合致した.さらに,エンドセリン受容体B型におけるボセンタンの結合部位は1残基を除きエンドセリン受容体A型においても保存されており,ボセンタンの結合様式はエンドセリン受容体A型とエンドセリン受容体B型とで等しいことが示唆された(図1c).
ボセンタンは内在性の作動薬であるエンドセリン-1をもとに開発されたわけではなく,エンドセリン-1との化学構造における類似点は少ない.しかし,エンドセリン受容体B型とボセンタンとの複合体の構造をエンドセリン-1との複合体の構造と比較すると,ボセンタンはエンドセリン-1との結合部位の底部をしめており,エンドセリン-1のC末端の3つの残基Ile19,Ile20,Trp336と非常によく重なっていた(図2a).ボセンタンのスルホンアミドはエンドセリン-1のC末端のカルボキシル基とよく重なり,共通した正電荷をもつ残基Lys182,Lys273,Arg343により認識されていた.さらに,ボセンタンのピリミジル基,4-t-ブチルフェニル基,2-メトキシフェニル基は,それぞれ,エンドセリン-1のIle19,Ile20,Trp21の側鎖に相当した.そして,基本的にボセンタンおよびエンドセリン-1はエンドセリン受容体B型の同じ残基により認識されていた.このように,ボセンタンあるいはエンドセリン-1のC末端の3つの残基とエンドセリン受容体B型との相互作用は非常に似ており,膜貫通部位における電荷相補的な相互作用および疎水的な相互作用が結合に重要であることが示された.
こうした相似性にもかかわらず,ボセンタンとの結合にともなうエンドセリン受容体B型の構造変化はエンドセリン-1との結合にともなうものとはまったく異なっていた(図2b).筆者らの過去の研究により,エンドセリン-1によるエンドセリン受容体B型の膜貫通へリックス6および膜貫通へリックス7の内側への4Åの動きがエンドセリン受容体B型の活性化に重要であることが明らかにされている5).この動きはおもに,エンドセリン-1のAsp18およびカルボニル基がエンドセリン受容体B型のArg343を引き寄せることによる.ボセンタンはエンドセリン-1のAsp18に相当する負電荷をもつ部分をもたない.さらに,ボセンタンの2-メトキシフェニル基はエンドセリン-1のTrp21の側鎖と比較して膜貫通へリックス6の方向に突き出ており,膜貫通へリックス6の構造変化を立体障害によりさまたげる.さらに,ボセンタンは膜貫通へリックス7との相互作用がほとんどないため,膜貫通へリックス7の構成するポケットの内部へと動かない.こうした違いにより,ボセンタンとの結合にともなうエンドセリン受容体B型の膜貫通へリックス6および膜貫通へリックス7の動きはわずかになるため,ボセンタンは作動薬ではなく拮抗薬として機能すると考えられた.
筆者らは2016年に,エンドセリン受容体B型とエンドセリン-1との複合体およびリガンドと結合していないエンドセリン受容体B型の構造を発表しており5),その構造解析に対する蓄積があったため,着手から約半年という比較的短い期間でエンドセリン受容体B型と拮抗薬との複合体の構造を決定することができた.とくに,ボセンタンとの複合体の構造については,当時,SPring-8のビームラインBL32XUにおいて開発していた自動測定システムZOOを用いてデータを収集することができた.近年,急速に普及している低温電子顕微鏡を用いた単粒子解析法も含め,自動測定技術の革新が構造生物学を新たな段階へと進めていることを実感している.
しかし,昨今のトップジャーナルをにぎわせる構造生物学分野における論文のレベルは飛躍的に上昇しており,医学的な重要性があるとはいえ,単に拮抗薬との複合体の構造にどのような科学的なインパクトを見い出せるのかは疑問に思っていた.論文の執筆にあたり,さまざまな状態のエンドセリン受容体B型の構造を比較していたところ,ある日,ボセンタンとエンドセリン-1のC末端との相互作用がきわめて似ていることに気づき“ビビッ”とくる瞬間があった.そこからアイディアを言葉に表現し新規性をどう主張するか苦労した面も多かったが,最終的に論文が掲載されたことに満足している.
今後のエンドセリン受容体の研究における課題のひとつは,小分子拮抗薬によるサブタイプの選択性の分子機構である.エンドセリン受容体のA型およびB型のそれぞれに選択的に結合する拮抗薬は多く開発されているものの,結合部位と推定される膜貫通領域の残基は高度に保存されているため,現状では,サブタイプの選択性については限定的な理解にとどまっている.今後,エンドセリン受容体A型の構造を決定することにより,こうした機構を明らかにし薬剤の自在なデザインを可能にしたいと考えている.
略歴:2017年 名古屋大学大学院創薬科学研究科博士課程 修了,同年より東京大学大学院理学系研究科 研究員.
研究テーマ:Gタンパク質共役受容体の構造および機能.
抱負:安易に競争に流されない.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2017 志甫谷 渉・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:志甫谷 渉,濡木 理
DOI: 10.7875/first.author.2017.084
X-ray structures of endothelin ETB receptor bound to clinical antagonist bosentan and its analog.
Wataru Shihoya, Tomohiro Nishizawa, Keitaro Yamashita, Asuka Inoue, Kunio Hirata, Francois Marie Ngako Kadji, Akiko Okuta, Kazutoshi Tani, Junken Aoki, Yoshinori Fujiyoshi, Tomoko Doi, Osamu Nureki
Nature Structural & Molecular Biology, 24, 758-764 (2017)
要 約
エンドセリン受容体は血圧の調整において重要な機能をもつGタンパク質共役受容体であり,循環器系の疾患やがんに対する創薬の標的である.エンドセリン受容体に対する拮抗薬であるボセンタンは,最初の肺動脈性肺高血圧症に対する経口投与性の治療薬である.この研究において,筆者らは,ヒトに由来するエンドセリン受容体B型とボセンタンとの複合体,および,ボセンタンの高親和性誘導体であるK-8794との複合体の結晶構造を決定した.それらの構造情報から,エンドセリン受容体B型と拮抗薬との詳細な結合様式が明らかにされた.エンドセリン受容体B型とボセンタンとの複合体の構造を内在性の作動薬であるエンドセリン-1との複合体の構造と比較したところ,ボセンタンはエンドセリン-1を部分的に模倣するかたちでエンドセリン受容体B型と相互作用していた.しかし,ボセンタンはエンドセリン受容体B型の構造変化を立体障害によりさまたげることにより,作動薬ではなく拮抗薬として機能していた.こうしたボセンタンとエンドセリン受容体B型との構造活性の相関情報は,エンドセリン受容体に対する新規の薬剤の理論的な開発に役だつものと考えられる.
はじめに
エンドセリン受容体は内在性のペプチドホルモンであるエンドセリン-1により活性化されるGタンパク質共役受容体である.エンドセリン受容体にはA型とB型があり,血圧の調整,塩分の排出,細胞の増殖などのさまざまな生理機能を担う1).エンドセリン-1の異常な亢進は肺動脈性肺高血圧症,うっ血性心不全,心室性不全,虚血性心疾患,慢性腎不全などの循環器系の疾患につながる.さらに,エンドセリン-1とその受容体を介したオートクリンやパラクリンのシグナルはがん細胞の増殖や生存にかかわる2).エンドセリン受容体はこうした疾患に対する創薬の標的として注目されており,長いあいだ,エンドセリン-1の作用を拮抗的に阻害するエンドセリン受容体の拮抗薬の開発がつづけられてきた.
その代表例が,エンドセリン受容体のサブタイプに非選択的な拮抗薬であるボセンタンである.ボセンタンはハイスループットスクリーニングにより選抜された低分子化合物で,最初に認可された肺動脈性肺高血圧症に対する経口投与性の治療薬である3).肺動脈性肺高血圧症それ自体は稀少疾患であるものの,全世界におけるボセンタンの売り上げは過去に年間1000億円をこえていたこともある4).しかし,エンドセリン受容体に対するボセンタンの結合能は低く解離も速いため,より薬効の高い薬剤の創出をめざしボセンタンをもとにして多数のエンドセリン受容体の拮抗薬が開発されてきた.しかし,ボセンタンあるいはその誘導体のエンドセリン受容体への結合様式については未知な点が多く,エンドセリン受容体の構造情報をもとにした拮抗薬の開発は困難であった.
これまでに,筆者らの研究グループは,ヒトに由来するエンドセリン受容体B型とその内在性の作動薬であるエンドセリン-1との複合体,および,リガンドの結合していないエンドセリン受容体B型の結晶構造を決定し,エンドセリン-1によるエンドセリン受容体B型の活性化の機構を明らかにしていた5)(新着論文レビュー でも掲載).しかし,低分子化合物であるボセンタンはペプチドホルモンであるエンドセリン-1とはまったく異なり,エンドセリン受容体B型とエンドセリン-1との複合体の構造情報からボセンタンの結合様式を類推することは不可能であった.そのため,エンドセリン受容体とボセンタンなど拮抗薬との複合体の構造情報が待ち望まれていた.
1.エンドセリン受容体B型と拮抗薬との複合体の全体構造
エンドセリン受容体B型と拮抗薬との複合体の結晶化に際しては,以前の研究において作製した,安定化のための変異を導入し細胞内第3ループにT4リゾチームを挿入した改変型のエンドセリン受容体B型を用いた6).この改変体とボセンタン(図1a),および,ボセンタンの高親和性の誘導体であるK-8794との共結晶化に成功し,それぞれ,分解能3.6Åおよび2.2Åで構造を決定した(PDB ID:5XPRおよびPDB ID:5X93).以下,エンドセリン受容体B型と実際に治療薬として使われているボセンタンとの複合体の構造(図1b)について述べる.
ボセンタンはヒトのようなかたちをしており,スルホンアミドを中心とした芳香族性の部分の多い化合物である.ボセンタンのスルホンアミドはエンドセリン受容体B型のLys181,Lys273,Arg343といった正電荷をもつ残基と電荷相補的な相互作用を形成していた(図1c).ボセンタンの4-t-ブチルフェニル基はエンドセリン受容体B型の細胞外第2ループのβシートの直下のPhe240,Val177,Pro178と疎水性相互作用を形成していた.ボセンタンはエンドセリン受容体B型のTrp336,Val185,His340,Leu277,Leu339にかこまれた疎水性のポケットにはまり込んでいた.さらに,ボセンタンのエーテル酸素原子とエンドセリン受容体B型のAsn181およびLys182が水素結合を形成していた.ボセンタンのエチレングリコール部分の水酸基はエンドセリン受容体B型のAsp154と水素結合を形成していた.全体としては,ボセンタンのスルホンアミドとエーテル酸素がエンドセリン受容体B型により水素結合を介し認識されており,ほかの芳香族性の部分が膜貫通部位のポケットをうめていた.こうしたボセンタンの結合様式は,エンドセリン受容体との結合に対するスルホンアミド部分の重要性を示した過去の研究と合致した.さらに,エンドセリン受容体B型におけるボセンタンの結合部位は1残基を除きエンドセリン受容体A型においても保存されており,ボセンタンの結合様式はエンドセリン受容体A型とエンドセリン受容体B型とで等しいことが示唆された(図1c).
2.ボセンタンはエンドセリン-1を模倣している
ボセンタンは内在性の作動薬であるエンドセリン-1をもとに開発されたわけではなく,エンドセリン-1との化学構造における類似点は少ない.しかし,エンドセリン受容体B型とボセンタンとの複合体の構造をエンドセリン-1との複合体の構造と比較すると,ボセンタンはエンドセリン-1との結合部位の底部をしめており,エンドセリン-1のC末端の3つの残基Ile19,Ile20,Trp336と非常によく重なっていた(図2a).ボセンタンのスルホンアミドはエンドセリン-1のC末端のカルボキシル基とよく重なり,共通した正電荷をもつ残基Lys182,Lys273,Arg343により認識されていた.さらに,ボセンタンのピリミジル基,4-t-ブチルフェニル基,2-メトキシフェニル基は,それぞれ,エンドセリン-1のIle19,Ile20,Trp21の側鎖に相当した.そして,基本的にボセンタンおよびエンドセリン-1はエンドセリン受容体B型の同じ残基により認識されていた.このように,ボセンタンあるいはエンドセリン-1のC末端の3つの残基とエンドセリン受容体B型との相互作用は非常に似ており,膜貫通部位における電荷相補的な相互作用および疎水的な相互作用が結合に重要であることが示された.
3.ボセンタンがエンドセリン受容体B型の拮抗薬として機能する機序
こうした相似性にもかかわらず,ボセンタンとの結合にともなうエンドセリン受容体B型の構造変化はエンドセリン-1との結合にともなうものとはまったく異なっていた(図2b).筆者らの過去の研究により,エンドセリン-1によるエンドセリン受容体B型の膜貫通へリックス6および膜貫通へリックス7の内側への4Åの動きがエンドセリン受容体B型の活性化に重要であることが明らかにされている5).この動きはおもに,エンドセリン-1のAsp18およびカルボニル基がエンドセリン受容体B型のArg343を引き寄せることによる.ボセンタンはエンドセリン-1のAsp18に相当する負電荷をもつ部分をもたない.さらに,ボセンタンの2-メトキシフェニル基はエンドセリン-1のTrp21の側鎖と比較して膜貫通へリックス6の方向に突き出ており,膜貫通へリックス6の構造変化を立体障害によりさまたげる.さらに,ボセンタンは膜貫通へリックス7との相互作用がほとんどないため,膜貫通へリックス7の構成するポケットの内部へと動かない.こうした違いにより,ボセンタンとの結合にともなうエンドセリン受容体B型の膜貫通へリックス6および膜貫通へリックス7の動きはわずかになるため,ボセンタンは作動薬ではなく拮抗薬として機能すると考えられた.
おわりに
筆者らは2016年に,エンドセリン受容体B型とエンドセリン-1との複合体およびリガンドと結合していないエンドセリン受容体B型の構造を発表しており5),その構造解析に対する蓄積があったため,着手から約半年という比較的短い期間でエンドセリン受容体B型と拮抗薬との複合体の構造を決定することができた.とくに,ボセンタンとの複合体の構造については,当時,SPring-8のビームラインBL32XUにおいて開発していた自動測定システムZOOを用いてデータを収集することができた.近年,急速に普及している低温電子顕微鏡を用いた単粒子解析法も含め,自動測定技術の革新が構造生物学を新たな段階へと進めていることを実感している.
しかし,昨今のトップジャーナルをにぎわせる構造生物学分野における論文のレベルは飛躍的に上昇しており,医学的な重要性があるとはいえ,単に拮抗薬との複合体の構造にどのような科学的なインパクトを見い出せるのかは疑問に思っていた.論文の執筆にあたり,さまざまな状態のエンドセリン受容体B型の構造を比較していたところ,ある日,ボセンタンとエンドセリン-1のC末端との相互作用がきわめて似ていることに気づき“ビビッ”とくる瞬間があった.そこからアイディアを言葉に表現し新規性をどう主張するか苦労した面も多かったが,最終的に論文が掲載されたことに満足している.
今後のエンドセリン受容体の研究における課題のひとつは,小分子拮抗薬によるサブタイプの選択性の分子機構である.エンドセリン受容体のA型およびB型のそれぞれに選択的に結合する拮抗薬は多く開発されているものの,結合部位と推定される膜貫通領域の残基は高度に保存されているため,現状では,サブタイプの選択性については限定的な理解にとどまっている.今後,エンドセリン受容体A型の構造を決定することにより,こうした機構を明らかにし薬剤の自在なデザインを可能にしたいと考えている.
文 献
- Maguire, J. J. & Davenport, A. P.: Endothelin@25: new agonists, antagonists, inhibitors and emerging research frontiers: IUPHAR review 12. Br. J. Pharmacol., 171, 5555-5572 (2014)[PubMed]
- Rosano, L., Spinella, F. & Bagnato, A.: Endothelin 1 in cancer: biological implications and therapeutic opportunities. Nat. Rev. Cancer, 13, 637-651 (2013)[PubMed]
- Clozel, M., Breu V, Gray. G. A. et al.: Pharmacological characterization of bosentan, a new potent orally active nonpeptide endothelin receptor antagonist. J. Pharmacol. Exp. Ther., 270, 228-235 (1994)[PubMed]
- Norman, P.: Pulmonary arterial hypertension: a rare disease that encourages the development of multiple treatments. Expert Opin. Orphan Drugs, 2, 1137-1145 (2014)
- Shihoya, W., Nishizawa T., Okuta, A. et al.: Activation mechanism of endothelin ETB receptor by endothelin-1. Nature, 537, 363-368 (2016)[PubMed] [新着論文レビュー]
- Okuta, A., Tani, K., Nishimura, S. et al.: Thermostabilization of the human endothelin type B receptor. J. Mol. Biol., 428, 2265-2274 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 名古屋大学大学院創薬科学研究科博士課程 修了,同年より東京大学大学院理学系研究科 研究員.
研究テーマ:Gタンパク質共役受容体の構造および機能.
抱負:安易に競争に流されない.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2017 志甫谷 渉・濡木 理 Licensed under CC 表示 2.1 日本