糸状菌の産生するメロテルペノイド化合物の多様化の機構
森 貴裕・阿部郁朗
(東京大学大学院薬学系研究科 天然物化学教室)
email:森 貴裕,阿部郁朗
DOI: 10.7875/first.author.2017.081
Molecular basis for the unusual ring reconstruction in fungal meroterpenoid biogenesis.
Takahiro Mori, Taiki Iwabuchi, Shotaro Hoshino, Hang Wang, Yudai Matsuda, Ikuro Abe
Nature Chemical Biology, 13, 1066-1073 (2017)
微生物や植物から見い出されるメロテルペノイド化合物は,その顕著な生物活性から医薬品のシード化合物として注目されている.その構造の多様性および複雑性は,骨格を劇的に変換する生合成酵素により生じることが示されてきた.筆者らは,糸状菌に由来するメロテルペノイド化合物の生合成経路において主骨格であるD環のユニークな拡大反応にかかわる異性化酵素について,精密な機能解析およびX線結晶構造解析を実施した.Aspergillus terreusの産生するメロテルペノイド化合物terretoninの生合成遺伝子クラスターにコードされる新規の異性化酵素Trt14のin vitroにおける機能解析により,この酵素はD環の拡大反応のみならず,D環の連続的な加水分解反応をも触媒する多機能型の酵素であることが判明した.また,Trt14および類縁する酵素の結晶構造解析,さらに,結晶構造をもとにした変異体の解析の結果,Trt14のユニークな骨格変換反応および加水分解反応の詳細な機構が解明され,酵素による分子骨格の複雑化および多様化に関する機構の一端が明らかにされた.
メロテルペノイドは,植物や微生物などに広く見い出される,部分的にテルペノイド骨格を含む化合物の総称であり,顕著な生物活性を示すことから医薬品のリード化合物として有望視されている1).とくに,糸状菌に由来するメロテルペノイドは,その重要な生物活性にくわえ,複雑かつ多様な骨格構造をもつため,その生合成経路も研究の対象とされてきた.これまでの研究により,メロテルペノイド化合物における構造の多様性は,テルペン鎖の長さ,テルペン環化酵素の反応様式の違い,環化ののちの修飾反応,によりもたらされることが示されていた1).しかしながら,それら酵素の詳細な機能や反応機構については多くが明らかにされていない.この研究においては,糸状菌Aspergillus terreusに由来する複雑な骨格をもつメロテルペノイドterretoninの生合成にかかわる新規の異性化酵素Trt14について,in vitroにおける精密な機能解析およびX線結晶構造解析により,新規のメロテルペノイド異性化酵素スーパーファミリーの詳細な反応機構の解明をめざした.
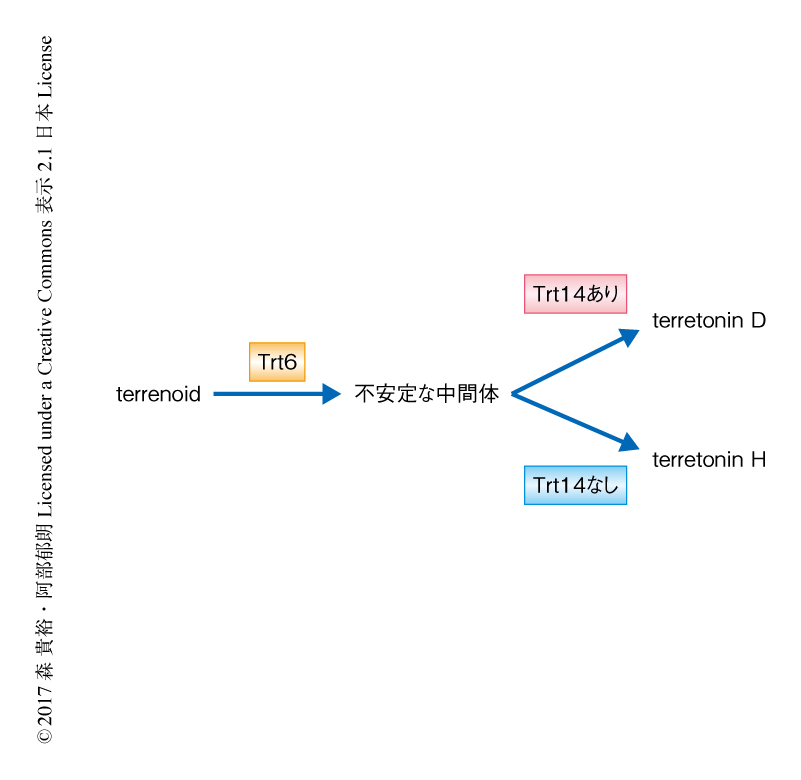
A. terreusに由来するメロテルペノイドterretoninの生合成遺伝子クラスターにコードされる,分子量約16,000の新規の異性化酵素Trt14は,シトクロムP450であるTrt6と協奏してD環のユニークな拡大反応を触媒する2).Trt6がterrenoidのB環のC6位およびC7位を酸化したのち,Trt14存在下においてはラクトン環のメタノリシスによるメトキシ基の転移が進行し,メトキシ基を保持したterretonin Dが生成される(図1).このように,Trt14は分子内におけるメトキシ基の転移をともなうD環のユニークな骨格変換反応を触媒する,これまでに例のない新しいタイプの異性化酵素である.しかしながら,B環のC6位およびC7位が酸化された予想中間体は非常に不安定なため,詳細な反応機構は明らかにされていなかった.そこで,Trt14の機能解析のため,予想中間体について安定な位置異性体を作製し,精製酵素を用いて酵素反応を行った.
terretoninの生合成遺伝子クラスターにコードされる7つの酵素を,Penicillium chrysogenumに由来するandrastin A生合成遺伝子クラスターにコードされるテルペン環化酵素であるAdrI 3) とともにAspergillus oryzaeに発現させたところ,C11-C12に二重結合をもつ予想中間体の位置異性体が生成された.この化合物は予想中間体と異なり非常に安定であったため,以降,この位置異性体を用いて実験した.
精製したTrt14と基質としてこの予想中間体の位置異性体を用いて酵素反応を行ったところ,C11-C12に二重結合をもつterretonin Dの異性体が生成された.このことから,仮説どおり,Trt14が予想中間体を基質としてD環の拡大反応を触媒することが示された.また,反応時間による生成物の変化をみたところ,段階的にさらに7つの化合物が生成された.各種のNMRスペクトルの測定により構造を決定したところ,それらはC11-C12に二重結合をもつterretonin Dの異性体のD環が異なる位置で加水分解された化合物であった.また,本来の生成物であるterretonin DにTrt14を作用させると,加水分解の進んだ化合物であるterretonin Hおよびterretonin HのD環が開いた化合物が生成された.すなわち,Trt14はD環の拡大反応のみならず,拡大したD環の加水分解反応をも触媒する多機能型酵素であった.
Trt14の詳細な反応機構の解明のため,X線結晶構造解析によりアポ型のTrt14の結晶構造を2.0Åの分解能で決定した(PDB ID:5WQF).さらに,Trt14と類縁する酵素であるaustinol生合成遺伝子クラスターにコードされるAusH 4)(Trt14との相同性は,30%)の結晶構造を1.8Åの分解能で(PDB ID:5X9K),paraherquonin生合成遺伝子クラスターにコードされるPrhC 5)(Trt14との相同性は,相同性31%)の結晶構造を2.1Åの分解能で決定した(PDB ID:5X9J).その全体構造は5本のαヘリックスと6枚のβシートからなるα+βバレル構造をとっていた(図2).1,2-エポキシド加水分解酵素などNTF2様スーパーファミリーに属する酵素はα+βバレル構造をもつことが知られているが,これらの酵素はTrt14とは機能的に異なりアミノ酸配列も相同性を示さない6).また,Trt14,AusH,PrhCの立体構造の比較から,酵素の中央に大きなポケットをもつことが明らかにされた.しかし,ポケットの形状やポケットを構成するアミノ酸残基はこれらの酵素のあいだでまったく保存されていなかった.
NTF2様スーパーファミリーに属する酵素はそれぞれ異なる反応を触媒するにもかかわらずその反応機構は類似しており,水酸基あるいはカルボニル基のCα位からのプロトンの引き抜きからはじまる酸-塩基触媒反応を行う.たとえば,よく研究されているエポキシド加水分解酵素Lsd19,MonBI,MonBIIは,Asp-TyrあるいはAsp-Gluの酸-塩基ペアを用いてエポキシドの開環反応を触媒する7,8).NTF2様スーパーファミリーに属するほかの酵素においても酸-塩基ペアの存在は確認されており,類似する反応を触媒する酵素のあいだで触媒残基は保存されている9).一方で,Trt14,AusH,PrhCのあいだで保存されている酸性残基および塩基性残基はポケットの外側,とくに二量体化の表面に位置していた.しかし,これらの酵素においても保存はされていないものの,ポケットの内部に複数の酸性残基および塩基性残基が存在し,このポケットを活性部位としてNTF2様スーパーファミリーに属する酵素と同様に酸-塩基反応を触媒すると推察された.この酸-塩基ペアの位置の違いは,おそらく受け入れる基質のA環,B環,C環や,プロトンの引き抜きの反応開始点が大きく異なるためと考えられた.
さらに詳細な解析のため,X線結晶構造解析によりTrt14と基質や生成物との複合体の結晶構造を決定した.Trt14と本来の生成物であるterretonin Dとの複合体の結晶構造を2.3Åの分解能(PDB ID:5WQG),Trt14と予想中間体の位置異性体との複合体およびC11-C12に二重結合をもつterretonin Dの異性体との複合体の結晶構造を2.1Åの分解能(PDB ID:5WQH),Trt14とC11-C12に二重結合をもつterretonin Dの異性体のD環が加水分解された化合物との複合体の結晶構造を1.9Åの分解能で決定した(PDB ID:5WQI).ソーキングされた化合物はポケットの内部に結合しており,このポケットが活性部位であることが示された.予想中間体の位置異性体をリガンドとしてソーキングしたところ結晶において酵素反応が進行し,5分間のソーキングにより予想中間体およびterretonin Dの異性体が,20分間のソーキングによりterretonin Dの異性体のD環が加水分解された化合物が,活性部位に結合した構造が得られた.この結果からも,Trt14が分子内におけるメトキシ基の転移をともなうD環の拡大反応,および,そののちのD環の加水分解を触媒するというin vitroにおける機能解析の結果が支持された.それぞれのリガンドの結合様式を比較した結果,基質あるいは生成物の水酸基は酵素の親水性残基などと水素結合を形成していた.基質あるいは生成物のA環,B環,C環と活性部位を構成するアミノ酸残基との相互作用は保存されていた一方,D環については,相互作用するアミノ酸残基は基質あるいは生成物により異なっていた.このように,活性部位のアミノ酸残基との水素結合ネットワークにより基質を固定し,異なるD環との結合様式によりD環の拡大反応およびそののちの加水分解反応の反応点を制御することにより,異なる生成物が生じることが推察された.
活性部位を構成するアミノ酸残基の役割を明らかにするため,D環と相互作用するTyr19,Arg31,Ser37,Arg39,Arg48をそれぞれAlaあるいはほかの疎水性残基と置換した変異体を作製し機能解析を行った.Tyr19,Arg39,Arg48をAlaに置換した変異体において予想中間体の位置異性体を基質としてD環の拡大反応をみたところ,野生型と比較して活性の低下がみられた.一方,Arg31をAlaに置換した変異体およびSer37をValに置換した変異体は野生型と同等の活性を維持していた.Tyr19をPheに置換した変異体においては野生型ではみられない3つの新規の生成物が得られた.
terretonin Dを基質として加水分解反応をみたところ,Arg31をAlaに置換した変異体およびSer37をValに置換した変異体は野生型と比較して十分な活性をもつ一方,Tyr19をAlaに置換した変異体,Tyr19をPheに置換した変異体,Arg39Alaに置換した変異体,Arg48をAlaに置換した変異体は,野生型の3~4割まで活性が低下し,また,おのおのの変異体において加水分解の選択性も変化した.この結果からも,基質と酵素の水素結合が基質の結合様式および反応部位を制御することが示唆された.
変異体の解析により,Tyr19,Arg39,Arg48がD環のメトキシ基の転移をともなう拡大反応およびそののちの加水分解反応に重要な役割を担うことが推察された.さらに,Tyr19をPheに置換した変異体はD環の拡大反応の活性を維持していたことから,Arg39およびArg48がTrt14による酸-塩基触媒反応の活性中心であると考えられた.また,Trt14によるD環の拡大反応の反応開始点としてはC7位あるいはC16位の水酸基が考えられたが,Ser37,Arg39,Arg48における変異体の解析から,Arg39と水素結合を形成するC7位が反応開始点であると考えられた.
結晶構造および変異体の解析をもとにTrt14の反応機構について考察した.Arg39が塩基として予想中間体のC7位の水酸基からプロトンを引き抜くことにより反応が開始する.生成したC7位のアルコキシドがC25位のメチルエステルにRe面から求核攻撃しラクトン中間体が生成する.ここで,酵素との水素結合により基質のコンフォメーションを固定し,メトキシ基とC15位とを近づけることにより分子内におけるメトキシ基の転移が可能になると考えられる.C14位とC15位とのあいだのC-C結合の開裂,および,生じたケト-エノール互変異性体へのC16位の水酸基からのプロトンの付加により,D環の開環した中間体が生成する.C16位のアルコキシドがラクトン環を開環しterretonin骨格を形成する.このとき,Arg48が酸触媒としてプロトンを付加する.
一方,加水分解反応については,D環の拡大したterretonin Dがふたたび活性部位に取り込まれ,水分子がC16位のメチルエステル基に求核攻撃するとエステルの加水分解が進行し,のちの自発的な脱炭酸によりterretonin Hが生成する.また,水分子がC17位に攻撃した場合はヘミアセタール中間体が生じ,D環が異なる位置で加水分解された化合物が生成する.水分子がterretonin DのC15位に攻撃するとterretonin HのD環が開いた化合物が生成する.
この研究においては,新規のメロテルペノイド異性化酵素Trt14が多機能酵素であること,そして,その立体構造および酸-塩基触媒残基によるD環の拡大反応および加水分解反応の機構が示された.また,AusHおよびPrhCの結晶構造から,ほかの糸状菌に分布する類縁の酵素も同様に酸-塩基触媒反応を行うことが示唆され,この新規のメロテルペノイド異性化酵素スーパーファミリーがメロテルペノイド化合物の複雑化および多様化に大きな役割をはたすものと考えられる.今後,Trt14の類縁の酵素の機能および構造をさらに解析することにより,酵素を利用した合成の困難な複雑な化合物の修飾など,生体触媒によるドラッグデザインへの応用が期待される.
略歴:2016年 東京大学大学院薬学系研究科 修了,同年よりスイスFederal Institute of Technology Zurich博士研究員.
研究テーマ:2次代謝産物の生合成酵素の立体構造解析.
関心事:ユニークな反応を触媒する酵素の機構.外貨為替.
阿部 郁朗(Ikuro Abe)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~tennen/head.htm
© 2017 森 貴裕・阿部郁朗 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 天然物化学教室)
email:森 貴裕,阿部郁朗
DOI: 10.7875/first.author.2017.081
Molecular basis for the unusual ring reconstruction in fungal meroterpenoid biogenesis.
Takahiro Mori, Taiki Iwabuchi, Shotaro Hoshino, Hang Wang, Yudai Matsuda, Ikuro Abe
Nature Chemical Biology, 13, 1066-1073 (2017)
要 約
微生物や植物から見い出されるメロテルペノイド化合物は,その顕著な生物活性から医薬品のシード化合物として注目されている.その構造の多様性および複雑性は,骨格を劇的に変換する生合成酵素により生じることが示されてきた.筆者らは,糸状菌に由来するメロテルペノイド化合物の生合成経路において主骨格であるD環のユニークな拡大反応にかかわる異性化酵素について,精密な機能解析およびX線結晶構造解析を実施した.Aspergillus terreusの産生するメロテルペノイド化合物terretoninの生合成遺伝子クラスターにコードされる新規の異性化酵素Trt14のin vitroにおける機能解析により,この酵素はD環の拡大反応のみならず,D環の連続的な加水分解反応をも触媒する多機能型の酵素であることが判明した.また,Trt14および類縁する酵素の結晶構造解析,さらに,結晶構造をもとにした変異体の解析の結果,Trt14のユニークな骨格変換反応および加水分解反応の詳細な機構が解明され,酵素による分子骨格の複雑化および多様化に関する機構の一端が明らかにされた.
はじめに
メロテルペノイドは,植物や微生物などに広く見い出される,部分的にテルペノイド骨格を含む化合物の総称であり,顕著な生物活性を示すことから医薬品のリード化合物として有望視されている1).とくに,糸状菌に由来するメロテルペノイドは,その重要な生物活性にくわえ,複雑かつ多様な骨格構造をもつため,その生合成経路も研究の対象とされてきた.これまでの研究により,メロテルペノイド化合物における構造の多様性は,テルペン鎖の長さ,テルペン環化酵素の反応様式の違い,環化ののちの修飾反応,によりもたらされることが示されていた1).しかしながら,それら酵素の詳細な機能や反応機構については多くが明らかにされていない.この研究においては,糸状菌Aspergillus terreusに由来する複雑な骨格をもつメロテルペノイドterretoninの生合成にかかわる新規の異性化酵素Trt14について,in vitroにおける精密な機能解析およびX線結晶構造解析により,新規のメロテルペノイド異性化酵素スーパーファミリーの詳細な反応機構の解明をめざした.
1.Trt14の精密な機能解析
A. terreusに由来するメロテルペノイドterretoninの生合成遺伝子クラスターにコードされる,分子量約16,000の新規の異性化酵素Trt14は,シトクロムP450であるTrt6と協奏してD環のユニークな拡大反応を触媒する2).Trt6がterrenoidのB環のC6位およびC7位を酸化したのち,Trt14存在下においてはラクトン環のメタノリシスによるメトキシ基の転移が進行し,メトキシ基を保持したterretonin Dが生成される(図1).このように,Trt14は分子内におけるメトキシ基の転移をともなうD環のユニークな骨格変換反応を触媒する,これまでに例のない新しいタイプの異性化酵素である.しかしながら,B環のC6位およびC7位が酸化された予想中間体は非常に不安定なため,詳細な反応機構は明らかにされていなかった.そこで,Trt14の機能解析のため,予想中間体について安定な位置異性体を作製し,精製酵素を用いて酵素反応を行った.
terretoninの生合成遺伝子クラスターにコードされる7つの酵素を,Penicillium chrysogenumに由来するandrastin A生合成遺伝子クラスターにコードされるテルペン環化酵素であるAdrI 3) とともにAspergillus oryzaeに発現させたところ,C11-C12に二重結合をもつ予想中間体の位置異性体が生成された.この化合物は予想中間体と異なり非常に安定であったため,以降,この位置異性体を用いて実験した.
精製したTrt14と基質としてこの予想中間体の位置異性体を用いて酵素反応を行ったところ,C11-C12に二重結合をもつterretonin Dの異性体が生成された.このことから,仮説どおり,Trt14が予想中間体を基質としてD環の拡大反応を触媒することが示された.また,反応時間による生成物の変化をみたところ,段階的にさらに7つの化合物が生成された.各種のNMRスペクトルの測定により構造を決定したところ,それらはC11-C12に二重結合をもつterretonin Dの異性体のD環が異なる位置で加水分解された化合物であった.また,本来の生成物であるterretonin DにTrt14を作用させると,加水分解の進んだ化合物であるterretonin Hおよびterretonin HのD環が開いた化合物が生成された.すなわち,Trt14はD環の拡大反応のみならず,拡大したD環の加水分解反応をも触媒する多機能型酵素であった.
2.Trt14および類縁する酵素のX線結晶構造解析
Trt14の詳細な反応機構の解明のため,X線結晶構造解析によりアポ型のTrt14の結晶構造を2.0Åの分解能で決定した(PDB ID:5WQF).さらに,Trt14と類縁する酵素であるaustinol生合成遺伝子クラスターにコードされるAusH 4)(Trt14との相同性は,30%)の結晶構造を1.8Åの分解能で(PDB ID:5X9K),paraherquonin生合成遺伝子クラスターにコードされるPrhC 5)(Trt14との相同性は,相同性31%)の結晶構造を2.1Åの分解能で決定した(PDB ID:5X9J).その全体構造は5本のαヘリックスと6枚のβシートからなるα+βバレル構造をとっていた(図2).1,2-エポキシド加水分解酵素などNTF2様スーパーファミリーに属する酵素はα+βバレル構造をもつことが知られているが,これらの酵素はTrt14とは機能的に異なりアミノ酸配列も相同性を示さない6).また,Trt14,AusH,PrhCの立体構造の比較から,酵素の中央に大きなポケットをもつことが明らかにされた.しかし,ポケットの形状やポケットを構成するアミノ酸残基はこれらの酵素のあいだでまったく保存されていなかった.
NTF2様スーパーファミリーに属する酵素はそれぞれ異なる反応を触媒するにもかかわらずその反応機構は類似しており,水酸基あるいはカルボニル基のCα位からのプロトンの引き抜きからはじまる酸-塩基触媒反応を行う.たとえば,よく研究されているエポキシド加水分解酵素Lsd19,MonBI,MonBIIは,Asp-TyrあるいはAsp-Gluの酸-塩基ペアを用いてエポキシドの開環反応を触媒する7,8).NTF2様スーパーファミリーに属するほかの酵素においても酸-塩基ペアの存在は確認されており,類似する反応を触媒する酵素のあいだで触媒残基は保存されている9).一方で,Trt14,AusH,PrhCのあいだで保存されている酸性残基および塩基性残基はポケットの外側,とくに二量体化の表面に位置していた.しかし,これらの酵素においても保存はされていないものの,ポケットの内部に複数の酸性残基および塩基性残基が存在し,このポケットを活性部位としてNTF2様スーパーファミリーに属する酵素と同様に酸-塩基反応を触媒すると推察された.この酸-塩基ペアの位置の違いは,おそらく受け入れる基質のA環,B環,C環や,プロトンの引き抜きの反応開始点が大きく異なるためと考えられた.
3.Trt14と基質との結合様式
さらに詳細な解析のため,X線結晶構造解析によりTrt14と基質や生成物との複合体の結晶構造を決定した.Trt14と本来の生成物であるterretonin Dとの複合体の結晶構造を2.3Åの分解能(PDB ID:5WQG),Trt14と予想中間体の位置異性体との複合体およびC11-C12に二重結合をもつterretonin Dの異性体との複合体の結晶構造を2.1Åの分解能(PDB ID:5WQH),Trt14とC11-C12に二重結合をもつterretonin Dの異性体のD環が加水分解された化合物との複合体の結晶構造を1.9Åの分解能で決定した(PDB ID:5WQI).ソーキングされた化合物はポケットの内部に結合しており,このポケットが活性部位であることが示された.予想中間体の位置異性体をリガンドとしてソーキングしたところ結晶において酵素反応が進行し,5分間のソーキングにより予想中間体およびterretonin Dの異性体が,20分間のソーキングによりterretonin Dの異性体のD環が加水分解された化合物が,活性部位に結合した構造が得られた.この結果からも,Trt14が分子内におけるメトキシ基の転移をともなうD環の拡大反応,および,そののちのD環の加水分解を触媒するというin vitroにおける機能解析の結果が支持された.それぞれのリガンドの結合様式を比較した結果,基質あるいは生成物の水酸基は酵素の親水性残基などと水素結合を形成していた.基質あるいは生成物のA環,B環,C環と活性部位を構成するアミノ酸残基との相互作用は保存されていた一方,D環については,相互作用するアミノ酸残基は基質あるいは生成物により異なっていた.このように,活性部位のアミノ酸残基との水素結合ネットワークにより基質を固定し,異なるD環との結合様式によりD環の拡大反応およびそののちの加水分解反応の反応点を制御することにより,異なる生成物が生じることが推察された.
4.Trt14の変異体の解析
活性部位を構成するアミノ酸残基の役割を明らかにするため,D環と相互作用するTyr19,Arg31,Ser37,Arg39,Arg48をそれぞれAlaあるいはほかの疎水性残基と置換した変異体を作製し機能解析を行った.Tyr19,Arg39,Arg48をAlaに置換した変異体において予想中間体の位置異性体を基質としてD環の拡大反応をみたところ,野生型と比較して活性の低下がみられた.一方,Arg31をAlaに置換した変異体およびSer37をValに置換した変異体は野生型と同等の活性を維持していた.Tyr19をPheに置換した変異体においては野生型ではみられない3つの新規の生成物が得られた.
terretonin Dを基質として加水分解反応をみたところ,Arg31をAlaに置換した変異体およびSer37をValに置換した変異体は野生型と比較して十分な活性をもつ一方,Tyr19をAlaに置換した変異体,Tyr19をPheに置換した変異体,Arg39Alaに置換した変異体,Arg48をAlaに置換した変異体は,野生型の3~4割まで活性が低下し,また,おのおのの変異体において加水分解の選択性も変化した.この結果からも,基質と酵素の水素結合が基質の結合様式および反応部位を制御することが示唆された.
変異体の解析により,Tyr19,Arg39,Arg48がD環のメトキシ基の転移をともなう拡大反応およびそののちの加水分解反応に重要な役割を担うことが推察された.さらに,Tyr19をPheに置換した変異体はD環の拡大反応の活性を維持していたことから,Arg39およびArg48がTrt14による酸-塩基触媒反応の活性中心であると考えられた.また,Trt14によるD環の拡大反応の反応開始点としてはC7位あるいはC16位の水酸基が考えられたが,Ser37,Arg39,Arg48における変異体の解析から,Arg39と水素結合を形成するC7位が反応開始点であると考えられた.
5.Trt14の酵素反応の機構
結晶構造および変異体の解析をもとにTrt14の反応機構について考察した.Arg39が塩基として予想中間体のC7位の水酸基からプロトンを引き抜くことにより反応が開始する.生成したC7位のアルコキシドがC25位のメチルエステルにRe面から求核攻撃しラクトン中間体が生成する.ここで,酵素との水素結合により基質のコンフォメーションを固定し,メトキシ基とC15位とを近づけることにより分子内におけるメトキシ基の転移が可能になると考えられる.C14位とC15位とのあいだのC-C結合の開裂,および,生じたケト-エノール互変異性体へのC16位の水酸基からのプロトンの付加により,D環の開環した中間体が生成する.C16位のアルコキシドがラクトン環を開環しterretonin骨格を形成する.このとき,Arg48が酸触媒としてプロトンを付加する.
一方,加水分解反応については,D環の拡大したterretonin Dがふたたび活性部位に取り込まれ,水分子がC16位のメチルエステル基に求核攻撃するとエステルの加水分解が進行し,のちの自発的な脱炭酸によりterretonin Hが生成する.また,水分子がC17位に攻撃した場合はヘミアセタール中間体が生じ,D環が異なる位置で加水分解された化合物が生成する.水分子がterretonin DのC15位に攻撃するとterretonin HのD環が開いた化合物が生成する.
おわりに
この研究においては,新規のメロテルペノイド異性化酵素Trt14が多機能酵素であること,そして,その立体構造および酸-塩基触媒残基によるD環の拡大反応および加水分解反応の機構が示された.また,AusHおよびPrhCの結晶構造から,ほかの糸状菌に分布する類縁の酵素も同様に酸-塩基触媒反応を行うことが示唆され,この新規のメロテルペノイド異性化酵素スーパーファミリーがメロテルペノイド化合物の複雑化および多様化に大きな役割をはたすものと考えられる.今後,Trt14の類縁の酵素の機能および構造をさらに解析することにより,酵素を利用した合成の困難な複雑な化合物の修飾など,生体触媒によるドラッグデザインへの応用が期待される.
文 献
- Matsuda, Y. & Abe, I.: Biosynthesis of fungal meroterpenoids. Nat. Prod. Rep., 33, 26-53 (2016)[PubMed]
- Matsuda, Y., Iwabuchi, T., Wakimoto, T. et al.: Uncovering the unusual D-ring construction in terretonin biosynthesis by collaboration of a multifunctional cytochrome P450 and a unique isomerase. J. Am. Chem. Soc., 137, 3393-3401 (2015)[PubMed]
- Matsuda, Y., Awakawa, T. & Abe, I.: Reconstituted biosynthesis of fungal meroterpenoid andrastin A. Tetrahedron, 69, 8199-8204 (2013)
- Matsuda, Y., Awakawa, T., Wakimoto, T. et al.: Spiro-ring formation is catalyzed by a multifunctional dioxygenase in austinol biosynthesis. J. Am. Chem. Soc., 135, 10962-10965 (2013)[PubMed]
- Matsuda, Y., Iwabuchi,T., Fujimoto, T. et al.: Discovery of key dioxygenases that diverged the paraherquonin and acetoxydehydroaustin pathways in Penicillium brasilianum. J. Am. Chem. Soc., 138, 12671-12677 (2016)[PubMed]
- Arand, M., Hallberg, B. M, Zou, J. et al.: Structure of Rhodococcus erythropolis limonene-1,2-epoxide hydrolase reveals a novel active site. EMBO J., 22, 2583-2592 (2003)[PubMed]
- Hotta, K., Chen, X., Paton, R. S. et al.: Enzymatic catalysis of anti-Baldwin ring closure in polyether biosynthesis. Nature, 483, 355-358 (2012)[PubMed]
- Minami, A., Migita, A., Inada. D. et al.: Enzymatic epoxide-opening cascades catalyzed by a pair of epoxide hydrolases in the ionophore polyether biosynthesis. Org. Lett., 13, 1638-1641 (2011)[PubMed]
- Eberhardt, R. Y. Chang, Y., Bateman, A. et al.: Filling out the structural map of the NTF2-like superfamily. BMC Bioinformatics, 14, 327 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 東京大学大学院薬学系研究科 修了,同年よりスイスFederal Institute of Technology Zurich博士研究員.
研究テーマ:2次代謝産物の生合成酵素の立体構造解析.
関心事:ユニークな反応を触媒する酵素の機構.外貨為替.
阿部 郁朗(Ikuro Abe)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~tennen/head.htm
© 2017 森 貴裕・阿部郁朗 Licensed under CC 表示 2.1 日本