配偶子に由来するDNAメチル化を維持した高品質なES細胞の樹立
八木正樹・山本拓也・山田泰広
(京都大学iPS細胞研究所 未来生命科学開拓部門)
email:八木正樹
DOI: 10.7875/first.author.2017.079
Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation.
Masaki Yagi, Satoshi Kishigami, Akito Tanaka, Katsunori Semi, Eiji Mizutani, Sayaka Wakayama, Teruhiko Wakayama, Takuya Yamamoto, Yasuhiro Yamada
Nature, 548, 224-227 (2017)
着床前胚の内部細胞塊から樹立されるES細胞は無限の増殖能および多分化能をもつことから,基礎医学の研究だけでなく再生医療への応用も期待されている.従来,マウスのES細胞の樹立および維持には血清およびLIFを含むS/L培地が用いられてきたが,近年,2種類の阻害化合物およびLIFを含む2i/L培地を用いることにより,血清なしでES細胞を効率よく樹立および維持することが可能になった.また,2i/L培地にて培養するとES細胞における遺伝子の発現パターンやDNAメチル化のレベルが内部細胞塊により類似することから,現在,汎用的に用いられている.しかしながら,今回,筆者らは,2i/L培地にて樹立したES細胞においてはゲノムインプリンティングとよばれる発生に重要なDNAメチル化が消失し,個体発生能が低下することを明らかにした.また,2i/L培地に含まれるMEK1/2阻害剤の濃度を低くする,あるいは,Src阻害剤にて代替することにより,ゲノムインプリンティングを維持したES細胞を効率よく樹立することに成功し,さらに,それらのES細胞は高い個体発生能をもつことが実証された.これらの発見はマウスおよびヒトの高品質な多能性幹細胞の樹立および維持に応用される可能性があり,再生医療および哺乳類の初期発生に関する研究への貢献につながることが期待される.
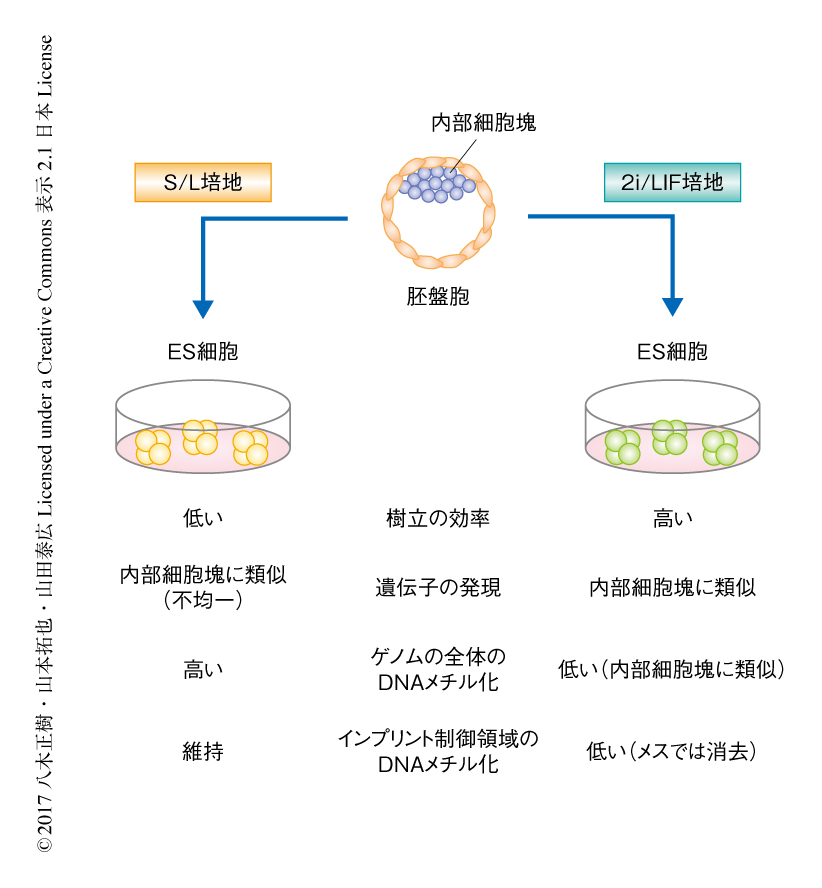
着床前胚の内部細胞塊より樹立されるES細胞は代表的な多能性幹細胞のひとつである.ES細胞は無限に増殖させることでき,また,さまざまな細胞へと分化させることが可能であることから,発生生物学を含む基礎医学の研究において有用であるのみならず,iPS細胞と同様に,再生医療への応用も期待されている.従来,ES細胞は血清およびLIF(leukemia inhibitory factor,白血病阻止因子)を含むS/L培地を用いて樹立および維持されてきた.しかしながら,これまでの研究により,S/L培地にて樹立したES細胞は多能性に関連する遺伝子として知られるNanog遺伝子やRex1遺伝子の発現パターンが不均一であることや,DNAメチル化のレベルが内部細胞塊と比べ高いことが明らかにされた.近年,MEK1/2阻害剤およびGSK3β阻害剤を添加することによりES細胞を血清なしで培養することが可能となり,現在,この2種類の阻害剤およびLIFを含む2i/L培地はES細胞の樹立および維持に汎用されている1).実際に,2i/L培地はS/L培地に比べ,ES細胞の樹立効率が高く,多能性に関連する遺伝子の発現パターンがより均一で,さらには,ゲノムの全体にわたるDNAメチル化のレベルが内部細胞塊と同じ程度になることが知られている2-4)(図1).しかしながら,2i/L培地にて樹立および維持したES細胞のエピゲノム状態の安定性や個体発生能などその品質について詳細には解析されていない.雌雄に特異的な配偶子に由来するDNAメチル化をひきつぐインプリント遺伝子は,父方アレルあるいは母方アレルの一方からのみ発現し,哺乳類の発生に重要であることが知られている5).しかしながら,アレルに特異的に制御されることから,多能性幹細胞において詳細に解析することは困難であった.そこで,筆者らは,父方アレルと母方アレルの区別が可能な胚を用いて,S/L培地および2/L培地にて樹立したES細胞を解析した.
父方のゲノムと母方のゲノムの区別が可能なマウスのかけ合わせによりF1世代の胚盤胞を得て,2i/L培地あるいはS/L培地を用いて雌雄につき複数の株のES細胞を樹立した.ここで用いたMSM/Msマウスは日本原産のマウスであり,一般に使用されるマウスと比べ1塩基多型(SNP)を数多くもつため6),樹立されたマウスのES細胞はアレルの区別が可能で,インプリント遺伝子に関連する解析をより高い精度で行うことができる.
これらのマウスのES細胞のDNAメチル化の状態を全ゲノムバイサルファイトシークエンス法およびメチルseq法にて解析したところ,これまでの報告と同様に,2i/L培地にて樹立したES細胞はゲノムの全体にわたりDNAメチル化に低い状態にあることがわかった.また,詳細な解析から,2i/L培地にて樹立したES細胞では一般にDNAメチル化の高い状態にあるトランスポゾンにおいてもDNAメチル化は低くなっており,さらに,受精ののちもDNAメチル化の維持されるインプリント制御領域におけるDNAメチル化も低下していた.S/L培地にて樹立したES細胞においてDNAメチル化は安定に維持されていたことから,2i/L培地にて特異的にインプリント制御領域におけるDNA脱メチル化の起こることが示唆された(図1).さらに,ゲノムインプリンティング以外の配偶子に特異的なDNAメチル化の情報も2i/L培地にて消失していた.DNA脱メチル化の程度は雌雄に差があり,メスのES細胞においてその程度は顕著であった.インプリント制御領域におけるDNAメチル化はインプリント遺伝子の片アレル性の発現制御に深くかかわることから,2i/L培地にて樹立したES細胞におけるインプリント遺伝子の発現パターンに着目した.RNA-seq解析から,2i/L培地にて樹立したES細胞においてインプリント遺伝子はインプリント制御領域におけるDNAメチル化の消失にともない両方のアレルから発現することがわかった.以上のことから,2i/L培地にて樹立したマウスのES細胞は発生に重要であるゲノムインプリンティングに異常が起こることが示された.
2i/Lにて樹立したマウスのES細胞において消失したゲノムインプリンティングが分化ののちどのように制御されるかを検証した.2i/L培地にて樹立したES細胞はゲノムインプリンティングを消失しているにもかかわらず3胚葉すべての系譜へ分化し効率的にキメラマウスに寄与した.しかし,2i/L培地にて樹立したES細胞をS/L培地にて培養した細胞,あるいは,2i/L培地にて樹立したES細胞から作製した胎仔線維芽細胞は,ゲノムの全体にわたりDNAメチル化されていたが,インプリント制御領域におけるDNAメチル化は依然として消失したままであった.このことから,2i/L培地にて樹立したマウスのES細胞において,インプリント制御領域以外のDNAメチル化の情報は可逆的である一方,インプリント制御領域は分化ののちにもDNAメチル化されないことが示された.
ゲノムインプリンティングは哺乳類における個体の発生に重要であることから,2i/L培地にて樹立したマウスのES細胞の個体発生能について核移植により検討した7).除核した卵にES細胞の核を移植し発生させた胚からクローンマウスが得られるかどうか検証したところ,S/L培地にて樹立したES細胞の核からはクローンマウスが得られたものの,2i/L培地にて樹立したES細胞の核からはクローンマウスは得られなかった.産仔が得られなかった原因をさぐるため,発生10.5日目のクローン胚の胎仔および胎盤を詳細に解析した結果,2i/L培地にて樹立したES細胞の核に由来するクローン胎盤において細胞接着の異常および壊死が高頻度に観察された.これまでの研究から,卵子に由来するDNAメチル化の情報により発現が抑制されるScml2遺伝子は,その抑制が胎盤の発育に重要であることが知られている8).実際に,2i/L培地にて樹立したES細胞は卵子に由来するDNAメチル化の情報を消失し,S/L培地にて樹立したES細胞と比べScml2遺伝子の発現が亢進していた.2i/L培地にて樹立したES細胞においてScml2遺伝子をノックアウトしたところ,Cdx2遺伝子の強制発現による栄養膜幹細胞様コロニー9) の形成率が上昇したことから,配偶子に特異的なDNAメチル化の情報の消失が胎盤の発育の異常の原因のひとつであると考えられた.
胚体組織の側への発生能について詳細に解析するため,4倍体補完法により個体発生能を評価した10).4倍体補完法とは,2細胞期胚を電気融合することにより4倍体胚を作製し,胚盤胞まで発生させES細胞を導入して個体を発生させるものである.4倍体胚は胎盤には寄与できるが胚体には寄与できない.したがって,産仔が得られた場合,その産仔は全身がES細胞に由来する細胞から構成される.4倍体補完法による産仔は,S/L培地にて樹立したES細胞からは得られたものの,2i/L培地にて樹立したES細胞からは得られなかった.また,発生14.5日目の胚において遺伝子の発現を解析したところ,2i/L培地にて樹立したES細胞に由来する胚においてインプリント遺伝子を含む多くの遺伝子の発現が異常を示した.
以上のことから,配偶子からひき継がれるDNAメチル化の情報はマウスにおける正常な胚体および胎盤の発生に重要であることが示唆された.
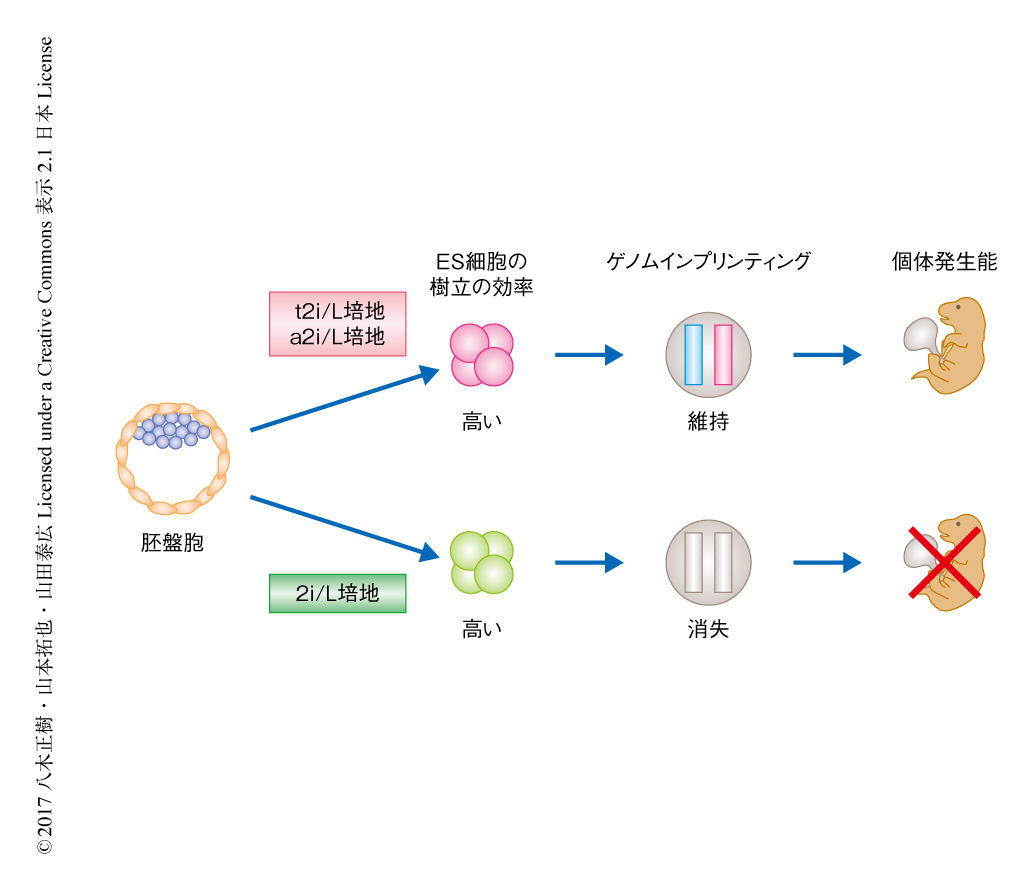
ここまでの結果から,2i/L培地にて樹立したマウスのES細胞は遺伝子の発現パターンなど内部細胞塊と類似した性質をもつ一方,配偶子に由来するひき継がれるべきDNAメチル化の情報が消失し,それにより個体発生能が低下することが明らかにされた.これらの課題を解決するため,ゲノムインプリンティングおよび個体発生能を維持したES細胞の樹立の条件を探索した.過去の報告により,MAPキナーゼ経路の抑制とDNAメチル化の低い状態とが関連づけられている11).そこで,MEK1/2阻害剤の濃度を通常の1/5にした培地,あるいは,MEK1/2阻害剤をSrc阻害剤により代替した培地12) によりES細胞を樹立した.この2つの培地は2i/L培地と同じ程度のES細胞の樹立の効率を示し,一般的にES細胞の樹立が困難とされるマウスの系統13) からも樹立することができた.さらに,RNA-seq解析から,この2つの培地にて樹立したES細胞における遺伝子の発現パターンは,S/L培地にて樹立したES細胞より2i/L培地にて樹立したES細胞に近いことが示された.MEK1/2阻害剤の濃度を通常の1/5にした培地あるいはMEK1/2阻害剤をSrc阻害剤により代替した培地にて樹立したES細胞のDNAメチル化の状態を解析したところ,インプリント制御領域におけるDNAメチル化はS/L培地にて樹立したES細胞と同じ程度に維持されていた.また,4倍体補完法により,この2つの培地にて樹立したES細胞から全身がES細胞に由来するマウスを高効率で作製することにも成功した.以上より,MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地により樹立されたマウスのES細胞は,インプリント制御領域におけるDNAメチル化の状態を維持し,さらに,高い個体発生能をもつことがわかった(図2).
マウスのES細胞におけるゲノムの全体およびインプリント制御領域におけるDNAメチル化の状態は,メスにおいてより低下する傾向にあった.その原因をさぐるため,ウェスタンブロット法によりDNAメチル化に関与する遺伝子の発現を比較した.その結果,すべての培養条件にて,メスのES細胞において,新規DNAメチル化酵素であるDnmt3aおよびDnmt3bにくわえ,維持DNAメチル化酵素の補因子であるUhrf1の発現量が低下していた.また,Uhrf1の低下は2本のX染色体の活性化の状態と相関していた.実際に,MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地により樹立されたメスのES細胞においても,長期にわたる培養ののちにインプリント制御領域におけるDNA脱メチル化が観察され,DNAメチル化は維持されないことが示唆された.つまり,2本の活性化したX染色体をもつメスのマウスのES細胞は,培養の過程において不安定なエピゲノム状態をとることが予想された.
2i/L培地は内部細胞塊の性質を模倣するかたちでマウスのES細胞を樹立および維持することができるとされ,多くの幹細胞研究者のあいだで汎用されてきた.しかしながら,受精ののちもDNAメチル化の維持されるインプリント制御領域を含む配偶子に由来するDNAメチル化の情報は,2i/L培地により樹立されたES細胞において消失することが明らかにされた.実際に,ゲノムインプリンティングの消失したES細胞は個体発生能が低下し,哺乳類の発生における配偶子に由来するゲノムインプリンティングの重要性が示された.MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地によるES細胞の樹立は,それらの問題点を解決する新たな手法になりうることが期待される一方,in vivoにおける多能性の状態がin vitroにおいていかに正確に模倣されるかについてはさらなる検証が必要である.今後,真なる多能性幹細胞の培養技術の開発により,多能性幹細胞を用いた再生医療,創薬の開発,基礎医学の研究など,種々の応用への道がさらに加速することが期待される.
略歴:京都大学大学院医学研究科博士後期課程 在学中.
研究テーマ:多能性幹細胞および発生におけるエピジェネティクス.
抱負:生物の発生や幹細胞の能力に魅力を感じ日々研究に励んでいます.好奇心を大切にしながら今後も研究生活を満喫したい.
山本 拓也(Takuya Yamamoto)
京都大学iPS細胞研究所 講師.
山田 泰広(Yasuhiro Yamada)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/ydy/
© 2017 八木正樹・山本拓也・山田泰広 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 未来生命科学開拓部門)
email:八木正樹
DOI: 10.7875/first.author.2017.079
Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation.
Masaki Yagi, Satoshi Kishigami, Akito Tanaka, Katsunori Semi, Eiji Mizutani, Sayaka Wakayama, Teruhiko Wakayama, Takuya Yamamoto, Yasuhiro Yamada
Nature, 548, 224-227 (2017)
要 約
着床前胚の内部細胞塊から樹立されるES細胞は無限の増殖能および多分化能をもつことから,基礎医学の研究だけでなく再生医療への応用も期待されている.従来,マウスのES細胞の樹立および維持には血清およびLIFを含むS/L培地が用いられてきたが,近年,2種類の阻害化合物およびLIFを含む2i/L培地を用いることにより,血清なしでES細胞を効率よく樹立および維持することが可能になった.また,2i/L培地にて培養するとES細胞における遺伝子の発現パターンやDNAメチル化のレベルが内部細胞塊により類似することから,現在,汎用的に用いられている.しかしながら,今回,筆者らは,2i/L培地にて樹立したES細胞においてはゲノムインプリンティングとよばれる発生に重要なDNAメチル化が消失し,個体発生能が低下することを明らかにした.また,2i/L培地に含まれるMEK1/2阻害剤の濃度を低くする,あるいは,Src阻害剤にて代替することにより,ゲノムインプリンティングを維持したES細胞を効率よく樹立することに成功し,さらに,それらのES細胞は高い個体発生能をもつことが実証された.これらの発見はマウスおよびヒトの高品質な多能性幹細胞の樹立および維持に応用される可能性があり,再生医療および哺乳類の初期発生に関する研究への貢献につながることが期待される.
はじめに
着床前胚の内部細胞塊より樹立されるES細胞は代表的な多能性幹細胞のひとつである.ES細胞は無限に増殖させることでき,また,さまざまな細胞へと分化させることが可能であることから,発生生物学を含む基礎医学の研究において有用であるのみならず,iPS細胞と同様に,再生医療への応用も期待されている.従来,ES細胞は血清およびLIF(leukemia inhibitory factor,白血病阻止因子)を含むS/L培地を用いて樹立および維持されてきた.しかしながら,これまでの研究により,S/L培地にて樹立したES細胞は多能性に関連する遺伝子として知られるNanog遺伝子やRex1遺伝子の発現パターンが不均一であることや,DNAメチル化のレベルが内部細胞塊と比べ高いことが明らかにされた.近年,MEK1/2阻害剤およびGSK3β阻害剤を添加することによりES細胞を血清なしで培養することが可能となり,現在,この2種類の阻害剤およびLIFを含む2i/L培地はES細胞の樹立および維持に汎用されている1).実際に,2i/L培地はS/L培地に比べ,ES細胞の樹立効率が高く,多能性に関連する遺伝子の発現パターンがより均一で,さらには,ゲノムの全体にわたるDNAメチル化のレベルが内部細胞塊と同じ程度になることが知られている2-4)(図1).しかしながら,2i/L培地にて樹立および維持したES細胞のエピゲノム状態の安定性や個体発生能などその品質について詳細には解析されていない.雌雄に特異的な配偶子に由来するDNAメチル化をひきつぐインプリント遺伝子は,父方アレルあるいは母方アレルの一方からのみ発現し,哺乳類の発生に重要であることが知られている5).しかしながら,アレルに特異的に制御されることから,多能性幹細胞において詳細に解析することは困難であった.そこで,筆者らは,父方アレルと母方アレルの区別が可能な胚を用いて,S/L培地および2/L培地にて樹立したES細胞を解析した.
1.父方アレルと母方アレルの区別が可能なマウスのES細胞の樹立
父方のゲノムと母方のゲノムの区別が可能なマウスのかけ合わせによりF1世代の胚盤胞を得て,2i/L培地あるいはS/L培地を用いて雌雄につき複数の株のES細胞を樹立した.ここで用いたMSM/Msマウスは日本原産のマウスであり,一般に使用されるマウスと比べ1塩基多型(SNP)を数多くもつため6),樹立されたマウスのES細胞はアレルの区別が可能で,インプリント遺伝子に関連する解析をより高い精度で行うことができる.
2.2i/L培地にて樹立したES細胞におけるゲノムインプリンティングの消失
これらのマウスのES細胞のDNAメチル化の状態を全ゲノムバイサルファイトシークエンス法およびメチルseq法にて解析したところ,これまでの報告と同様に,2i/L培地にて樹立したES細胞はゲノムの全体にわたりDNAメチル化に低い状態にあることがわかった.また,詳細な解析から,2i/L培地にて樹立したES細胞では一般にDNAメチル化の高い状態にあるトランスポゾンにおいてもDNAメチル化は低くなっており,さらに,受精ののちもDNAメチル化の維持されるインプリント制御領域におけるDNAメチル化も低下していた.S/L培地にて樹立したES細胞においてDNAメチル化は安定に維持されていたことから,2i/L培地にて特異的にインプリント制御領域におけるDNA脱メチル化の起こることが示唆された(図1).さらに,ゲノムインプリンティング以外の配偶子に特異的なDNAメチル化の情報も2i/L培地にて消失していた.DNA脱メチル化の程度は雌雄に差があり,メスのES細胞においてその程度は顕著であった.インプリント制御領域におけるDNAメチル化はインプリント遺伝子の片アレル性の発現制御に深くかかわることから,2i/L培地にて樹立したES細胞におけるインプリント遺伝子の発現パターンに着目した.RNA-seq解析から,2i/L培地にて樹立したES細胞においてインプリント遺伝子はインプリント制御領域におけるDNAメチル化の消失にともない両方のアレルから発現することがわかった.以上のことから,2i/L培地にて樹立したマウスのES細胞は発生に重要であるゲノムインプリンティングに異常が起こることが示された.
3.消失したゲノムインプリンティングの不可逆性
2i/Lにて樹立したマウスのES細胞において消失したゲノムインプリンティングが分化ののちどのように制御されるかを検証した.2i/L培地にて樹立したES細胞はゲノムインプリンティングを消失しているにもかかわらず3胚葉すべての系譜へ分化し効率的にキメラマウスに寄与した.しかし,2i/L培地にて樹立したES細胞をS/L培地にて培養した細胞,あるいは,2i/L培地にて樹立したES細胞から作製した胎仔線維芽細胞は,ゲノムの全体にわたりDNAメチル化されていたが,インプリント制御領域におけるDNAメチル化は依然として消失したままであった.このことから,2i/L培地にて樹立したマウスのES細胞において,インプリント制御領域以外のDNAメチル化の情報は可逆的である一方,インプリント制御領域は分化ののちにもDNAメチル化されないことが示された.
4.2i/L培地にて樹立したES細胞における個体発生能の低下
ゲノムインプリンティングは哺乳類における個体の発生に重要であることから,2i/L培地にて樹立したマウスのES細胞の個体発生能について核移植により検討した7).除核した卵にES細胞の核を移植し発生させた胚からクローンマウスが得られるかどうか検証したところ,S/L培地にて樹立したES細胞の核からはクローンマウスが得られたものの,2i/L培地にて樹立したES細胞の核からはクローンマウスは得られなかった.産仔が得られなかった原因をさぐるため,発生10.5日目のクローン胚の胎仔および胎盤を詳細に解析した結果,2i/L培地にて樹立したES細胞の核に由来するクローン胎盤において細胞接着の異常および壊死が高頻度に観察された.これまでの研究から,卵子に由来するDNAメチル化の情報により発現が抑制されるScml2遺伝子は,その抑制が胎盤の発育に重要であることが知られている8).実際に,2i/L培地にて樹立したES細胞は卵子に由来するDNAメチル化の情報を消失し,S/L培地にて樹立したES細胞と比べScml2遺伝子の発現が亢進していた.2i/L培地にて樹立したES細胞においてScml2遺伝子をノックアウトしたところ,Cdx2遺伝子の強制発現による栄養膜幹細胞様コロニー9) の形成率が上昇したことから,配偶子に特異的なDNAメチル化の情報の消失が胎盤の発育の異常の原因のひとつであると考えられた.
胚体組織の側への発生能について詳細に解析するため,4倍体補完法により個体発生能を評価した10).4倍体補完法とは,2細胞期胚を電気融合することにより4倍体胚を作製し,胚盤胞まで発生させES細胞を導入して個体を発生させるものである.4倍体胚は胎盤には寄与できるが胚体には寄与できない.したがって,産仔が得られた場合,その産仔は全身がES細胞に由来する細胞から構成される.4倍体補完法による産仔は,S/L培地にて樹立したES細胞からは得られたものの,2i/L培地にて樹立したES細胞からは得られなかった.また,発生14.5日目の胚において遺伝子の発現を解析したところ,2i/L培地にて樹立したES細胞に由来する胚においてインプリント遺伝子を含む多くの遺伝子の発現が異常を示した.
以上のことから,配偶子からひき継がれるDNAメチル化の情報はマウスにおける正常な胚体および胎盤の発生に重要であることが示唆された.
5.ゲノムインプリンティングおよび個体発生能を維持したES細胞の樹立法の探索
ここまでの結果から,2i/L培地にて樹立したマウスのES細胞は遺伝子の発現パターンなど内部細胞塊と類似した性質をもつ一方,配偶子に由来するひき継がれるべきDNAメチル化の情報が消失し,それにより個体発生能が低下することが明らかにされた.これらの課題を解決するため,ゲノムインプリンティングおよび個体発生能を維持したES細胞の樹立の条件を探索した.過去の報告により,MAPキナーゼ経路の抑制とDNAメチル化の低い状態とが関連づけられている11).そこで,MEK1/2阻害剤の濃度を通常の1/5にした培地,あるいは,MEK1/2阻害剤をSrc阻害剤により代替した培地12) によりES細胞を樹立した.この2つの培地は2i/L培地と同じ程度のES細胞の樹立の効率を示し,一般的にES細胞の樹立が困難とされるマウスの系統13) からも樹立することができた.さらに,RNA-seq解析から,この2つの培地にて樹立したES細胞における遺伝子の発現パターンは,S/L培地にて樹立したES細胞より2i/L培地にて樹立したES細胞に近いことが示された.MEK1/2阻害剤の濃度を通常の1/5にした培地あるいはMEK1/2阻害剤をSrc阻害剤により代替した培地にて樹立したES細胞のDNAメチル化の状態を解析したところ,インプリント制御領域におけるDNAメチル化はS/L培地にて樹立したES細胞と同じ程度に維持されていた.また,4倍体補完法により,この2つの培地にて樹立したES細胞から全身がES細胞に由来するマウスを高効率で作製することにも成功した.以上より,MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地により樹立されたマウスのES細胞は,インプリント制御領域におけるDNAメチル化の状態を維持し,さらに,高い個体発生能をもつことがわかった(図2).
6.マウスのES細胞の雌雄におけるエピゲノム状態の違い
マウスのES細胞におけるゲノムの全体およびインプリント制御領域におけるDNAメチル化の状態は,メスにおいてより低下する傾向にあった.その原因をさぐるため,ウェスタンブロット法によりDNAメチル化に関与する遺伝子の発現を比較した.その結果,すべての培養条件にて,メスのES細胞において,新規DNAメチル化酵素であるDnmt3aおよびDnmt3bにくわえ,維持DNAメチル化酵素の補因子であるUhrf1の発現量が低下していた.また,Uhrf1の低下は2本のX染色体の活性化の状態と相関していた.実際に,MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地により樹立されたメスのES細胞においても,長期にわたる培養ののちにインプリント制御領域におけるDNA脱メチル化が観察され,DNAメチル化は維持されないことが示唆された.つまり,2本の活性化したX染色体をもつメスのマウスのES細胞は,培養の過程において不安定なエピゲノム状態をとることが予想された.
おわりに
2i/L培地は内部細胞塊の性質を模倣するかたちでマウスのES細胞を樹立および維持することができるとされ,多くの幹細胞研究者のあいだで汎用されてきた.しかしながら,受精ののちもDNAメチル化の維持されるインプリント制御領域を含む配偶子に由来するDNAメチル化の情報は,2i/L培地により樹立されたES細胞において消失することが明らかにされた.実際に,ゲノムインプリンティングの消失したES細胞は個体発生能が低下し,哺乳類の発生における配偶子に由来するゲノムインプリンティングの重要性が示された.MEK1/2阻害剤の濃度を通常の1/5にした2i/L培地およびMEK1/2阻害剤をSrc阻害剤により代替した2i/L培地によるES細胞の樹立は,それらの問題点を解決する新たな手法になりうることが期待される一方,in vivoにおける多能性の状態がin vitroにおいていかに正確に模倣されるかについてはさらなる検証が必要である.今後,真なる多能性幹細胞の培養技術の開発により,多能性幹細胞を用いた再生医療,創薬の開発,基礎医学の研究など,種々の応用への道がさらに加速することが期待される.
文 献
- Ying, Q. L., Wray, J., Nichols, J. et al.: The ground state of embryonic stem cell self-renewal. Nature, 453, 519-523 (2008)[PubMed]
- Ficz, G., Hore, T. A., Santos, F. et al.: FGF signaling inhibition in ESCs drives rapid genome-wide demethylation to the epigenetic ground state of pluripotency. Cell Stem Cell, 13, 351-359 (2013)[PubMed]
- Habibi, E., Brinkman, A. B., Arand, J. et al.: Whole-genome bisulfite sequencing of two distinct interconvertible DNA methylomes of mouse embryonic stem cells. Cell Stem Cell, 13, 360-369 (2013)[PubMed]
- Marks, H., Kalkan, T., Menafra, R. et al.: The transcriptional and epigenomic foundations of ground state pluripotency. Cell, 149, 590-604 (2012)[PubMed]
- Surani, M. A., Barton, S. C. & Norris, M. L.: Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature, 308, 548-550 (1984)[PubMed]
- Takada, T., Ebata, T., Noguchi, H. et al.: The ancestor of extant Japanese fancy mice contributed to the mosaic genomes of classical inbred strains. Genome Res., 23, 1329-1338 (2013)[PubMed]
- Wakayama, T., Perry, A. C., Zuccotti, M. et al.: Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature, 394, 369-374 (1998)[PubMed]
- Branco, M. R., King, M., Perez-Garcia, V. et al.: Maternal DNA methylation regulates early trophoblast development. Dev. Cell, 36, 152-163 (2016)[PubMed]
- Niwa, H., Toyooka, Y., Shimosato, D. et al.: Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation. Cell, 123, 917-929 (2005)[PubMed]
- Nagy, A., Rossant, J., Nagy, R. et al.: Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc. Natl. Acad. Sci. USA, 90, 8424-8428 (1993)[PubMed]
- Choi, J., Clement, K., Huebner, A. J. et al.: DUSP9 modulates DNA hypomethylation in female mouse pluripotent stem cells. Cell Stem Cell, 20, 706-719.e7 (2017)[PubMed]
- Shimizu, T., Ueda, J., Ho, J. C. et al.: Dual inhibition of Src and GSK3 maintains mouse embryonic stem cells, whose differentiation is mechanically regulated by Src signaling. Stem Cells, 30, 1394-1404 (2012)[PubMed]
- Czechanski, A., Byers, C., Greenstein, I. et al.: Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nat. Protoc., 9, 559-574 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:京都大学大学院医学研究科博士後期課程 在学中.
研究テーマ:多能性幹細胞および発生におけるエピジェネティクス.
抱負:生物の発生や幹細胞の能力に魅力を感じ日々研究に励んでいます.好奇心を大切にしながら今後も研究生活を満喫したい.
山本 拓也(Takuya Yamamoto)
京都大学iPS細胞研究所 講師.
山田 泰広(Yasuhiro Yamada)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/ydy/
© 2017 八木正樹・山本拓也・山田泰広 Licensed under CC 表示 2.1 日本