ショウジョウバエのキノコ体における細胞のタイプに特異的な匂いの情報処理の機構
稲田健吾・風間北斗
(理化学研究所脳科学総合研究センター 知覚神経回路機構研究チーム)
email:稲田健吾,風間北斗
DOI: 10.7875/first.author.2017.077
Origins of cell-type-specific olfactory processing in the Drosophila mushroom body circuit.
Kengo Inada, Yoshiko Tsuchimoto, Hokto Kazama
Neuron, 95, 357-367.e4 (2017)
動物の脳はさまざまなタイプの細胞から構成される.脳の神経回路が機能をもつにあたり,おのおののタイプの細胞はそれぞれ異なる役割を担うと考えられるが,その役割の詳細やタイプごとの違いを生じる神経基盤についてはよくわかっていない.筆者らは,ショウジョウバエの成虫において匂いの情報処理をつかさどるキノコ体とよばれる領域に着目し,キノコ体の細胞のタイプに特異的な機能およびそれを生じる神経基盤の解明をめざした.キノコ体のKenyon細胞はα/β,α’/β’,γの3つのタイプに分類される.Kenyon細胞は約50個の糸球体から構成される触覚葉という領域から匂いの情報を興奮性のシグナルとして受け取る.3つのタイプのKenyon細胞が糸球体からの情報をどのように統合するのか,光遺伝学的な手法,2光子励起法,電気生理学的な手法を組み合わせて調べたところ,入力の統合においてタイプのあいだに差はなかった.興奮性の入力をうけたのちにおのおののタイプのKenyon細胞がどのようにふるまうのか調べたところ,α’/β’ Kenyon細胞はα/β Kenyon細胞あるいはγ Kenyon細胞よりも興奮しやすく,抑制性の細胞を強く活性化させることがわかった.そこで,α’/β’ Kenyon細胞は匂い刺激に対しもっともすばやく応答しかつより低濃度の匂い刺激に応答する,また,α’/β’ Kenyon細胞は低濃度の匂いの弁別に役だち適切な抑制性の入力がないとこの弁別能力がなくなる,という2つの仮説をたてた.これらの仮説を検証するため,おのおののタイプのKenyon細胞の匂いに対する応答をCa2+イメージング法により調べた結果,仮説の正しいことが確認された.これらの結果は,脳の神経回路における細胞のタイプに特異的な情報処理およびその神経基盤の一端を解明したものである.
脳はさまざまなタイプの細胞から構成される1-3).脳の神経回路が機能をもつにあたり,異なるタイプの細胞は異なる役割を担うと考えられている.しかし,脳には非常に多くのタイプの細胞が存在するため,それぞれがどのような役割をはたすのかをその機構まで含めて説明することは困難である.そのため,おのおのの細胞のタイプの役割の詳細やタイプごとの違いを生じる神経基盤についてはよくわかっていなかった.筆者らは,哺乳類と同様に多様なタイプの細胞をもち,特定のタイプの細胞を遺伝学的に標識あるいは操作しやすいショウジョウバエの成虫の脳を対象としてこの課題に取り組んだ.
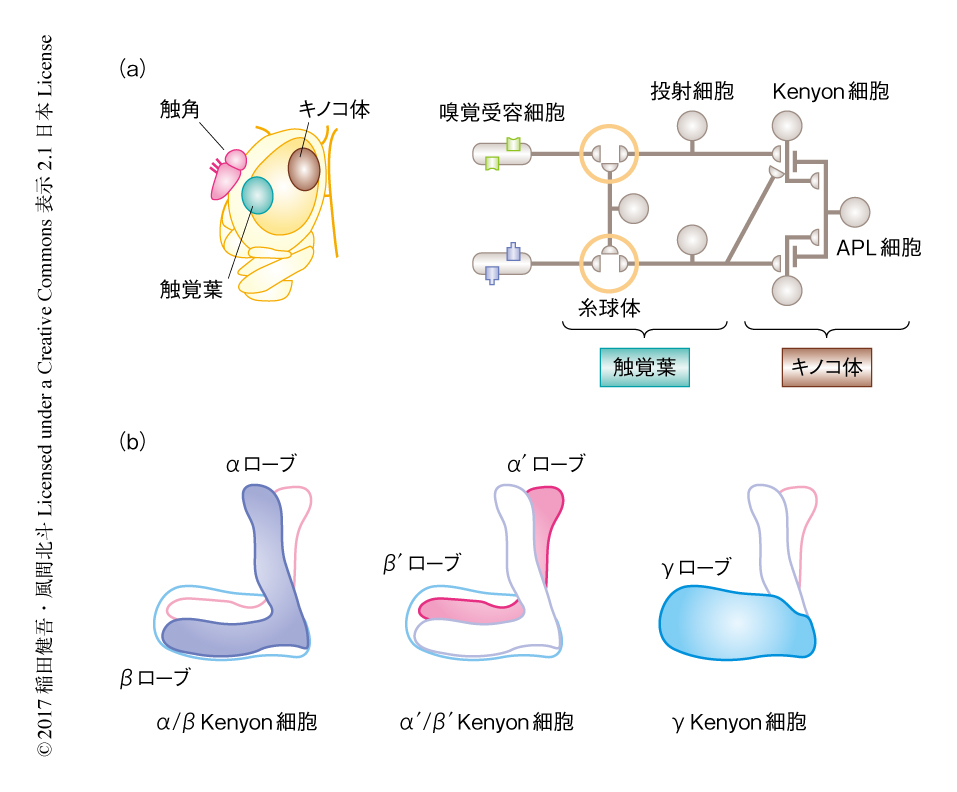
ショウジョウバエの脳にある神経回路のうち,匂いの情報を処理するキノコ体とよばれる領域に着目した.キノコ体は昆虫において匂いの記憶および学習をつかさどる4).触角にある嗅覚受容細胞において検出された匂いの情報は,1次嗅覚中枢である触覚葉へと伝達される(図1a).触覚葉は約50個の糸球体という球状の構造から構成されており,それぞれの糸球体は異なる匂いの情報を伝達する経路とみなすことができる.おのおのの糸球体に属する投射細胞は,触角葉における計算の結果を興奮性のシグナルとしてキノコ体に伝達する.
キノコ体は約2000個のKenyon細胞から構成される.Kenyon細胞は形態学的および発生学的な特徴から,α/β,α’/β’,γの3つのタイプに分類される5).α/β Kenyon細胞の軸索はαローブおよびβローブ,α’/β’ Kenyon細胞の軸索はα’ローブおよびβ’ローブ,γ Kenyon細胞の軸索はγローブを形成する(図1b).これらタイプの異なるKenyon細胞は,匂い応答や記憶学習に関して異なる性質をもつ.たとえば,α’/β’ Kenyon細胞は自発性の発火や匂い刺激に対する発火率がα/β Kenyon細胞あるいはγ Kenyon細胞より高い6).また,匂いの記憶学習において,α/β Kenyon細胞は想起や固定化,α’/β’ Kenyon細胞は獲得,γ Kenyon細胞は短期記憶に重要であることが示唆されている7,8).しかし,これらのKenyon細胞のタイプのあいだの差異の生じる機構はわかっていない.
筆者らは,Kenyon細胞へと興奮性の情報を伝達する投射細胞の活動を人為的に操作しつつ,Kenyon細胞から電気生理学的な記録をとることにより,細胞のタイプのあいだの差異を生じる神経基盤の解明,および,その結果から予想される匂いの情報処理への影響について検証した.
おのおののKenyon細胞は平均して7つの投射細胞から入力をうける9).これらの投射細胞からの興奮性の入力がKenyon細胞においてどのように統合されるか調べた.具体的には,2つの糸球体を同時に刺激した場合のKenyon細胞の応答と,それら2つの糸球体を1つずつ刺激した場合の応答とを比較した.触覚葉においておのおのの糸球体は互いに密接している.そのため,おのおのの糸球体(すなわち,おのおのの投射細胞)を個別かつ網羅的に刺激することは技術的にむずかしかった.そこで,近年,開発が進んだ光遺伝学的な手法と2光子励起法を組み合わせることにより個別の糸球体を刺激することを考えた.光遺伝学的な手法においては,細胞に光感受性タンパク質を発現させて光で刺激することにより,細胞を人為的に興奮させたり抑制させたりすることができる.異なる組み合わせの糸球体を網羅的に刺激するため,約50個のうち44個の糸球体に光感受性タンパク質を発現させた.一方,2光子励起法は分子を2つの光子により同時に励起する手法である.光源にはパルスレーザーを用いる.1つの光子でその分子を励起する場合と比べ,エネルギーが半分(波長が2倍)の光子を使うことができる.2光子励起は光子密度の高い場所においてのみ起こるため,深さ方向に関してより高い空間分解能が得られる.光遺伝学的な手法と2光子励起法を組み合せることにより,局所的な光による刺激と,それによる局所的な光感受性タンパク質の活性化が期待された.
キノコ体のKenyon細胞から全細胞記録により膜電位の記録をとりつつ,光により糸球体(正確には,糸球体およそ1つ分に相当する領域)を刺激した.その結果,2つの糸球体を同時に刺激したときのKenyon細胞の膜電位の応答は,1つずつ刺激した場合の応答の線形和とほぼ等しいことがわかった.刺激する糸球体の数を3つまで増やしても線形性は保存されていた.この投射細胞からの入力の統合において,異なるタイプのKenyon細胞のあいだに差異はなかった.これらの結果から,いずれのタイプのKenyon細胞でも複数の投射細胞からの入力が忠実に足し算されることが示された(図2).
興奮性の入力は細胞の膜電位を押し上げる.膜電位が上がり閾値をこえるとスパイクとよばれる一過性のパルスを発する発火という現象が起こるが,細胞の興奮度は発火率として定量化できる.投射細胞から興奮性の入力をうけたのち,おのおののタイプのKenyon細胞はどのくらい発火するのかを調べるため,膜電位と発火率との関係を解析した結果,α’/β’ Kenyon細胞,α/β Kenyon細胞,γ Kenyon細胞の順に興奮性の高いことがわかった(図2).この順序は,先行研究において報告されたおのおののタイプのKenyon細胞の匂い刺激に対する発火や自発性の発火率の順序と一致したため6),Kenyon細胞の内因性の興奮度が匂い応答を決める機構のひとつであることが示唆された.
触覚葉からキノコ体へ強い入力が入ると,GABA作動性のAPL細胞が活性化される.APL細胞はキノコ体の全体に投射しておりKenyon細胞を抑制する.Ca2+イメージング法を用いた先行研究においては,すべてのタイプのKenyon細胞が活動すると,APL細胞はすべてのタイプのKenyon細胞を回帰的に抑制すると報告されている10).
約13個の投射細胞に光感受性タンパク質を発現させて光により刺激しつつKenyon細胞から電気生理学的な記録をとると,投射細胞に由来する興奮性の入力にくわえ,抑制性の入力も観察された.この抑制性の入力についてくわしく解析するため,光感受性タンパク質を発現する投射細胞から直接の入力をうけていない,つまり,興奮性の成分のないKenyon細胞から電気生理学的な記録をとった.すると,先行研究からの予想とは異なり,刺激に対してかならずしもすべてのKenyon細胞が抑制されるわけではなく,一部のKenyon細胞は抑制されたが残りのKenyon細胞は抑制性の入力をうけていなかった.さらに,APL細胞がこの一部のKenyon細胞を抑制していることがわかった.そこで,先行研究において報告されたAPL細胞によるすべてのタイプのKenyon細胞の抑制をグローバル抑制,一部のKenyon細胞のみが抑制される現象をローカル抑制と名づけた.
Kenyon細胞に電流を流して発火させ,それによりAPL細胞を活性化させて,Kenyon細胞へとフィードバックされる抑制性の入力について解析した.すると,α’/β’ Kenyon細胞が発火したとき,α/β Kenyon細胞あるいはγ Kenyon細胞が発火したときと比べ,より強い抑制性の入力が入ることがわかった(図2).では,この細胞のタイプに特異的な差異は,Kenyon細胞からAPL細胞への機能的な結合と,APL細胞からKenyon細胞への機能的な結合の,どちらに起因するのだろうか.この問いに答えるため,APL細胞に光感受性タンパク質を発現させて光により活性化しつつKenyon細胞から(抑制性の)応答を記録した.その結果,APL細胞はすべてのタイプのKenyon細胞をほぼ同じ強度で抑制することがわかった.したがって,Kenyon細胞からAPL細胞への機能的な結合により細胞のタイプに特異的な差異が生じていると考えられた(図2).
APL細胞によるグローバル抑制とローカル抑制との関係について探るため,APL細胞にCa2+センサーであるGCaMPを発現させ,匂い刺激に対する応答について調べた.低濃度から高濃度までの匂い刺激をあたえつつ,APL細胞の活動をβローブ,β’ローブ,γローブにおいてイメージングした.その結果,低濃度の匂い刺激においてはAPL細胞の活動はβ’ローブにおいてより高く,βローブあるいはγローブにおいて低かった.これは,α’/β’ Kenyon細胞がより高い興奮性をもち,かつ,APL細胞とより強く機能的に結合するためと考えられた.匂い濃度を高くするとβローブやγローブにおいてもAPL細胞の活動がみられた.したがって,APL細胞は匂い刺激の強度に応じてローカル抑制とグローバル抑制の2つのモードを切り替えることが明らかにされた.
α’/β’ Kenyon細胞の興奮性がα/β Kenyon細胞あるいはγ Kenyon細胞と比べて高かったことから,2つの仮説をたてた.1つ目は,α’/β’ Kenyon細胞は匂い刺激に対してもっともすばやく応答するというもの,2つ目は,α’/β’ Kenyon細胞はより低い濃度の匂い刺激にも応答するというものである.これらの仮説を検証するため,GCaMPをすべてのKenyon細胞に発現させ,βローブ,β’ローブ,γローブの活動をイメージングした.1つ目の仮説に関して,高濃度の匂い刺激をあたえてからGCaMPの蛍光強度が上昇しはじめるまでの所要時間を比較したところ,α’/β’ Kenyon細胞はα/β Kenyon細胞あるいはγ Kenyon細胞よりも短い,すなわち,すばやく応答することがわかった.2つ目の仮説に関して,低濃度から高濃度までの匂い刺激をあたえたところ,低濃度においてα’/β’ Kenyon細胞は応答した一方,α/β Kenyon細胞およびγ Kenyon細胞は応答しなかった.匂い濃度を上昇させていくとα/β Kenyon細胞およびγ Kenyon細胞も応答しはじめた.これらの結果より,2つの仮説は両方とも正しいことが示された.
α’/β’ Kenyon細胞はより低濃度の匂い刺激にも応答するため,このタイプの細胞があることにより,キノコ体はより広範囲の濃度を弁別できる可能性がある.そこで,Ca2+イメージングにより得られた匂い応答を解析することにより,おのおののタイプのKenyon細胞の匂い濃度を弁別する能力を評価した.その結果,α’/β’ Kenyon細胞の応答を用いた場合,もっとも正確に匂い濃度を弁別できることがわかった.さらに,キノコ体への抑制性の入力を薬理学的に阻害するとこの弁別能力はいちじるしく低下した.これらの結果から,興奮性の高いタイプの細胞があることで実際に広範囲の濃度を弁別できること,また,この弁別能力には抑制性のフィードバックが重要な役割をはたすことが示された.
脳の高次領域には異なるタイプの細胞が数多く存在するが,この研究により,匂いの情報処理におけるその意義が明らかにされた.また,おのおののタイプの細胞に固有の機能が生じる機構の一端が解明された.今後,匂いの情報処理にすぐれた性質をもつタイプの細胞の解析を進めることにより,ヒトを含むあらゆる生物のもつ,匂いのすばやい検出や匂いの濃さを認識する能力の神経基盤の理解につながることが期待される.一方,この研究において扱ったキノコ体は昆虫の記憶および学習に重要な領域であることから,匂い情報が脳に記憶されるしくみをより深く理解することにもつながると考えられる.
略歴:理化学研究所脳科学総合研究センター テクニカルスタッフ.
研究テーマ:記憶をつかさどる機構の解明およびその工学分野への応用.
風間 北斗(Hokto Kazama)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://kazama.brain.riken.jp/index_jp.php
© 2017 稲田健吾・風間北斗 Licensed under CC 表示 2.1 日本
(理化学研究所脳科学総合研究センター 知覚神経回路機構研究チーム)
email:稲田健吾,風間北斗
DOI: 10.7875/first.author.2017.077
Origins of cell-type-specific olfactory processing in the Drosophila mushroom body circuit.
Kengo Inada, Yoshiko Tsuchimoto, Hokto Kazama
Neuron, 95, 357-367.e4 (2017)
要 約
動物の脳はさまざまなタイプの細胞から構成される.脳の神経回路が機能をもつにあたり,おのおののタイプの細胞はそれぞれ異なる役割を担うと考えられるが,その役割の詳細やタイプごとの違いを生じる神経基盤についてはよくわかっていない.筆者らは,ショウジョウバエの成虫において匂いの情報処理をつかさどるキノコ体とよばれる領域に着目し,キノコ体の細胞のタイプに特異的な機能およびそれを生じる神経基盤の解明をめざした.キノコ体のKenyon細胞はα/β,α’/β’,γの3つのタイプに分類される.Kenyon細胞は約50個の糸球体から構成される触覚葉という領域から匂いの情報を興奮性のシグナルとして受け取る.3つのタイプのKenyon細胞が糸球体からの情報をどのように統合するのか,光遺伝学的な手法,2光子励起法,電気生理学的な手法を組み合わせて調べたところ,入力の統合においてタイプのあいだに差はなかった.興奮性の入力をうけたのちにおのおののタイプのKenyon細胞がどのようにふるまうのか調べたところ,α’/β’ Kenyon細胞はα/β Kenyon細胞あるいはγ Kenyon細胞よりも興奮しやすく,抑制性の細胞を強く活性化させることがわかった.そこで,α’/β’ Kenyon細胞は匂い刺激に対しもっともすばやく応答しかつより低濃度の匂い刺激に応答する,また,α’/β’ Kenyon細胞は低濃度の匂いの弁別に役だち適切な抑制性の入力がないとこの弁別能力がなくなる,という2つの仮説をたてた.これらの仮説を検証するため,おのおののタイプのKenyon細胞の匂いに対する応答をCa2+イメージング法により調べた結果,仮説の正しいことが確認された.これらの結果は,脳の神経回路における細胞のタイプに特異的な情報処理およびその神経基盤の一端を解明したものである.
はじめに
脳はさまざまなタイプの細胞から構成される1-3).脳の神経回路が機能をもつにあたり,異なるタイプの細胞は異なる役割を担うと考えられている.しかし,脳には非常に多くのタイプの細胞が存在するため,それぞれがどのような役割をはたすのかをその機構まで含めて説明することは困難である.そのため,おのおのの細胞のタイプの役割の詳細やタイプごとの違いを生じる神経基盤についてはよくわかっていなかった.筆者らは,哺乳類と同様に多様なタイプの細胞をもち,特定のタイプの細胞を遺伝学的に標識あるいは操作しやすいショウジョウバエの成虫の脳を対象としてこの課題に取り組んだ.
ショウジョウバエの脳にある神経回路のうち,匂いの情報を処理するキノコ体とよばれる領域に着目した.キノコ体は昆虫において匂いの記憶および学習をつかさどる4).触角にある嗅覚受容細胞において検出された匂いの情報は,1次嗅覚中枢である触覚葉へと伝達される(図1a).触覚葉は約50個の糸球体という球状の構造から構成されており,それぞれの糸球体は異なる匂いの情報を伝達する経路とみなすことができる.おのおのの糸球体に属する投射細胞は,触角葉における計算の結果を興奮性のシグナルとしてキノコ体に伝達する.
キノコ体は約2000個のKenyon細胞から構成される.Kenyon細胞は形態学的および発生学的な特徴から,α/β,α’/β’,γの3つのタイプに分類される5).α/β Kenyon細胞の軸索はαローブおよびβローブ,α’/β’ Kenyon細胞の軸索はα’ローブおよびβ’ローブ,γ Kenyon細胞の軸索はγローブを形成する(図1b).これらタイプの異なるKenyon細胞は,匂い応答や記憶学習に関して異なる性質をもつ.たとえば,α’/β’ Kenyon細胞は自発性の発火や匂い刺激に対する発火率がα/β Kenyon細胞あるいはγ Kenyon細胞より高い6).また,匂いの記憶学習において,α/β Kenyon細胞は想起や固定化,α’/β’ Kenyon細胞は獲得,γ Kenyon細胞は短期記憶に重要であることが示唆されている7,8).しかし,これらのKenyon細胞のタイプのあいだの差異の生じる機構はわかっていない.
筆者らは,Kenyon細胞へと興奮性の情報を伝達する投射細胞の活動を人為的に操作しつつ,Kenyon細胞から電気生理学的な記録をとることにより,細胞のタイプのあいだの差異を生じる神経基盤の解明,および,その結果から予想される匂いの情報処理への影響について検証した.
1.糸球体からの興奮性の入力は細胞のタイプにかかわらず線形に加算される
おのおののKenyon細胞は平均して7つの投射細胞から入力をうける9).これらの投射細胞からの興奮性の入力がKenyon細胞においてどのように統合されるか調べた.具体的には,2つの糸球体を同時に刺激した場合のKenyon細胞の応答と,それら2つの糸球体を1つずつ刺激した場合の応答とを比較した.触覚葉においておのおのの糸球体は互いに密接している.そのため,おのおのの糸球体(すなわち,おのおのの投射細胞)を個別かつ網羅的に刺激することは技術的にむずかしかった.そこで,近年,開発が進んだ光遺伝学的な手法と2光子励起法を組み合わせることにより個別の糸球体を刺激することを考えた.光遺伝学的な手法においては,細胞に光感受性タンパク質を発現させて光で刺激することにより,細胞を人為的に興奮させたり抑制させたりすることができる.異なる組み合わせの糸球体を網羅的に刺激するため,約50個のうち44個の糸球体に光感受性タンパク質を発現させた.一方,2光子励起法は分子を2つの光子により同時に励起する手法である.光源にはパルスレーザーを用いる.1つの光子でその分子を励起する場合と比べ,エネルギーが半分(波長が2倍)の光子を使うことができる.2光子励起は光子密度の高い場所においてのみ起こるため,深さ方向に関してより高い空間分解能が得られる.光遺伝学的な手法と2光子励起法を組み合せることにより,局所的な光による刺激と,それによる局所的な光感受性タンパク質の活性化が期待された.
キノコ体のKenyon細胞から全細胞記録により膜電位の記録をとりつつ,光により糸球体(正確には,糸球体およそ1つ分に相当する領域)を刺激した.その結果,2つの糸球体を同時に刺激したときのKenyon細胞の膜電位の応答は,1つずつ刺激した場合の応答の線形和とほぼ等しいことがわかった.刺激する糸球体の数を3つまで増やしても線形性は保存されていた.この投射細胞からの入力の統合において,異なるタイプのKenyon細胞のあいだに差異はなかった.これらの結果から,いずれのタイプのKenyon細胞でも複数の投射細胞からの入力が忠実に足し算されることが示された(図2).
2.内因性の興奮度は細胞のタイプごとに異なる
興奮性の入力は細胞の膜電位を押し上げる.膜電位が上がり閾値をこえるとスパイクとよばれる一過性のパルスを発する発火という現象が起こるが,細胞の興奮度は発火率として定量化できる.投射細胞から興奮性の入力をうけたのち,おのおののタイプのKenyon細胞はどのくらい発火するのかを調べるため,膜電位と発火率との関係を解析した結果,α’/β’ Kenyon細胞,α/β Kenyon細胞,γ Kenyon細胞の順に興奮性の高いことがわかった(図2).この順序は,先行研究において報告されたおのおののタイプのKenyon細胞の匂い刺激に対する発火や自発性の発火率の順序と一致したため6),Kenyon細胞の内因性の興奮度が匂い応答を決める機構のひとつであることが示唆された.
3.α’/β’ Kenyon細胞は局所的な抑制性の入力を誘起する
触覚葉からキノコ体へ強い入力が入ると,GABA作動性のAPL細胞が活性化される.APL細胞はキノコ体の全体に投射しておりKenyon細胞を抑制する.Ca2+イメージング法を用いた先行研究においては,すべてのタイプのKenyon細胞が活動すると,APL細胞はすべてのタイプのKenyon細胞を回帰的に抑制すると報告されている10).
約13個の投射細胞に光感受性タンパク質を発現させて光により刺激しつつKenyon細胞から電気生理学的な記録をとると,投射細胞に由来する興奮性の入力にくわえ,抑制性の入力も観察された.この抑制性の入力についてくわしく解析するため,光感受性タンパク質を発現する投射細胞から直接の入力をうけていない,つまり,興奮性の成分のないKenyon細胞から電気生理学的な記録をとった.すると,先行研究からの予想とは異なり,刺激に対してかならずしもすべてのKenyon細胞が抑制されるわけではなく,一部のKenyon細胞は抑制されたが残りのKenyon細胞は抑制性の入力をうけていなかった.さらに,APL細胞がこの一部のKenyon細胞を抑制していることがわかった.そこで,先行研究において報告されたAPL細胞によるすべてのタイプのKenyon細胞の抑制をグローバル抑制,一部のKenyon細胞のみが抑制される現象をローカル抑制と名づけた.
Kenyon細胞に電流を流して発火させ,それによりAPL細胞を活性化させて,Kenyon細胞へとフィードバックされる抑制性の入力について解析した.すると,α’/β’ Kenyon細胞が発火したとき,α/β Kenyon細胞あるいはγ Kenyon細胞が発火したときと比べ,より強い抑制性の入力が入ることがわかった(図2).では,この細胞のタイプに特異的な差異は,Kenyon細胞からAPL細胞への機能的な結合と,APL細胞からKenyon細胞への機能的な結合の,どちらに起因するのだろうか.この問いに答えるため,APL細胞に光感受性タンパク質を発現させて光により活性化しつつKenyon細胞から(抑制性の)応答を記録した.その結果,APL細胞はすべてのタイプのKenyon細胞をほぼ同じ強度で抑制することがわかった.したがって,Kenyon細胞からAPL細胞への機能的な結合により細胞のタイプに特異的な差異が生じていると考えられた(図2).
4.APL細胞は匂い強度に応じておのおののタイプの細胞を抑制する
APL細胞によるグローバル抑制とローカル抑制との関係について探るため,APL細胞にCa2+センサーであるGCaMPを発現させ,匂い刺激に対する応答について調べた.低濃度から高濃度までの匂い刺激をあたえつつ,APL細胞の活動をβローブ,β’ローブ,γローブにおいてイメージングした.その結果,低濃度の匂い刺激においてはAPL細胞の活動はβ’ローブにおいてより高く,βローブあるいはγローブにおいて低かった.これは,α’/β’ Kenyon細胞がより高い興奮性をもち,かつ,APL細胞とより強く機能的に結合するためと考えられた.匂い濃度を高くするとβローブやγローブにおいてもAPL細胞の活動がみられた.したがって,APL細胞は匂い刺激の強度に応じてローカル抑制とグローバル抑制の2つのモードを切り替えることが明らかにされた.
5.α’/β’ Kenyon細胞は匂いのすばやい検出および濃度の弁別にすぐれる
α’/β’ Kenyon細胞の興奮性がα/β Kenyon細胞あるいはγ Kenyon細胞と比べて高かったことから,2つの仮説をたてた.1つ目は,α’/β’ Kenyon細胞は匂い刺激に対してもっともすばやく応答するというもの,2つ目は,α’/β’ Kenyon細胞はより低い濃度の匂い刺激にも応答するというものである.これらの仮説を検証するため,GCaMPをすべてのKenyon細胞に発現させ,βローブ,β’ローブ,γローブの活動をイメージングした.1つ目の仮説に関して,高濃度の匂い刺激をあたえてからGCaMPの蛍光強度が上昇しはじめるまでの所要時間を比較したところ,α’/β’ Kenyon細胞はα/β Kenyon細胞あるいはγ Kenyon細胞よりも短い,すなわち,すばやく応答することがわかった.2つ目の仮説に関して,低濃度から高濃度までの匂い刺激をあたえたところ,低濃度においてα’/β’ Kenyon細胞は応答した一方,α/β Kenyon細胞およびγ Kenyon細胞は応答しなかった.匂い濃度を上昇させていくとα/β Kenyon細胞およびγ Kenyon細胞も応答しはじめた.これらの結果より,2つの仮説は両方とも正しいことが示された.
α’/β’ Kenyon細胞はより低濃度の匂い刺激にも応答するため,このタイプの細胞があることにより,キノコ体はより広範囲の濃度を弁別できる可能性がある.そこで,Ca2+イメージングにより得られた匂い応答を解析することにより,おのおののタイプのKenyon細胞の匂い濃度を弁別する能力を評価した.その結果,α’/β’ Kenyon細胞の応答を用いた場合,もっとも正確に匂い濃度を弁別できることがわかった.さらに,キノコ体への抑制性の入力を薬理学的に阻害するとこの弁別能力はいちじるしく低下した.これらの結果から,興奮性の高いタイプの細胞があることで実際に広範囲の濃度を弁別できること,また,この弁別能力には抑制性のフィードバックが重要な役割をはたすことが示された.
おわりに
脳の高次領域には異なるタイプの細胞が数多く存在するが,この研究により,匂いの情報処理におけるその意義が明らかにされた.また,おのおののタイプの細胞に固有の機能が生じる機構の一端が解明された.今後,匂いの情報処理にすぐれた性質をもつタイプの細胞の解析を進めることにより,ヒトを含むあらゆる生物のもつ,匂いのすばやい検出や匂いの濃さを認識する能力の神経基盤の理解につながることが期待される.一方,この研究において扱ったキノコ体は昆虫の記憶および学習に重要な領域であることから,匂い情報が脳に記憶されるしくみをより深く理解することにもつながると考えられる.
文 献
- Ascoli, G. A., Alonso-Nanclares, L., Anderson, S. A. et al.: Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nat. Rev. Neurosci., 9, 557-568 (2008)[PubMed]
- Markram, H., Muller, E., Ramaswamy, S. et al.: Reconstruction and simulation of neocortical microcircuitry. Cell, 163, 456-492 (2015)[PubMed]
- Tasic, B., Menon, V., Nguyen, T. N. et al.: Adult mouse cortical cell taxonomy revealed by single cell transcriptomics. Nat. Neurosci., 19, 335-346 (2016)[PubMed]
- Heisenberg, M.: Mushroom body memoir: from maps to models. Nat. Rev. Neurosci., 4, 266-275 (2003)[PubMed]
- Lee, T., Lee, A. & Luo, L.: Development of the Drosophila mushroom bodies: sequential generation of three distinct types of neurons from a neuroblast. Development, 126, 4065-4076 (1999)[PubMed]
- Turner, G. C., Bazhenov, M. & Laurent, G.: Olfactory representations by Drosophila mushroom body neurons. J. Neurophysiol., 99, 734-746 (2008)[PubMed]
- Krashes, M. J., Keene, A. C., Leung, B. et al.: Sequential use of mushroom body neuron subsets during Drosophila odor memory processing. Neuron 53, 103-115 (2007)[PubMed]
- Trannoy, S., Redt-Clouet, C., Dura, J. M. et al.: Parallel processing of appetitive short- and long-term memories in Drosophila. Curr. Biol., 21, 1647-1653 (2011)[PubMed]
- Caron, S. J., Ruta, V., Abbott, L. F. et al.: Random convergence of olfactory inputs in the Drosophila mushroom body. Nature, 497, 113-117 (2013)[PubMed]
- Lin, A. C., Bygrave, A. M., de Calignon, A. et al.: Sparse, decorrelated odor coding in the mushroom body enhances learned odor discrimination. Nat. Neurosci., 17, 559-568 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:理化学研究所脳科学総合研究センター テクニカルスタッフ.
研究テーマ:記憶をつかさどる機構の解明およびその工学分野への応用.
風間 北斗(Hokto Kazama)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://kazama.brain.riken.jp/index_jp.php
© 2017 稲田健吾・風間北斗 Licensed under CC 表示 2.1 日本