ヒストンのメチル化により制御されるゲノムインプリンティングの発見
井上 梓・Yi Zhang
(米国Boston Children's Hospital,Program in Cellular and Molecular Medicine)
email:井上 梓
DOI: 10.7875/first.author.2017.076
Maternal H3K27me3 controls DNA methylation-independent imprinting.
Azusa Inoue, Lan Jiang, Falong Lu, Tsukasa Suzuki, Yi Zhang
Nature, 547, 419-424 (2017)
精子と卵のエピゲノムは大きく異なるが,受精ののちの初期発生をつうじてゲノムワイドにリプログラミングされ,父性アレルと母性アレルのエピゲノムはほぼ同一になる.しかし,ゲノムインプリンティングをうけるインプリント遺伝子はリプログラミングをまぬがれ,配偶子に由来するエピゲノムの情報を次世代まで維持する.しかし,特定の領域が受精ののちのリプログラミングをどのようにまぬがれるかについてはよくわかっていない.今回,筆者らは,マウスの受精卵および桑実胚において父性アレルおよび母性アレルに特異的なDNase I高感受性部位を同定し,アレルに対する特異性がどのように制御されるのかを調べた.アレルに特異的なDNase I高感受性部位におけるDNAのメチル化およびヒストンのメチル化について調べたところ,父性アレルに特異的なDNase I高感受性部位,すなわち,母性アレルにて閉じたクロマチン構造をとる領域の多くにおいて,母性アレルに特異的にヒストンH3のLys27のメチル化が認められた.さらに,母性アレルにヒストンH3のLys27のメチル化をもつ遺伝子は,着床のまえの胚において父性アレルに特異的な片アレル性の発現を示した.受精の直後に母性アレルのヒストンH3のLys27のメチル化を一過的に消去したところ,それらの遺伝子の母性アレルはDNase I高感受性となり両アレル性の発現を示した.ヒストンH3のLys27のメチル化に依存して片アレル性の発現を示す遺伝子は,DNAのメチル化に非依存的と報告されていた常染色体のすべてのインプリント遺伝子を含んでいた.それらを含む少なくとも5つの遺伝子は,着床ののちの胚体外の組織においても父性アレルに特異的な発現を維持していた.この研究により,母性アレルに特異的なヒストンH3のLys27のメチル化は,DNAのメチル化を必要としないゲノムインプリンティングを制御することが明らかにされた.
哺乳類の精子と卵は互いに大きく異なるエピゲノムをもつため,受精の直後の胚においてもアレルのあいだにエピゲノムの非対称性が存在する1).このエピゲノムの非対称性は着床のまえの発生をつうじ徐々に失われるが,ゲノムインプリンティングをうけるインプリント遺伝子は配偶子のエピゲノムの情報を次世代にひき継ぎ,胚においても父性アレルと母性アレルとのあいだで異なるエピゲノムを維持する2).しかし,これらの領域がリプログラミングをまぬがれる機構に関しては不明な点が多い.また,このようなエピゲノムの非対称性が着床の前後の胚における遺伝子の発現の制御にどのように寄与するのかも不明である.
最近,筆者らは,100個程度の少ない細胞に対し用いることのできる微量DNase Iシークエンス法を確立し,マウスの着床のまえの胚において開いたクロマチン構造をとるDNase I高感受性部位を同定した3)(新着論文レビュー でも掲載).亜系統のあいだに存在する1塩基多型を解析して父性アレルと母性アレルとのあいだで異なるDNase I高感受性部位を探索したところ,いくつかのインプリント遺伝子について,その発現が開始するまえからアレルに特異的なDNase I高感受性をもつことがわかった3).このことから,アレルに特異的なDNase I高感受性部位を網羅的に同定することにより未知のインプリント遺伝子を同定できる可能性が考えられた.しかし,そのためにはアレルに特異的なDNase I高感受性部位を高い解像度をもって同定する必要があり,父性アレルと母性アレルとの識別を1塩基多型に依存するかぎりはほとんど不可能であった.この研究においては,父性ゲノムのみをもつ雄性の単為発生胚と母性ゲノムのみをもつ雌性の単為発生胚を作出し,これらを微量DNase Iシークエンス法により解析した.
リプログラミングの初期にあたる1細胞期の受精卵におけるアレルに特異的なDNase I高感受性部位を同定するため,約200個の受精卵から雄性前核と雌性前核を単離し微量DNase Iシークエンス法を実施した結果,3462箇所の両アレル性のDNase I高感受性部位,687箇所の父性アレルに特異的なDNase I高感受性部位,169箇所の母性アレルに特異的なDNase I高感受性部位が同定された.受精卵におけるアレルに特異的なDNase I高感受性が,2細胞期における片アレル性の胚性遺伝子の発現と相関するかどうか調べるため,2細胞期の雄性および雌性の単為発生胚を作出しRNAシークエンス解析を実施した結果,アレルのあいだの発現量の差が10倍以上あるものとして,107個の父性発現遺伝子および14個の母性発現遺伝子が同定された.それらの遺伝子のプロモーターにおけるDNase I高感受性のアレルに対する特異性について調べたところ,父性発現遺伝子については59%,母性発現遺伝子については79%が発現するアレルにかたよったDNase I高感受性を示した.このことから,2細胞期において片アレル性の発現を示す遺伝子には,それらの遺伝子が発現していない受精卵において,すでにアレルに特異的なDNase I高感受性が存在する,すなわち,プライム状態にあることが示唆された.
受精卵においては2つの前核が同一の細胞質に存在するため,クロマチンに対しトランスにはたらく転写因子などは両方の前核に共通して存在すると推察される.にもかかわらず,DNase I高感受性部位には違いがあったことから,DNase Iに対し感受性の低いアレルにおいてはエピジェネティックな機構によりクロマチンが積極的に閉じた構造をとることが示唆された.そこで,父性アレルに特異的なDNase I高感受性部位に着目し,それらの部位の母性アレルをヘテロクロマチン化させる機構について探った.
ヘテロクロマチンの主要なマーカーであるDNAのメチル化が卵子に特異的に存在し,母性アレルのクロマチンが閉じた構造をとっている可能性について検証した.しかし,精子および卵におけるDNAのメチロームの情報4) を解析したところ,卵に特異的なDNAのメチル化は,父性アレルに特異的なDNase I高感受性部位の全体のわずか17%にしか認められなかった.このことから,DNAのメチル化に非依存的に母性アレルだけをヘテロクロマチン化させる機構のあることが示唆された.
DNAのメチル化の低い領域をヘテロクロマチン化する機構としてヒストンH3のLys27のメチル化がある5).このヒストン修飾の関与について検証するために,配偶子および受精卵における既存のクロマチン免疫沈降シークエンス法のデータを解析した6).その結果,DNAのメチル化の低い領域にある父性アレルに特異的なDNase I高感受性部位には,卵に特異的なヒストンH3のLys27のメチル化が豊富に認められ,受精ののちにも母性アレルに特異的に維持されていた.
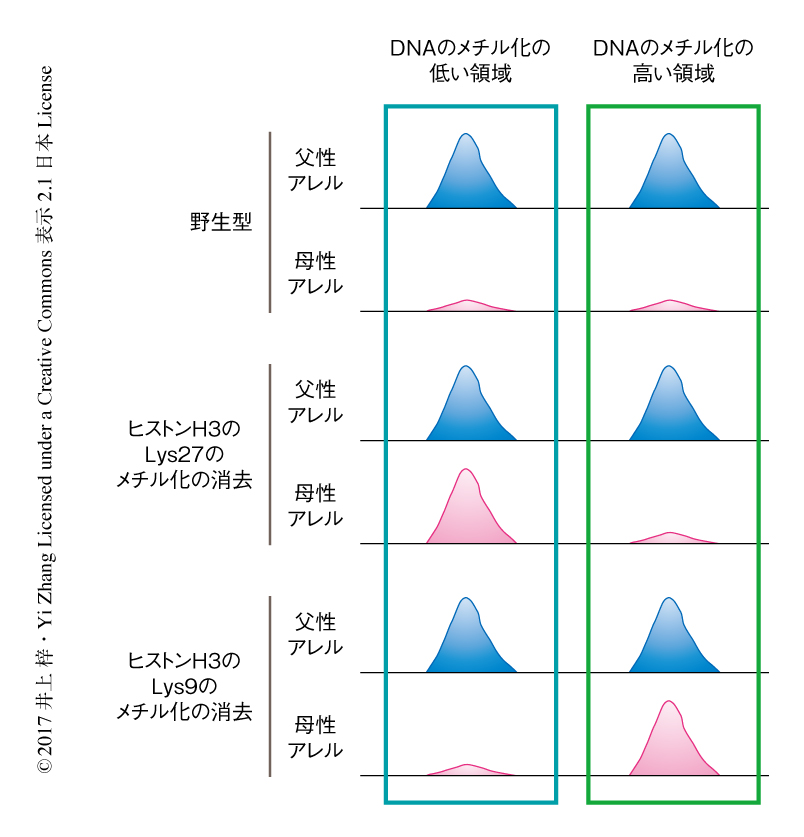
このヒストン修飾が母性アレルに特異的なヘテロクロマチン化に寄与するかどうかを検証するため,ヒストンH3のLys27のメチル化に特異的な脱メチル化酵素であるKdm6bをコードするmRNAを受精の直後の卵にマイクロインジェクションすることにより,このヒストン修飾を一過的に消去した.さらに,ヘテロクロマチンの形成にかかわるもうひとつの主要なヒストン修飾であるヒストンH3のLys9のメチル化に特異的な脱メチル化酵素であるKdm4dを発現させた受精卵も作製した.これらの受精卵から雄性前核および雌性前核を単離して微量DNase Iシークエンス法を実施した結果,Kdm6bの酵素活性に依存して18%,また,Kdm4dの酵素活性に依存して35%の父性アレルに特異的なDNase I高感受性部位が両アレル性のDNase I高感受性部位に変化した(図1).Kdm6bにより両アレル性に変化した領域は卵においてDNAのメチル化の低い領域と重なっていた一方,Kdm4dにより両アレル性に変化したDNase I高感受性部位は卵においてDNAのメチル化の高い領域と重なっていた(図1).これらのことから,受精卵において,母性アレルに特異的なヒストンH3のLys9のメチル化がDNAのメチル化の高い領域を,ヒストンH3のLys27のメチル化がDNAのメチル化の低い領域を,それぞれヘテロクロマチン化することが示唆された.
受精ののちのリプログラミングの後期にあたる桑実胚においてアレルに特異的なDNase I高感受性部位がどのくらい残存しているのかを調べるため,雄性および雌性の単為発生胚を作出し微量DNase Iシークエンス法を実施した結果,36,569箇所の両アレル性のDNase I高感受性部位,247箇所の父性アレルに特異的なDNase I高感受性部位,176箇所の母性アレルに特異的なDNase I高感受性部位が同定された.雌雄のエピゲノムは発生の過程において均質化されるという考えと一致して,アレルに特異的なDNase I高感受性部位の割合は受精卵と比較して非常に低かった.しかしながら,リプログラミングをまぬがれる既知のインプリント遺伝子の制御領域のほぼすべてがアレルに特異的なDNase I高感受性を示したことから,桑実胚におけるアレルに特異的なDNase I高感受性部位には未知のインプリント遺伝子の含まれる可能性が考えられた.
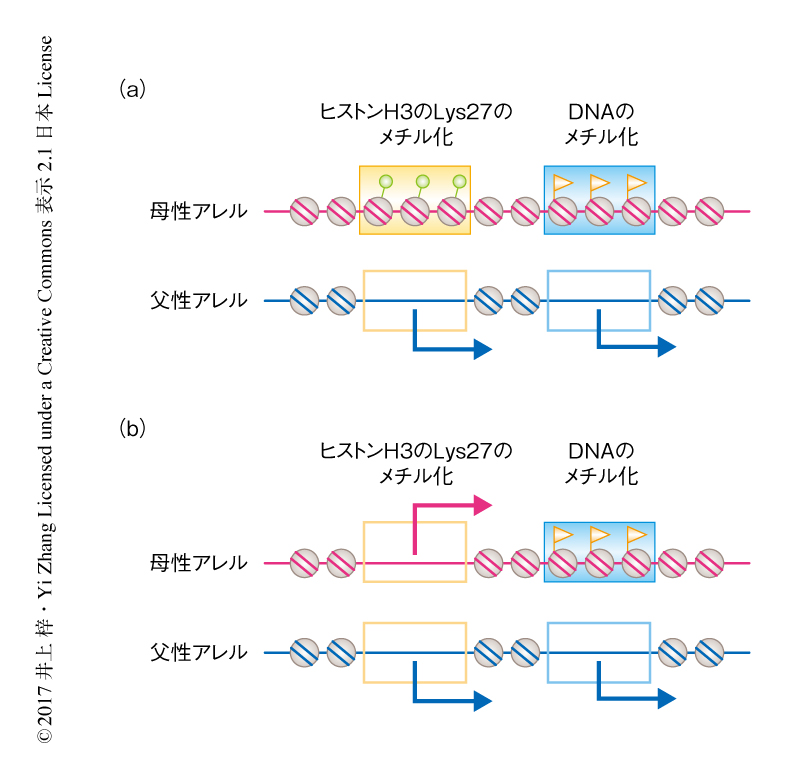
桑実胚における父性アレルに特異的なDNase I高感受性が,DNAのメチル化あるいはヒストンH3のLys27のメチル化とどのくらい相関するのか調べるため,DNAのメチロームの情報4) および既存のクロマチン免疫沈降シークエンス法のデータ6) を解析した.その結果,父性アレルに特異的なDNase I高感受性部位の74%はDNAのメチル化の低い領域に存在し,その多くが着床のまえの発生をつうじ母性アレルに特異的なヒストンH3のLys27のメチル化をもっていた.このように,父性アレルはDNase I高感受性を示す一方,母性アレルはヒストンH3のLys27のメチル化により閉じたクロマチン構造をとる76個の遺伝子が同定され,インプリント遺伝子の候補とした.
これらのインプリント遺伝子の候補が片アレル性の発現を示すか検証するため,雄性および雌性の単為発生胚の桑実胚を用いてRNAシークエンス解析を実施した結果,76個の遺伝子のうち28個が桑実胚において発現しており,そのうち27個は雄性の単為発生胚に特異的に発現することがわかった.つづいて,正常な受精胚においても片アレル性の発現を示すかどうか検証するため,亜系統のあいだの配偶子を受精させて作出した桑実胚の既存のRNAシークエンス法のデータ7) を解析した結果,さきの28個の遺伝子のうち,1塩基多型をもつ13個の遺伝子すべてが父性アレルに特異的な発現を示した.これら28個の遺伝子は,DNAのメチル化に非依存的として報告されていた4個のインプリント遺伝子すべてを含んでいた8-10).この4個を含むインプリント遺伝子の候補は,卵においてその遺伝子領域の全体がドメイン状のヒストンH3のLys27のメチル化におおわれており,これは着床のまえの発生をつうじ維持されていた.このような特徴はDNAのメチル化により制御されるインプリント遺伝子にはみられなかった.
ヒストンH3のLys27のメチル化がインプリント遺伝子の候補における母性アレルの抑制に必要かどうかを調べるため,Kdm6bを1細胞期の雌性の単為発生胚に発現させてヒストンH3のLys27のメチル化を一過的に消去したのち,桑実胚まで発生させてRNAシークエンス解析を実施した結果,桑実胚において発現する28個の遺伝子のうち,さきに述べた4個のインプリント遺伝子を含む16個の遺伝子においてKdm6bの活性に依存した母性アレルからの有意な発現が認められた.亜系統のあいだの配偶子を用いて作出した受精卵にKdm6bを発現させて桑実胚においてRNAシークエンス解析を実施したところ,1塩基多型をもつ17個のインプリント遺伝子の候補のうち16個がKdm6bの活性に依存して父性アレル性の発現から両アレル性の発現へと変化した(図2).
母性アレルの脱抑制がDNase I高感受性の獲得をともなうかどうか検証するため,Kdm6bを一過的に発現させた桑実胚期の雌性の単為発生胚において微量DNase Iシークエンス法を実施した結果,さきに述べた4個のインプリント遺伝子を含む多くのインプリント遺伝子の候補がKdm6bの活性に依存してDNase I高感受性を獲得することがわかった(図2).その一方で,DNAのメチル化により制御されるインプリント遺伝子は,Kdm6bの発現により遺伝子の発現およびDNase I高感受性ともに変化は認められなかった(図2).これらのことから,卵から伝達されるヒストンH3のLys27のメチル化は,さきのインプリント遺伝子の候補において母性アレルをヘテロクロマチン化することにより父性アレル性の発現を可能にすることが示された.これまでにも,DNAのメチル化により制御される通常のインプリント遺伝子にヒストンH3のLys27のメチル化の存在することは報告されていたが10),これは,アレルに特異的なDNAのメチル化が引き金になる下流のイベントとして発生の過程において獲得されるものであった.今回の結果から,これまでひとくくりにされていたインプリント遺伝子が,DNAのメチル化,および,ヒストンH3のLys27のメチル化という2つの異なる機構により制御されることが示唆された.
DNAのメチル化に非依存的なインプリント遺伝子であるGab1遺伝子,Sfmbt2遺伝子,Phf17遺伝子は,胎盤においてのみ父性アレルに特異的な発現を示すことが示唆されていた11).そこで,ヒストンH3のLys27のメチル化に依存的なインプリント遺伝子の候補について,胚盤胞期の内部細胞塊および栄養外胚葉において片アレル性の発現に違いがみられるかどうか検証した.雄性および雌性の単為発生胚から内部細胞塊および栄養外胚葉を単離してRNAシークエンス解析を実施したところ,内部細胞塊において発現していた24個のインプリント遺伝子の候補のうち16個,栄養外胚葉において発現していた23個のインプリント遺伝子の候補のうちのうち18個が父性アレル性の発現を示した.この18個の遺伝子のうち半数は,内部細胞塊において母性アレルからの発現も上昇しており,父性アレル性の発現へのかたよりが低下していた.このことから,ヒストンH3のLys27のメチル化によるゲノムインプリンティングの制御は,栄養外胚葉においては維持される一方,内部細胞塊においては失われはじめることが示唆された.
ヒストンH3のLys27のメチル化に依存的なインプリント遺伝子の候補が着床ののちに片アレル性の発現を維持するかどうか調べるため,亜系統のあいだの配偶子を受精させて作出した6.5日胚から,エピブラスト,臓側内胚葉,胚体外外胚葉を単離してRNAシークエンス解析を実施した結果,76個の遺伝子のうち,エピブラストにおいて25個,臓側内胚葉において23個,胚体外外胚葉において18個の遺伝子について1塩基多型の解析が可能であり,そのうち,エピブラストにおいてSlc38a4遺伝子,臓側内胚葉においてGab1遺伝子,Phf17遺伝子,Sfmbt2遺伝子,胚体外外胚葉においてGab1遺伝子,Phf17遺伝子,Sfmbt2遺伝子,Slc38a4遺伝子,Smoc1遺伝子が父性アレル性の発現を示した.9.5日胚の胎盤の細胞を用いてRNAシークエンス解析を実施したところ,76個の遺伝子のうち27個について1塩基多型の解析が可能であり,Gab1遺伝子,Sfmbt2遺伝子,Slc38a4遺伝子,Smoc1遺伝子が父性アレル性の発現を示した.これらのことから,着床のまえの胚においてヒストンH3のLys27のメチル化に依存して片アレル性の発現を示すインプリント遺伝子の候補は,将来的に胚になる細胞系列においては両アレル性の発現を示す一方,いくつかは将来的に胚体外の組織になる細胞系列においては片アレル性の発現を維持することが明らかにされた(図3).
哺乳類におけるゲノムインプリンティングの研究は,1984年,マウスの単為発生胚が発生を停止するという報告からはじまった12).それ以降,この分野は,エピジェネティックな修飾,非コードRNA,クロマチン構造の変化による転写の制御など,生命科学における数多の重要な発見に貢献してきた2).しかし,2000年代初頭までにはゲノムインプリンティングの概要は理解され,この分野の先導者たちは幹細胞やリプログラミングといった広義の意味でのエピジェネティクスの分野に展開していった.その結果,ゲノムインプリンティングそれ自体の研究者は顕著に減少するというドーナツ化現象が起こった.残るは各論的な疑問のみと考えられていたゲノムインプリンティングの分野であるが,じつは,知る人ぞ知るビッグクエスチョンがかくされていた.それこそが,DNAのメチル化に非依存的なインプリント遺伝子である.数こそ少ないものの,生殖細胞においてDNAのメチル化を消去しても片アレル性に発現する遺伝子が存在したのである8-10).はたして,そのゲノムインプリンティングの機構は何であろうか.かくして,この研究ははじまったのである.
といえば聞こえはいいのだが,この発見,研究の開始の時点ではまったくねらっていなかった.この研究の発端は,なぜ受精卵の雌雄の前核においてDNase I高感受性部位が異なるのか,という好奇心であった.われながら少々マニアックな疑問だとは思っていたが,ほかの研究材料にはない利点があるときは大なり小なり何かしらの発見があると信じていた.すなわち,ひとつの細胞にエピジェネティックな修飾の異なる2つの核をもち,その修飾を実験的に消去することのできる系は受精卵に特異であるのだ.発見の大小はあとから付随してくるものであるが,今回はたまたま幸運であった.
この研究は新しいゲノムインプリンティングの機構の大枠を明らかにしたにすぎず,多くの重要な疑問が残っている.アレルに特異的なヒストンH3のLys27のメチル化を維持する遺伝子と維持しない遺伝子との違いはなにか.どのように細胞系列に依存的にかつ一部の遺伝子のみが片アレル性の発現を維持するのか.そして,このゲノムインプリンティングの機構は進化的にどこまで保存されているのか.とくに,DNAのメチル化をもたないショウジョウバエや線虫などにおいてもヒストンH3のLys27のメチル化は配偶子から次世代へと伝達されることが知られており13,14),同様のゲノムインプリンティングの機構が存在するのかもしれない.また,配偶子からひき継がれて次世代において転写の制御にはたらく第2の修飾として,哺乳類におけるエピジェネティクス遺伝学の分野にブレークスルーをもたらす可能性がある.DNAからヒストンへとモデルチェンジしてふたたび檜舞台にたったゲノムインプリンティングの分野が,今後,どう展開していくのか,目が離せない.
略歴:2011年 東京大学大学院新領域創成科学研究科 修了.同年 米国North Carolina大学Chapel Hill校 研究員,2012年 米国Harvard Medical School研究員を経て,2015年よりHoward Hughes Medical Instituteリサーチスペシャリスト.
研究テーマ:ヒストンのメチル化によるゲノムインプリンティング.
好物:ラボと子供と受精卵.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
? 2017 井上 梓・Yi Zhang Licensed under CC 表示 2.1 日本
(米国Boston Children's Hospital,Program in Cellular and Molecular Medicine)
email:井上 梓
DOI: 10.7875/first.author.2017.076
Maternal H3K27me3 controls DNA methylation-independent imprinting.
Azusa Inoue, Lan Jiang, Falong Lu, Tsukasa Suzuki, Yi Zhang
Nature, 547, 419-424 (2017)
要 約
精子と卵のエピゲノムは大きく異なるが,受精ののちの初期発生をつうじてゲノムワイドにリプログラミングされ,父性アレルと母性アレルのエピゲノムはほぼ同一になる.しかし,ゲノムインプリンティングをうけるインプリント遺伝子はリプログラミングをまぬがれ,配偶子に由来するエピゲノムの情報を次世代まで維持する.しかし,特定の領域が受精ののちのリプログラミングをどのようにまぬがれるかについてはよくわかっていない.今回,筆者らは,マウスの受精卵および桑実胚において父性アレルおよび母性アレルに特異的なDNase I高感受性部位を同定し,アレルに対する特異性がどのように制御されるのかを調べた.アレルに特異的なDNase I高感受性部位におけるDNAのメチル化およびヒストンのメチル化について調べたところ,父性アレルに特異的なDNase I高感受性部位,すなわち,母性アレルにて閉じたクロマチン構造をとる領域の多くにおいて,母性アレルに特異的にヒストンH3のLys27のメチル化が認められた.さらに,母性アレルにヒストンH3のLys27のメチル化をもつ遺伝子は,着床のまえの胚において父性アレルに特異的な片アレル性の発現を示した.受精の直後に母性アレルのヒストンH3のLys27のメチル化を一過的に消去したところ,それらの遺伝子の母性アレルはDNase I高感受性となり両アレル性の発現を示した.ヒストンH3のLys27のメチル化に依存して片アレル性の発現を示す遺伝子は,DNAのメチル化に非依存的と報告されていた常染色体のすべてのインプリント遺伝子を含んでいた.それらを含む少なくとも5つの遺伝子は,着床ののちの胚体外の組織においても父性アレルに特異的な発現を維持していた.この研究により,母性アレルに特異的なヒストンH3のLys27のメチル化は,DNAのメチル化を必要としないゲノムインプリンティングを制御することが明らかにされた.
はじめに
哺乳類の精子と卵は互いに大きく異なるエピゲノムをもつため,受精の直後の胚においてもアレルのあいだにエピゲノムの非対称性が存在する1).このエピゲノムの非対称性は着床のまえの発生をつうじ徐々に失われるが,ゲノムインプリンティングをうけるインプリント遺伝子は配偶子のエピゲノムの情報を次世代にひき継ぎ,胚においても父性アレルと母性アレルとのあいだで異なるエピゲノムを維持する2).しかし,これらの領域がリプログラミングをまぬがれる機構に関しては不明な点が多い.また,このようなエピゲノムの非対称性が着床の前後の胚における遺伝子の発現の制御にどのように寄与するのかも不明である.
最近,筆者らは,100個程度の少ない細胞に対し用いることのできる微量DNase Iシークエンス法を確立し,マウスの着床のまえの胚において開いたクロマチン構造をとるDNase I高感受性部位を同定した3)(新着論文レビュー でも掲載).亜系統のあいだに存在する1塩基多型を解析して父性アレルと母性アレルとのあいだで異なるDNase I高感受性部位を探索したところ,いくつかのインプリント遺伝子について,その発現が開始するまえからアレルに特異的なDNase I高感受性をもつことがわかった3).このことから,アレルに特異的なDNase I高感受性部位を網羅的に同定することにより未知のインプリント遺伝子を同定できる可能性が考えられた.しかし,そのためにはアレルに特異的なDNase I高感受性部位を高い解像度をもって同定する必要があり,父性アレルと母性アレルとの識別を1塩基多型に依存するかぎりはほとんど不可能であった.この研究においては,父性ゲノムのみをもつ雄性の単為発生胚と母性ゲノムのみをもつ雌性の単為発生胚を作出し,これらを微量DNase Iシークエンス法により解析した.
1.受精卵におけるアレルに特異的なDNase I高感受性部位の同定
リプログラミングの初期にあたる1細胞期の受精卵におけるアレルに特異的なDNase I高感受性部位を同定するため,約200個の受精卵から雄性前核と雌性前核を単離し微量DNase Iシークエンス法を実施した結果,3462箇所の両アレル性のDNase I高感受性部位,687箇所の父性アレルに特異的なDNase I高感受性部位,169箇所の母性アレルに特異的なDNase I高感受性部位が同定された.受精卵におけるアレルに特異的なDNase I高感受性が,2細胞期における片アレル性の胚性遺伝子の発現と相関するかどうか調べるため,2細胞期の雄性および雌性の単為発生胚を作出しRNAシークエンス解析を実施した結果,アレルのあいだの発現量の差が10倍以上あるものとして,107個の父性発現遺伝子および14個の母性発現遺伝子が同定された.それらの遺伝子のプロモーターにおけるDNase I高感受性のアレルに対する特異性について調べたところ,父性発現遺伝子については59%,母性発現遺伝子については79%が発現するアレルにかたよったDNase I高感受性を示した.このことから,2細胞期において片アレル性の発現を示す遺伝子には,それらの遺伝子が発現していない受精卵において,すでにアレルに特異的なDNase I高感受性が存在する,すなわち,プライム状態にあることが示唆された.
2.受精卵におけるアレルに特異的なDNase I高感受性の制御の機構
受精卵においては2つの前核が同一の細胞質に存在するため,クロマチンに対しトランスにはたらく転写因子などは両方の前核に共通して存在すると推察される.にもかかわらず,DNase I高感受性部位には違いがあったことから,DNase Iに対し感受性の低いアレルにおいてはエピジェネティックな機構によりクロマチンが積極的に閉じた構造をとることが示唆された.そこで,父性アレルに特異的なDNase I高感受性部位に着目し,それらの部位の母性アレルをヘテロクロマチン化させる機構について探った.
ヘテロクロマチンの主要なマーカーであるDNAのメチル化が卵子に特異的に存在し,母性アレルのクロマチンが閉じた構造をとっている可能性について検証した.しかし,精子および卵におけるDNAのメチロームの情報4) を解析したところ,卵に特異的なDNAのメチル化は,父性アレルに特異的なDNase I高感受性部位の全体のわずか17%にしか認められなかった.このことから,DNAのメチル化に非依存的に母性アレルだけをヘテロクロマチン化させる機構のあることが示唆された.
DNAのメチル化の低い領域をヘテロクロマチン化する機構としてヒストンH3のLys27のメチル化がある5).このヒストン修飾の関与について検証するために,配偶子および受精卵における既存のクロマチン免疫沈降シークエンス法のデータを解析した6).その結果,DNAのメチル化の低い領域にある父性アレルに特異的なDNase I高感受性部位には,卵に特異的なヒストンH3のLys27のメチル化が豊富に認められ,受精ののちにも母性アレルに特異的に維持されていた.
このヒストン修飾が母性アレルに特異的なヘテロクロマチン化に寄与するかどうかを検証するため,ヒストンH3のLys27のメチル化に特異的な脱メチル化酵素であるKdm6bをコードするmRNAを受精の直後の卵にマイクロインジェクションすることにより,このヒストン修飾を一過的に消去した.さらに,ヘテロクロマチンの形成にかかわるもうひとつの主要なヒストン修飾であるヒストンH3のLys9のメチル化に特異的な脱メチル化酵素であるKdm4dを発現させた受精卵も作製した.これらの受精卵から雄性前核および雌性前核を単離して微量DNase Iシークエンス法を実施した結果,Kdm6bの酵素活性に依存して18%,また,Kdm4dの酵素活性に依存して35%の父性アレルに特異的なDNase I高感受性部位が両アレル性のDNase I高感受性部位に変化した(図1).Kdm6bにより両アレル性に変化した領域は卵においてDNAのメチル化の低い領域と重なっていた一方,Kdm4dにより両アレル性に変化したDNase I高感受性部位は卵においてDNAのメチル化の高い領域と重なっていた(図1).これらのことから,受精卵において,母性アレルに特異的なヒストンH3のLys9のメチル化がDNAのメチル化の高い領域を,ヒストンH3のLys27のメチル化がDNAのメチル化の低い領域を,それぞれヘテロクロマチン化することが示唆された.
3.桑実胚におけるアレルに特異的なDNase I高感受性部位の同定
受精ののちのリプログラミングの後期にあたる桑実胚においてアレルに特異的なDNase I高感受性部位がどのくらい残存しているのかを調べるため,雄性および雌性の単為発生胚を作出し微量DNase Iシークエンス法を実施した結果,36,569箇所の両アレル性のDNase I高感受性部位,247箇所の父性アレルに特異的なDNase I高感受性部位,176箇所の母性アレルに特異的なDNase I高感受性部位が同定された.雌雄のエピゲノムは発生の過程において均質化されるという考えと一致して,アレルに特異的なDNase I高感受性部位の割合は受精卵と比較して非常に低かった.しかしながら,リプログラミングをまぬがれる既知のインプリント遺伝子の制御領域のほぼすべてがアレルに特異的なDNase I高感受性を示したことから,桑実胚におけるアレルに特異的なDNase I高感受性部位には未知のインプリント遺伝子の含まれる可能性が考えられた.
桑実胚における父性アレルに特異的なDNase I高感受性が,DNAのメチル化あるいはヒストンH3のLys27のメチル化とどのくらい相関するのか調べるため,DNAのメチロームの情報4) および既存のクロマチン免疫沈降シークエンス法のデータ6) を解析した.その結果,父性アレルに特異的なDNase I高感受性部位の74%はDNAのメチル化の低い領域に存在し,その多くが着床のまえの発生をつうじ母性アレルに特異的なヒストンH3のLys27のメチル化をもっていた.このように,父性アレルはDNase I高感受性を示す一方,母性アレルはヒストンH3のLys27のメチル化により閉じたクロマチン構造をとる76個の遺伝子が同定され,インプリント遺伝子の候補とした.
これらのインプリント遺伝子の候補が片アレル性の発現を示すか検証するため,雄性および雌性の単為発生胚の桑実胚を用いてRNAシークエンス解析を実施した結果,76個の遺伝子のうち28個が桑実胚において発現しており,そのうち27個は雄性の単為発生胚に特異的に発現することがわかった.つづいて,正常な受精胚においても片アレル性の発現を示すかどうか検証するため,亜系統のあいだの配偶子を受精させて作出した桑実胚の既存のRNAシークエンス法のデータ7) を解析した結果,さきの28個の遺伝子のうち,1塩基多型をもつ13個の遺伝子すべてが父性アレルに特異的な発現を示した.これら28個の遺伝子は,DNAのメチル化に非依存的として報告されていた4個のインプリント遺伝子すべてを含んでいた8-10).この4個を含むインプリント遺伝子の候補は,卵においてその遺伝子領域の全体がドメイン状のヒストンH3のLys27のメチル化におおわれており,これは着床のまえの発生をつうじ維持されていた.このような特徴はDNAのメチル化により制御されるインプリント遺伝子にはみられなかった.
4.ヒストンH3のLys27のメチル化によるゲノムインプリンティング
ヒストンH3のLys27のメチル化がインプリント遺伝子の候補における母性アレルの抑制に必要かどうかを調べるため,Kdm6bを1細胞期の雌性の単為発生胚に発現させてヒストンH3のLys27のメチル化を一過的に消去したのち,桑実胚まで発生させてRNAシークエンス解析を実施した結果,桑実胚において発現する28個の遺伝子のうち,さきに述べた4個のインプリント遺伝子を含む16個の遺伝子においてKdm6bの活性に依存した母性アレルからの有意な発現が認められた.亜系統のあいだの配偶子を用いて作出した受精卵にKdm6bを発現させて桑実胚においてRNAシークエンス解析を実施したところ,1塩基多型をもつ17個のインプリント遺伝子の候補のうち16個がKdm6bの活性に依存して父性アレル性の発現から両アレル性の発現へと変化した(図2).
母性アレルの脱抑制がDNase I高感受性の獲得をともなうかどうか検証するため,Kdm6bを一過的に発現させた桑実胚期の雌性の単為発生胚において微量DNase Iシークエンス法を実施した結果,さきに述べた4個のインプリント遺伝子を含む多くのインプリント遺伝子の候補がKdm6bの活性に依存してDNase I高感受性を獲得することがわかった(図2).その一方で,DNAのメチル化により制御されるインプリント遺伝子は,Kdm6bの発現により遺伝子の発現およびDNase I高感受性ともに変化は認められなかった(図2).これらのことから,卵から伝達されるヒストンH3のLys27のメチル化は,さきのインプリント遺伝子の候補において母性アレルをヘテロクロマチン化することにより父性アレル性の発現を可能にすることが示された.これまでにも,DNAのメチル化により制御される通常のインプリント遺伝子にヒストンH3のLys27のメチル化の存在することは報告されていたが10),これは,アレルに特異的なDNAのメチル化が引き金になる下流のイベントとして発生の過程において獲得されるものであった.今回の結果から,これまでひとくくりにされていたインプリント遺伝子が,DNAのメチル化,および,ヒストンH3のLys27のメチル化という2つの異なる機構により制御されることが示唆された.
5.胚盤胞期における細胞系列に依存的な片アレル性の遺伝子発現のダイナミクス
DNAのメチル化に非依存的なインプリント遺伝子であるGab1遺伝子,Sfmbt2遺伝子,Phf17遺伝子は,胎盤においてのみ父性アレルに特異的な発現を示すことが示唆されていた11).そこで,ヒストンH3のLys27のメチル化に依存的なインプリント遺伝子の候補について,胚盤胞期の内部細胞塊および栄養外胚葉において片アレル性の発現に違いがみられるかどうか検証した.雄性および雌性の単為発生胚から内部細胞塊および栄養外胚葉を単離してRNAシークエンス解析を実施したところ,内部細胞塊において発現していた24個のインプリント遺伝子の候補のうち16個,栄養外胚葉において発現していた23個のインプリント遺伝子の候補のうちのうち18個が父性アレル性の発現を示した.この18個の遺伝子のうち半数は,内部細胞塊において母性アレルからの発現も上昇しており,父性アレル性の発現へのかたよりが低下していた.このことから,ヒストンH3のLys27のメチル化によるゲノムインプリンティングの制御は,栄養外胚葉においては維持される一方,内部細胞塊においては失われはじめることが示唆された.
6.着床ののちの細胞系列に依存的な片アレル性の遺伝子発現のダイナミクス
ヒストンH3のLys27のメチル化に依存的なインプリント遺伝子の候補が着床ののちに片アレル性の発現を維持するかどうか調べるため,亜系統のあいだの配偶子を受精させて作出した6.5日胚から,エピブラスト,臓側内胚葉,胚体外外胚葉を単離してRNAシークエンス解析を実施した結果,76個の遺伝子のうち,エピブラストにおいて25個,臓側内胚葉において23個,胚体外外胚葉において18個の遺伝子について1塩基多型の解析が可能であり,そのうち,エピブラストにおいてSlc38a4遺伝子,臓側内胚葉においてGab1遺伝子,Phf17遺伝子,Sfmbt2遺伝子,胚体外外胚葉においてGab1遺伝子,Phf17遺伝子,Sfmbt2遺伝子,Slc38a4遺伝子,Smoc1遺伝子が父性アレル性の発現を示した.9.5日胚の胎盤の細胞を用いてRNAシークエンス解析を実施したところ,76個の遺伝子のうち27個について1塩基多型の解析が可能であり,Gab1遺伝子,Sfmbt2遺伝子,Slc38a4遺伝子,Smoc1遺伝子が父性アレル性の発現を示した.これらのことから,着床のまえの胚においてヒストンH3のLys27のメチル化に依存して片アレル性の発現を示すインプリント遺伝子の候補は,将来的に胚になる細胞系列においては両アレル性の発現を示す一方,いくつかは将来的に胚体外の組織になる細胞系列においては片アレル性の発現を維持することが明らかにされた(図3).
おわりに
哺乳類におけるゲノムインプリンティングの研究は,1984年,マウスの単為発生胚が発生を停止するという報告からはじまった12).それ以降,この分野は,エピジェネティックな修飾,非コードRNA,クロマチン構造の変化による転写の制御など,生命科学における数多の重要な発見に貢献してきた2).しかし,2000年代初頭までにはゲノムインプリンティングの概要は理解され,この分野の先導者たちは幹細胞やリプログラミングといった広義の意味でのエピジェネティクスの分野に展開していった.その結果,ゲノムインプリンティングそれ自体の研究者は顕著に減少するというドーナツ化現象が起こった.残るは各論的な疑問のみと考えられていたゲノムインプリンティングの分野であるが,じつは,知る人ぞ知るビッグクエスチョンがかくされていた.それこそが,DNAのメチル化に非依存的なインプリント遺伝子である.数こそ少ないものの,生殖細胞においてDNAのメチル化を消去しても片アレル性に発現する遺伝子が存在したのである8-10).はたして,そのゲノムインプリンティングの機構は何であろうか.かくして,この研究ははじまったのである.
といえば聞こえはいいのだが,この発見,研究の開始の時点ではまったくねらっていなかった.この研究の発端は,なぜ受精卵の雌雄の前核においてDNase I高感受性部位が異なるのか,という好奇心であった.われながら少々マニアックな疑問だとは思っていたが,ほかの研究材料にはない利点があるときは大なり小なり何かしらの発見があると信じていた.すなわち,ひとつの細胞にエピジェネティックな修飾の異なる2つの核をもち,その修飾を実験的に消去することのできる系は受精卵に特異であるのだ.発見の大小はあとから付随してくるものであるが,今回はたまたま幸運であった.
この研究は新しいゲノムインプリンティングの機構の大枠を明らかにしたにすぎず,多くの重要な疑問が残っている.アレルに特異的なヒストンH3のLys27のメチル化を維持する遺伝子と維持しない遺伝子との違いはなにか.どのように細胞系列に依存的にかつ一部の遺伝子のみが片アレル性の発現を維持するのか.そして,このゲノムインプリンティングの機構は進化的にどこまで保存されているのか.とくに,DNAのメチル化をもたないショウジョウバエや線虫などにおいてもヒストンH3のLys27のメチル化は配偶子から次世代へと伝達されることが知られており13,14),同様のゲノムインプリンティングの機構が存在するのかもしれない.また,配偶子からひき継がれて次世代において転写の制御にはたらく第2の修飾として,哺乳類におけるエピジェネティクス遺伝学の分野にブレークスルーをもたらす可能性がある.DNAからヒストンへとモデルチェンジしてふたたび檜舞台にたったゲノムインプリンティングの分野が,今後,どう展開していくのか,目が離せない.
文 献
- Burton, A. & Torres-Padilla, M.: Chromatin dynamics in the regulation of cell fate allocation during early embryogenesis. Nat. Rev. Mol. Cell Biol., 15, 723-735 (2014)[PubMed]
- Ferguson-Smith, A. C.: Genomic imprinting: the emergence of an epigenetic paradigm. Nat. Rev. Genet., 12, 565-575 (2011)[PubMed]
- Lu, F., Liu, Y., Inou,e A. et al.: Establishing chromatin regulatory landscape during mouse preimplantation development. Cell, 165, 1375-1388 (2016)[PubMed] [新着論文レビュー]
- Kobayashi, H., Sakurai, T., Imai, M. et al.: Contribution of intragenic DNA methylation in mouse gametic DNA methylomes to establish oocyte-specific heritable marks. PLoS Genet., 8, e1002440 (2012)[PubMed]
- Deaton, A. M. & Bird, A.: CpG islands and the regulation of transcription. Genes Dev., 25, 1010-1022 (2011)[PubMed]
- Zheng, H., Huang, B., Zhang, B. et al.: Resetting epigenetic memory by reprogramming of histone modifications in mammals. Mol. Cell, 63, 1066-1079 (2016)[PubMed]
- Borensztein, M., Syx, L., Ancelin, K. et al.: Xist-dependent imprinted X inactivation and the early developmental consequences of its failure. Nat. Struct. Mol. Biol., 24, 226-233 (2017)[PubMed]
- Okae, H., Hiura, H., Nishida, Y. et al.: Re-investigation and RNA sequencing-based identification of genes with placenta-specific imprinted expression. Hum. Mol. Genet., 21, 548-558 (2012)[PubMed]
- Okae, H., Matoba, S., Nagashima, T. et al.: RNA sequencing-based identification of aberrant imprinting in cloned mice. Hum. Mol. Genet., 23, 992-1001 (2014)[PubMed]
- Varmuza, S. & Miri, K.: What does genetics tell us about imprinting and the placenta connection? Cell. Mol. Life Sci., 72, 51-72 (2015)[PubMed]
- Babak, T., DeVeale, B., Tsang, E. K. et al.: Genetic conflict reflected in tissue-specific maps of genomic imprinting in human and mouse. Nat. Genet., 47, 544-549 (2015)[PubMed]
- Surani, M. A., Barton, S. C. & Norris, M. L.: Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature, 308, 548-550 (1984)[PubMed]
- Gaydos, L. J., Wang, W. & Strome, S.: H3K27me and PRC2 transmit a memory of repression across generations and during development. Science, 345, 1515-1518 (2014)[PubMed]
- Zenk, F., Loeser, E., Schiavo, R. et al.: Germ line-inherited H3K27me3 restricts enhancer function during maternal-to-zygotic transition. Science, 357, 212-216 (2017)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院新領域創成科学研究科 修了.同年 米国North Carolina大学Chapel Hill校 研究員,2012年 米国Harvard Medical School研究員を経て,2015年よりHoward Hughes Medical Instituteリサーチスペシャリスト.
研究テーマ:ヒストンのメチル化によるゲノムインプリンティング.
好物:ラボと子供と受精卵.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
? 2017 井上 梓・Yi Zhang Licensed under CC 表示 2.1 日本