視神経脊髄炎の患者において血液脳関門を破綻させる抗GRP78抗体の同定
清水文崇・神田 隆
(山口大学大学院医学系研究科 神経内科学)
email:清水文崇
DOI: 10.7875/first.author.2017.073
Glucose-regulated protein 78 autoantibody associates with blood-brain barrier disruption in neuromyelitis optica.
Fumitaka Shimizu, Kristin L. Schaller, Gregory P. Owens, Anne C. Cotleur, Debra Kellner, Yukio Takeshita, Birgit Obermeier, Thomas J. Kryzer, Yasuteru Sano, Takashi Kanda, Vanda A. Lennon, Richard M. Ransohoff, Jeffrey L. Bennett
Science Translational Medicine, 9, eaai9111 (2017)
視神経脊髄炎においては抗アクアポリン4抗体によるアストロサイトの傷害が病態の形成に大きくかかわる.抗アクアポリン4抗体はおもに末梢血において産生されるため,アストロサイトの突起に存在するアクアポリン4と結合するには血液脳関門をこえる必要がある.筆者らは,視神経脊髄炎の患者の血中には血管内皮細胞を標的とする自己抗体が存在し,この抗体が血液脳関門を傷害することにより抗アクアポリン4抗体の脳への移行が促進され,視神経脊髄炎の発症および増悪に関与するという仮説をたてた.視神経脊髄炎の患者から精製した複数のモノクローナル抗体から,血液脳関門を構成する血管内皮細胞と強く結合しバリア機能を弱めるモノクローナル抗体が同定された.そして,このモノクローナル抗体の反応する抗原はGRP78であることが明らかにされた.視神経脊髄炎の患者の免疫グロブリンGからGRP78に特異的に反応する抗体を除去すると,血液脳関門を構成する血管内皮細胞に対する生物学的な活性が低下した.GRP78を標的とするモノクローナル抗体をマウスに投与したところ,血液脳関門の破綻が確認された.これらの結果から,視神経脊髄炎における血液脳関門の破綻に対する抗GRP78抗体の関与が示された.抗GRP78抗体は,現在,開発中の中枢神経疾患に対する抗体製剤の中枢神経への移行に応用できる可能性がある.
視神経脊髄炎は視神経および脊髄を病変の首座とする自己免疫性かつ炎症性の中枢神経疾患であり,多発性硬化症との異同がくり返し議論されてきたが,2005年に視神経脊髄炎に特異的な自己抗体として抗アクアポリン4抗体が同定され多発性硬化症とは明確に区別されるようになった1,2).抗アクアポリン4抗体は視神経脊髄炎の有用な診断マーカーとして世界中で利用されており,その病態の形成に大きくかかわることが認識されている.抗アクアポリン4抗体はおもに末梢血において産生されるため,アストロサイトの突起に存在するアクアポリン4と結合し細胞傷害をきたすためには血液脳関門を通過する必要がある3,4).しかし,抗アクアポリン4抗体がどのように血液脳関門を通過するかについては解明されていない.臨床的には,視神経脊髄炎の患者において急性期に血液脳関門の破綻が確認され,視神経脊髄炎の患者はしばしば全身性エリトマトーデスを合併するが,全身性エリテマトーデスの患者において血中に血管内皮細胞を標的とする自己抗体の存在が報告されている5).以前に,筆者らは,視神経脊髄炎の患者の血清が血液脳関門を構成する血管内皮細胞のタイトジャンクションに関連するタンパク質であるクローディン5の減少を介してバリア機能を低下させることを報告した6).これらの臨床的な観察および基礎研究の結果から,視神経脊髄炎においては血管内皮細胞を標的とする自己抗体が存在し,その抗体が血液脳関門を破綻させ抗アクアポリン4抗体の中枢神経への移行を促進するという仮説をたてた.
視神経脊髄炎の急性期の患者50例の血漿から精製した免疫グロブリンGは,筆者らにより樹立された血液脳関門に由来する血管内皮細胞であるTY10細胞7) を活性化させるかどうか検討した.患者の免疫グロブリンGあるいは健常な成人の免疫グロブリンGをディッシュに単培養したTY10細胞に添加し,免疫グロブリンGが細胞と結合するか,および,血管内皮細胞の活性化のマーカーであるNF-κB p65の核への移行およびICAM-1の発現が変化するかを免疫染色法により確認した.その結果,患者の免疫グロブリンGを添加した1時間後にNF-κB p65が核へと移行した細胞が有意に増加し,ICAM-1強陽性の細胞が増加したが,健常な成人の免疫グロブリンGを添加しても変化はなかった.
個々の患者の血漿から精製した免疫グロブリンGが同じ作用をもつかどうかを確認した.視神経脊髄炎の患者4例,全身性エリテマトーデスの患者4例,健常な成人2例から免疫グロブリンGを精製しTY10細胞に添加した.その結果,視神経脊髄炎の患者2例および全身性エリテマトーデスの患者3例においてNF-κB p65の核への移行の増加が有意に確認された.視神経脊髄炎の患者はすべて抗アクアポリン4抗体陽性であったが,全身性エリテマトーデスの患者はすべて陰性であったことから,血管内皮細胞の活性化に抗アクアポリン4抗体は必ずしも必要ないことが明らかにされた.
視神経脊髄炎の患者の免疫グロブリンGのなかに血液脳関門を構成する血管内皮細胞に対する複数の抗体がある可能性があるため,複数の視神経脊髄炎の患者の脳脊髄液のB細胞からモノクローナル抗体を作製し8),これらの抗体がTY10細胞を活性化するかどうか検討した.その結果,視神経脊髄炎の患者から作製したうちの2つのモノクローナル抗体がTY10細胞と結合しICAM-1の発現を上昇させ,そのうちの1つはNF-κB p65の核への移行を有意に増加させた.この2つのモノクローナル抗体はアストロサイトに発現するアクアポリン4とは結合しなかった.視神経脊髄炎の患者から作製したモノクローナル抗体は,肺あるいは皮膚に由来する微小血管を構成する血管内皮細胞とは結合せずICAM-1の発現を上昇させなかったことから,血液脳関門を構成する血管内皮細胞の表面に存在する標的と特異的に結合すると考えられた.さらに,視神経脊髄炎の患者から作製したモノクローナル抗体はTY10細胞に存在するタイトジャンクションに関連する重要なタンパク質であるクローディン5の発現を低下させ,10 kDaのデキストランの透過性を増加させ,免疫グロブリンGの透過性を増加させた.これらの一連の解析から,血液脳関門を構成する血管内皮細胞を活性化し,タイトジャンクションに関連するタンパク質の減少を介してバリア機能を低下させるモノクローナル抗体が視神経脊髄炎の患者から同定されたと判断した.
血管内皮細胞と結合する視神経脊髄炎の患者から作製した2つのモノクローナル抗体の抗原の同定を試みた.この2つのモノクローナル抗体はグリオーマ細胞株であるU87MG細胞およびオリゴデンドロサイトの表面と結合したことから,これらの細胞の膜画分を電気泳動しウェスタンブロット法により解析したところ,2つのモノクローナル抗体の反応は複数のバンドとして検出された.U87MG細胞に2つのモノクローナル抗体を添加し,架橋剤により固定したのち細胞を溶解して,ビーズを用いた免疫沈降法により抗原抗体複合体を単離した.この抗原抗体複合体を溶出し,電気泳動ののちウェスタンブロット法により解析すると,視神経脊髄炎の患者から作製した2つのモノクローナル抗体は同一のバンドに反応した.そのバンドをプロテアーゼにより消化し質量分析計により同定したところGRP78であった.U87MG細胞において抗GRP78抗体と視神経脊髄炎の患者から作製した2つのモノクローナル抗体とを共染色したところ,これらは共局在した.さらに,視神経脊髄炎の患者から作製した2つのモノクローナル抗体はウェスタンブロット法により組換えGRP78と結合することが示された.これらの結果から,視神経脊髄炎の患者から作製したモノクローナル抗体が反応する標的となる抗原はGRP78であることが確認された.
GRP78は腎臓あるいは皮膚に由来する血管内皮細胞株と比べて,TY10細胞において細胞の表面により多く発現していた.マウスの脳の切片において,GRP78が血液脳関門を構成する血管内皮細胞に発現することが確認された.さらに,市販されている2つの抗GRP78抗体はTY10細胞においてNF-κB p65の核への移行をひき起こした.これらの結果から,抗GRP78抗体は血液脳関門を構成する血管内皮細胞の表面に豊富に存在するGRP78と結合し生物学的な活性を示すことが確認された.さらに,視神経脊髄炎の急性期の患者50例の血漿から精製した免疫グロブリンGから組換えGRP78を用いた免疫吸着法により抗GRP78抗体を除去したところ,TY10細胞への添加においてNF-κB p65の核への移行が有意に減少したことから,抗GRP78抗体は視神経脊髄炎の患者の免疫グロブリンGによる血管内皮細胞の活性化に重要な役割をはたすことが示された.
マウスに抗GRP78抗体を投与して, in vivoにおける血液脳関門の透過性について評価した.視神経脊髄炎の患者から作製したGRP78を標的とするモノクローナル抗体あるいは対照となるモノクローナル抗体を経静脈的あるいは経腹腔的に7日間にわたり連日投与し,9日後に脳を採取して,経静脈的に投与した免疫グロブリンG,および,内在性のフィブリノーゲンおよびアルブミンの脳実質の外への漏出量について比較した.その結果,視神経脊髄炎の患者から作製したモノクローナル抗体を投与すると血管の外への漏出が確認され,血管径の拡大が認められたが,対照となるモノクローナル抗体を投与してもそれらの変化はみられなかった.
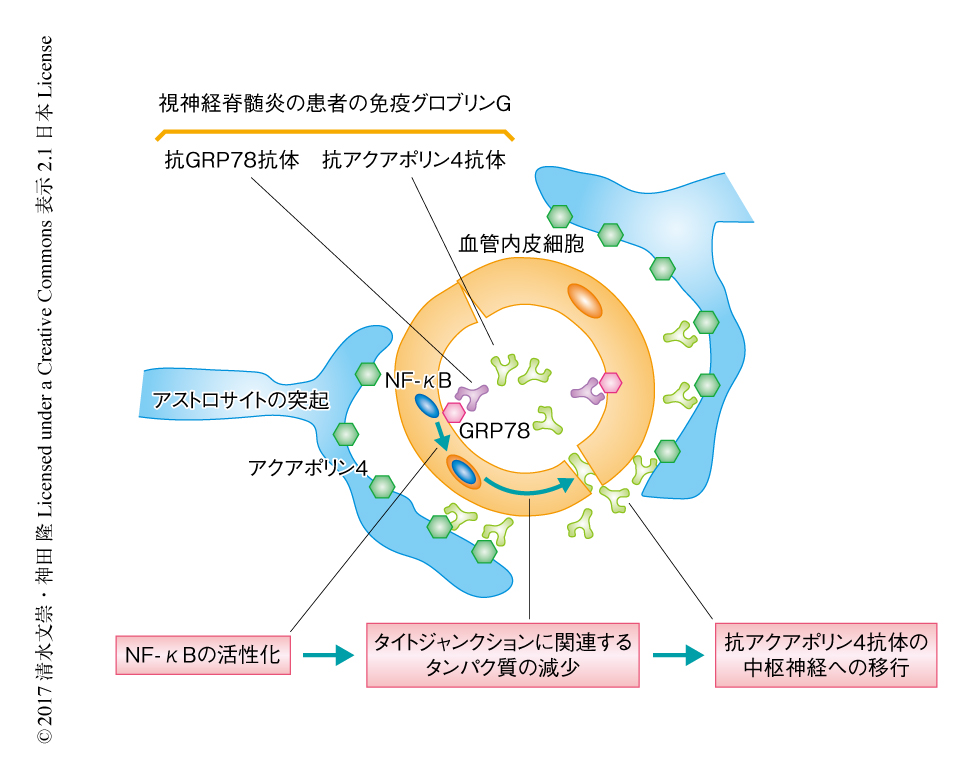
GRP78/BiP/HSPA5は熱ショックタンパク質のひとつであり,すべての細胞の細胞質に局在し分子シャペロンとして機能する.GRP78はがん細胞や血管内皮細胞においては細胞の表面に局在することが報告されており,GRP78はがん細胞に特異的な抗原としての役割が注目されている9).また,がんや関節リウマチの患者において血中に低力価の抗GRP78抗体が検出されることが報告されている10).この研究により,視神経脊髄炎における血液脳関門の破綻に関与する新規の自己抗体の候補として抗GRP78抗体が同定された(図1).
現在,国内外の研究所や製薬メーカーにより,アルツハイマー病における抗アミロイド抗体など複数の中枢神経疾患に対する有望なモノクローナル抗体の開発が進んでいる.しかし,抗体製剤は血液脳関門をわずかしか通過できないため,いかに効率よく血液脳関門を通過させるかが今後の重要な課題になっている.視神経脊髄炎の患者から同定された抗GRP78抗体は,自然に近い状態で血液脳関門を操作しうるツールとなる可能性をひめている.
略歴:2008年 山口大学大学院医学系研究科にて博士号取得,2014年 米国Cleveland Clinicポスドク,同年 米国Biogen社 ポスドクサイエンティストを経て,2016年より山口大学大学院医学系研究科 助教.
関心事:神経免疫疾患の臨床および研究.
抱負:神経免疫疾患や神経変性疾患などの難病の患者に対する治療のブレイクスルーをめざし,神経内科医とサイエンティストの両輪での活動を目標にしている.
神田 隆(Takashi Kanda)
山口大学大学院医学系研究科 教授.
? 2017 清水文崇・神田 隆 Licensed under CC 表示 2.1 日本
(山口大学大学院医学系研究科 神経内科学)
email:清水文崇
DOI: 10.7875/first.author.2017.073
Glucose-regulated protein 78 autoantibody associates with blood-brain barrier disruption in neuromyelitis optica.
Fumitaka Shimizu, Kristin L. Schaller, Gregory P. Owens, Anne C. Cotleur, Debra Kellner, Yukio Takeshita, Birgit Obermeier, Thomas J. Kryzer, Yasuteru Sano, Takashi Kanda, Vanda A. Lennon, Richard M. Ransohoff, Jeffrey L. Bennett
Science Translational Medicine, 9, eaai9111 (2017)
要 約
視神経脊髄炎においては抗アクアポリン4抗体によるアストロサイトの傷害が病態の形成に大きくかかわる.抗アクアポリン4抗体はおもに末梢血において産生されるため,アストロサイトの突起に存在するアクアポリン4と結合するには血液脳関門をこえる必要がある.筆者らは,視神経脊髄炎の患者の血中には血管内皮細胞を標的とする自己抗体が存在し,この抗体が血液脳関門を傷害することにより抗アクアポリン4抗体の脳への移行が促進され,視神経脊髄炎の発症および増悪に関与するという仮説をたてた.視神経脊髄炎の患者から精製した複数のモノクローナル抗体から,血液脳関門を構成する血管内皮細胞と強く結合しバリア機能を弱めるモノクローナル抗体が同定された.そして,このモノクローナル抗体の反応する抗原はGRP78であることが明らかにされた.視神経脊髄炎の患者の免疫グロブリンGからGRP78に特異的に反応する抗体を除去すると,血液脳関門を構成する血管内皮細胞に対する生物学的な活性が低下した.GRP78を標的とするモノクローナル抗体をマウスに投与したところ,血液脳関門の破綻が確認された.これらの結果から,視神経脊髄炎における血液脳関門の破綻に対する抗GRP78抗体の関与が示された.抗GRP78抗体は,現在,開発中の中枢神経疾患に対する抗体製剤の中枢神経への移行に応用できる可能性がある.
はじめに
視神経脊髄炎は視神経および脊髄を病変の首座とする自己免疫性かつ炎症性の中枢神経疾患であり,多発性硬化症との異同がくり返し議論されてきたが,2005年に視神経脊髄炎に特異的な自己抗体として抗アクアポリン4抗体が同定され多発性硬化症とは明確に区別されるようになった1,2).抗アクアポリン4抗体は視神経脊髄炎の有用な診断マーカーとして世界中で利用されており,その病態の形成に大きくかかわることが認識されている.抗アクアポリン4抗体はおもに末梢血において産生されるため,アストロサイトの突起に存在するアクアポリン4と結合し細胞傷害をきたすためには血液脳関門を通過する必要がある3,4).しかし,抗アクアポリン4抗体がどのように血液脳関門を通過するかについては解明されていない.臨床的には,視神経脊髄炎の患者において急性期に血液脳関門の破綻が確認され,視神経脊髄炎の患者はしばしば全身性エリトマトーデスを合併するが,全身性エリテマトーデスの患者において血中に血管内皮細胞を標的とする自己抗体の存在が報告されている5).以前に,筆者らは,視神経脊髄炎の患者の血清が血液脳関門を構成する血管内皮細胞のタイトジャンクションに関連するタンパク質であるクローディン5の減少を介してバリア機能を低下させることを報告した6).これらの臨床的な観察および基礎研究の結果から,視神経脊髄炎においては血管内皮細胞を標的とする自己抗体が存在し,その抗体が血液脳関門を破綻させ抗アクアポリン4抗体の中枢神経への移行を促進するという仮説をたてた.
1.視神経脊髄炎の患者の免疫グロブリンGは血管内皮細胞を活性化させる
視神経脊髄炎の急性期の患者50例の血漿から精製した免疫グロブリンGは,筆者らにより樹立された血液脳関門に由来する血管内皮細胞であるTY10細胞7) を活性化させるかどうか検討した.患者の免疫グロブリンGあるいは健常な成人の免疫グロブリンGをディッシュに単培養したTY10細胞に添加し,免疫グロブリンGが細胞と結合するか,および,血管内皮細胞の活性化のマーカーであるNF-κB p65の核への移行およびICAM-1の発現が変化するかを免疫染色法により確認した.その結果,患者の免疫グロブリンGを添加した1時間後にNF-κB p65が核へと移行した細胞が有意に増加し,ICAM-1強陽性の細胞が増加したが,健常な成人の免疫グロブリンGを添加しても変化はなかった.
個々の患者の血漿から精製した免疫グロブリンGが同じ作用をもつかどうかを確認した.視神経脊髄炎の患者4例,全身性エリテマトーデスの患者4例,健常な成人2例から免疫グロブリンGを精製しTY10細胞に添加した.その結果,視神経脊髄炎の患者2例および全身性エリテマトーデスの患者3例においてNF-κB p65の核への移行の増加が有意に確認された.視神経脊髄炎の患者はすべて抗アクアポリン4抗体陽性であったが,全身性エリテマトーデスの患者はすべて陰性であったことから,血管内皮細胞の活性化に抗アクアポリン4抗体は必ずしも必要ないことが明らかにされた.
2.視神経脊髄炎の患者から作製したモノクローナル抗体は血管内皮細胞を活性化させる
視神経脊髄炎の患者の免疫グロブリンGのなかに血液脳関門を構成する血管内皮細胞に対する複数の抗体がある可能性があるため,複数の視神経脊髄炎の患者の脳脊髄液のB細胞からモノクローナル抗体を作製し8),これらの抗体がTY10細胞を活性化するかどうか検討した.その結果,視神経脊髄炎の患者から作製したうちの2つのモノクローナル抗体がTY10細胞と結合しICAM-1の発現を上昇させ,そのうちの1つはNF-κB p65の核への移行を有意に増加させた.この2つのモノクローナル抗体はアストロサイトに発現するアクアポリン4とは結合しなかった.視神経脊髄炎の患者から作製したモノクローナル抗体は,肺あるいは皮膚に由来する微小血管を構成する血管内皮細胞とは結合せずICAM-1の発現を上昇させなかったことから,血液脳関門を構成する血管内皮細胞の表面に存在する標的と特異的に結合すると考えられた.さらに,視神経脊髄炎の患者から作製したモノクローナル抗体はTY10細胞に存在するタイトジャンクションに関連する重要なタンパク質であるクローディン5の発現を低下させ,10 kDaのデキストランの透過性を増加させ,免疫グロブリンGの透過性を増加させた.これらの一連の解析から,血液脳関門を構成する血管内皮細胞を活性化し,タイトジャンクションに関連するタンパク質の減少を介してバリア機能を低下させるモノクローナル抗体が視神経脊髄炎の患者から同定されたと判断した.
3.視神経脊髄炎の患者から作製したモノクローナル抗体の標的となる抗原としてのGRP78の同定
血管内皮細胞と結合する視神経脊髄炎の患者から作製した2つのモノクローナル抗体の抗原の同定を試みた.この2つのモノクローナル抗体はグリオーマ細胞株であるU87MG細胞およびオリゴデンドロサイトの表面と結合したことから,これらの細胞の膜画分を電気泳動しウェスタンブロット法により解析したところ,2つのモノクローナル抗体の反応は複数のバンドとして検出された.U87MG細胞に2つのモノクローナル抗体を添加し,架橋剤により固定したのち細胞を溶解して,ビーズを用いた免疫沈降法により抗原抗体複合体を単離した.この抗原抗体複合体を溶出し,電気泳動ののちウェスタンブロット法により解析すると,視神経脊髄炎の患者から作製した2つのモノクローナル抗体は同一のバンドに反応した.そのバンドをプロテアーゼにより消化し質量分析計により同定したところGRP78であった.U87MG細胞において抗GRP78抗体と視神経脊髄炎の患者から作製した2つのモノクローナル抗体とを共染色したところ,これらは共局在した.さらに,視神経脊髄炎の患者から作製した2つのモノクローナル抗体はウェスタンブロット法により組換えGRP78と結合することが示された.これらの結果から,視神経脊髄炎の患者から作製したモノクローナル抗体が反応する標的となる抗原はGRP78であることが確認された.
4.抗GRP78抗体は視神経脊髄炎の患者の免疫グロブリンGによる血管内皮細胞の活性化に重要な役割をはたす
GRP78は腎臓あるいは皮膚に由来する血管内皮細胞株と比べて,TY10細胞において細胞の表面により多く発現していた.マウスの脳の切片において,GRP78が血液脳関門を構成する血管内皮細胞に発現することが確認された.さらに,市販されている2つの抗GRP78抗体はTY10細胞においてNF-κB p65の核への移行をひき起こした.これらの結果から,抗GRP78抗体は血液脳関門を構成する血管内皮細胞の表面に豊富に存在するGRP78と結合し生物学的な活性を示すことが確認された.さらに,視神経脊髄炎の急性期の患者50例の血漿から精製した免疫グロブリンGから組換えGRP78を用いた免疫吸着法により抗GRP78抗体を除去したところ,TY10細胞への添加においてNF-κB p65の核への移行が有意に減少したことから,抗GRP78抗体は視神経脊髄炎の患者の免疫グロブリンGによる血管内皮細胞の活性化に重要な役割をはたすことが示された.
5.マウスへの抗GRP78抗体の投与により血液脳関門の透過性は亢進する
マウスに抗GRP78抗体を投与して, in vivoにおける血液脳関門の透過性について評価した.視神経脊髄炎の患者から作製したGRP78を標的とするモノクローナル抗体あるいは対照となるモノクローナル抗体を経静脈的あるいは経腹腔的に7日間にわたり連日投与し,9日後に脳を採取して,経静脈的に投与した免疫グロブリンG,および,内在性のフィブリノーゲンおよびアルブミンの脳実質の外への漏出量について比較した.その結果,視神経脊髄炎の患者から作製したモノクローナル抗体を投与すると血管の外への漏出が確認され,血管径の拡大が認められたが,対照となるモノクローナル抗体を投与してもそれらの変化はみられなかった.
おわりに
GRP78/BiP/HSPA5は熱ショックタンパク質のひとつであり,すべての細胞の細胞質に局在し分子シャペロンとして機能する.GRP78はがん細胞や血管内皮細胞においては細胞の表面に局在することが報告されており,GRP78はがん細胞に特異的な抗原としての役割が注目されている9).また,がんや関節リウマチの患者において血中に低力価の抗GRP78抗体が検出されることが報告されている10).この研究により,視神経脊髄炎における血液脳関門の破綻に関与する新規の自己抗体の候補として抗GRP78抗体が同定された(図1).
現在,国内外の研究所や製薬メーカーにより,アルツハイマー病における抗アミロイド抗体など複数の中枢神経疾患に対する有望なモノクローナル抗体の開発が進んでいる.しかし,抗体製剤は血液脳関門をわずかしか通過できないため,いかに効率よく血液脳関門を通過させるかが今後の重要な課題になっている.視神経脊髄炎の患者から同定された抗GRP78抗体は,自然に近い状態で血液脳関門を操作しうるツールとなる可能性をひめている.
文 献
- Lennon, V. A., Wingerchuk, D. M., Kryzer, T. J. et al.: A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet, 364, 2106-2112 (2004)[PubMed]
- Wingerchuk, D. M., Lennon, V. A., Pittock, S. J. et al.: Revised diagnostic criteria for neuromyelitis optica. Neurology, 66, 1485-1489 (2006)[PubMed]
- Hinson, S. R., Romero, M. F., Popescu, B. F. et al.: Molecular outcomes of neuromyelitis optica (NMO)-IgG binding to aquaporin-4 in astrocytes. Proc, Natl, Acad, Sci, USA, 109, 1245-1250 (2012)[PubMed]
- Papadopoulos, M. C., Bennett, J. L. & Verkman, A. S.: Treatment of neuromyelitis optica: state-of-the-art and emerging therapies. Nat. Rev. Neurol., 10, 493-506 (2014)[PubMed]
- Renaudineau, Y., Dugue, C., Dueymes, M. et al.: Antiendothelial cell antibodies in systemic lupus erythematosus. Autoimmun. Rev., 1, 365-372 (2002)[PubMed]
- Shimizu, F., Sano, Y., Takahashi, T. et al.: Sera from neuromyelitis optica patients disrupt the blood-brain barrier. J. Neurol. Neurosurg, Psychiatry, 83, 288-297 (2012)[PubMed]
- Sano, Y., Shimizu, F., Abe, M. et al.: Establishment of a new conditionally immortalized human brain microvascular endothelial cell line retaining an in vivo blood-brain barrier function. J. Cell. Physiol., 225, 519-528 (2010)[PubMed]
- Bennett, J. L., Lam, C., Kalluri, S. R. et al.: Intrathecal pathogenic anti-aquaporin-4 antibodies in early neuromyelitis optica. Ann. Neurol., 66, 617-629 (2009)[PubMed]
- Jakobsen, C. G., Rasmussen, N., Laenkholm, A. V. et al.: Phage display derived human monoclonal antibodies isolated by binding to the surface of live primary breast cancer cells recognize GRP78. Cancer Res., 67, 9507-9517 (2007)[PubMed]
- Mintz, P. J., Kim, J., Do, K. A. et al.: Fingerprinting the circulating repertoire of antibodies from cancer patients. Nat. Biotechnol., 21, 57-63 (2003)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 山口大学大学院医学系研究科にて博士号取得,2014年 米国Cleveland Clinicポスドク,同年 米国Biogen社 ポスドクサイエンティストを経て,2016年より山口大学大学院医学系研究科 助教.
関心事:神経免疫疾患の臨床および研究.
抱負:神経免疫疾患や神経変性疾患などの難病の患者に対する治療のブレイクスルーをめざし,神経内科医とサイエンティストの両輪での活動を目標にしている.
神田 隆(Takashi Kanda)
山口大学大学院医学系研究科 教授.
? 2017 清水文崇・神田 隆 Licensed under CC 表示 2.1 日本