OPA1およびカルジオリピンの一方向性のはたらきによるミトコンドリアの選択的な融合機構
伴 匡人・石原直忠
(久留米大学分子生命科学研究所 高分子化学研究部門)
email:伴 匡人
DOI: 10.7875/first.author.2017.069
Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin.
Tadato Ban, Takaya Ishihara, Hiroto Kohno, Shotaro Saita, Ayaka Ichimura, Katsumi Maenaka, Toshihiko Oka, Katsuyoshi Mihara, Naotada Ishihara
Nature Cell Biology, 19, 856-863 (2017)
ミトコンドリアは活発な融合と分裂のサイクルによりその形態を変化させており,このダイナミクスの制御には種をこえて保存されたダイナミン様GTPaseが機能する.そのうちのひとつOPA1はミトコンドリア内膜の融合およびクリステ構造の形成に中心的な役割をもつ.融合に機能する膜結合型のOPA1であるL-OPA1はN末端側に膜貫通領域をもち,大腸菌における発現が困難であったためその詳細な解析は進んでいなかった.この研究において,筆者らは,カイコのバキュロウイルス系により調製したOPA1を用いたin vitroにおける膜融合アッセイの解析により,一方にOPA1,もう一方にミトコンドリア内膜に局在する脂質カルジオリピンがあれば膜融合が起こることを示した.このことから,ミトコンドリア内膜の融合は膜小胞輸送や小胞体にみられるような既知の膜融合とは異なる独自の分子機構をもつことがわかった.また,このOPA1とカルジオリピンによる一方向性の膜融合が,損傷したミトコンドリアを選択的に排除するために利用されることが示唆された.
ミトコンドリアの融合を制御するタンパク質として,酵母から哺乳動物まで広く保存されたダイナミン様GTPaseが同定されている1).これらのGTPaseの強制発現や抑制によりミトコンドリアの形態は制御されることから,真核生物における分泌経路,あるいは,ウイルスの細胞融合にかかわる膜融合機構とは異なる,ミトコンドリアに独自の膜融合機構の存在が考えられる.ミトコンドリア内膜のGTPaseであるOPA1は,ミトコンドリア内膜の融合2) および分裂3),ミトコンドリア内膜のクリステ構造の形成4) など,さまざまな役割をもつ.細胞質において合成されたOPA1の前駆体はミトコンドリアに取り込まれたのち切断され,内膜貫通領域をもつL-OPA1となる.L-OPA1はミトコンドリアが失活すると切断され内膜貫通ドメインを欠失してS-OPA1となり,その結果,ミトコンドリアの融合活性は低下する2).OPA1の出芽酵母におけるホモログであるMgm1については,膜貫通領域をもつL-Mgm1と,ミトコンドリア内膜に局在する脂質カルジオリピンとの結合により活性化された膜貫通領域が欠失したS-Mgm1の両者がミトコンドリアの融合に必要である5).また,出芽酵母から単離したミトコンドリアを用いた融合アッセイにおいては,融合する膜のあいだに形成されたMgm1のトランス複合体が融合に寄与するとされている6).しかしながら,哺乳動物においては,in vitroにおける膜融合アッセイの解析に適したL-OPA1の調製の問題から機能解析は進んでおらず,GTPaseやカルジオリピンがどのようにミトコンドリアの融合を起こすのか,その分子機構は明らかにされていなかった.
ミトコンドリア内膜の融合におけるL-OPA1の機能をin vitroにおける膜融合アッセイにより解析するため,活性をもつ膜タンパク質を効率よく得ることができるとされる7),カイコのバキュロウイルス系を利用した組換え体L-OPA1の発現法および精製法を確立した.L-OPA1をコードする遺伝子を組み込んだバクミドDNAをカイコの5齢幼虫に注射し,ウイルスの感染が確認された幼虫から脂肪体を回収した.脂肪体を超音波により破砕したのち,遠心操作によりL-OPAを含む沈殿を回収し,界面活性剤ドデシルマルトシドにより可溶化したのち,ニッケルアフィニティクロマトグラフィーにより精製した.精製したL-OPA1においてはGTPase活性が確認され,カイコのバキュロウイルス系によりin vitroにおける膜融合アッセイに十分な量のL-OPA1を得ることが可能になった.
これまでの報告をもとに8),ミトコンドリア内膜のコンタクトサイト部位を模した内膜リポソームを調製した.界面活性剤の存在のもと精製したL-OPA1と内膜リポソームとを混合し,透析によりOPA1プロテオリポソームを得た.in vitroにおける膜融合アッセイには,広く使われている蛍光色素NBDとローダミンとのあいだのFRET(fluorescence resonance energy,蛍光共鳴エネルギー移動)を利用した方法を用いた9).384ウェルプレートにおいてOPA1プロテオリポソームにGTPをくわえたところ,時間とともに膜融合が増加した.この膜融合の増加はL-OPA1およびGTPの加水分解に依存的であった.L-OPA1のもつ,ダイナミン様GTPaseに広く保存されているG2モチーフに点変異を導入したところ,膜融合の増加率がいちじるしく低下したことから,L-OPA1は膜融合活性をもつことが明らかにされた.in vitroにおける膜融合アッセイの利点を生かし,異なる濃度のL-OPA1を含むOPA1プロテオリポソームを用いたところ,膜融合にはリポソームあたり約25分子のL-OPA1が必要であることがわかった.
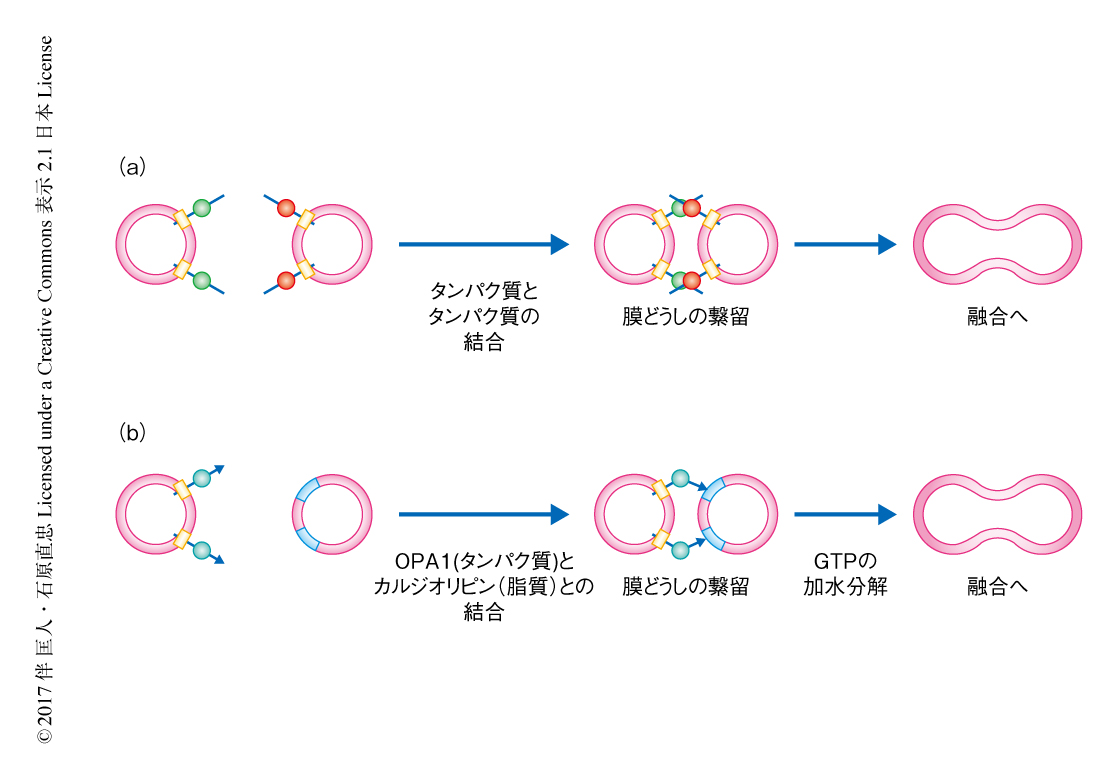
ミトコンドリア内膜には脂質カルジオリピンが豊富に含まれる8).カルジオリピンは,ミトコンドリア膜に存在するタンパク質の安定化,アポトーシスの際のシトクロムcの放出の制御10),マイトファジーにおいてLC3の受容体になるなど,ミトコンドリアのさまざまな機能と密接にかかわる11).カルジオリピンの量の少ない外膜を模した外膜リポソームからOPA1プロテオリポソームを調製しin vitroにおける膜融合アッセイを行ったところ,膜融合は観察されなかった.カルジオリピンの濃度の異なるL-OPA1プロテオリポソームを用いたところ,カルジオリピンの濃度の上昇にともない膜融合が観察されたことから,カルジリピンが膜融合に重要な役割をもつことが明らかにされた.OPA1プロテオリポソームと内膜リポソームとを混合しGTPをくわえたところ,膜融合が観察された.一方,内膜リポソームの代わりに外膜リポソームを用いた場合にはGTPをくわえても膜融合は観察されなかった.さらに,HeLa細胞を用いた実験において,通常のミトコンドリアとCRISPR-Cas9法によるゲノム編集技術によりOPA1を欠損させたミトコンドリアとのあいだで融合が観察された.これらの結果から,一方にL-OPA1,もう一方にカルジオリピンが豊富に存在すれば膜融合が起こることが強く示された.これまでに報告された細胞における膜融合においては,融合する膜に存在するタンパク質がトランス複合体を形成することにより膜融合が起こると考えられてきた9).したがって,ミトコンドリア内膜の融合は独自の分子機構をもつことが明らかにされた(図1).
L-OPA1とカルジオリピンとのあいだの相互作用を解析するため,OPA1プロテオリポソームを固定化した磁気ビーズを用いてin vitroにおける膜結合アッセイを行った.内膜リポソームを用いたところ,GTPの有無にかかわらずL-OPA1と内膜リポソームとの結合が観察された.GTPの非加水分解アナログの存在のもとでも結合が観察されたが,膜融合はGTPの存在のもとでのみ観察された.内膜リポソームに含まれるカルジオリピンをホスファチジン酸など負電荷をもつほかの脂質と置き換えたところ,結合および膜融合はいちじるしく減少した.これらの結果から,融合する膜どうしはL-OPA1とカルジオリピンとの特異的な相互作用により繋留され,そののち,GTPの加水分解にともない膜融合することが示された(図1).脂肪酸鎖の飽和度,数,長さの異なるカルジオリピンを用いたところ,脂肪酸鎖の数が少ないカルジオリピンや脂肪酸鎖の短いカルジオリピンでは結合および膜融合は減少した.また,内膜リポソームからホスファチジルエタノールアミンを除くと結合および膜融合が減少したことから,L-OPA1とカルジオリピンとのあいだの特異性にはカルジオリピンの構造や分布が強く影響することがわかった.L-OPA1のGTPaseドメインよりC末端側を欠失させた変異体は結合および膜融合がいちじるしく減少したことから,L-OPAはGTPaseドメインのC末端側にカルジオリピンとの結合ドメインをもつことが示唆された.
外膜リポソームにL-OPA1を挿入した場合,外膜リポソームとの結合は観察されなかった.両方の外膜リポソームにL-OPA1を挿入すると結合が観察されたことから,カルジオリピンの少ない外膜リポソームにおいてL-OPA1のトランス会合体が形成されたことが示された.GTPの存在のもとでも膜融合は観察されなかったことから,L-OPA1のトランス複合体は膜のあいだの繋留には機能するが膜融合には寄与しないことがわかった.ミトコンドリア内膜は内膜のコンタクトサイト部位よりカルジオリピンが少ないので8),L-OPA1のトランス複合体はクリステ構造の安定化に寄与すると考えられた.
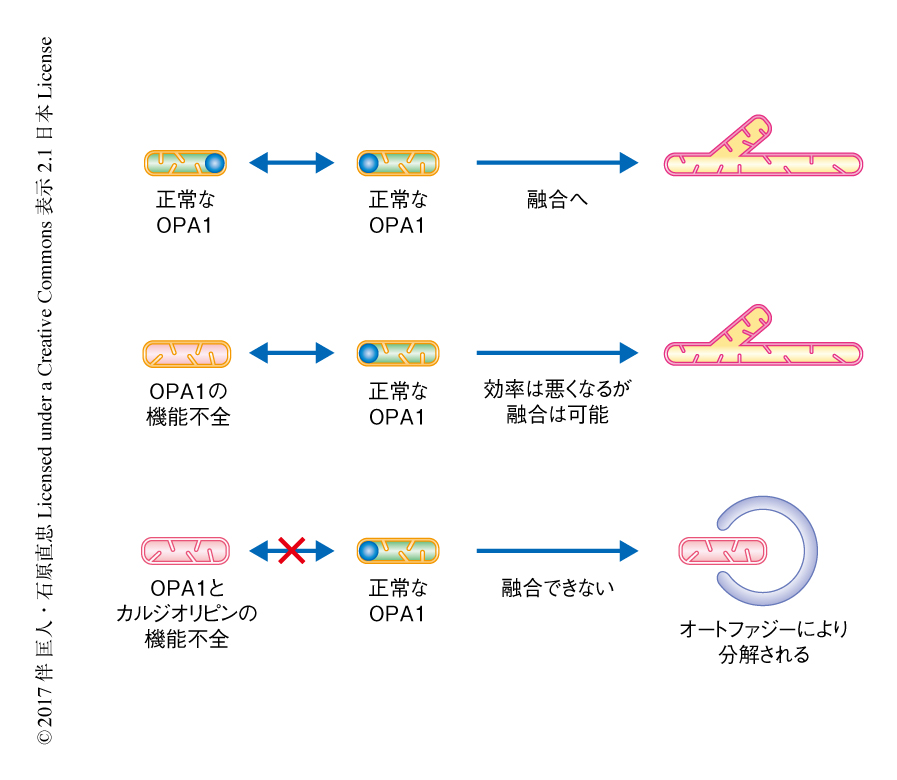
L-OPA1による膜融合におけるカルジオリピンの役割について,HeLa細胞におけるミトコンドリア融合アッセイから検証した.in vitroにおける膜融合アッセイと同様に,siRNAによりカルジリピン合成酵素CLS1をノックダウンしたHeLa細胞のミトコンドリアと野生型のHeLa細胞のミトコンドリアとは融合した.さらに,OPA1をノックダウンしたミトコンドリアとCLS1をノックダウンしたミトコンドリアとのあいだにも融合が観察されたことから,培養細胞においてもミトコンドリアには独自の一方向性の膜融合機構が存在することが示された.また,OPA1およびCLS1を同時にノックダウンしたHeLa細胞のミトコンドリアにおいては融合活性が消失した.これらの結果から,OPA1およびカルジオリピンの変動により,損傷した活性の低いミトコンドリアは活性の高いミトコンドリアから選択的に排除されることが示された(図2).
定常状態の細胞において,OPA1として膜貫通領域をもつL-OPA1および膜貫通領域が欠失したS-OPA1の両方が存在する.損傷したミトコンドリアにおいては大部分のL-OPA1が切断をうけてS-OPA1となり融合活性を失う2).しかしながら,S-OPA1がミトコンドリアの融合を促進するという報告12),また,ミトコンドリアの分裂を促進するという報告もあり3),L-OPA1およびS-OPA1の役割については統一的な見解が得られていない.ミトコンドリア内膜の融合におけるS-OPA1の役割について明らかにするため,L-OPA1と同様に,カイコのバキュロウイルス系により組換え体S-OPA1を調製した.in vitroにおける膜融合アッセイの系に界面活性剤を除いたS-OPA1を添加したところ,S-OPA1の濃度に依存的にOPA1プロテオリポソームと内膜リポソームとのあいだの膜融合が促進された.また,OPA1プロテオリポソームと内膜リポソームとの結合が増加したことから,S-OPA1はL-OPA1とカルジオリピンとの結合を強化することが示された.一方で,L-OPA1とS-OPA1の合計の量を一定にした場合,S-OPA1の量が増えると,逆に,OPA1プロテオリポソームと内膜リポソームとのあいだの膜融合は減少した.さらに,S-OPA1しか存在しない場合,有意な膜融合は観察されなかった.これらの結果から,膜融合においてはおもにL-OPA1が機能し,S-OPA1はその活性を補助する役割のあることがわかった.
この研究において,in vitroにおける膜融合アッセイを詳細に解析することにより,哺乳動物のミトコンドリア内膜は独自の一方向性の膜融合機構をもつことが示された.用いられた実験法は,ミトコンドリア外膜の融合機構の解析,融合の促進にはたらくタンパク質の探索,あるいは,詳細な機能解析の進んでいないミトコンドリア膜タンパク質への応用など,さまざまなミトコンドリアの研究への応用が期待される.一方で,GTPの加水分解ののち,OPA1に何が起こったのかについては理解が不十分である.この疑問を解くには,OPA1のコンフォメーションの変化の解析や構造解析が必要になる.また,膜融合やクリステ構造の形成などにおけるOPA1の機能は,局所的なカルジオリピンの分布に空間的および時間的に厳密に制御されることが示された.ミトコンドリア内膜の融合の全貌を知るには,OPA1のみならず,ミトコンドリア膜におけるカルジオリピンの解析も重要になると考えられる.
略歴:2005年 大阪大学大学院理学研究科博士後期課程 修了,2006年 産業技術総合研究所 研究員,2008年 米国California Institute of Technology研究員,2010年 福井大学重点研究高度推進本部 特命助教,2011年 久留米大学分子生命科学研究所 助教を経て,2014年より同 講師.
研究テーマ:組換えタンパク質を用いたミトコンドリア膜の融合機構の解明.
関心事:GTPがOPA1にどのような構造の変化をもたらすのか?
石原 直忠(Naotada Ishihara)
久留米大学分子生命科学研究所 教授.
研究室URL:http://mitochondria.jp/
© 2017 伴 匡人・石原直忠 Licensed under CC 表示 2.1 日本
(久留米大学分子生命科学研究所 高分子化学研究部門)
email:伴 匡人
DOI: 10.7875/first.author.2017.069
Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin.
Tadato Ban, Takaya Ishihara, Hiroto Kohno, Shotaro Saita, Ayaka Ichimura, Katsumi Maenaka, Toshihiko Oka, Katsuyoshi Mihara, Naotada Ishihara
Nature Cell Biology, 19, 856-863 (2017)
要 約
ミトコンドリアは活発な融合と分裂のサイクルによりその形態を変化させており,このダイナミクスの制御には種をこえて保存されたダイナミン様GTPaseが機能する.そのうちのひとつOPA1はミトコンドリア内膜の融合およびクリステ構造の形成に中心的な役割をもつ.融合に機能する膜結合型のOPA1であるL-OPA1はN末端側に膜貫通領域をもち,大腸菌における発現が困難であったためその詳細な解析は進んでいなかった.この研究において,筆者らは,カイコのバキュロウイルス系により調製したOPA1を用いたin vitroにおける膜融合アッセイの解析により,一方にOPA1,もう一方にミトコンドリア内膜に局在する脂質カルジオリピンがあれば膜融合が起こることを示した.このことから,ミトコンドリア内膜の融合は膜小胞輸送や小胞体にみられるような既知の膜融合とは異なる独自の分子機構をもつことがわかった.また,このOPA1とカルジオリピンによる一方向性の膜融合が,損傷したミトコンドリアを選択的に排除するために利用されることが示唆された.
はじめに
ミトコンドリアの融合を制御するタンパク質として,酵母から哺乳動物まで広く保存されたダイナミン様GTPaseが同定されている1).これらのGTPaseの強制発現や抑制によりミトコンドリアの形態は制御されることから,真核生物における分泌経路,あるいは,ウイルスの細胞融合にかかわる膜融合機構とは異なる,ミトコンドリアに独自の膜融合機構の存在が考えられる.ミトコンドリア内膜のGTPaseであるOPA1は,ミトコンドリア内膜の融合2) および分裂3),ミトコンドリア内膜のクリステ構造の形成4) など,さまざまな役割をもつ.細胞質において合成されたOPA1の前駆体はミトコンドリアに取り込まれたのち切断され,内膜貫通領域をもつL-OPA1となる.L-OPA1はミトコンドリアが失活すると切断され内膜貫通ドメインを欠失してS-OPA1となり,その結果,ミトコンドリアの融合活性は低下する2).OPA1の出芽酵母におけるホモログであるMgm1については,膜貫通領域をもつL-Mgm1と,ミトコンドリア内膜に局在する脂質カルジオリピンとの結合により活性化された膜貫通領域が欠失したS-Mgm1の両者がミトコンドリアの融合に必要である5).また,出芽酵母から単離したミトコンドリアを用いた融合アッセイにおいては,融合する膜のあいだに形成されたMgm1のトランス複合体が融合に寄与するとされている6).しかしながら,哺乳動物においては,in vitroにおける膜融合アッセイの解析に適したL-OPA1の調製の問題から機能解析は進んでおらず,GTPaseやカルジオリピンがどのようにミトコンドリアの融合を起こすのか,その分子機構は明らかにされていなかった.
1.カイコのバキュロウイルス系による組換え体L-OPA1の発現法および精製法の確立
ミトコンドリア内膜の融合におけるL-OPA1の機能をin vitroにおける膜融合アッセイにより解析するため,活性をもつ膜タンパク質を効率よく得ることができるとされる7),カイコのバキュロウイルス系を利用した組換え体L-OPA1の発現法および精製法を確立した.L-OPA1をコードする遺伝子を組み込んだバクミドDNAをカイコの5齢幼虫に注射し,ウイルスの感染が確認された幼虫から脂肪体を回収した.脂肪体を超音波により破砕したのち,遠心操作によりL-OPAを含む沈殿を回収し,界面活性剤ドデシルマルトシドにより可溶化したのち,ニッケルアフィニティクロマトグラフィーにより精製した.精製したL-OPA1においてはGTPase活性が確認され,カイコのバキュロウイルス系によりin vitroにおける膜融合アッセイに十分な量のL-OPA1を得ることが可能になった.
2.L-OPA1は膜融合活性をもつ
これまでの報告をもとに8),ミトコンドリア内膜のコンタクトサイト部位を模した内膜リポソームを調製した.界面活性剤の存在のもと精製したL-OPA1と内膜リポソームとを混合し,透析によりOPA1プロテオリポソームを得た.in vitroにおける膜融合アッセイには,広く使われている蛍光色素NBDとローダミンとのあいだのFRET(fluorescence resonance energy,蛍光共鳴エネルギー移動)を利用した方法を用いた9).384ウェルプレートにおいてOPA1プロテオリポソームにGTPをくわえたところ,時間とともに膜融合が増加した.この膜融合の増加はL-OPA1およびGTPの加水分解に依存的であった.L-OPA1のもつ,ダイナミン様GTPaseに広く保存されているG2モチーフに点変異を導入したところ,膜融合の増加率がいちじるしく低下したことから,L-OPA1は膜融合活性をもつことが明らかにされた.in vitroにおける膜融合アッセイの利点を生かし,異なる濃度のL-OPA1を含むOPA1プロテオリポソームを用いたところ,膜融合にはリポソームあたり約25分子のL-OPA1が必要であることがわかった.
3.一方にL-OPA1,もう一方にカルジオリピンがあれば膜融合が起こる
ミトコンドリア内膜には脂質カルジオリピンが豊富に含まれる8).カルジオリピンは,ミトコンドリア膜に存在するタンパク質の安定化,アポトーシスの際のシトクロムcの放出の制御10),マイトファジーにおいてLC3の受容体になるなど,ミトコンドリアのさまざまな機能と密接にかかわる11).カルジオリピンの量の少ない外膜を模した外膜リポソームからOPA1プロテオリポソームを調製しin vitroにおける膜融合アッセイを行ったところ,膜融合は観察されなかった.カルジオリピンの濃度の異なるL-OPA1プロテオリポソームを用いたところ,カルジオリピンの濃度の上昇にともない膜融合が観察されたことから,カルジリピンが膜融合に重要な役割をもつことが明らかにされた.OPA1プロテオリポソームと内膜リポソームとを混合しGTPをくわえたところ,膜融合が観察された.一方,内膜リポソームの代わりに外膜リポソームを用いた場合にはGTPをくわえても膜融合は観察されなかった.さらに,HeLa細胞を用いた実験において,通常のミトコンドリアとCRISPR-Cas9法によるゲノム編集技術によりOPA1を欠損させたミトコンドリアとのあいだで融合が観察された.これらの結果から,一方にL-OPA1,もう一方にカルジオリピンが豊富に存在すれば膜融合が起こることが強く示された.これまでに報告された細胞における膜融合においては,融合する膜に存在するタンパク質がトランス複合体を形成することにより膜融合が起こると考えられてきた9).したがって,ミトコンドリア内膜の融合は独自の分子機構をもつことが明らかにされた(図1).
4.カルジオリピンはL-OPA1の特異的なパートナーとして膜融合に寄与する
L-OPA1とカルジオリピンとのあいだの相互作用を解析するため,OPA1プロテオリポソームを固定化した磁気ビーズを用いてin vitroにおける膜結合アッセイを行った.内膜リポソームを用いたところ,GTPの有無にかかわらずL-OPA1と内膜リポソームとの結合が観察された.GTPの非加水分解アナログの存在のもとでも結合が観察されたが,膜融合はGTPの存在のもとでのみ観察された.内膜リポソームに含まれるカルジオリピンをホスファチジン酸など負電荷をもつほかの脂質と置き換えたところ,結合および膜融合はいちじるしく減少した.これらの結果から,融合する膜どうしはL-OPA1とカルジオリピンとの特異的な相互作用により繋留され,そののち,GTPの加水分解にともない膜融合することが示された(図1).脂肪酸鎖の飽和度,数,長さの異なるカルジオリピンを用いたところ,脂肪酸鎖の数が少ないカルジオリピンや脂肪酸鎖の短いカルジオリピンでは結合および膜融合は減少した.また,内膜リポソームからホスファチジルエタノールアミンを除くと結合および膜融合が減少したことから,L-OPA1とカルジオリピンとのあいだの特異性にはカルジオリピンの構造や分布が強く影響することがわかった.L-OPA1のGTPaseドメインよりC末端側を欠失させた変異体は結合および膜融合がいちじるしく減少したことから,L-OPAはGTPaseドメインのC末端側にカルジオリピンとの結合ドメインをもつことが示唆された.
5.クリステ構造の形成やミトコンドリアの品質管理におけるOPA1の機能はカルジオリピンにより制御される
外膜リポソームにL-OPA1を挿入した場合,外膜リポソームとの結合は観察されなかった.両方の外膜リポソームにL-OPA1を挿入すると結合が観察されたことから,カルジオリピンの少ない外膜リポソームにおいてL-OPA1のトランス会合体が形成されたことが示された.GTPの存在のもとでも膜融合は観察されなかったことから,L-OPA1のトランス複合体は膜のあいだの繋留には機能するが膜融合には寄与しないことがわかった.ミトコンドリア内膜は内膜のコンタクトサイト部位よりカルジオリピンが少ないので8),L-OPA1のトランス複合体はクリステ構造の安定化に寄与すると考えられた.
L-OPA1による膜融合におけるカルジオリピンの役割について,HeLa細胞におけるミトコンドリア融合アッセイから検証した.in vitroにおける膜融合アッセイと同様に,siRNAによりカルジリピン合成酵素CLS1をノックダウンしたHeLa細胞のミトコンドリアと野生型のHeLa細胞のミトコンドリアとは融合した.さらに,OPA1をノックダウンしたミトコンドリアとCLS1をノックダウンしたミトコンドリアとのあいだにも融合が観察されたことから,培養細胞においてもミトコンドリアには独自の一方向性の膜融合機構が存在することが示された.また,OPA1およびCLS1を同時にノックダウンしたHeLa細胞のミトコンドリアにおいては融合活性が消失した.これらの結果から,OPA1およびカルジオリピンの変動により,損傷した活性の低いミトコンドリアは活性の高いミトコンドリアから選択的に排除されることが示された(図2).
6.ミトコンドリア内膜の融合におけるL-OPA1およびS-OPA1の役割
定常状態の細胞において,OPA1として膜貫通領域をもつL-OPA1および膜貫通領域が欠失したS-OPA1の両方が存在する.損傷したミトコンドリアにおいては大部分のL-OPA1が切断をうけてS-OPA1となり融合活性を失う2).しかしながら,S-OPA1がミトコンドリアの融合を促進するという報告12),また,ミトコンドリアの分裂を促進するという報告もあり3),L-OPA1およびS-OPA1の役割については統一的な見解が得られていない.ミトコンドリア内膜の融合におけるS-OPA1の役割について明らかにするため,L-OPA1と同様に,カイコのバキュロウイルス系により組換え体S-OPA1を調製した.in vitroにおける膜融合アッセイの系に界面活性剤を除いたS-OPA1を添加したところ,S-OPA1の濃度に依存的にOPA1プロテオリポソームと内膜リポソームとのあいだの膜融合が促進された.また,OPA1プロテオリポソームと内膜リポソームとの結合が増加したことから,S-OPA1はL-OPA1とカルジオリピンとの結合を強化することが示された.一方で,L-OPA1とS-OPA1の合計の量を一定にした場合,S-OPA1の量が増えると,逆に,OPA1プロテオリポソームと内膜リポソームとのあいだの膜融合は減少した.さらに,S-OPA1しか存在しない場合,有意な膜融合は観察されなかった.これらの結果から,膜融合においてはおもにL-OPA1が機能し,S-OPA1はその活性を補助する役割のあることがわかった.
おわりに
この研究において,in vitroにおける膜融合アッセイを詳細に解析することにより,哺乳動物のミトコンドリア内膜は独自の一方向性の膜融合機構をもつことが示された.用いられた実験法は,ミトコンドリア外膜の融合機構の解析,融合の促進にはたらくタンパク質の探索,あるいは,詳細な機能解析の進んでいないミトコンドリア膜タンパク質への応用など,さまざまなミトコンドリアの研究への応用が期待される.一方で,GTPの加水分解ののち,OPA1に何が起こったのかについては理解が不十分である.この疑問を解くには,OPA1のコンフォメーションの変化の解析や構造解析が必要になる.また,膜融合やクリステ構造の形成などにおけるOPA1の機能は,局所的なカルジオリピンの分布に空間的および時間的に厳密に制御されることが示された.ミトコンドリア内膜の融合の全貌を知るには,OPA1のみならず,ミトコンドリア膜におけるカルジオリピンの解析も重要になると考えられる.
文 献
- Ishihara, N., Otera, H., Oka, T. et al.: Regulation and physiologic function of GTPases in mitochondrial fusion and fission in mammals. Antioxid. Redox. Signal, 19, 389-399 (2013)[PubMed]
- Ishihara, N., Fujita, Y., Oka, T. et al.: Regulation of mitochondrial morphology through proteolytic cleavage of OPA1. EMBO J., 25, 2966-2977 (2006)[PubMed]
- Anand, R., Wai, T., Baker, M. J. et al.: The i-AAA protease YME1L and OMA1 cleave OPA1 to balance mitochondrial fusion and fission. J. Cell. Biol., 204, 919-929 (2014)[PubMed]
- Frezza, C., Cipolat, S., Martism de Brito, O. et al.: OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell, 126, 177-189 (2006)[PubMed]
- DeVay, R. M., Dominguez-Ramirez, L., Lackner, L. L. et al.: Coassembly of Mgm1 isoforms requires cardiolipin and mediates mitochondrial inner membrane fusion. J. Cell. Biol., 186, 793-803 (2009)[PubMed]
- Meeusen, S., DeVay, R. M., Block, J. et al.: Mitochondrial inner-membrane fusion and crista maintenance requires the dynamin-related GTPase Mgm1. Cell, 127, 383-395 (2006)[PubMed]
- Kajikawa, M. Sasaki, K., Wakimoto, Y. et al.: Efficient silkworm expression of human GPCR (nociceptin receptor) by a Bombyx mori bacmid DNA system. Biochem. Biophys. Res. Commun., 385, 375-379 (2009)[PubMed]
- Ardail, D., Privat, J. P., Egret-Charlier, M. et al.: Mitochondrial contact sites. Lipid composition and dynamics. J. Biol. Chem., 265, 18797-18802 (1990)[PubMed]
- Weber, T., Zemelman, B. V., McNew, J. A. et al.: SNAREpins: minimal machinery for membrane fusion. Cell, 92, 759-772 (1998)[PubMed]
- Claypool, S. M. & Koehler, C. M.: The complexity of cardiolipin in health and disease. Trends Biochem. Sci., 37, 32-41 (2012)[PubMed]
- Chu, C. T., Ji, J. Dagda, R. K. et al.: Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nat. Cell Biol., 15, 1197-1205 (2013)[PubMed]
- Mishra, P., Carelli, V., Manfredi, G. et al.: Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metab., 19, 630-641 (2014)[PubMed]
著者プロフィール
略歴:2005年 大阪大学大学院理学研究科博士後期課程 修了,2006年 産業技術総合研究所 研究員,2008年 米国California Institute of Technology研究員,2010年 福井大学重点研究高度推進本部 特命助教,2011年 久留米大学分子生命科学研究所 助教を経て,2014年より同 講師.
研究テーマ:組換えタンパク質を用いたミトコンドリア膜の融合機構の解明.
関心事:GTPがOPA1にどのような構造の変化をもたらすのか?
石原 直忠(Naotada Ishihara)
久留米大学分子生命科学研究所 教授.
研究室URL:http://mitochondria.jp/
© 2017 伴 匡人・石原直忠 Licensed under CC 表示 2.1 日本