ジストロフィン-糖タンパク複合体は転写共役因子Yapを細胞膜にとどめることにより心筋細胞の増殖を阻害する
森川雪香・James F. Martin
(米国Texas Heart Institute,Cardiomyocyte Renewal Laboratory)
email:森川雪香
DOI: 10.7875/first.author.2017.062
Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation.
Yuka Morikawa, Todd Heallen, John Leach, Yang Xiao, James F. Martin
Nature, 547, 227-231 (2017)
哺乳類の成体の心臓においては心筋細胞がほとんど増殖しないため,心臓の再生はほとんどみられない.心筋細胞は胎仔および新生仔期においては活発に増殖するが,出生ののちただちに細胞周期をはずれ,それ以降の心臓の増大は心筋細胞の肥大による.Hippo経路は進化的に保存されたシグナル伝達系であり,心筋細胞の増殖を抑制することにより,胎仔期においては心臓の大きさを制御し,成体においては心筋細胞の再生を抑制する.筆者らは,この研究において,成体のマウスにおいて心筋細胞の増殖が抑制される機構のひとつとして,ジストロフィン-糖タンパク質複合体の構成成分であるジストログリカンとHippo経路の転写共役因子Yapとが結合することを明らかにした.ジストロフィン-糖タンパク質複合体は細胞骨格と細胞外マトリックスとをつなぐ巨大な複合体であり,心筋細胞のホメオスタシスに必須である.また,ジストロフィンの欠損はヒトにおける筋ジストロフィーの原因として知られている.ジストログリカンとYapの結合はHippo経路によるYapのリン酸化により強化されたことから,Hippo経路とジストロフィン-糖タンパク質複合体とは密接な関係のあることが明らかにされた.Hippo経路を阻害しジストロフィン-糖タンパク質複合体を欠失させたマウスにおいては,心臓に傷害をうけたのちに心筋細胞の過剰な増殖がひき起こされた.これは,Hippo経路のみ阻害されたマウスの心臓において,傷害ののち心臓のもとの大きさへの再生が促進されたこととは対照的であった.また,Hippo経路の阻害は筋ジストロフィーのモデル動物であるmdxマウスにおいて心不全を保護する作用のあることがわかった.
哺乳類の心臓は,胎仔および新生仔期には再生するが,成体になるとほとんど再生しない.その一因として,哺乳類の成体において心筋細胞はほとんど増殖しないことがあげられる.ヒトの成体における心筋細胞の増殖速度は年間1%未満であり,50歳のヒトにおいておよそ半分の心筋細胞は出生のときのものと試算されている1,2).一方,新生仔期においては心臓の再生は既存の心筋細胞が増殖することにより促進される3).また,ヒトの新生児の心臓においても同様の再生能が示唆されている4).
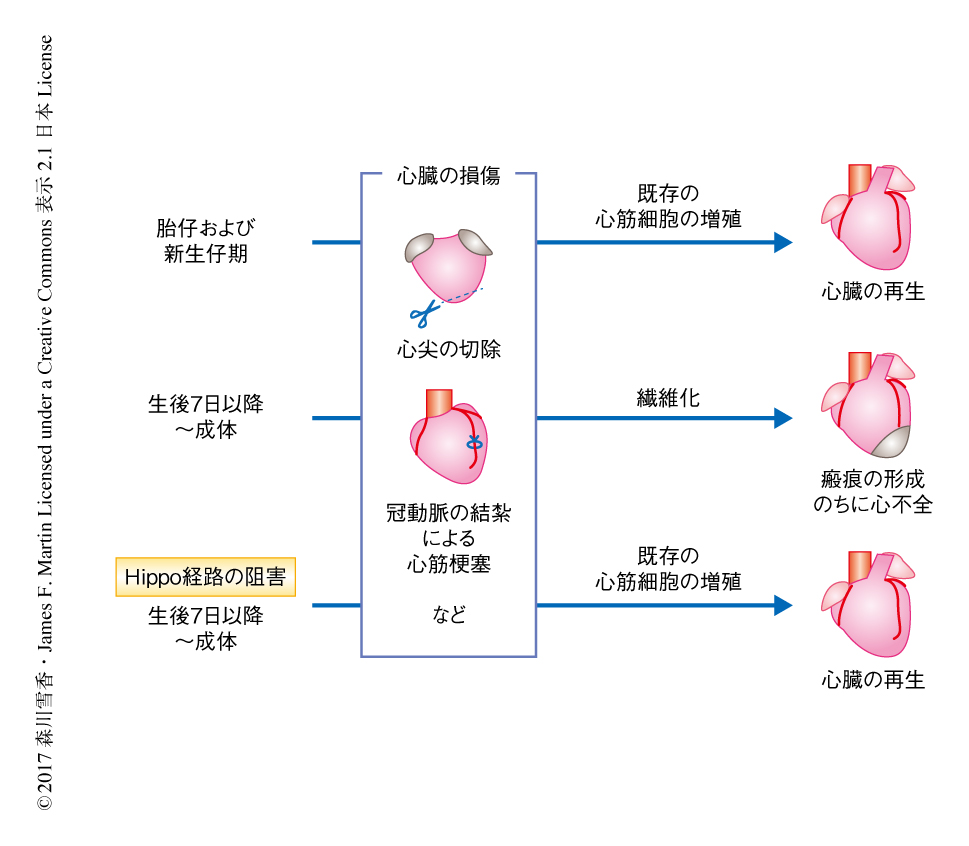
筆者らの研究グループにおいては,成体のマウスにおいて心筋細胞の増殖および心臓の再生が抑制される機構を解明し,新生仔期の心臓のもつ再生能をふたたび活性化するというアプローチにより,ヒトを含む哺乳類における心臓の再生の促進をめざしている.以前の研究において,成体のマウスの心筋細胞において組織に特異的にHippo経路を阻害すると,心筋梗塞ののち心臓の再生が促進されることが示された5)(図1).このとき,新たな心筋細胞は,新生仔期と同様に,すでに分化した既存の心筋細胞が増殖することにより生じていた.
進化的に保存されたシグナル伝達系であるHippo経路は,胎仔期の心筋細胞においてはその増殖を抑制することにより心臓の大きさを制御する6).Hippo経路が活性化されると転写共役因子Yapがリン酸化され細胞質に局在することにより活性が抑制される.一方,Hippo経路が不活性化されるとYapは核へと移行し,TEADなどの転写因子とともに標的となる遺伝子の発現を促進する.Yapの強制発現は,Hippo経路の阻害と同様に,非再生期における心筋梗塞ののちの心臓の再生を促進する7).これまでの研究により,Yapが心筋細胞において細胞周期の進行を制御する遺伝子,アクチンの重合を促進する遺伝子,細胞骨格と細胞外マトリックスとの連結に関与する遺伝子などを制御することが明らかにされた8).また,筋細胞に特異的なジストロフィン-糖タンパク質複合体の構成成分をコードする遺伝子はYapの標的であり,また,ジストロフィン-糖タンパク質複合体は新生仔期における心臓の再生に必須であることが示された8).これらの研究から,Hippo経路とジストロフィン-糖タンパク質複合体とは密接な関係があると考えた.
ジストロフィン-糖タンパク質複合体とHippo経路との関係について調べるため,2つの遺伝子をダブルノックアウトしたマウスを作製した.Hippo経路の阻害されたマウスとしてはHippoキナーゼのアダプタータンパク質であるSalvのコンディショナルノックアウトマウスを用いた.ジストロフィン-糖タンパク質複合体を欠失したマウスとしては筋ジストロフィーのモデル動物であるmdxマウスを用いた.mdxマウスはジストロフィンを欠損するためジストロフィン-糖タンパク質複合体の集合が起こらない.これらのマウスにおける心筋細胞の再生能について調べるため,非再生期である生後8日目において心臓を損傷したところ,このダブルノックアウトマウスにおいては心筋細胞の過剰な増殖がみられ,心臓の先端にコブのような心筋細胞のかたまりが生じた.これは,Hippo経路のみ阻害されたマウスの心臓において,傷害ののちに心臓のもとの大きさへの再生が促進されたこととは対照的であった.このダブルノックアウトマウスにおいては損傷の付近の心筋細胞においてYapの核への移行が観察され,Yapの標的となるタンパク質の発現が上昇していた.よって,ジストロフィン-糖タンパク質複合体がなんらかのかたちでYapの核への移行を抑制することが明らかにされた.
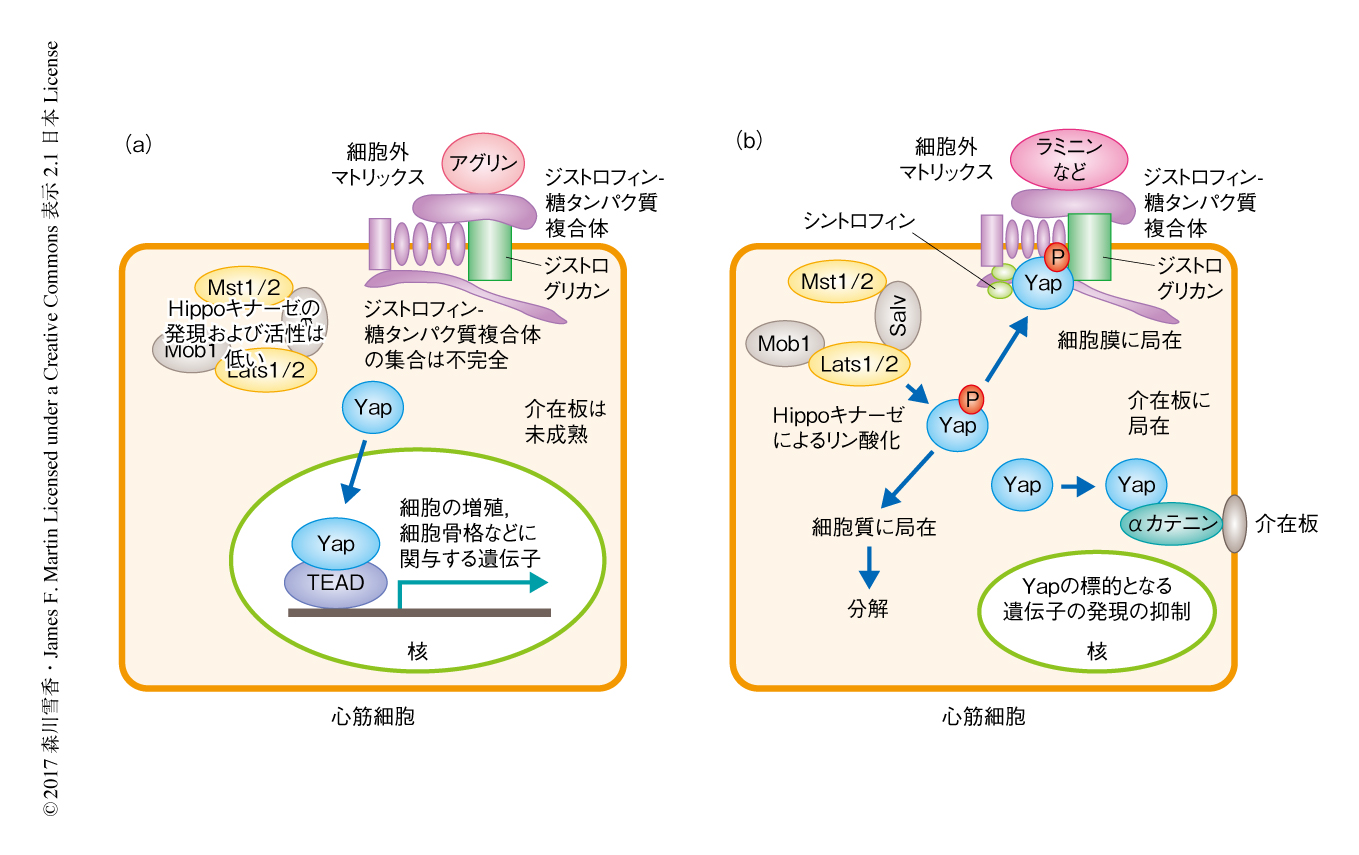
ジストロフィン-糖タンパク質複合体とYapはタンパク質のレベルで直接に相互作用していると考えた.共免疫沈降法によりYapおよびジストロフィン-糖タンパク質複合体の構成成分のひとつであるジストログリカンと結合するタンパク質について解析したところ,野生型のマウスの心臓から抽出した試料においてYapとジストログリカンは共沈したため,両者は結合することが明らかにされた.mdxマウスにおいてはYapとジストログリカンとの相互作用はみられなかった.Yapとジストロフィン-糖タンパク質複合体とが相互作用したことからYapは細胞膜に局在すると示唆されたが,実際に,生化学的な手法および顕微鏡による観察によりYapの細胞膜への局在が確認された.
Yapとジストロフィン-糖タンパク質複合体との結合にはHippoキナーゼによるYapのリン酸化が必須であり,Hippo経路とジストロフィン-糖タンパク質複合体との密接な関係が明らかにされた.さらに,以前の研究において,Yapはαカテニンとの結合を介して心筋細胞どうしを連結させる介在板に局在することが明らかにされていたが9),Yapとαカテニンとの結合はYapのリン酸化およびジストロフィンの欠損には影響されなかった.
筋ジストロフィーは骨格筋の疾患として知られているが,進行とともに心機能の障害もひき起こされ,心不全が死因となることも少なくない.Hippo経路の阻害が筋ジストロフィーのモデル動物において心不全を軽減するかどうか検討した.mdxマウスにおいて心不全の症状が現われるのに生後15カ月もしくはそれ以上の期間が必要であるため,生後9週のマウスにおいて横行大動脈の縮窄による心臓圧負荷モデルを適用した.
mdxマウスにおいて横行大動脈の縮窄ののち2週間で心筋細胞の壊死,線維化,心機能の低下が起こったが,それにくわえてHippo経路が阻害されたダブルノックアウトマウスにおいては線維化が減少しており,心機能の低下もみられなかった.このとき,このダブルノックアウトマウスの心筋細胞において細胞の増殖およびアポトーシスの減少の両方がみられた.さらに,Hippo経路の阻害を用いた遺伝子治療の可能性について検討するため,アデノ随伴ウイルスベクターを用いてHippo経路の構成タンパク質をノックダウンしたところ,ノックアウトと同様に,mdxマウスにおいて心臓の線維化および心機能の低下が軽減された.
心臓の再生医療といえば,心筋梗塞などにより壊死した心筋細胞を新たな細胞に置き換えるためのアプローチとして,ES細胞やiPS細胞から分化させた心筋細胞を移植する細胞治療や,線維芽細胞を直接的に心筋細胞へと転換させるダイレクトリプログラミング法などがある.筆者らは,それらとは異なるアプローチとして,心筋細胞においてYapを活性化することにより心臓の再生を促進する方法をとっている.しかし,Yapはほかの臓器においてはがん遺伝子産物として知られており,その活性化はがんをひき起こす可能性が高いため,医療への応用のためには心筋細胞に特異的な経路の発見が必須であった.今回,筋細胞に特異的に発現するジストロフィン-糖タンパク質複合体がYapと結合し,Yapを細胞膜にとどめることにより核への移行が抑制されることが明らかにされた.よって,このジストロフィン-糖タンパク質複合体とYapとの結合を制御することにより心筋細胞のみでYapを活性化できることが期待され,将来的に医療への応用が可能であると考えている.
この論文と同時に同じNature誌に発表されたイスラエルの研究グループによる論文においては10),マウスの新生仔の細胞外マトリックスに注目し,新生仔期における心臓の再生に必須の物質としてアグリンが同定された.また,成体にアグリンを投与することにより心筋梗塞ののち心臓の再生が促進された.アグリンが心臓の再生を促進する機構のひとつとして,ジストロフィン-糖タンパク質複合体の構成成分にアグリンが作用してその集合を不完全にし,Yapの核への移行を促進することが見い出された.筆者らの研究グループは,Hippo経路およびジストロフィン-糖タンパク質複合体に注目することによりYapがジストロフィン-糖タンパク質複合体と作用することを示したが,細胞外マトリックスに注目することによりYapとジストロフィン-糖タンパク質複合体との相互作用が示されたことは10),結果的に相互の研究を補い合うことになった(図2).このように,心筋細胞にいくつものYapの抑制機構のあることが心筋細胞の増殖が強く抑制される一因と考えている.
略歴:2001年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 米国Louisiana州立大学 博士研究員,2004年 米国Tulane大学 博士研究員,2008年 同 リサーチアシスタントプロフェッサーを経て,2011年より米国Texas Heart Instituteリサーチ・サイエンティスト.
James F. Martin
米国Baylor College of MedicineにてProfessor.
© 2017 森川雪香・James F. Martin Licensed under CC 表示 2.1 日本
(米国Texas Heart Institute,Cardiomyocyte Renewal Laboratory)
email:森川雪香
DOI: 10.7875/first.author.2017.062
Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation.
Yuka Morikawa, Todd Heallen, John Leach, Yang Xiao, James F. Martin
Nature, 547, 227-231 (2017)
要 約
哺乳類の成体の心臓においては心筋細胞がほとんど増殖しないため,心臓の再生はほとんどみられない.心筋細胞は胎仔および新生仔期においては活発に増殖するが,出生ののちただちに細胞周期をはずれ,それ以降の心臓の増大は心筋細胞の肥大による.Hippo経路は進化的に保存されたシグナル伝達系であり,心筋細胞の増殖を抑制することにより,胎仔期においては心臓の大きさを制御し,成体においては心筋細胞の再生を抑制する.筆者らは,この研究において,成体のマウスにおいて心筋細胞の増殖が抑制される機構のひとつとして,ジストロフィン-糖タンパク質複合体の構成成分であるジストログリカンとHippo経路の転写共役因子Yapとが結合することを明らかにした.ジストロフィン-糖タンパク質複合体は細胞骨格と細胞外マトリックスとをつなぐ巨大な複合体であり,心筋細胞のホメオスタシスに必須である.また,ジストロフィンの欠損はヒトにおける筋ジストロフィーの原因として知られている.ジストログリカンとYapの結合はHippo経路によるYapのリン酸化により強化されたことから,Hippo経路とジストロフィン-糖タンパク質複合体とは密接な関係のあることが明らかにされた.Hippo経路を阻害しジストロフィン-糖タンパク質複合体を欠失させたマウスにおいては,心臓に傷害をうけたのちに心筋細胞の過剰な増殖がひき起こされた.これは,Hippo経路のみ阻害されたマウスの心臓において,傷害ののち心臓のもとの大きさへの再生が促進されたこととは対照的であった.また,Hippo経路の阻害は筋ジストロフィーのモデル動物であるmdxマウスにおいて心不全を保護する作用のあることがわかった.
はじめに
哺乳類の心臓は,胎仔および新生仔期には再生するが,成体になるとほとんど再生しない.その一因として,哺乳類の成体において心筋細胞はほとんど増殖しないことがあげられる.ヒトの成体における心筋細胞の増殖速度は年間1%未満であり,50歳のヒトにおいておよそ半分の心筋細胞は出生のときのものと試算されている1,2).一方,新生仔期においては心臓の再生は既存の心筋細胞が増殖することにより促進される3).また,ヒトの新生児の心臓においても同様の再生能が示唆されている4).
筆者らの研究グループにおいては,成体のマウスにおいて心筋細胞の増殖および心臓の再生が抑制される機構を解明し,新生仔期の心臓のもつ再生能をふたたび活性化するというアプローチにより,ヒトを含む哺乳類における心臓の再生の促進をめざしている.以前の研究において,成体のマウスの心筋細胞において組織に特異的にHippo経路を阻害すると,心筋梗塞ののち心臓の再生が促進されることが示された5)(図1).このとき,新たな心筋細胞は,新生仔期と同様に,すでに分化した既存の心筋細胞が増殖することにより生じていた.
進化的に保存されたシグナル伝達系であるHippo経路は,胎仔期の心筋細胞においてはその増殖を抑制することにより心臓の大きさを制御する6).Hippo経路が活性化されると転写共役因子Yapがリン酸化され細胞質に局在することにより活性が抑制される.一方,Hippo経路が不活性化されるとYapは核へと移行し,TEADなどの転写因子とともに標的となる遺伝子の発現を促進する.Yapの強制発現は,Hippo経路の阻害と同様に,非再生期における心筋梗塞ののちの心臓の再生を促進する7).これまでの研究により,Yapが心筋細胞において細胞周期の進行を制御する遺伝子,アクチンの重合を促進する遺伝子,細胞骨格と細胞外マトリックスとの連結に関与する遺伝子などを制御することが明らかにされた8).また,筋細胞に特異的なジストロフィン-糖タンパク質複合体の構成成分をコードする遺伝子はYapの標的であり,また,ジストロフィン-糖タンパク質複合体は新生仔期における心臓の再生に必須であることが示された8).これらの研究から,Hippo経路とジストロフィン-糖タンパク質複合体とは密接な関係があると考えた.
1.Hippo経路を阻害しジストロフィン-糖タンパク質複合体を欠失したマウスは心筋細胞の過剰な増殖をひき起こす
ジストロフィン-糖タンパク質複合体とHippo経路との関係について調べるため,2つの遺伝子をダブルノックアウトしたマウスを作製した.Hippo経路の阻害されたマウスとしてはHippoキナーゼのアダプタータンパク質であるSalvのコンディショナルノックアウトマウスを用いた.ジストロフィン-糖タンパク質複合体を欠失したマウスとしては筋ジストロフィーのモデル動物であるmdxマウスを用いた.mdxマウスはジストロフィンを欠損するためジストロフィン-糖タンパク質複合体の集合が起こらない.これらのマウスにおける心筋細胞の再生能について調べるため,非再生期である生後8日目において心臓を損傷したところ,このダブルノックアウトマウスにおいては心筋細胞の過剰な増殖がみられ,心臓の先端にコブのような心筋細胞のかたまりが生じた.これは,Hippo経路のみ阻害されたマウスの心臓において,傷害ののちに心臓のもとの大きさへの再生が促進されたこととは対照的であった.このダブルノックアウトマウスにおいては損傷の付近の心筋細胞においてYapの核への移行が観察され,Yapの標的となるタンパク質の発現が上昇していた.よって,ジストロフィン-糖タンパク質複合体がなんらかのかたちでYapの核への移行を抑制することが明らかにされた.
2.ジストロフィン-糖タンパク複合体はYapと結合する
ジストロフィン-糖タンパク質複合体とYapはタンパク質のレベルで直接に相互作用していると考えた.共免疫沈降法によりYapおよびジストロフィン-糖タンパク質複合体の構成成分のひとつであるジストログリカンと結合するタンパク質について解析したところ,野生型のマウスの心臓から抽出した試料においてYapとジストログリカンは共沈したため,両者は結合することが明らかにされた.mdxマウスにおいてはYapとジストログリカンとの相互作用はみられなかった.Yapとジストロフィン-糖タンパク質複合体とが相互作用したことからYapは細胞膜に局在すると示唆されたが,実際に,生化学的な手法および顕微鏡による観察によりYapの細胞膜への局在が確認された.
Yapとジストロフィン-糖タンパク質複合体との結合にはHippoキナーゼによるYapのリン酸化が必須であり,Hippo経路とジストロフィン-糖タンパク質複合体との密接な関係が明らかにされた.さらに,以前の研究において,Yapはαカテニンとの結合を介して心筋細胞どうしを連結させる介在板に局在することが明らかにされていたが9),Yapとαカテニンとの結合はYapのリン酸化およびジストロフィンの欠損には影響されなかった.
3.筋ジストロフィーのモデル動物においてHippo経路の阻害は心不全を軽減する
筋ジストロフィーは骨格筋の疾患として知られているが,進行とともに心機能の障害もひき起こされ,心不全が死因となることも少なくない.Hippo経路の阻害が筋ジストロフィーのモデル動物において心不全を軽減するかどうか検討した.mdxマウスにおいて心不全の症状が現われるのに生後15カ月もしくはそれ以上の期間が必要であるため,生後9週のマウスにおいて横行大動脈の縮窄による心臓圧負荷モデルを適用した.
mdxマウスにおいて横行大動脈の縮窄ののち2週間で心筋細胞の壊死,線維化,心機能の低下が起こったが,それにくわえてHippo経路が阻害されたダブルノックアウトマウスにおいては線維化が減少しており,心機能の低下もみられなかった.このとき,このダブルノックアウトマウスの心筋細胞において細胞の増殖およびアポトーシスの減少の両方がみられた.さらに,Hippo経路の阻害を用いた遺伝子治療の可能性について検討するため,アデノ随伴ウイルスベクターを用いてHippo経路の構成タンパク質をノックダウンしたところ,ノックアウトと同様に,mdxマウスにおいて心臓の線維化および心機能の低下が軽減された.
おわりに
心臓の再生医療といえば,心筋梗塞などにより壊死した心筋細胞を新たな細胞に置き換えるためのアプローチとして,ES細胞やiPS細胞から分化させた心筋細胞を移植する細胞治療や,線維芽細胞を直接的に心筋細胞へと転換させるダイレクトリプログラミング法などがある.筆者らは,それらとは異なるアプローチとして,心筋細胞においてYapを活性化することにより心臓の再生を促進する方法をとっている.しかし,Yapはほかの臓器においてはがん遺伝子産物として知られており,その活性化はがんをひき起こす可能性が高いため,医療への応用のためには心筋細胞に特異的な経路の発見が必須であった.今回,筋細胞に特異的に発現するジストロフィン-糖タンパク質複合体がYapと結合し,Yapを細胞膜にとどめることにより核への移行が抑制されることが明らかにされた.よって,このジストロフィン-糖タンパク質複合体とYapとの結合を制御することにより心筋細胞のみでYapを活性化できることが期待され,将来的に医療への応用が可能であると考えている.
この論文と同時に同じNature誌に発表されたイスラエルの研究グループによる論文においては10),マウスの新生仔の細胞外マトリックスに注目し,新生仔期における心臓の再生に必須の物質としてアグリンが同定された.また,成体にアグリンを投与することにより心筋梗塞ののち心臓の再生が促進された.アグリンが心臓の再生を促進する機構のひとつとして,ジストロフィン-糖タンパク質複合体の構成成分にアグリンが作用してその集合を不完全にし,Yapの核への移行を促進することが見い出された.筆者らの研究グループは,Hippo経路およびジストロフィン-糖タンパク質複合体に注目することによりYapがジストロフィン-糖タンパク質複合体と作用することを示したが,細胞外マトリックスに注目することによりYapとジストロフィン-糖タンパク質複合体との相互作用が示されたことは10),結果的に相互の研究を補い合うことになった(図2).このように,心筋細胞にいくつものYapの抑制機構のあることが心筋細胞の増殖が強く抑制される一因と考えている.
文 献
- Bergmann, O., Bhardwaj, R. D., Bernard, S. et al.: Evidence for cardiomyocyte renewal in humans. Science, 324, 98-102 (2009)[PubMed]
- Bergmann, O., Zdunek, S., Felker, A. et al.: Dynamics of cell generation and turnover in the human heart. Cell, 161, 1566-1575 (2015)[PubMed]
- Porrello, E. R., Mahmoud, A. I., Simpson, E. et al.: Transient regenerative potential of the neonatal mouse heart. Science, 331, 1078-1080 (2011)[PubMed]
- Haubner, B. J., Schneider, J., Schweigmann, U. et al.: Functional recovery of a human neonatal heart after severe myocardial infarction. Circ. Res., 118, 216-221 (2016)[PubMed]
- Heallen, T., Morikawa, Y., Leach, J. et al.: Hippo signaling impedes adult heart regeneration. Development, 23, 4683-4690 (2013)[PubMed]
- Heallen, T,, Zhang, M., Wang, J. et al.: Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size. Science, 332, 458-461 (2011)[PubMed]
- Xin, M., Kim, Y., Sutherland, L. B. et al.: Hippo pathway effector Yap promotes cardiac regeneration. Proc. Natl. Acad. Sci. USA, 110, 13839-13844 (2013)[PubMed]
- Morikawa, Y., Zhang, M., Heallen, T. et al.: Actin cytoskeletal remodeling with protrusion formation is essential for heart regeneration in Hippo-deficient mice. Sci. Signal., 8, ra41 (2015)[PubMed]
- Li, J., Gao, E., Vite, A. et al.: Alpha-catenins control cardiomyocyte proliferation by regulating Yap activity. Circ. Res., 116, 70-79 (2015)[PubMed]
- Bassat, E., Mutlak, Y. E., Genzelinakh, A. et al.: The extracellular matrix protein Agrin promotes heart regeneration in mice. Nature, 547, 179-184 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2001年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 米国Louisiana州立大学 博士研究員,2004年 米国Tulane大学 博士研究員,2008年 同 リサーチアシスタントプロフェッサーを経て,2011年より米国Texas Heart Instituteリサーチ・サイエンティスト.
James F. Martin
米国Baylor College of MedicineにてProfessor.
© 2017 森川雪香・James F. Martin Licensed under CC 表示 2.1 日本