Src/c-Abl経路は筋萎縮性側索硬化症の潜在的な治療の標的である
今村恵子・井上治久
(京都大学iPS細胞研究所 増殖分化機構研究部門)
email:井上治久
DOI: 10.7875/first.author.2017.056
The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis.
Keiko Imamura , Yuishin Izumi, Akira Watanabe, Kayoko Tsukita, Knut Woltjen, Takuya Yamamoto, Akitsu Hotta, Takayuki Kondo, Shiho Kitaoka, Akira Ohta, Akito Tanaka, Dai Watanabe, Mitsuya Morita, Hiroshi Takuma, Akira Tamaoka, Tilo Kunath, Selina Wray, Hirokazu Furuya, Takumi Era, Kouki Makioka, Koichi Okamoto, Takao Fujisawa, Hideki Nishitoh, Kengo Homma, Hidenori Ichijo, Jean-Pierre Julien, Nanako Obata, Masato Hosokawa, Haruhiko Akiyama, Satoshi Kaneko, Takashi Ayaki, Hidefumi Ito, Ryuji Kaji, Ryosuke Takahashi, Shinya Yamanaka, Haruhisa Inoue
Science Translational Medicine, 9, eaaf3962 (2017)
筋萎縮性側索硬化症は進行性に運動ニューロンが障害される難治性の疾患であり,現在のところ十分な治療法はない.筆者らは,SOD1遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者から作製したiPS細胞に由来する運動ニューロンの生存率を指標として化合物スクリーニングを施行したところ,ヒットの約半数はSrc/c-Abl経路を標的としていた.Src/c-Abl阻害薬,および,Srcあるいはc-Ablのノックダウンは,患者から作製した運動ニューロンの生存率を上昇させた.ヒット化合物のひとつであるSrc/c-Abl阻害薬ボスチニブは患者から作製した運動ニューロンにおいてオートファジーを促進し,ミスフォールドしたSOD1の蓄積を減少させた.また,ボスチニブはTDP-43遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者,C9orf72遺伝子におけるリピートの伸長をともなう家族性の筋萎縮性側索硬化症の患者,孤発性の筋萎縮性側索硬化症の患者から作製したiPS細胞に由来する運動ニューロンの生存率も上昇させ,さらに,ボスチニブは筋萎縮性側索硬化症のモデルマウスの生存期間を延長させた.これらの結果から,Src/c-Abl経路は筋萎縮性側索硬化症の治療において標的となる可能性が示唆された.
筋萎縮性側索硬化症は運動ニューロンが進行性に細胞死をきたす神経変性疾患であり,その進行は速く,現在のところ十分な治療法はない.多くは孤発性であるが,約10%は家族性であり,そのうち約25%はSOD1遺伝子の変異が原因とされる1).変異SOD1をもつ筋萎縮性側索硬化症のモデルマウスが作製されたことにより2),その病態や治療薬の開発にかかわる研究は飛躍的に進歩した.しかし,モデルマウスにおいて多数の薬剤をスクリーニングすることは現実には困難である.そこで,筆者らは,筋萎縮性側索硬化症の患者から作製したiPS細胞を用いて,そこから分化させた運動ニューロンの生存率を指標とする化合物スクリーニング系を構築し,運動ニューロンの変性を抑制する薬剤を探索した.
Srcおよびc-Ablはチロシンキナーゼであり,Srcはがん細胞において活性化しており,また,BCR-ABL融合タンパク質は慢性骨髄性白血病を生じることが知られている.Src/c-Abl経路はさまざまな機能をもち,いくつかの神経変性疾患への関与が知られている3-5).
大規模な化合物スクリーニングのためには短期間で大量の運動ニューロンを作製する方法が必要であったため,iPS細胞に転写因子を導入して運動ニューロンを作製する方法を開発した.具体的には,神経幹細胞から運動ニューロンを分化させることがすでに報告されていた3つの転写因子Lhx3,Ngn2,Isl1 6) を2Aペプチドで連結してTet-on系により発現するベクターに搭載し,piggyBacトランスポゾンを用いてiPS細胞に導入して恒常的な発現株を作製した.これにより,ドキシサイクリンを添加したのち7日間でiPS細胞から運動ニューロンを作製することに成功した.この方法を用いて,健常者に由来するiPS細胞およびSOD1遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者に由来するiPS細胞から運動ニューロンを作製した.また,この患者に由来するiPS細胞において遺伝子変異を修復したうえで運動ニューロンを作製した.その結果,患者から作製した運動ニューロンにおいては,ミスフォールドしたSOD1が蓄積していた.また,分化7日目に対する分化14日目の運動ニューロンの生存率を比較したところ,健常者から作製した運動ニューロンや遺伝子変異を修復したうえで作製した運動ニューロンに比べ,患者から作製した運動ニューロンにおいては生存率が低下した.iPS細胞から作製された運動ニューロンにおいて,異常なタンパク質の蓄積および細胞死という神経変性による2つの表現型が再現された.
SOD1遺伝子に変異をもつ家族性の萎縮性側索硬化症の患者から作製した運動ニューロンを用いて,その生存率を指標とする化合物スクリーニング系を構築した.iPS細胞に由来する運動ニューロンの生存率を上昇させることが知られているケンパウロン7) を陽性対照,ジメチルスルホキシドを陰性対照に用いて,既存薬および開発候補薬を含む1416個の化合物スクリーニングを施行した.陰性対照に対し生存率の上昇が標準偏差の3倍以上みられた化合物をヒットと定義し,27個のヒット化合物が同定された.そのうち13個はSrc/c-Abl経路を標的とする化合物であった.そこで,Srcあるいはc-Ablをノックダウンしたところ,患者から作製した運動ニューロンにおいて生存率が上昇した.また,患者から作製した運動ニューロンにおいてはSrcおよびc-Ablのリン酸化が増加していた.
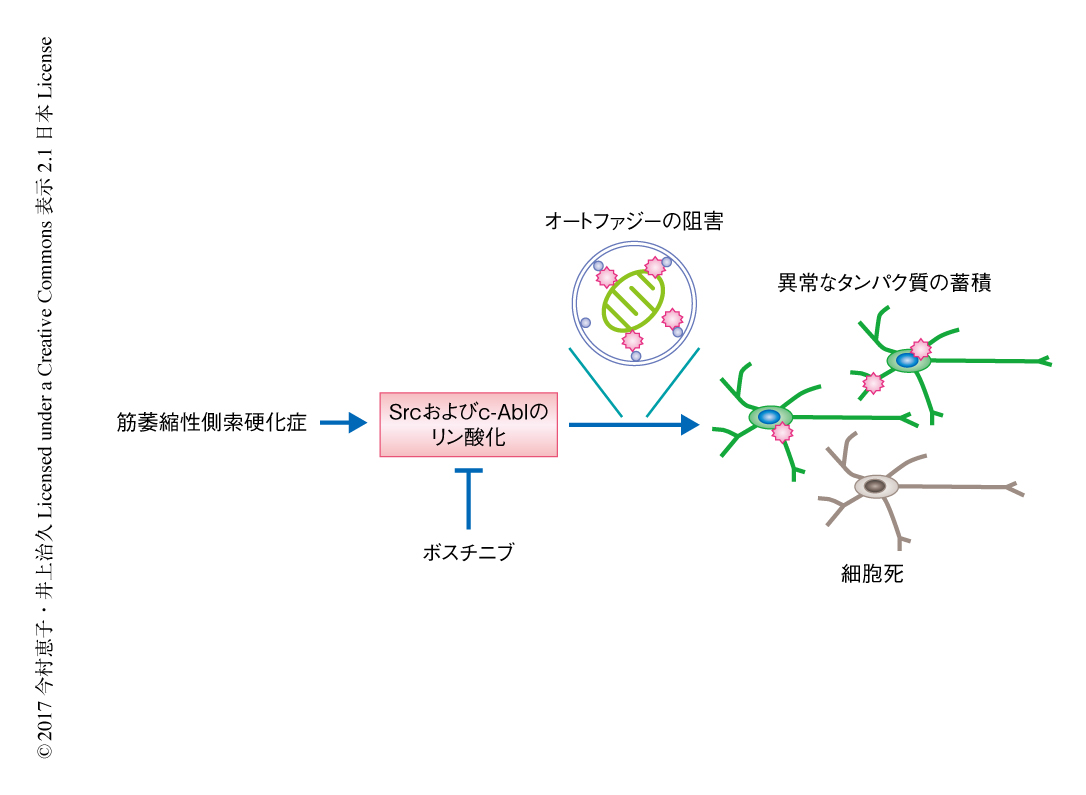
ヒット化合物のうちSrc/c-Abl阻害薬のひとつであるボスチニブに注目し,筋萎縮性側索硬化症の患者から作製した運動ニューロンの生存率を改善させる機序について調べた.SOD1遺伝子変異をもつ家族性の萎縮性側索硬化症の患者から作製した運動ニューロンとこの患者から遺伝子変異を修復したうえで作製した運動ニューロンとを比較すると,患者から作製した運動ニューロンにおいてp62およびLC3-II/LC3-I比が増加していたが,ボスチニブはこれらを改善した.さらに,mTOR阻害薬であるラパマイシンやmTORのノックダウンにより患者から作製した運動ニューロンの生存率は上昇したこと,オートファジーの阻害薬であるLY294002やクロロキンによりボスチニブによる運動ニューロンの生存率の上昇は抑制されたことから,患者から作製した運動ニューロンにおいてはオートファジーが阻害されており,ボスチニブはこれを改善することが示唆された.また,ボスチニブは患者から作製した運動ニューロンにおいてミスフォールドしたSOD1の蓄積を減少させた.患者から作製した運動ニューロンにおいては遺伝子変異を修復した運動ニューロンと比較してATPの量が減少していたが,ボスチニブはこれを改善した.また,1細胞RNA-seq法により,患者から作製した運動ニューロンにおいては遺伝子変異を修復した運動ニューロンと比較してミトコンドリアにおけるエネルギーの産生に関連する遺伝子の発現が上昇していたが,これもボスチニブにより改善された.これらの結果から,オートファジーを促進しATPの不足を解消することが,筋萎縮性側索硬化症の患者から作製した運動ニューロンにおけるボスチニブの有効性の機序のひとつであることが示唆された(図1).
さらに,異なるタイプの患者から作製した運動ニューロンにおけるボスチニブの効果について調べるため,TDP-43遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者,C9orf72遺伝子におけるリピートの伸長をともなう家族性の筋萎縮性側索硬化症の患者,孤発性の筋萎縮性側索硬化症の患者に由来するiPS細胞から運動ニューロンを作製した.その結果,ボスチニブはこれら家族性の患者から作製した運動ニューロン,および,一部の孤発性の患者から作製した運動ニューロンにおいて生存率を上昇させた.さらに,in vivoにおけるボスチニブの有効性について調べるため,変異SOD1をもつ筋萎縮性側索硬化症のモデルマウスにボスチニブを投与したところ,発症は10.8日遅延し,生存期間は7.8日延長した.また,ボスチニブはモデルマウスの脊髄においてミスフォールドしたSOD1の蓄積を減少させた.
この研究においては,Src/c-Abl経路が筋萎縮性側索硬化症の治療において標的となる可能性が示された.Src/c-Abl阻害薬であるボスチニブは筋萎縮性側索硬化症の患者から作製されたiPS細胞に由来する運動ニューロンの生存率を上昇させ,筋萎縮性側索硬化症のモデルマウスの生存期間を延長した.今後は,Src/c-Abl経路において筋萎縮性側索硬化症の病態に関連する分子標的についての詳細な解析が必要であると考えられる.
略歴:2007年 鳥取大学大学院医学系研究科 修了,2011年 京都大学iPS細胞研究所 研究員を経て,2016年より 同 特定拠点助教.
研究テーマ:神経変性疾患の病態の解析および治療法の開発.
井上 治久(Haruhisa Inoue)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/inoue/
© 2017 今村恵子・井上治久 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 増殖分化機構研究部門)
email:井上治久
DOI: 10.7875/first.author.2017.056
The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis.
Keiko Imamura , Yuishin Izumi, Akira Watanabe, Kayoko Tsukita, Knut Woltjen, Takuya Yamamoto, Akitsu Hotta, Takayuki Kondo, Shiho Kitaoka, Akira Ohta, Akito Tanaka, Dai Watanabe, Mitsuya Morita, Hiroshi Takuma, Akira Tamaoka, Tilo Kunath, Selina Wray, Hirokazu Furuya, Takumi Era, Kouki Makioka, Koichi Okamoto, Takao Fujisawa, Hideki Nishitoh, Kengo Homma, Hidenori Ichijo, Jean-Pierre Julien, Nanako Obata, Masato Hosokawa, Haruhiko Akiyama, Satoshi Kaneko, Takashi Ayaki, Hidefumi Ito, Ryuji Kaji, Ryosuke Takahashi, Shinya Yamanaka, Haruhisa Inoue
Science Translational Medicine, 9, eaaf3962 (2017)
要 約
筋萎縮性側索硬化症は進行性に運動ニューロンが障害される難治性の疾患であり,現在のところ十分な治療法はない.筆者らは,SOD1遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者から作製したiPS細胞に由来する運動ニューロンの生存率を指標として化合物スクリーニングを施行したところ,ヒットの約半数はSrc/c-Abl経路を標的としていた.Src/c-Abl阻害薬,および,Srcあるいはc-Ablのノックダウンは,患者から作製した運動ニューロンの生存率を上昇させた.ヒット化合物のひとつであるSrc/c-Abl阻害薬ボスチニブは患者から作製した運動ニューロンにおいてオートファジーを促進し,ミスフォールドしたSOD1の蓄積を減少させた.また,ボスチニブはTDP-43遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者,C9orf72遺伝子におけるリピートの伸長をともなう家族性の筋萎縮性側索硬化症の患者,孤発性の筋萎縮性側索硬化症の患者から作製したiPS細胞に由来する運動ニューロンの生存率も上昇させ,さらに,ボスチニブは筋萎縮性側索硬化症のモデルマウスの生存期間を延長させた.これらの結果から,Src/c-Abl経路は筋萎縮性側索硬化症の治療において標的となる可能性が示唆された.
はじめに
筋萎縮性側索硬化症は運動ニューロンが進行性に細胞死をきたす神経変性疾患であり,その進行は速く,現在のところ十分な治療法はない.多くは孤発性であるが,約10%は家族性であり,そのうち約25%はSOD1遺伝子の変異が原因とされる1).変異SOD1をもつ筋萎縮性側索硬化症のモデルマウスが作製されたことにより2),その病態や治療薬の開発にかかわる研究は飛躍的に進歩した.しかし,モデルマウスにおいて多数の薬剤をスクリーニングすることは現実には困難である.そこで,筆者らは,筋萎縮性側索硬化症の患者から作製したiPS細胞を用いて,そこから分化させた運動ニューロンの生存率を指標とする化合物スクリーニング系を構築し,運動ニューロンの変性を抑制する薬剤を探索した.
Srcおよびc-Ablはチロシンキナーゼであり,Srcはがん細胞において活性化しており,また,BCR-ABL融合タンパク質は慢性骨髄性白血病を生じることが知られている.Src/c-Abl経路はさまざまな機能をもち,いくつかの神経変性疾患への関与が知られている3-5).
1.iPS細胞から短期間で運動ニューロンを作製する方法の開発とその表現型の解析
大規模な化合物スクリーニングのためには短期間で大量の運動ニューロンを作製する方法が必要であったため,iPS細胞に転写因子を導入して運動ニューロンを作製する方法を開発した.具体的には,神経幹細胞から運動ニューロンを分化させることがすでに報告されていた3つの転写因子Lhx3,Ngn2,Isl1 6) を2Aペプチドで連結してTet-on系により発現するベクターに搭載し,piggyBacトランスポゾンを用いてiPS細胞に導入して恒常的な発現株を作製した.これにより,ドキシサイクリンを添加したのち7日間でiPS細胞から運動ニューロンを作製することに成功した.この方法を用いて,健常者に由来するiPS細胞およびSOD1遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者に由来するiPS細胞から運動ニューロンを作製した.また,この患者に由来するiPS細胞において遺伝子変異を修復したうえで運動ニューロンを作製した.その結果,患者から作製した運動ニューロンにおいては,ミスフォールドしたSOD1が蓄積していた.また,分化7日目に対する分化14日目の運動ニューロンの生存率を比較したところ,健常者から作製した運動ニューロンや遺伝子変異を修復したうえで作製した運動ニューロンに比べ,患者から作製した運動ニューロンにおいては生存率が低下した.iPS細胞から作製された運動ニューロンにおいて,異常なタンパク質の蓄積および細胞死という神経変性による2つの表現型が再現された.
2.筋萎縮性側索硬化症の患者から作製した運動ニューロンを用いた化合物スクリーニング
SOD1遺伝子に変異をもつ家族性の萎縮性側索硬化症の患者から作製した運動ニューロンを用いて,その生存率を指標とする化合物スクリーニング系を構築した.iPS細胞に由来する運動ニューロンの生存率を上昇させることが知られているケンパウロン7) を陽性対照,ジメチルスルホキシドを陰性対照に用いて,既存薬および開発候補薬を含む1416個の化合物スクリーニングを施行した.陰性対照に対し生存率の上昇が標準偏差の3倍以上みられた化合物をヒットと定義し,27個のヒット化合物が同定された.そのうち13個はSrc/c-Abl経路を標的とする化合物であった.そこで,Srcあるいはc-Ablをノックダウンしたところ,患者から作製した運動ニューロンにおいて生存率が上昇した.また,患者から作製した運動ニューロンにおいてはSrcおよびc-Ablのリン酸化が増加していた.
3.筋萎縮性側索硬化症の患者から作製した運動ニューロンにおけるSrc/c-Abl阻害薬ボスチニブの有効性とその機序
ヒット化合物のうちSrc/c-Abl阻害薬のひとつであるボスチニブに注目し,筋萎縮性側索硬化症の患者から作製した運動ニューロンの生存率を改善させる機序について調べた.SOD1遺伝子変異をもつ家族性の萎縮性側索硬化症の患者から作製した運動ニューロンとこの患者から遺伝子変異を修復したうえで作製した運動ニューロンとを比較すると,患者から作製した運動ニューロンにおいてp62およびLC3-II/LC3-I比が増加していたが,ボスチニブはこれらを改善した.さらに,mTOR阻害薬であるラパマイシンやmTORのノックダウンにより患者から作製した運動ニューロンの生存率は上昇したこと,オートファジーの阻害薬であるLY294002やクロロキンによりボスチニブによる運動ニューロンの生存率の上昇は抑制されたことから,患者から作製した運動ニューロンにおいてはオートファジーが阻害されており,ボスチニブはこれを改善することが示唆された.また,ボスチニブは患者から作製した運動ニューロンにおいてミスフォールドしたSOD1の蓄積を減少させた.患者から作製した運動ニューロンにおいては遺伝子変異を修復した運動ニューロンと比較してATPの量が減少していたが,ボスチニブはこれを改善した.また,1細胞RNA-seq法により,患者から作製した運動ニューロンにおいては遺伝子変異を修復した運動ニューロンと比較してミトコンドリアにおけるエネルギーの産生に関連する遺伝子の発現が上昇していたが,これもボスチニブにより改善された.これらの結果から,オートファジーを促進しATPの不足を解消することが,筋萎縮性側索硬化症の患者から作製した運動ニューロンにおけるボスチニブの有効性の機序のひとつであることが示唆された(図1).
4.異なるタイプの患者から作製した運動ニューロンおよびモデルマウスにおけるボスチニブの効果
さらに,異なるタイプの患者から作製した運動ニューロンにおけるボスチニブの効果について調べるため,TDP-43遺伝子に変異をもつ家族性の筋萎縮性側索硬化症の患者,C9orf72遺伝子におけるリピートの伸長をともなう家族性の筋萎縮性側索硬化症の患者,孤発性の筋萎縮性側索硬化症の患者に由来するiPS細胞から運動ニューロンを作製した.その結果,ボスチニブはこれら家族性の患者から作製した運動ニューロン,および,一部の孤発性の患者から作製した運動ニューロンにおいて生存率を上昇させた.さらに,in vivoにおけるボスチニブの有効性について調べるため,変異SOD1をもつ筋萎縮性側索硬化症のモデルマウスにボスチニブを投与したところ,発症は10.8日遅延し,生存期間は7.8日延長した.また,ボスチニブはモデルマウスの脊髄においてミスフォールドしたSOD1の蓄積を減少させた.
おわりに
この研究においては,Src/c-Abl経路が筋萎縮性側索硬化症の治療において標的となる可能性が示された.Src/c-Abl阻害薬であるボスチニブは筋萎縮性側索硬化症の患者から作製されたiPS細胞に由来する運動ニューロンの生存率を上昇させ,筋萎縮性側索硬化症のモデルマウスの生存期間を延長した.今後は,Src/c-Abl経路において筋萎縮性側索硬化症の病態に関連する分子標的についての詳細な解析が必要であると考えられる.
文 献
- Rosen, D. R., Siddique, T., Patterson, D. et al.: Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature, 362, 59-62 (1993)[PubMed]
- Gurney, M. E., Pu, H., Chiu, A. Y. et al.: Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science, 264, 1772-1775 (1994)[PubMed]
- Katsumata, R., Ishigaki, S., Katsuno, M. et al.: c-Abl inhibition delays motor neuron degeneration in the G93A mouse, an animal model of amyotrophic lateral sclerosis. PLoS One, 7, e46185 (2012)[PubMed]
- Wenqiang, C., Lonskaya, I., Hebron, M. L. et al.: Parkin-mediated reduction of nuclear and soluble TDP-43 reverses behavioral decline in symptomatic mice. Hum. Mol. Genet., 23, 4960-4969 (2014)[PubMed]
- Schlatterer, S. D., Acker, C. M. & Davies, P.: c-Abl in neurodegenerative disease. J. Mol. Neurosci., 45, 445-452 (2011)[PubMed]
- Hester, M. E., Murtha, M. J., Song, S. et al.: Rapid and efficient generation of functional motor neurons from human pluripotent stem cells using gene delivered transcription factor codes. Mol. Ther., 19, 1905-1912 (2011)[PubMed]
- Yang, Y. M., Gupta, S. K., Kim, K. J. et al.: A small molecule screen in stem-cell-derived motor neurons identifies a kinase inhibitor as a candidate therapeutic for ALS. Cell Stem Cell, 12, 713-726 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 鳥取大学大学院医学系研究科 修了,2011年 京都大学iPS細胞研究所 研究員を経て,2016年より 同 特定拠点助教.
研究テーマ:神経変性疾患の病態の解析および治療法の開発.
井上 治久(Haruhisa Inoue)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/inoue/
© 2017 今村恵子・井上治久 Licensed under CC 表示 2.1 日本