アミノ酸代謝のリプログラミングによるがんの進行の制御
服部鮎奈・伊藤貴浩
(米国Georgia大学Department of Biochemistry and Molecular Biology)
email:伊藤貴浩
DOI: 10.7875/first.author.2017.054
Cancer progression by reprogrammed BCAA metabolism in myeloid leukaemia.
Ayuna Hattori, Makoto Tsunoda, Takaaki Konuma, Masayuki Kobayashi, Tamas Nagy, John Glushka, Fariba Tayyari, Daniel McSkimming, Natarajan Kannan, Arinobu Tojo, Arthur S. Edison, Takahiro Ito
Nature, 545, 500-504 (2017)
Warburg効果をはじめ,がん細胞は正常な細胞とは異なる代謝を示すことが知られている.近年,がん化にともなう遺伝子の変異が細胞の代謝を変えることが示されてきたが,がんの進行における代謝の変化の役割については不明である.筆者らは,分枝鎖アミノ酸を基質とするアミノ基転移酵素BCAT1が,分枝鎖アミノ酸の産生の亢進を介し慢性骨髄性白血病の悪性化に必須であることを見い出した.マウスモデルを用いた解析により,慢性骨髄性白血病の病期の進行にともないBCAT1の発現が上昇すること,BCAT1の機能の阻害により白血病細胞が分化すること,マウスの生存率が改善すること,が明らかにされた.ヒトの慢性骨髄性白血病においても,病期の進行にともないBCAT1の発現は上昇し,また,BCAT1のノックダウンあるいは阻害薬により患者に由来する白血病細胞の増殖は抑制された.さらに,BCAT1の発現を制御するタンパク質としてRNA結合タンパク質MSI2が同定された.MSI2はBCAT1 mRNAと結合してその発現の促進に寄与すると考えられた.以上の結果から,慢性骨髄性白血病の病期の進行がRNA結合タンパク質による転写後の発現制御および分枝鎖アミノ酸の代謝の活性化により制御されることが示された.
われわれのからだを構成するすべての細胞は,栄養飢餓状態やストレスなどの外的および内的な変動に応じて細胞の代謝系を制御することにより細胞の増殖や生存を適切に制御する.同様に,がん細胞も自らに有利になるよう代謝系をリプログラミングすると考えられている1).ATPの産生の効率の低い解糖系を積極的に利用する“Warburg効果”も,がん細胞においてみられる代謝系のリプログラミングのひとつである.このように,がん細胞は代謝系を積極的に変化させることにより,活発な細胞分裂に必要なタンパク質や核酸の産生の材料を大量に供給したり,低酸素状態など周囲の特殊な周囲に適応したりすることが明らかにされた.これらのことから,正常な細胞とがん細胞とで異なる代謝系を見い出すことにより,この違いを標的とする新たながんの治療戦略の開発が期待されている2).一方で,良性腫瘍や前がん状態から,未分化ながん細胞の増加する悪性度の高いがんへと進展するときにも,このような代謝系の変化が起こっているかについては明らかではない.
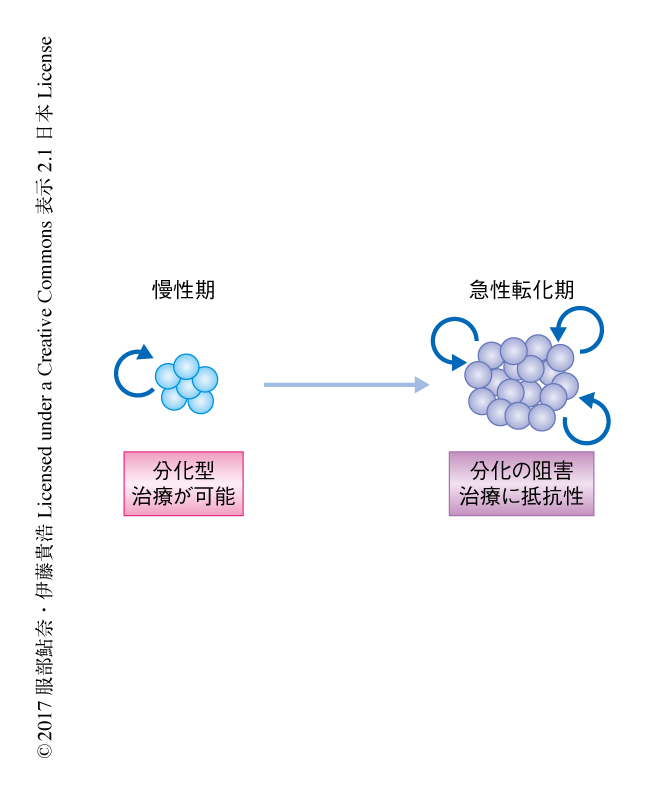
筆者らは,慢性骨髄性白血病の病期の進行に着目した.慢性骨髄性白血病は造血幹細胞において染色体の転座によりBCR-ABL1キメラ遺伝子が生じることにより発症する白血病である(図1).病期の初期にあたる慢性期においてはBCR-ABL1により増殖が促進され成熟型の造血細胞が増加するが,未成熟な血液細胞である芽球の割合は低い状態に維持される.イマチニブなどのチロシンキナーゼ阻害薬はBCR-ABL1の分子標的薬であり,慢性骨髄性白血病の治療の成績を大きく改善した.一方,後期にあたる急性転化期においては分化の停止した異常な細胞が増加し,正常な造血がいちじるしく阻害される.イマチニブや移植療法などに対する応答もかんばしくなく難治性である.急性転化期への進行にはp53遺伝子などのがん抑制遺伝子の変異あるいは新たな染色体転座など第2の変異が関与すると考えられるが,それらの変異がどのように慢性期の細胞をリプログラミングし分化の障害をひき起こすのかについては不明な点が多い.
代謝系のリプログラミングの慢性骨髄性白血病の病期の進行への寄与について明らかにするため,アミノ酸代謝に注目した.解析にはヒトの慢性骨髄性白血病の病期を再現するマウスモデルを用いた.慢性期のマウスモデル,あるいは,急性転化期のマウスモデルは,単離した正常な造血幹細胞および前駆細胞の画分に,BCR-ABL1を単独にて強制発現,あるいは,BCR-ABL1およびNUP98-HOXA9を強制発現し,その細胞をレシピエントマウスに移植することにより作製した.
慢性期のマウスモデルおよび急性転化期のマウスモデルにおいて血中のアミノ酸の濃度の変化を調べた.アミノ基に特異的に反応する蛍光試薬を用いてアミノ酸を標識し,高速液体クロマトグラフィにより分離および定量する高感度な分析法によりアミノ酸の濃度を定量した.その結果,病期の初期にあたる慢性期に比べ,急性転化期においてはアラニン,グルタミン酸,および,3種の分枝鎖アミノ酸であるバリン,ロイシン,イソロイシンの濃度が上昇していた.これらのマウスから蛍光セルソーターを用いて白血病細胞を分取し,同様の方法により細胞におけるアミノ酸を定量したところ,3種の分枝鎖アミノ酸すべてとプロリンが有意に高値を示し,アラニンあるいはグルタミン酸の増加はみられなかった.これらの結果から,分枝鎖アミノ酸の細胞への取り込みの亢進あるいは代謝の変化が慢性骨髄性白血病の病期の進行に関与すると考えられた.
放射性同位体により標識したロイシンを用いて細胞への取り込みについて検討したところ,慢性期のマウスモデルと比べ,急性転化期のマウスモデルには取り込みの亢進はみられなかった.そこで,細胞における濃度の増加は代謝酵素の発現の変動によると考え,アミノ酸代謝に関連する遺伝子の発現について精査したところ,細胞質型の分枝鎖アミノ酸アミノ基転移酵素をコードするBCAT1遺伝子の発現が,mRNAおよびタンパク質のレベルにおいて急性転化期のマウスモデルにて顕著に増加していた.マウスの正常な組織においてBCAT1遺伝子は組織に特異的な発現パターンを示し,とくに正常な造血細胞においてほとんど発現は検出されなかった.また,ミトコンドリア型の分枝鎖アミノ酸アミノ基転移酵素をコードするBCAT2遺伝子や,アラニンアミノ基転移酵素をコードするGPT1遺伝子およびGPT2遺伝子などは病期に特異的な発現を示さなかった.
BCAT1は分枝鎖ケト酸とグルタミン酸から分枝鎖アミノ酸とα-ケトグルタル酸を産生あるいは分解する反応を両方向に触媒する酵素で,多くの先行研究において,分枝鎖アミノ酸の分解にはたらくとされている.一方,白血病細胞においてはBCAT1の発現の上昇および分枝鎖アミノ酸の増加がみられた.そこで,分枝鎖アミノ酸の産生のためにBCAT1の基質となる分枝鎖ケト酸が細胞に存在するかどうか調べたところ,血中および白血病細胞において存在が確認された.安定同位体により標識した分枝鎖アミノ酸および分枝鎖ケト酸の代謝における運命をMNR法により追跡した結果,急性転化期の白血病細胞においては分枝鎖アミノ酸の分解はほとんど観察されず,むしろ,BCAT1により分枝鎖アミノ酸の産生が亢進していた.これらの結果から,白血病細胞においてはBCAT1の酵素反応を正常な細胞とは異なる用途に転用する代謝系のリプログラミングが起こることが示された.
BCAT1が白血病細胞の増殖および維持に必要かどうかを調べる目的で,shRNAを用いてBCAT1のノックダウン,および,低分子化合物を用いてBCAT1の酵素活性を阻害した.その結果,BCAT1の機能の阻害により腫瘍形成能の指標のひとつである白血病細胞のコロニー数が有意に減少した.コロニー形成能は細胞の分化により失われるため,この結果から,BCATの機能の阻害により細胞の分化が誘導されることが示唆された.in vivoにおいても,BCAT1をノックダウンした細胞を移植したマウスにおいては,対照と比べ分化型のがん細胞が増加し白血病の発症率が低下した.1次移植により白血病を発症したマウスから細胞を回収して2次移植したところ,対照においてはすべてのマウスが白血病により死亡したのに対し,BCAT1の機能を阻害したマウスは白血病を発症しなかった.これは,対照のマウスにおいては白血病のがん幹細胞が保持されているが,BCAT1の機能を阻害したマウスにおいては未分化性が失われて細胞が分化した結果,がん幹細胞による白血病の発症の活性が消失したためと考えられた.また,BCR-ABL1とともにBCAT1を強制発現すると,未分化型の細胞が増加し急性転化に類似した病態を示した.一方で,正常な造血細胞においてはBCAT1の機能を阻害しても細胞の増殖に大きな影響はみられなかった.以上のことから,BCAT1はがん細胞の分化を阻害し白血病幹細胞の維持に寄与することが明らかにされた.
ヒトの白血病においてもBCAT1が病期の進行に重要なのか検討した.日本および米国の慢性骨髄性白血病の患者から得た検体について遺伝子の発現を解析したところ,マウスモデルと同様に,病期の進行にともないほぼすべての症例においてBCAT1遺伝子の発現が上昇していた.また,BCAT1のノックダウンおよび阻害薬により,ヒトの急性転化期の慢性骨髄性白血病に由来する細胞株K562細胞および急性転化期の慢性骨髄性白血病の患者から得た検体においてコロニー形成能が低下した.さらに,急性骨髄性白血病においてもBCAT1遺伝子の発現の上昇が観察された.ヒトの急性骨髄性白血病に由来する3種の細胞株,および,急性骨髄性白血病の患者から得た2つの検体において,BCAT1の阻害薬によりコロニー形成能が低下した.さらに,BCAT1の発現量と予後との相関について解析したところ,急性骨髄性白血病についてBCAT1を高発現する症例は低発現する症例と比べて有意に予後が不良であった.この結果から,BCAT1は2次変異の種類や人種によらず,骨髄性白血病において広範に機能することが示唆された.
BCAT1のノックダウンおよび阻害薬により急性転化期の慢性骨髄性白血病に由来するK562細胞のコロニー形成能は低下したが,このとき細胞におけるアミノ酸の濃度を測定したところ分枝鎖アミノ酸が有意に減少しており,さらに,コロニー形成能の低下は培地への分枝鎖アミノ酸の添加により抑圧された.アミノ酸,とくにロイシンは細胞の増殖を促進するmTOR複合体1経路を活性化することが知られている3).そこで,mTOR複合体1の活性化の指標であるS6Kのリン酸化について調べたところ,BCAT1のノックダウンによりリン酸化型のS6Kが減少した.この減少は分枝鎖アミノ酸の添加により回復し,mTORC複合体1の阻害薬であるラパマイシンの添加によりふたたび消失した.以上の結果から,BCAT1による分枝鎖アミノ酸の産生の亢進はmTORC複合体1経路の活性化を介して白血病細胞の増殖に機能することが示唆された.
BCAT1の発現の制御機構について明らかにするため,複数種の腫瘍について患者における遺伝子の発現データからBCAT1遺伝子と共発現する遺伝子を解析したところ,候補としてRNA結合タンパク質MSI2をコードする遺伝子が同定された.MSI2はがん細胞における幹細胞シグナルの活性化を介して慢性骨髄性白血病の維持に必要であることが報告されている4).BCAT1 mRNAの3’非翻訳領域には40コピーのMSI2結合コンセンサス配列が存在し,MSI2はそのRNA結合能に依存してBCAT1 mRNAと結合した.MSI2をノックダウンするとBCAT1が減少したことから,MSI2はBCAT1 mRNAと結合しその量を正に制御することが示唆された.さらに,急性転化期の慢性骨髄性白血病に由来するK562細胞のコロニー形成能はMSI2のノックダウンにより低下したが,これはBCAT1遺伝子の過剰発現あるいは分枝鎖アミノ酸の添加により抑圧されたことから,MSI2-BCAT1経路は分枝鎖アミノ酸の産生の亢進およびmTOR複合体1経路の活性化を介し,急性転化期の慢性骨髄性白血病において細胞の増殖を促進することがわかった.
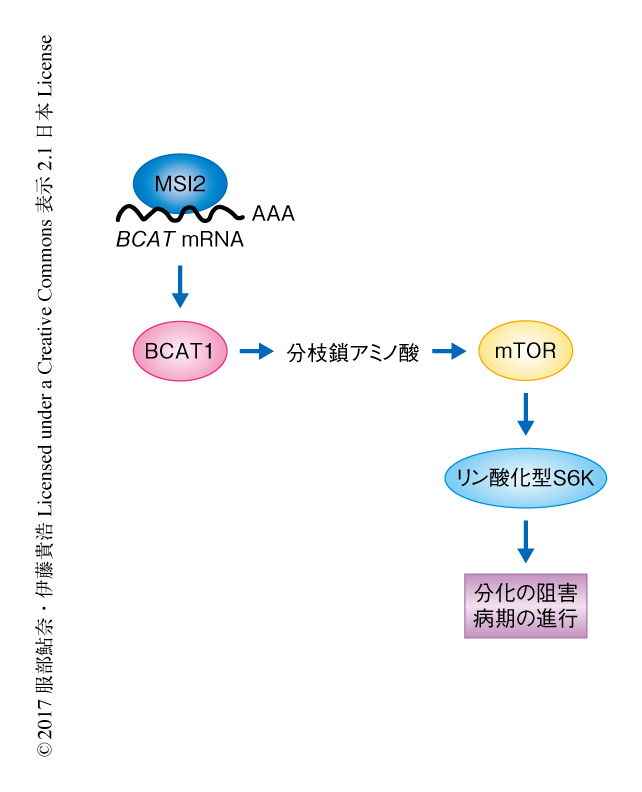
筆者らは,この研究において,分枝鎖アミノ酸アミノ基転移酵素BCAT1が慢性骨髄性白血病において分枝鎖アミノ酸を産生することにより病期の進行に関与することを見い出した(図2).一方で,筋肉組織やグリオーマにおいてBCAT1は分枝鎖アミノ酸の分解を促進することが知られていることから,代謝におけるBCAT1の機能は組織や細胞腫に特異的であることが示された5).この研究は,がんの悪性化に分枝鎖アミノ酸の代謝の変化が直接的に寄与することを明らかにしただけでなく,MSI2-BCAT1経路の活性化による代謝系のリプログラミングを介し白血病の病期の進展を遅延あるいは阻止する新たな治療戦略の開発につながる可能性をも示した.BCAT1の発現の上昇はグリオーマ,大腸がん,乳がんにおいても観察されること,それらのがんにおいてMSI2も高発現することがわかっている.このことから,MSI2-BCAT1経路を標的とした治療は,白血病のみならず広範ながんにおいて有効であることが期待される.
略歴:米国Georgia大学Postdoctoral Research Associate.
研究テーマ:造血幹細胞およびがん幹細胞における細胞運命の決定の機構.
伊藤 貴浩(Takahiro Ito)
米国Georgia大学Assistant Professor.
研究室URL:http://www.bmb.uga.edu/labs/ito
© 2017 服部鮎奈・伊藤貴浩 Licensed under CC 表示 2.1 日本
(米国Georgia大学Department of Biochemistry and Molecular Biology)
email:伊藤貴浩
DOI: 10.7875/first.author.2017.054
Cancer progression by reprogrammed BCAA metabolism in myeloid leukaemia.
Ayuna Hattori, Makoto Tsunoda, Takaaki Konuma, Masayuki Kobayashi, Tamas Nagy, John Glushka, Fariba Tayyari, Daniel McSkimming, Natarajan Kannan, Arinobu Tojo, Arthur S. Edison, Takahiro Ito
Nature, 545, 500-504 (2017)
要 約
Warburg効果をはじめ,がん細胞は正常な細胞とは異なる代謝を示すことが知られている.近年,がん化にともなう遺伝子の変異が細胞の代謝を変えることが示されてきたが,がんの進行における代謝の変化の役割については不明である.筆者らは,分枝鎖アミノ酸を基質とするアミノ基転移酵素BCAT1が,分枝鎖アミノ酸の産生の亢進を介し慢性骨髄性白血病の悪性化に必須であることを見い出した.マウスモデルを用いた解析により,慢性骨髄性白血病の病期の進行にともないBCAT1の発現が上昇すること,BCAT1の機能の阻害により白血病細胞が分化すること,マウスの生存率が改善すること,が明らかにされた.ヒトの慢性骨髄性白血病においても,病期の進行にともないBCAT1の発現は上昇し,また,BCAT1のノックダウンあるいは阻害薬により患者に由来する白血病細胞の増殖は抑制された.さらに,BCAT1の発現を制御するタンパク質としてRNA結合タンパク質MSI2が同定された.MSI2はBCAT1 mRNAと結合してその発現の促進に寄与すると考えられた.以上の結果から,慢性骨髄性白血病の病期の進行がRNA結合タンパク質による転写後の発現制御および分枝鎖アミノ酸の代謝の活性化により制御されることが示された.
はじめに
われわれのからだを構成するすべての細胞は,栄養飢餓状態やストレスなどの外的および内的な変動に応じて細胞の代謝系を制御することにより細胞の増殖や生存を適切に制御する.同様に,がん細胞も自らに有利になるよう代謝系をリプログラミングすると考えられている1).ATPの産生の効率の低い解糖系を積極的に利用する“Warburg効果”も,がん細胞においてみられる代謝系のリプログラミングのひとつである.このように,がん細胞は代謝系を積極的に変化させることにより,活発な細胞分裂に必要なタンパク質や核酸の産生の材料を大量に供給したり,低酸素状態など周囲の特殊な周囲に適応したりすることが明らかにされた.これらのことから,正常な細胞とがん細胞とで異なる代謝系を見い出すことにより,この違いを標的とする新たながんの治療戦略の開発が期待されている2).一方で,良性腫瘍や前がん状態から,未分化ながん細胞の増加する悪性度の高いがんへと進展するときにも,このような代謝系の変化が起こっているかについては明らかではない.
筆者らは,慢性骨髄性白血病の病期の進行に着目した.慢性骨髄性白血病は造血幹細胞において染色体の転座によりBCR-ABL1キメラ遺伝子が生じることにより発症する白血病である(図1).病期の初期にあたる慢性期においてはBCR-ABL1により増殖が促進され成熟型の造血細胞が増加するが,未成熟な血液細胞である芽球の割合は低い状態に維持される.イマチニブなどのチロシンキナーゼ阻害薬はBCR-ABL1の分子標的薬であり,慢性骨髄性白血病の治療の成績を大きく改善した.一方,後期にあたる急性転化期においては分化の停止した異常な細胞が増加し,正常な造血がいちじるしく阻害される.イマチニブや移植療法などに対する応答もかんばしくなく難治性である.急性転化期への進行にはp53遺伝子などのがん抑制遺伝子の変異あるいは新たな染色体転座など第2の変異が関与すると考えられるが,それらの変異がどのように慢性期の細胞をリプログラミングし分化の障害をひき起こすのかについては不明な点が多い.
1.慢性骨髄性白血病の病期の進行にともなう分枝鎖アミノ酸の増加
代謝系のリプログラミングの慢性骨髄性白血病の病期の進行への寄与について明らかにするため,アミノ酸代謝に注目した.解析にはヒトの慢性骨髄性白血病の病期を再現するマウスモデルを用いた.慢性期のマウスモデル,あるいは,急性転化期のマウスモデルは,単離した正常な造血幹細胞および前駆細胞の画分に,BCR-ABL1を単独にて強制発現,あるいは,BCR-ABL1およびNUP98-HOXA9を強制発現し,その細胞をレシピエントマウスに移植することにより作製した.
慢性期のマウスモデルおよび急性転化期のマウスモデルにおいて血中のアミノ酸の濃度の変化を調べた.アミノ基に特異的に反応する蛍光試薬を用いてアミノ酸を標識し,高速液体クロマトグラフィにより分離および定量する高感度な分析法によりアミノ酸の濃度を定量した.その結果,病期の初期にあたる慢性期に比べ,急性転化期においてはアラニン,グルタミン酸,および,3種の分枝鎖アミノ酸であるバリン,ロイシン,イソロイシンの濃度が上昇していた.これらのマウスから蛍光セルソーターを用いて白血病細胞を分取し,同様の方法により細胞におけるアミノ酸を定量したところ,3種の分枝鎖アミノ酸すべてとプロリンが有意に高値を示し,アラニンあるいはグルタミン酸の増加はみられなかった.これらの結果から,分枝鎖アミノ酸の細胞への取り込みの亢進あるいは代謝の変化が慢性骨髄性白血病の病期の進行に関与すると考えられた.
放射性同位体により標識したロイシンを用いて細胞への取り込みについて検討したところ,慢性期のマウスモデルと比べ,急性転化期のマウスモデルには取り込みの亢進はみられなかった.そこで,細胞における濃度の増加は代謝酵素の発現の変動によると考え,アミノ酸代謝に関連する遺伝子の発現について精査したところ,細胞質型の分枝鎖アミノ酸アミノ基転移酵素をコードするBCAT1遺伝子の発現が,mRNAおよびタンパク質のレベルにおいて急性転化期のマウスモデルにて顕著に増加していた.マウスの正常な組織においてBCAT1遺伝子は組織に特異的な発現パターンを示し,とくに正常な造血細胞においてほとんど発現は検出されなかった.また,ミトコンドリア型の分枝鎖アミノ酸アミノ基転移酵素をコードするBCAT2遺伝子や,アラニンアミノ基転移酵素をコードするGPT1遺伝子およびGPT2遺伝子などは病期に特異的な発現を示さなかった.
2.BCAT1は急性転化期の慢性骨髄性白血病において分枝鎖アミノ酸の産生を促進する
BCAT1は分枝鎖ケト酸とグルタミン酸から分枝鎖アミノ酸とα-ケトグルタル酸を産生あるいは分解する反応を両方向に触媒する酵素で,多くの先行研究において,分枝鎖アミノ酸の分解にはたらくとされている.一方,白血病細胞においてはBCAT1の発現の上昇および分枝鎖アミノ酸の増加がみられた.そこで,分枝鎖アミノ酸の産生のためにBCAT1の基質となる分枝鎖ケト酸が細胞に存在するかどうか調べたところ,血中および白血病細胞において存在が確認された.安定同位体により標識した分枝鎖アミノ酸および分枝鎖ケト酸の代謝における運命をMNR法により追跡した結果,急性転化期の白血病細胞においては分枝鎖アミノ酸の分解はほとんど観察されず,むしろ,BCAT1により分枝鎖アミノ酸の産生が亢進していた.これらの結果から,白血病細胞においてはBCAT1の酵素反応を正常な細胞とは異なる用途に転用する代謝系のリプログラミングが起こることが示された.
3.BCAT1は分化の阻害を介して急性転化期の白血病細胞の維持に寄与する
BCAT1が白血病細胞の増殖および維持に必要かどうかを調べる目的で,shRNAを用いてBCAT1のノックダウン,および,低分子化合物を用いてBCAT1の酵素活性を阻害した.その結果,BCAT1の機能の阻害により腫瘍形成能の指標のひとつである白血病細胞のコロニー数が有意に減少した.コロニー形成能は細胞の分化により失われるため,この結果から,BCATの機能の阻害により細胞の分化が誘導されることが示唆された.in vivoにおいても,BCAT1をノックダウンした細胞を移植したマウスにおいては,対照と比べ分化型のがん細胞が増加し白血病の発症率が低下した.1次移植により白血病を発症したマウスから細胞を回収して2次移植したところ,対照においてはすべてのマウスが白血病により死亡したのに対し,BCAT1の機能を阻害したマウスは白血病を発症しなかった.これは,対照のマウスにおいては白血病のがん幹細胞が保持されているが,BCAT1の機能を阻害したマウスにおいては未分化性が失われて細胞が分化した結果,がん幹細胞による白血病の発症の活性が消失したためと考えられた.また,BCR-ABL1とともにBCAT1を強制発現すると,未分化型の細胞が増加し急性転化に類似した病態を示した.一方で,正常な造血細胞においてはBCAT1の機能を阻害しても細胞の増殖に大きな影響はみられなかった.以上のことから,BCAT1はがん細胞の分化を阻害し白血病幹細胞の維持に寄与することが明らかにされた.
4.ヒトの骨髄性白血病におけるBCAT1の重要性
ヒトの白血病においてもBCAT1が病期の進行に重要なのか検討した.日本および米国の慢性骨髄性白血病の患者から得た検体について遺伝子の発現を解析したところ,マウスモデルと同様に,病期の進行にともないほぼすべての症例においてBCAT1遺伝子の発現が上昇していた.また,BCAT1のノックダウンおよび阻害薬により,ヒトの急性転化期の慢性骨髄性白血病に由来する細胞株K562細胞および急性転化期の慢性骨髄性白血病の患者から得た検体においてコロニー形成能が低下した.さらに,急性骨髄性白血病においてもBCAT1遺伝子の発現の上昇が観察された.ヒトの急性骨髄性白血病に由来する3種の細胞株,および,急性骨髄性白血病の患者から得た2つの検体において,BCAT1の阻害薬によりコロニー形成能が低下した.さらに,BCAT1の発現量と予後との相関について解析したところ,急性骨髄性白血病についてBCAT1を高発現する症例は低発現する症例と比べて有意に予後が不良であった.この結果から,BCAT1は2次変異の種類や人種によらず,骨髄性白血病において広範に機能することが示唆された.
5.BCAT1による分枝鎖アミノ酸の産生はmTOR複合体1経路を活性化する
BCAT1のノックダウンおよび阻害薬により急性転化期の慢性骨髄性白血病に由来するK562細胞のコロニー形成能は低下したが,このとき細胞におけるアミノ酸の濃度を測定したところ分枝鎖アミノ酸が有意に減少しており,さらに,コロニー形成能の低下は培地への分枝鎖アミノ酸の添加により抑圧された.アミノ酸,とくにロイシンは細胞の増殖を促進するmTOR複合体1経路を活性化することが知られている3).そこで,mTOR複合体1の活性化の指標であるS6Kのリン酸化について調べたところ,BCAT1のノックダウンによりリン酸化型のS6Kが減少した.この減少は分枝鎖アミノ酸の添加により回復し,mTORC複合体1の阻害薬であるラパマイシンの添加によりふたたび消失した.以上の結果から,BCAT1による分枝鎖アミノ酸の産生の亢進はmTORC複合体1経路の活性化を介して白血病細胞の増殖に機能することが示唆された.
6.RNA結合タンパク質MSI2は急性転化期の慢性骨髄性白血病においてBCAT1の発現を促進する
BCAT1の発現の制御機構について明らかにするため,複数種の腫瘍について患者における遺伝子の発現データからBCAT1遺伝子と共発現する遺伝子を解析したところ,候補としてRNA結合タンパク質MSI2をコードする遺伝子が同定された.MSI2はがん細胞における幹細胞シグナルの活性化を介して慢性骨髄性白血病の維持に必要であることが報告されている4).BCAT1 mRNAの3’非翻訳領域には40コピーのMSI2結合コンセンサス配列が存在し,MSI2はそのRNA結合能に依存してBCAT1 mRNAと結合した.MSI2をノックダウンするとBCAT1が減少したことから,MSI2はBCAT1 mRNAと結合しその量を正に制御することが示唆された.さらに,急性転化期の慢性骨髄性白血病に由来するK562細胞のコロニー形成能はMSI2のノックダウンにより低下したが,これはBCAT1遺伝子の過剰発現あるいは分枝鎖アミノ酸の添加により抑圧されたことから,MSI2-BCAT1経路は分枝鎖アミノ酸の産生の亢進およびmTOR複合体1経路の活性化を介し,急性転化期の慢性骨髄性白血病において細胞の増殖を促進することがわかった.
おわりに
筆者らは,この研究において,分枝鎖アミノ酸アミノ基転移酵素BCAT1が慢性骨髄性白血病において分枝鎖アミノ酸を産生することにより病期の進行に関与することを見い出した(図2).一方で,筋肉組織やグリオーマにおいてBCAT1は分枝鎖アミノ酸の分解を促進することが知られていることから,代謝におけるBCAT1の機能は組織や細胞腫に特異的であることが示された5).この研究は,がんの悪性化に分枝鎖アミノ酸の代謝の変化が直接的に寄与することを明らかにしただけでなく,MSI2-BCAT1経路の活性化による代謝系のリプログラミングを介し白血病の病期の進展を遅延あるいは阻止する新たな治療戦略の開発につながる可能性をも示した.BCAT1の発現の上昇はグリオーマ,大腸がん,乳がんにおいても観察されること,それらのがんにおいてMSI2も高発現することがわかっている.このことから,MSI2-BCAT1経路を標的とした治療は,白血病のみならず広範ながんにおいて有効であることが期待される.
文 献
- Hanahan, D. & Weinberg, R. A.: Hallmarks of cancer: the next generation. Cell, 144, 646-674 (2011)[PubMed]
- Vander Heiden, M. G.: Targeting cancer metabolism: a therapeutic window opens. Nat. Rev. Drug. Discov., 10, 671-684 (2011)[PubMed]
- Efeyan, A., Comb, W. C. & Sabatini, D. M.: Nutrient-sensing mechanisms and pathways. Nature, 517, 302-310 (2015)[PubMed]
- Ito, T., Kwon, H. Y., Zimdahl, B. et al.: Regulation of myeloid leukaemia by the cell-fate determinant Musashi. Nature, 466, 765-768 (2010)[PubMed]
- Tonjes, M., Barbus, S., Park, Y. J. et al.: BCAT1 promotes cell proliferation through amino acid catabolism in gliomas carrying wild-type IDH1. Nat. Med., 19, 901-908 (2013)[PubMed]
著者プロフィール
略歴:米国Georgia大学Postdoctoral Research Associate.
研究テーマ:造血幹細胞およびがん幹細胞における細胞運命の決定の機構.
伊藤 貴浩(Takahiro Ito)
米国Georgia大学Assistant Professor.
研究室URL:http://www.bmb.uga.edu/labs/ito
© 2017 服部鮎奈・伊藤貴浩 Licensed under CC 表示 2.1 日本