ユビキチンリガーゼ活性を欠失したMDM2によるp53の活性の制御
野村浩司・Karen H. Vousden
(英国Cancer Research UK Beatson Institute)
email:野村浩司
DOI: 10.7875/first.author.2017.053
Structural analysis of MDM2 RING separates degradation from regulation of p53 transcription activity.
Koji Nomura, Marta Klejnot, Dominika Kowalczyk, Andreas K. Hock, Gary J. Sibbet, Karen H. Vousden, Danny T. Huang
Nature Structural & Molecular Biology, 24, 578-587 (2017)
MDM2はがん抑制タンパク質p53と結合してその転写活性化能を直接的に抑制することにくわえ,p53をユビキチン化してプロテアソームによる分解にみちびく.p53とMDM2との結合の阻害剤はp53を活性化してがんを抑制するが,臨床への応用においては正常な細胞におけるp53の活性化によりひき起こされる毒性が課題になる.筆者らは,新規に決定された結晶構造にもとづき,MDM2のもつRINGフィンガーモチーフの立体構造は変化させずに,ユビキチン結合酵素-ユビキチン複合体との結合のみが起こらないようにしたMDM2の変異体を設計した.このMDM2変異体はユビキチンリガーゼ活性を欠失するが,非ストレス下においてp53の転写活性化能を抑制するため細胞増殖は阻害しない.このMDM2変異体を発現させた細胞においてはp53が分解されずに安定して発現するため,野生型のMDM2を発現する細胞よりも迅速にストレスに対して細胞増殖を停止させることができる.MDM2のもつユビキチンリガーゼ活性のみを標的とすることにより,がん細胞において特異的にp53を活性化させる新規の治療薬の開発につながることが期待される.
がん抑制タンパク質p53は種々のストレスに応答して発現し,細胞増殖の停止およびストレスが持続する場合にはアポトーシスをひき起こす1).p53のもつこれらの活性は悪性腫瘍の進行をさまたげるのに有効であるが,非ストレス下においてその活性が制御されなければ不必要な細胞死などがひき起こされる.このp53の活性を制御するのに重要な役割を担うのがMDM2である.事実,マウスにおけるMDM2の欠損は制御不能になったp53の活性化に起因する早期の胚致死をもたらす2,3).
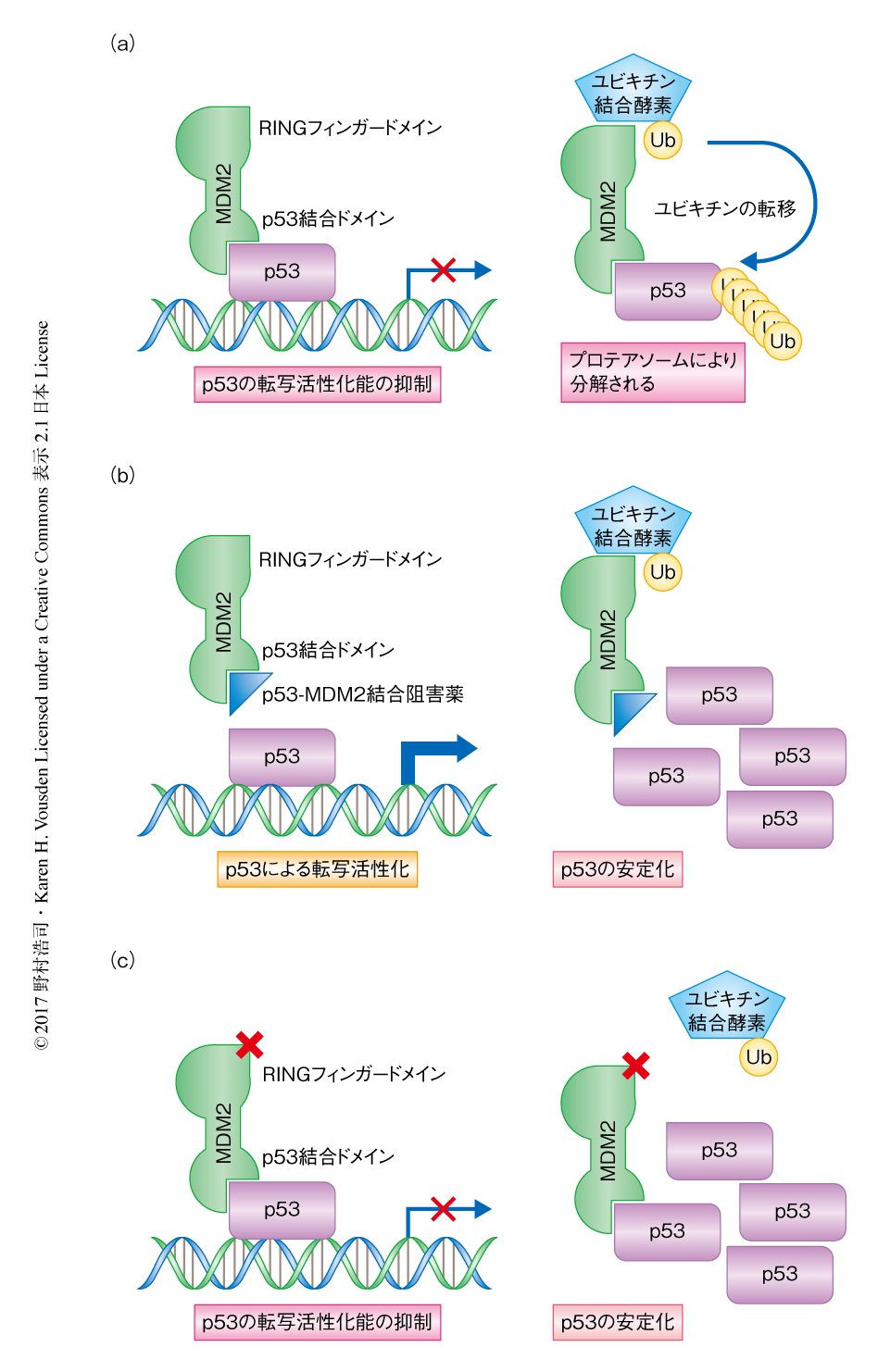
MDM2はN末端側のp53結合ドメインとC末端側のRINGフィンガードメインから構成される.正常なストレスをうけていない細胞においてMDM2はおもに核に局在し,p53結合ドメインを介してp53と結合することによりその転写活性化能を直接的に抑制する4)(図1a).さらに,p53と結合したMDM2はRINGフィンガードメインを介してユビキチン結合酵素-ユビキチン複合体と結合し,結合したp53をユビキチン化してプロテアソームによる分解の標的とする5)(図1a).これにより,MDM2は細胞におけるp53の量の制御にも関与する.
DNAの損傷などのストレス下においては,MDM2の不活性化を介してp53の安定化および転写活性化能の亢進が起こり,細胞増殖の停止およびアポトーシスがひき起こされる1).p53遺伝子に変異をもたないがん細胞の場合,MDM2の阻害薬の投与によりMDM2を不活性化することでp53の活性化が促進され抗がん作用が発揮されると考えられる.すでにMDM2のp53結合ドメインを標的とするいくつかの薬剤が開発されており,p53の安定化および転写活性化能の亢進における標的への特異性にすぐれることが確認されている6)(図1b).しかし,これらの薬剤は正常な細胞においてもp53の転写活性化能を亢進してしまうため(図1b),それにともなう副作用,たとえば,血小板や好中球の減少症によりその有効性および有用性は制限される6).筆者らは,この問題を解決するため,RINGフィンガードメインにおけるユビキチン結合酵素-ユビキチン複合体との結合を阻害することを考えた.これにより,p53はユビキチン化されなくなるため分解されないが,非ストレス下におけるMDM2によるp53の転写活性化能の抑制には影響しないため,正常な細胞における毒性は低減される(図1c).ストレスに対してはp53のリン酸化などによりp53とMDM2との結合が解離するため7),すでに細胞に蓄積したp53により即座に細胞増殖の停止やアポトーシスがひき起こされる.
すでにMDM2のRINGフィンガードメインを標的とした多く研究がなされているが,十分な成果は得られていない.その理由として,RINGフィンガードメインはユビキチン結合酵素-ユビキチン複合体との結合のほかにも,二量化やほかのタンパク質との結合に重要な役割をはたすことが知られており8),とくに,MDM2は二量体を形成してはたらくことから9),RINGフィンガーモチーフの立体構造の異常が二量体の形成を阻害して本来のp53の抑制の機能を発揮できない可能性がある.事実,RINGフィンガーモチーフの構造に異常をもつMDM2の変異体を発現するマウスはp53の活性を抑制することができず,MDM2の欠損と同様に,早期の胚致死がもたらされた10).
筆者らは,MDM2の新規の結晶構造にもとづき,RINGフィンガーモチーフの立体構造を変化させずにユビキチン結合酵素-ユビキチン複合体との結合のみをさまたげるMDM2の変異体を設計した.
MDM2の新規の結晶構造(PDB ID:5MNJ)にもとづき,MDM2とユビキチン結合酵素-ユビキチン複合体との結合に重要な部位を推定した.MDM2のRINGフィンガーモチーフに存在するIle440はユビキチン結合酵素-ユビキチン複合体との疎水結合に重要であり,Arg479はユビキチン結合酵素-ユビキチン複合体との親水性の結合に重要であると推定された.そして,Ile440あるいはArg479を置換することにより,MDM2はユビキチン結合酵素-ユビキチン複合体と結合しなくなることが表面プラズモン共鳴法により確認された.また,これらのMDM2変異体を細胞に発現させるとp53のユビキチン化が起こらなくなり,その結果として,p53は分解されず安定して発現した.さらに,生化学的な手法による試験や細胞を用いた試験により,これらのMDM2変異体はp53との結合や二量体の形成などには影響がなく,ユビキチンリガーゼ活性のみが欠失した変異体であることが確かめられた.
内因性のp53をドキシサイクリンの添加に依存してノックダウンすることが可能で,かつ,内因性のMDM2をノックアウトした細胞を作製し,そこにMDM2変異体を発現させる系を構築した.p53を条件的にノックダウンできるようにした理由は,MDM2変異体を導入したときにp53に起因する細胞増殖の抑制やアポトーシスの起こる可能性があるので,それをふせぐためである.この系を用いて,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させたときの内因性のp53のもつ転写活性化能について調べた.非ストレス下においてこれらのMDM2変異体を発現させた細胞は,RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体とは異なり,MDM2を欠損した細胞と比較して,p53を分解しないにもかかわらずp21遺伝子などp53の標的となる遺伝子の発現をmRNAレベルおよびタンパク質レベルで有意に抑制した.この抑制能は野生型のMDM2とほぼ同じであった.
MDM2によるp53の転写活性化能の抑制を説明する機序のひとつとして,MDM2がp53の標的となる遺伝子のプロモーターにおいてp53と結合しその転写活性化能を低下させるということがある5).MDM2変異体がクロマチンにおいてp53と直接に結合するかどうかを明らかにするためクロマチン-免疫沈降法により解析した.その結果,p21遺伝子のプロモーターにおいてp53と結合したMDM2の割合は,RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体の場合,野生型のMDM2と比較して有意に低かった.このことから,この変異体はp53の転写活性化能を抑制できないことが説明された.対照的に,ユビキチンリガーゼ活性のみを欠失したMDM2変異体の場合は野生型のMDM2と同じ程度の割合であった.このことから,この変異体が非ストレス下においてp53の転写活性化能を抑制することが示唆された.
非ストレス下においてMDM2の変異体の発現が細胞増殖におよぼす影響について調べた.その結果,MDM2を欠損した細胞は,野生型のMDM2を発現させた細胞と比較して,p53の恒常的な活性化が起こったことにより細胞増殖が有意に抑制された.RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体を発現させた細胞の場合も,野生型のMDM2を発現させた細胞と比較して有意に細胞増殖が抑制された.一方,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は,野生型のMDM2を発現させた細胞と同じ程度の細胞増殖を示した.このことから,非ストレス下においてこの変異体を発現する細胞は,p53の量が多いにもかかわらず細胞増殖に影響のないことが示唆された.
DNAの損傷などのストレスに対して,p53はN末端のリン酸化などを介してMDM2と解離する7).これにより,細胞におけるp53の量の増加およびp53の活性化が起こり,細胞増殖の停止やアポトーシスがひき起こされる.この応答が迅速に起こらないと,DNAの損傷などをもつ細胞の増殖,つまり,悪性腫瘍の形成がみちびかれる.ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は,DNAの損傷などのストレスに対しどのように応答するのだろうか.この変異体を発現させた細胞においてはp53が分解されないため,野生型のMDM2を発現させた細胞と比べp53の量が有意に多いことから,p53とMDM2とを解離させるようなストレスに対し即座にp53の活性化が起こり迅速に細胞増殖を停止するのではないかと仮説をたてた.この仮説を検証するため,DNAの損傷をひき起こす薬剤やp53とMDM2とを物理的に解離させる薬剤を用いてその影響について調べた.その結果,野生型のMDM2を発現させた細胞は薬剤の処理ののちにp53の標的となる遺伝子の発現まである程度の時間を要した.これは,p53の応答にはタンパク質レベルでのp53の蓄積が必要であるため,この過程に時間がかかったことが考えられた.これとは対照的に,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は薬剤の処理ののちp53の標的となる遺伝子の発現が即座に起こり,迅速に細胞増殖は停止した.これは,すでにp53は十分に存在しその蓄積の過程を必要としないためと考えられた.
野生型のMDM2はp53と直接に結合することによりその転写活性化能を抑制し,また,p53をユビキチン化することによりその分解に関与する.しかし,DNAの損傷などのストレス下において細胞増殖の停止やアポトーシスをひき起こすには,p53の量の増加,p53の標的となる遺伝子の発現といったステップが必要となる(図2).一方,ユビキチン活性のみを欠失したMDM2変異体を発現した細胞は,p53が分解されないためその量はすでに十分にあり,ストレスに対し細胞増殖の停止などを迅速にひき起こす(図2).非ストレス下においてはp53の転写活性化能を制御するため,p53とMDM2との結合の阻害した場合とは異なり,正常な細胞における毒性は大幅に軽減することが期待される.
さらに,この研究の戦略は,ほかのRINGフィンガー型ユビキチンリガーゼにおいても,ユビキチンリガーゼに依存的あるいは非依存的な機能を理解するための応用が可能であると思われる.
略歴:英国Cancer Research UK Beatson Institute博士課程 在学中.
研究テーマ:MDM2によるp53の制御.
関心事:世界の地ビールの飲み比べ.
Karen H. Vousden
英国Cancer Research UKにてChief Scientist.
© 2017 野村浩司・Karen H. Vousden Licensed under CC 表示 2.1 日本
(英国Cancer Research UK Beatson Institute)
email:野村浩司
DOI: 10.7875/first.author.2017.053
Structural analysis of MDM2 RING separates degradation from regulation of p53 transcription activity.
Koji Nomura, Marta Klejnot, Dominika Kowalczyk, Andreas K. Hock, Gary J. Sibbet, Karen H. Vousden, Danny T. Huang
Nature Structural & Molecular Biology, 24, 578-587 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
ユビキチンリガーゼ, MDM2(Q00987), p53(P04637), ユビキチン, プロテアソーム, ユビキチン結合酵素, p21(Q9H633), E3ユビキチンリガーゼ, RINGフィンガー型ユビキチンリガーゼ
要 約
MDM2はがん抑制タンパク質p53と結合してその転写活性化能を直接的に抑制することにくわえ,p53をユビキチン化してプロテアソームによる分解にみちびく.p53とMDM2との結合の阻害剤はp53を活性化してがんを抑制するが,臨床への応用においては正常な細胞におけるp53の活性化によりひき起こされる毒性が課題になる.筆者らは,新規に決定された結晶構造にもとづき,MDM2のもつRINGフィンガーモチーフの立体構造は変化させずに,ユビキチン結合酵素-ユビキチン複合体との結合のみが起こらないようにしたMDM2の変異体を設計した.このMDM2変異体はユビキチンリガーゼ活性を欠失するが,非ストレス下においてp53の転写活性化能を抑制するため細胞増殖は阻害しない.このMDM2変異体を発現させた細胞においてはp53が分解されずに安定して発現するため,野生型のMDM2を発現する細胞よりも迅速にストレスに対して細胞増殖を停止させることができる.MDM2のもつユビキチンリガーゼ活性のみを標的とすることにより,がん細胞において特異的にp53を活性化させる新規の治療薬の開発につながることが期待される.
はじめに
がん抑制タンパク質p53は種々のストレスに応答して発現し,細胞増殖の停止およびストレスが持続する場合にはアポトーシスをひき起こす1).p53のもつこれらの活性は悪性腫瘍の進行をさまたげるのに有効であるが,非ストレス下においてその活性が制御されなければ不必要な細胞死などがひき起こされる.このp53の活性を制御するのに重要な役割を担うのがMDM2である.事実,マウスにおけるMDM2の欠損は制御不能になったp53の活性化に起因する早期の胚致死をもたらす2,3).
MDM2はN末端側のp53結合ドメインとC末端側のRINGフィンガードメインから構成される.正常なストレスをうけていない細胞においてMDM2はおもに核に局在し,p53結合ドメインを介してp53と結合することによりその転写活性化能を直接的に抑制する4)(図1a).さらに,p53と結合したMDM2はRINGフィンガードメインを介してユビキチン結合酵素-ユビキチン複合体と結合し,結合したp53をユビキチン化してプロテアソームによる分解の標的とする5)(図1a).これにより,MDM2は細胞におけるp53の量の制御にも関与する.
DNAの損傷などのストレス下においては,MDM2の不活性化を介してp53の安定化および転写活性化能の亢進が起こり,細胞増殖の停止およびアポトーシスがひき起こされる1).p53遺伝子に変異をもたないがん細胞の場合,MDM2の阻害薬の投与によりMDM2を不活性化することでp53の活性化が促進され抗がん作用が発揮されると考えられる.すでにMDM2のp53結合ドメインを標的とするいくつかの薬剤が開発されており,p53の安定化および転写活性化能の亢進における標的への特異性にすぐれることが確認されている6)(図1b).しかし,これらの薬剤は正常な細胞においてもp53の転写活性化能を亢進してしまうため(図1b),それにともなう副作用,たとえば,血小板や好中球の減少症によりその有効性および有用性は制限される6).筆者らは,この問題を解決するため,RINGフィンガードメインにおけるユビキチン結合酵素-ユビキチン複合体との結合を阻害することを考えた.これにより,p53はユビキチン化されなくなるため分解されないが,非ストレス下におけるMDM2によるp53の転写活性化能の抑制には影響しないため,正常な細胞における毒性は低減される(図1c).ストレスに対してはp53のリン酸化などによりp53とMDM2との結合が解離するため7),すでに細胞に蓄積したp53により即座に細胞増殖の停止やアポトーシスがひき起こされる.
すでにMDM2のRINGフィンガードメインを標的とした多く研究がなされているが,十分な成果は得られていない.その理由として,RINGフィンガードメインはユビキチン結合酵素-ユビキチン複合体との結合のほかにも,二量化やほかのタンパク質との結合に重要な役割をはたすことが知られており8),とくに,MDM2は二量体を形成してはたらくことから9),RINGフィンガーモチーフの立体構造の異常が二量体の形成を阻害して本来のp53の抑制の機能を発揮できない可能性がある.事実,RINGフィンガーモチーフの構造に異常をもつMDM2の変異体を発現するマウスはp53の活性を抑制することができず,MDM2の欠損と同様に,早期の胚致死がもたらされた10).
筆者らは,MDM2の新規の結晶構造にもとづき,RINGフィンガーモチーフの立体構造を変化させずにユビキチン結合酵素-ユビキチン複合体との結合のみをさまたげるMDM2の変異体を設計した.
1.ユビキチンリガーゼ活性のみを欠失したMDM2変異体はp53をユビキチン化しない
MDM2の新規の結晶構造(PDB ID:5MNJ)にもとづき,MDM2とユビキチン結合酵素-ユビキチン複合体との結合に重要な部位を推定した.MDM2のRINGフィンガーモチーフに存在するIle440はユビキチン結合酵素-ユビキチン複合体との疎水結合に重要であり,Arg479はユビキチン結合酵素-ユビキチン複合体との親水性の結合に重要であると推定された.そして,Ile440あるいはArg479を置換することにより,MDM2はユビキチン結合酵素-ユビキチン複合体と結合しなくなることが表面プラズモン共鳴法により確認された.また,これらのMDM2変異体を細胞に発現させるとp53のユビキチン化が起こらなくなり,その結果として,p53は分解されず安定して発現した.さらに,生化学的な手法による試験や細胞を用いた試験により,これらのMDM2変異体はp53との結合や二量体の形成などには影響がなく,ユビキチンリガーゼ活性のみが欠失した変異体であることが確かめられた.
2.ユビキチンリガーゼ活性のみを欠失したMDM2変異体はp53の転写活性化能を抑制する
内因性のp53をドキシサイクリンの添加に依存してノックダウンすることが可能で,かつ,内因性のMDM2をノックアウトした細胞を作製し,そこにMDM2変異体を発現させる系を構築した.p53を条件的にノックダウンできるようにした理由は,MDM2変異体を導入したときにp53に起因する細胞増殖の抑制やアポトーシスの起こる可能性があるので,それをふせぐためである.この系を用いて,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させたときの内因性のp53のもつ転写活性化能について調べた.非ストレス下においてこれらのMDM2変異体を発現させた細胞は,RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体とは異なり,MDM2を欠損した細胞と比較して,p53を分解しないにもかかわらずp21遺伝子などp53の標的となる遺伝子の発現をmRNAレベルおよびタンパク質レベルで有意に抑制した.この抑制能は野生型のMDM2とほぼ同じであった.
3.ユビキチンリガーゼ活性のみを欠失したMDM2変異体はp21遺伝子のプロモーターに局在する
MDM2によるp53の転写活性化能の抑制を説明する機序のひとつとして,MDM2がp53の標的となる遺伝子のプロモーターにおいてp53と結合しその転写活性化能を低下させるということがある5).MDM2変異体がクロマチンにおいてp53と直接に結合するかどうかを明らかにするためクロマチン-免疫沈降法により解析した.その結果,p21遺伝子のプロモーターにおいてp53と結合したMDM2の割合は,RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体の場合,野生型のMDM2と比較して有意に低かった.このことから,この変異体はp53の転写活性化能を抑制できないことが説明された.対照的に,ユビキチンリガーゼ活性のみを欠失したMDM2変異体の場合は野生型のMDM2と同じ程度の割合であった.このことから,この変異体が非ストレス下においてp53の転写活性化能を抑制することが示唆された.
4.ユビキチンリガーゼ活性のみを欠失したMDM2変異体の発現は非ストレス下において細胞増殖に影響をおよぼさない
非ストレス下においてMDM2の変異体の発現が細胞増殖におよぼす影響について調べた.その結果,MDM2を欠損した細胞は,野生型のMDM2を発現させた細胞と比較して,p53の恒常的な活性化が起こったことにより細胞増殖が有意に抑制された.RINGフィンガーモチーフの立体構造に異常をもつMDM2変異体を発現させた細胞の場合も,野生型のMDM2を発現させた細胞と比較して有意に細胞増殖が抑制された.一方,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は,野生型のMDM2を発現させた細胞と同じ程度の細胞増殖を示した.このことから,非ストレス下においてこの変異体を発現する細胞は,p53の量が多いにもかかわらず細胞増殖に影響のないことが示唆された.
5.E3ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現した細胞はストレスに対し迅速に応答する
DNAの損傷などのストレスに対して,p53はN末端のリン酸化などを介してMDM2と解離する7).これにより,細胞におけるp53の量の増加およびp53の活性化が起こり,細胞増殖の停止やアポトーシスがひき起こされる.この応答が迅速に起こらないと,DNAの損傷などをもつ細胞の増殖,つまり,悪性腫瘍の形成がみちびかれる.ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は,DNAの損傷などのストレスに対しどのように応答するのだろうか.この変異体を発現させた細胞においてはp53が分解されないため,野生型のMDM2を発現させた細胞と比べp53の量が有意に多いことから,p53とMDM2とを解離させるようなストレスに対し即座にp53の活性化が起こり迅速に細胞増殖を停止するのではないかと仮説をたてた.この仮説を検証するため,DNAの損傷をひき起こす薬剤やp53とMDM2とを物理的に解離させる薬剤を用いてその影響について調べた.その結果,野生型のMDM2を発現させた細胞は薬剤の処理ののちにp53の標的となる遺伝子の発現まである程度の時間を要した.これは,p53の応答にはタンパク質レベルでのp53の蓄積が必要であるため,この過程に時間がかかったことが考えられた.これとは対照的に,ユビキチンリガーゼ活性のみを欠失したMDM2変異体を発現させた細胞は薬剤の処理ののちp53の標的となる遺伝子の発現が即座に起こり,迅速に細胞増殖は停止した.これは,すでにp53は十分に存在しその蓄積の過程を必要としないためと考えられた.
おわりに
野生型のMDM2はp53と直接に結合することによりその転写活性化能を抑制し,また,p53をユビキチン化することによりその分解に関与する.しかし,DNAの損傷などのストレス下において細胞増殖の停止やアポトーシスをひき起こすには,p53の量の増加,p53の標的となる遺伝子の発現といったステップが必要となる(図2).一方,ユビキチン活性のみを欠失したMDM2変異体を発現した細胞は,p53が分解されないためその量はすでに十分にあり,ストレスに対し細胞増殖の停止などを迅速にひき起こす(図2).非ストレス下においてはp53の転写活性化能を制御するため,p53とMDM2との結合の阻害した場合とは異なり,正常な細胞における毒性は大幅に軽減することが期待される.
さらに,この研究の戦略は,ほかのRINGフィンガー型ユビキチンリガーゼにおいても,ユビキチンリガーゼに依存的あるいは非依存的な機能を理解するための応用が可能であると思われる.
文 献
- Lakin, N. D. & Jackson, S. P.: Regulation of p53 in response to DNA damage. Oncogene, 18, 7644-7655 (1999)[PubMed]
- Montes de Oca Luna, R., Wagner, D. S. & Lozano, G.: Rescue of early embryonic lethality in mdm2-deficient mice by deletion of p53. Nature, 378, 203-206 (1995)[PubMed]
- Jones, S. N., Roe, A. E., Donehower, L. A. et al.: Rescue of embryonic lethality in Mdm2-deficient mice by absence of p53. Nature, 378, 206-208 (1995)[PubMed]
- Oliner, J. D., Pietenpol, J. A., Thiagalingam, S. et al.: Oncoprotein MDM2 conceals the activation domain of tumour suppressor p53. Nature, 362, 857-860 (1993)[PubMed]
- Shi, D. & Gu, W.: Dual roles of MDM2 in the regulation of p53: ubiquitination dependent and ubiquitination independent mechanisms of MDM2 repression of p53 activity. Genes Cancer, 3, 240-248 (2012)[PubMed]
- Khoo, K. H., Verma, C. S. & Lane, D. P.: Drugging the p53 pathway: understanding the route to clinical efficacy. Nat. Rev. Drug. Discov., 13, 217-236 (2014)[PubMed]
- Meek, D. W.: Regulation of the p53 response and its relationship to cancer. Biochem. J., 469, 325-346 (2015)[PubMed]
- Deshaies, R. J. & Joazeiro, C. A.: RING domain E3 ubiquitin ligases. Annu. Rev. Biochem., 78, 399-434 (2009)[PubMed]
- Linke, K., Mace, P. D., Smith, C. A. et al.: Structure of the MDM2/MDMX RING domain heterodimer reveals dimerization is required for their ubiquitylation in trans. Cell Death Differ., 15, 841-848 (2008)[PubMed]
- Itahana, K., Mao, H., Jin, A. W. et al.: Targeted inactivation of Mdm2 RING finger E3 ubiquitin ligase activity in the mouse reveals mechanistic insights into p53 regulation. Cancer Cell, 12, 355-366 (2007)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:英国Cancer Research UK Beatson Institute博士課程 在学中.
研究テーマ:MDM2によるp53の制御.
関心事:世界の地ビールの飲み比べ.
Karen H. Vousden
英国Cancer Research UKにてChief Scientist.
© 2017 野村浩司・Karen H. Vousden Licensed under CC 表示 2.1 日本