Eタンパク質-Idタンパク質の制御軸がT細胞のアイデンティティを規定し胸腺における自然リンパ球の分化を抑制する
宮崎正輝1・宮崎和子1・河本 宏1・Cornelis Murre 2
(1京都大学ウイルス・再生医科学研究所 再生免疫学分野,2米国California大学San Diego校Department of Molecular Biology)
email:宮崎正輝
DOI: 10.7875/first.author.2017.047
The E-Id protein axis specifies adaptive lymphoid cell identity and suppresses thymic innate lymphoid cell development.
Masaki Miyazaki, Kazuko Miyazaki, Kenian Chen, Yi Jin, Jacob Turner, Amanda J. Moore, Rintaro Saito, Kenichi Yoshida, Seishi Ogawa, Hans-Reimer Rodewald, Yin C. Lin, Hiroshi Kawamoto, Cornelis Murre
Immunity, 46, 818-834.e4 (2017)
獲得免疫はB細胞とT細胞による抗原に特異的な反応により惹起される.Eタンパク質のひとつE2AはB細胞の分化において必須の機能をもつが,T細胞の分化における機能については明らかではなかった.また,Eタンパク質の拮抗タンパク質であるIdタンパク質のひとつId2は自然リンパ球や樹状細胞の分化に必須であるが,これらの分化とEタンパク質の機能との関連についてはまったく解明されていなかった.今回の研究において,Eタンパク質のうちE2AおよびHEBが協調的にはたらくことにより胸腺におけるT細胞への分化が決定すること,同時に,胸腺における自然リンパ球の異所性の分化が抑制されることが見い出された.また,ノックアウトマウスの解析により,自然リンパ球への分化はE2AおよびHEBの活性の低下により起こり,Id2の機能がなくても起こることが証明された.その分子機構として,Eタンパク質はT細胞への分化の決定に必須であるタンパク質をコードする遺伝子の発現を直接に制御すること,さらに,これらの遺伝子の発現を制御するエンハンサーに対するアクセシビリティの維持に必要であることが示された.以上の結果から,リンパ球系の前駆細胞において獲得免疫系のリンパ球へと分化するのか,それとも,自然免疫系のリンパ球へと分化するかという運命決定は,Eタンパク質-Idタンパク質の制御軸により規定されることが示唆された.
免疫応答は獲得免疫と自然免疫との協調によりなりたつ.T細胞は獲得免疫において中心的な役割を担うリンパ球であり,感染防御,アレルギー炎症,がん免疫などにおいて重要であることが知られている.最近,自然免疫系における新たなリンパ球として自然リンパ球が同定された.自然リンパ球はアレルギー疾患,炎症性腸疾患,糖尿病などの代謝性の疾患に関連すると考えられ,おもに炎症性サイトカインを分泌することにより免疫応答を増強する.自然リンパ球は分泌するサイトカインにより大きく3つに分類される.転写因子T-betを発現しインターフェロンγを分泌する1型自然リンパ球,転写因子Gata3に依存しインターロイキン4,インターロイキン5,インターロイキン13を分泌する2型自然リンパ球,転写因子Rorγtを発現しインターロイキン17およびインターロイキン22を分泌する3型自然リンパ球である1).T細胞と自然リンパ球は分泌するサイトカインや鍵となる転写因子などを共有しており,機能的にも類似性が高い.また,ともに共通リンパ球前駆細胞から分化する.とくに,Tcf1,Bcl11b,Gata3,Nfil3,Tox,Id2といったT細胞の分化において重要な機能をもつ転写因子は,自然リンパ球の分化の過程においても高く発現し重要な機能をはたす.T細胞と自然リンパ球との最大の違いは,T細胞が抗原に特異的な受容体により活性化されるのに対し,自然リンパ球はサイトカインの刺激により活性化されることである.いい換えると,遺伝子の再構成による受容体の形成こそがT細胞と自然リンパ球との違いを決定する.これまで,T細胞と自然リンパ球の分化の分岐点についてはまったく研究されていなかった.それは,正常な状態においては胸腺に自然リンパ球が存在しないためであろう.
哺乳類のEタンパク質は,E2A遺伝子にコードされるE47およびE12,HEB,E2-2の4つからなる.E2AはEBF1やFoxo1とともにB細胞への分化の決定に必須であるが2),T細胞への分化の決定における機能は不明であった.それは,E2Aノックアウトマウスにおいては胸腺におけるT細胞の分化は維持されたためである.一方,Idタンパク質としてはId1~Id4があり,Id2およびId3は胸腺におけるT細胞の選択,活性化,メモリーT細胞の維持,濾胞性ヘルパーT細胞の分化,制御性T細胞による炎症の抑制に重要であることが,筆者らも含む多くの研究グループにより報告されている3-5).Id2は自然リンパ球の分化およびその機能に重要であることが広く知られているが,Id2がいったい何を制御するのかはまったく不明であった.
今回,筆者らは,Eタンパク質のうちE2AとHEBが協調的に機能し,生体におけるT細胞の分化に決定的に必要であること,また,胸腺における自然リンパ球の分化を抑制することを見い出した.
自然リンパ球の分化におけるE2AおよびId2による転写制御の詳細について,E2AのレポーターマウスおよびId2のレポーターマウスを解析した.その結果,自然リンパ球の前駆細胞は,E2A高発現かつId2低発現,および,E2A低発現かつId2高発現,という2つの細胞の集団に分けられた.このことは,E2Aの活性が低下してからId2の発現が上昇することを意味し,従来のId2がE2Aの活性を抑制することにより自然リンパ球の分化を決定するという考えとは異なる結果であった.さらに,転写因子PLZFは自然リンパ球の前駆細胞において一過性に発現することが報告されていたことから6),Id2とPLZFのダブルリポーターマウスを作製しId2とPLZFの発現の順序についても検討した.その結果,PLZFの発現はId2の発現よりも先行し,そののち,PLZFの発現が低下してもId2は高発現を維持した.これらの結果から,自然リンパ球への分化の過程におけるE2A,Id2,PLZFの発現の順序が明らかにされ,E2Aの発現とId2の発現の逆相関が示された.
T細胞への分化の決定におけるEタンパク質の機能について検討するため,E2AとHEBのダブルコンディショナルノックアウトを作製した.E2AおよびHEBを後天的に欠損,あるいは,リンパ球の系列に分化してから欠損させた結果,いずれも,胸腺においてもっとも初期のT前駆細胞の段階で分化は障害された.また,αβT細胞だけでなくγδT細胞も顕著に減少し,T細胞の系列全体に重度な障害が認められた.くわえて,胎仔の胸腺から採取したT前駆細胞を用いたin vitroにおける分化の誘導においても,E2AとHEBのダブルノックアウトマウスのT前駆細胞には顕著な障害が認められた.以上の結果から,T細胞の分化の決定においてE2AおよびHEBは必須であり相補的に機能することが示された.
胸腺に存在するT前駆細胞においてE2AおよびHEBを欠損させた結果,野生型のマウスの胸腺において自然リンパ球はほとんど認められなかったが,E2AとHEBのダブルノックアウトマウスの胸腺においては2型自然リンパ球およびリンパ組織誘導細胞様細胞が顕著に増加していた.また,自然リンパ球の前駆細胞であるPLZF発現前駆細胞も胸腺において顕著に増加していた.これら異所性に分化した2型自然リンパ球は転写因子Gata3を発現し,刺激によりインターロイキン4,インターロイキン5,インターロイキン13を発現したことから,機能的にも2型自然リンパ球と考えられた.この2型自然リンパ球は胸腺にて増殖していたことから,ほかの臓器において増殖したものが胸腺に2次的に移入した可能性は低いと考えられた.E2AおよびHEBの欠損によりT細胞およびB細胞が顕著に減少したことから,リンパ球の減少した環境により2型自然リンパ球が2次的に増加した可能性も否定できなかった.そこで,E2AとHEBのダブルノックアウトマウスをRag2ノックアウトマウスと交配したところ自然リンパ球の異所性の分化に大きな影響はなく,また,Rag2ノックアウトマウスの胸腺において自然リンパ球の異所性の分化は認められなかった.これらのことから,リンパ球の減少した環境により自然リンパ球が2次的に増加したのではないことが証明された.
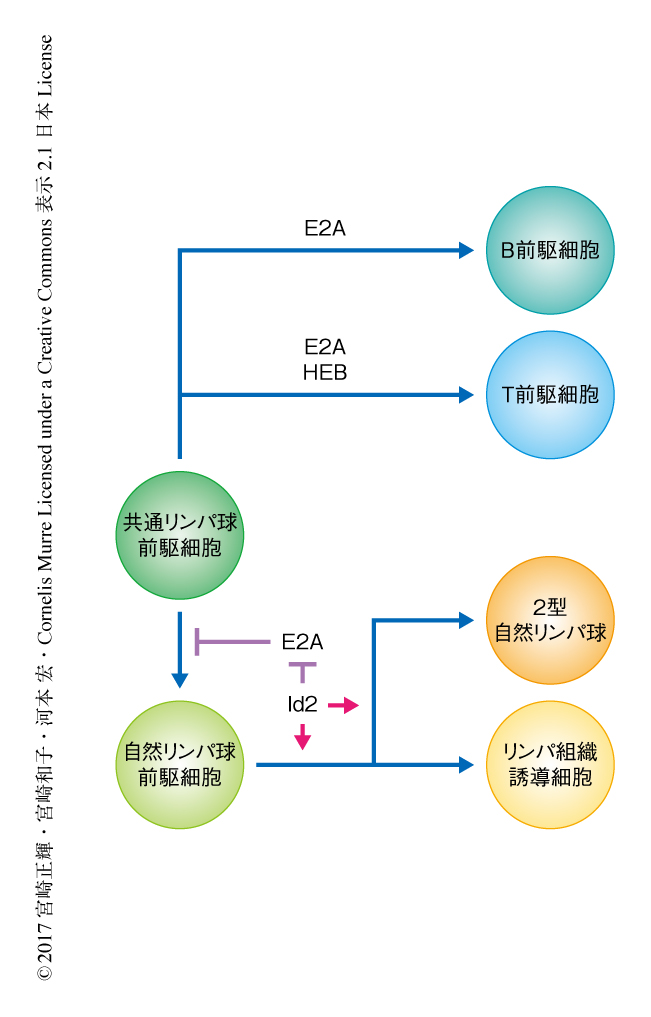
ドキシサイクリンの添加によりId2を高発現するマウスを作製した.その結果,Id2の短期間の強制発現は,E2AとHEBのダブルノックアウトマウスと同様に,生体におけるT細胞およびB細胞の初期の分化に強い障害をひき起こし,さらに,胸腺における2型自然リンパ球の異所性の分化も起こした.このことから,Id2によるE2AおよびHEBのDNAに対する結合能の低下がT細胞の分化を抑制し自然リンパ球の分化を誘導することが強く示唆された.つまり,E2AおよびHEBの活性がT細胞と自然リンパ球の分岐を規定すると考えられた.このことを明確に証明するため,E2A,HEB,Id2のトリプルコンディショナルノックアウトマウスを作製したところ,E2AとHEBのダブルノックアウトマウスと同様に,自然リンパ球の異所性の分化が認められた.このことから,Id2が自然リンパ球の分化に必須なのではなく,E2AおよびHEBの活性の低下が自然リンパ球への分化をひき起こすことが明確に示された(図1).
E2AおよびHEBの欠損による自然リンパ球の異所性の分化の分子機構について解明するためトランスクリプトームを解析した.外部の環境の影響を排除するため,胎仔の胸腺から初期のT前駆細胞を採取し,RNA-seq法により解析した.その結果,およそ1800の遺伝子の発現の変化が認められ,とくに,T細胞に必須のタンパク質であるRag1,Rag2,Notch1,Notch3,Ptcra,CD3e,CD3dなどをコードする遺伝子の発現が顕著に低下していた.一方,Tcf7,Bcl11b,Gata3などをコードする遺伝子の発現の低下は認められなかった.さらに,Metascape解析により,発現の上昇した遺伝子は炎症反応,サイトカイン,活性化などエフェクター細胞様の機能に関与することが示された.PLZF,Tox,Gata3など,自然リンパ球の分化に関与するタンパク質をコードする遺伝子の発現が上昇していた一方,成熟した自然リンパ球のマーカーとなる遺伝子の発現は認められなかった.以上の結果から,E2AおよびHEBの欠損により,T前駆細胞から自然リンパ球への系列へと変化することが考えられた.
最近の報告から,細胞の分化あるいは活性化において遺伝子の発現にさきだちエンハンサーのレパトアが確立しており,こうした遺伝子制御領域のレパトアの形成が分化に必須であることがわかっている.そのため,ATAC-seq(assay for transposase-accessible chromatin sequencing)法を用いてレギュロームを解析した7).さらに,野生型のマウスとE2AとHEBのダブルノックアウトマウスのT前駆細胞のレギュロームを,血液幹細胞から成熟したリンパ球までのレギュロームと比較した.開いた構造をとるクロマチン領域をプロモーターとエンハンサーとに分けたうえで階層的にクラスタリングしたところ,プロモーターにおいては野生型のマウスのT前駆細胞とE2AとHEBのダブルノックアウトマウスのT前駆細胞は同じくクラスタリングされた一方,エンハンサーにおいては野生型のマウスのT前駆細胞は共通リンパ球前駆細胞や血液幹細胞などの近くにクラスタリングされたが,E2AとHEBのダブルノックアウトマウスのT前駆細胞は未熟な2型自然リンパ球ともっとも近くクラスタリングされた.くわえて,開いた構造をとるクロマチン領域において転写因子の結合モチーフの頻度を解析したところ,やはり,E2AとHEBのダブルノックアウトマウスのT前駆細胞は未熟な2型自然リンパ球の近くにクラスタリングされた.E2AおよびHEBの欠損が実際に標的となる遺伝子座にどのような影響を及ぼすのか検討したところ,Notch1遺伝子座,Rag1遺伝子座,Rag2遺伝子座において,プロモーターにはあまり影響がなかったにもかかわらず,E2Aと結合するエンハンサーに対するアクセシビリティが顕著に障害されていた.このことは,E2AおよびHEBがT細胞への分化に必須のタンパク質をコードする遺伝子のエンハンサーの機能を維持することによりその発現を制御することを示した結果であった.
今回の論文は,2011年にNature Immunologyに発表した論文3)(新着論文レビュー でも掲載)の内容を発展させたものである.数年前からE2AおよびHEBがT細胞への分化に必須であることはわかっていたが,自然リンパ球の分化と関連するとは想定していなかった.自然リンパ球に関する多くの論文からT細胞と自然リンパ球との類似性に気づき,T細胞と自然リンパ球の分化には分岐点が存在するのではないかと疑問をもち研究をはじめた.つまり,数年間にわたりずっとその答を探してきたのである.この研究から,リンパ球の分化と系統発生に関してさらに多くの謎が感じられる.もし,こうした疑問の答にほんの少しでも近づけたらうれしく思う.
略歴:2005年 広島大学大学院医歯薬学総合研究科博士課程 修了,同年 同 助教,2009年 米国California大学San Diego校 研究員,2010年 同Assistant Project Scientist,2015年 京都大学再生医科学研究所 助教を経て,2016年より京都大学ウイルス・再生医科学研究所 准教授.
研究テーマ:T細胞の分化および活性化における転写の制御機構.
抱負:人生は短いので,Scienceを楽しむことを一番に!
宮崎 和子(Kazuko Miyazaki)
京都大学ウイルス・再生医科学研究所 特定研究員.
河本 宏(Hiroshi Kawamoto)
京都大学ウイルス・再生医科学研究所 教授.
Cornelis Murre
米国California大学San Diego校 特別教授.
© 2017 宮崎正輝・宮崎和子・河本 宏・Cornelis Murre Licensed under CC 表示 2.1 日本
(1京都大学ウイルス・再生医科学研究所 再生免疫学分野,2米国California大学San Diego校Department of Molecular Biology)
email:宮崎正輝
DOI: 10.7875/first.author.2017.047
The E-Id protein axis specifies adaptive lymphoid cell identity and suppresses thymic innate lymphoid cell development.
Masaki Miyazaki, Kazuko Miyazaki, Kenian Chen, Yi Jin, Jacob Turner, Amanda J. Moore, Rintaro Saito, Kenichi Yoshida, Seishi Ogawa, Hans-Reimer Rodewald, Yin C. Lin, Hiroshi Kawamoto, Cornelis Murre
Immunity, 46, 818-834.e4 (2017)
要 約
獲得免疫はB細胞とT細胞による抗原に特異的な反応により惹起される.Eタンパク質のひとつE2AはB細胞の分化において必須の機能をもつが,T細胞の分化における機能については明らかではなかった.また,Eタンパク質の拮抗タンパク質であるIdタンパク質のひとつId2は自然リンパ球や樹状細胞の分化に必須であるが,これらの分化とEタンパク質の機能との関連についてはまったく解明されていなかった.今回の研究において,Eタンパク質のうちE2AおよびHEBが協調的にはたらくことにより胸腺におけるT細胞への分化が決定すること,同時に,胸腺における自然リンパ球の異所性の分化が抑制されることが見い出された.また,ノックアウトマウスの解析により,自然リンパ球への分化はE2AおよびHEBの活性の低下により起こり,Id2の機能がなくても起こることが証明された.その分子機構として,Eタンパク質はT細胞への分化の決定に必須であるタンパク質をコードする遺伝子の発現を直接に制御すること,さらに,これらの遺伝子の発現を制御するエンハンサーに対するアクセシビリティの維持に必要であることが示された.以上の結果から,リンパ球系の前駆細胞において獲得免疫系のリンパ球へと分化するのか,それとも,自然免疫系のリンパ球へと分化するかという運命決定は,Eタンパク質-Idタンパク質の制御軸により規定されることが示唆された.
はじめに
免疫応答は獲得免疫と自然免疫との協調によりなりたつ.T細胞は獲得免疫において中心的な役割を担うリンパ球であり,感染防御,アレルギー炎症,がん免疫などにおいて重要であることが知られている.最近,自然免疫系における新たなリンパ球として自然リンパ球が同定された.自然リンパ球はアレルギー疾患,炎症性腸疾患,糖尿病などの代謝性の疾患に関連すると考えられ,おもに炎症性サイトカインを分泌することにより免疫応答を増強する.自然リンパ球は分泌するサイトカインにより大きく3つに分類される.転写因子T-betを発現しインターフェロンγを分泌する1型自然リンパ球,転写因子Gata3に依存しインターロイキン4,インターロイキン5,インターロイキン13を分泌する2型自然リンパ球,転写因子Rorγtを発現しインターロイキン17およびインターロイキン22を分泌する3型自然リンパ球である1).T細胞と自然リンパ球は分泌するサイトカインや鍵となる転写因子などを共有しており,機能的にも類似性が高い.また,ともに共通リンパ球前駆細胞から分化する.とくに,Tcf1,Bcl11b,Gata3,Nfil3,Tox,Id2といったT細胞の分化において重要な機能をもつ転写因子は,自然リンパ球の分化の過程においても高く発現し重要な機能をはたす.T細胞と自然リンパ球との最大の違いは,T細胞が抗原に特異的な受容体により活性化されるのに対し,自然リンパ球はサイトカインの刺激により活性化されることである.いい換えると,遺伝子の再構成による受容体の形成こそがT細胞と自然リンパ球との違いを決定する.これまで,T細胞と自然リンパ球の分化の分岐点についてはまったく研究されていなかった.それは,正常な状態においては胸腺に自然リンパ球が存在しないためであろう.
哺乳類のEタンパク質は,E2A遺伝子にコードされるE47およびE12,HEB,E2-2の4つからなる.E2AはEBF1やFoxo1とともにB細胞への分化の決定に必須であるが2),T細胞への分化の決定における機能は不明であった.それは,E2Aノックアウトマウスにおいては胸腺におけるT細胞の分化は維持されたためである.一方,Idタンパク質としてはId1~Id4があり,Id2およびId3は胸腺におけるT細胞の選択,活性化,メモリーT細胞の維持,濾胞性ヘルパーT細胞の分化,制御性T細胞による炎症の抑制に重要であることが,筆者らも含む多くの研究グループにより報告されている3-5).Id2は自然リンパ球の分化およびその機能に重要であることが広く知られているが,Id2がいったい何を制御するのかはまったく不明であった.
今回,筆者らは,Eタンパク質のうちE2AとHEBが協調的に機能し,生体におけるT細胞の分化に決定的に必要であること,また,胸腺における自然リンパ球の分化を抑制することを見い出した.
1.E2Aの発現とId2の発現は自然リンパ球の分化において逆相関を示す
自然リンパ球の分化におけるE2AおよびId2による転写制御の詳細について,E2AのレポーターマウスおよびId2のレポーターマウスを解析した.その結果,自然リンパ球の前駆細胞は,E2A高発現かつId2低発現,および,E2A低発現かつId2高発現,という2つの細胞の集団に分けられた.このことは,E2Aの活性が低下してからId2の発現が上昇することを意味し,従来のId2がE2Aの活性を抑制することにより自然リンパ球の分化を決定するという考えとは異なる結果であった.さらに,転写因子PLZFは自然リンパ球の前駆細胞において一過性に発現することが報告されていたことから6),Id2とPLZFのダブルリポーターマウスを作製しId2とPLZFの発現の順序についても検討した.その結果,PLZFの発現はId2の発現よりも先行し,そののち,PLZFの発現が低下してもId2は高発現を維持した.これらの結果から,自然リンパ球への分化の過程におけるE2A,Id2,PLZFの発現の順序が明らかにされ,E2Aの発現とId2の発現の逆相関が示された.
2.E2AおよびHEBは胸腺におけるT細胞の分化に必須である
T細胞への分化の決定におけるEタンパク質の機能について検討するため,E2AとHEBのダブルコンディショナルノックアウトを作製した.E2AおよびHEBを後天的に欠損,あるいは,リンパ球の系列に分化してから欠損させた結果,いずれも,胸腺においてもっとも初期のT前駆細胞の段階で分化は障害された.また,αβT細胞だけでなくγδT細胞も顕著に減少し,T細胞の系列全体に重度な障害が認められた.くわえて,胎仔の胸腺から採取したT前駆細胞を用いたin vitroにおける分化の誘導においても,E2AとHEBのダブルノックアウトマウスのT前駆細胞には顕著な障害が認められた.以上の結果から,T細胞の分化の決定においてE2AおよびHEBは必須であり相補的に機能することが示された.
3.E2AおよびHEBの欠損は胸腺において自然リンパ球の異所性の分化を起こす
胸腺に存在するT前駆細胞においてE2AおよびHEBを欠損させた結果,野生型のマウスの胸腺において自然リンパ球はほとんど認められなかったが,E2AとHEBのダブルノックアウトマウスの胸腺においては2型自然リンパ球およびリンパ組織誘導細胞様細胞が顕著に増加していた.また,自然リンパ球の前駆細胞であるPLZF発現前駆細胞も胸腺において顕著に増加していた.これら異所性に分化した2型自然リンパ球は転写因子Gata3を発現し,刺激によりインターロイキン4,インターロイキン5,インターロイキン13を発現したことから,機能的にも2型自然リンパ球と考えられた.この2型自然リンパ球は胸腺にて増殖していたことから,ほかの臓器において増殖したものが胸腺に2次的に移入した可能性は低いと考えられた.E2AおよびHEBの欠損によりT細胞およびB細胞が顕著に減少したことから,リンパ球の減少した環境により2型自然リンパ球が2次的に増加した可能性も否定できなかった.そこで,E2AとHEBのダブルノックアウトマウスをRag2ノックアウトマウスと交配したところ自然リンパ球の異所性の分化に大きな影響はなく,また,Rag2ノックアウトマウスの胸腺において自然リンパ球の異所性の分化は認められなかった.これらのことから,リンパ球の減少した環境により自然リンパ球が2次的に増加したのではないことが証明された.
4.E2AおよびHEBの活性がT細胞と自然リンパ球の分岐を規定する
ドキシサイクリンの添加によりId2を高発現するマウスを作製した.その結果,Id2の短期間の強制発現は,E2AとHEBのダブルノックアウトマウスと同様に,生体におけるT細胞およびB細胞の初期の分化に強い障害をひき起こし,さらに,胸腺における2型自然リンパ球の異所性の分化も起こした.このことから,Id2によるE2AおよびHEBのDNAに対する結合能の低下がT細胞の分化を抑制し自然リンパ球の分化を誘導することが強く示唆された.つまり,E2AおよびHEBの活性がT細胞と自然リンパ球の分岐を規定すると考えられた.このことを明確に証明するため,E2A,HEB,Id2のトリプルコンディショナルノックアウトマウスを作製したところ,E2AとHEBのダブルノックアウトマウスと同様に,自然リンパ球の異所性の分化が認められた.このことから,Id2が自然リンパ球の分化に必須なのではなく,E2AおよびHEBの活性の低下が自然リンパ球への分化をひき起こすことが明確に示された(図1).
5.E2AおよびHEBはT細胞への分化に必須のタンパク質をコードする遺伝子のエンハンサーを制御する
E2AおよびHEBの欠損による自然リンパ球の異所性の分化の分子機構について解明するためトランスクリプトームを解析した.外部の環境の影響を排除するため,胎仔の胸腺から初期のT前駆細胞を採取し,RNA-seq法により解析した.その結果,およそ1800の遺伝子の発現の変化が認められ,とくに,T細胞に必須のタンパク質であるRag1,Rag2,Notch1,Notch3,Ptcra,CD3e,CD3dなどをコードする遺伝子の発現が顕著に低下していた.一方,Tcf7,Bcl11b,Gata3などをコードする遺伝子の発現の低下は認められなかった.さらに,Metascape解析により,発現の上昇した遺伝子は炎症反応,サイトカイン,活性化などエフェクター細胞様の機能に関与することが示された.PLZF,Tox,Gata3など,自然リンパ球の分化に関与するタンパク質をコードする遺伝子の発現が上昇していた一方,成熟した自然リンパ球のマーカーとなる遺伝子の発現は認められなかった.以上の結果から,E2AおよびHEBの欠損により,T前駆細胞から自然リンパ球への系列へと変化することが考えられた.
最近の報告から,細胞の分化あるいは活性化において遺伝子の発現にさきだちエンハンサーのレパトアが確立しており,こうした遺伝子制御領域のレパトアの形成が分化に必須であることがわかっている.そのため,ATAC-seq(assay for transposase-accessible chromatin sequencing)法を用いてレギュロームを解析した7).さらに,野生型のマウスとE2AとHEBのダブルノックアウトマウスのT前駆細胞のレギュロームを,血液幹細胞から成熟したリンパ球までのレギュロームと比較した.開いた構造をとるクロマチン領域をプロモーターとエンハンサーとに分けたうえで階層的にクラスタリングしたところ,プロモーターにおいては野生型のマウスのT前駆細胞とE2AとHEBのダブルノックアウトマウスのT前駆細胞は同じくクラスタリングされた一方,エンハンサーにおいては野生型のマウスのT前駆細胞は共通リンパ球前駆細胞や血液幹細胞などの近くにクラスタリングされたが,E2AとHEBのダブルノックアウトマウスのT前駆細胞は未熟な2型自然リンパ球ともっとも近くクラスタリングされた.くわえて,開いた構造をとるクロマチン領域において転写因子の結合モチーフの頻度を解析したところ,やはり,E2AとHEBのダブルノックアウトマウスのT前駆細胞は未熟な2型自然リンパ球の近くにクラスタリングされた.E2AおよびHEBの欠損が実際に標的となる遺伝子座にどのような影響を及ぼすのか検討したところ,Notch1遺伝子座,Rag1遺伝子座,Rag2遺伝子座において,プロモーターにはあまり影響がなかったにもかかわらず,E2Aと結合するエンハンサーに対するアクセシビリティが顕著に障害されていた.このことは,E2AおよびHEBがT細胞への分化に必須のタンパク質をコードする遺伝子のエンハンサーの機能を維持することによりその発現を制御することを示した結果であった.
おわりに
今回の論文は,2011年にNature Immunologyに発表した論文3)(新着論文レビュー でも掲載)の内容を発展させたものである.数年前からE2AおよびHEBがT細胞への分化に必須であることはわかっていたが,自然リンパ球の分化と関連するとは想定していなかった.自然リンパ球に関する多くの論文からT細胞と自然リンパ球との類似性に気づき,T細胞と自然リンパ球の分化には分岐点が存在するのではないかと疑問をもち研究をはじめた.つまり,数年間にわたりずっとその答を探してきたのである.この研究から,リンパ球の分化と系統発生に関してさらに多くの謎が感じられる.もし,こうした疑問の答にほんの少しでも近づけたらうれしく思う.
文 献
- Diefenbach, A., Colonna, M. & Koyasu, S.: Development, differentiation, and diversity of innate lymphoid cells. Immunity, 41, 354-365 (2014)[PubMed]
- Lin, Y. C., Jhunjhunwala, S., Benner, C. et al.: A global network of transcription factors, involving E2A, EBF1 and Foxo1, that orchestrates B cell fate. Nat. Immunol., 11, 635-643 (2010)[PubMed]
- Miyazaki, M., Rivera, R. R., Miyazaki, K. et al.: The opposing roles of the transcription factor E2A and its antagonist Id3 that orchestrate and enforce the naive fate of T cells. Nat. Immunol., 12, 992-1001 (2011)[PubMed] [新着論文レビュー]
- Omilusik, K. D., Shaw, L. A. & Goldrath, A. W.: Remembering one’s ID/E-ntity: E/ID protein regulation of T cell memory. Curr. Opin. Immunol., 25, 660-666 (2013)[PubMed]
- Miyazaki, M., Miyazaki, K., Chen, S. et al.: Id2 and Id3 maintain the regulatory T cell pool to suppress inflammatory disease. Nat. Immunol., 15, 767-776 (2014)[PubMed] [新着論文レビュー]
- Constantinides, M. G., McDonald, B. D., Verhoef, P. A. et al.: A committed precursor to innate lymphoid cells. Nature, 508, 397-401 (2014)[PubMed]
- Buenrostro, J. D., Giresi, P. G., Zaba, L. C. et al.: Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position. Nat. Methods, 10, 1213-1218 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 広島大学大学院医歯薬学総合研究科博士課程 修了,同年 同 助教,2009年 米国California大学San Diego校 研究員,2010年 同Assistant Project Scientist,2015年 京都大学再生医科学研究所 助教を経て,2016年より京都大学ウイルス・再生医科学研究所 准教授.
研究テーマ:T細胞の分化および活性化における転写の制御機構.
抱負:人生は短いので,Scienceを楽しむことを一番に!
宮崎 和子(Kazuko Miyazaki)
京都大学ウイルス・再生医科学研究所 特定研究員.
河本 宏(Hiroshi Kawamoto)
京都大学ウイルス・再生医科学研究所 教授.
Cornelis Murre
米国California大学San Diego校 特別教授.
© 2017 宮崎正輝・宮崎和子・河本 宏・Cornelis Murre Licensed under CC 表示 2.1 日本