葉緑体ゲノムの分配はHollidayジャンクション解離酵素MOC1により保障される
小林優介1・三角修己2・西村芳樹1
(1京都大学大学院理学研究科生物科学専攻 植物学教室植物分子遺伝学分科,2山口大学大学院創成科学研究科理学系学域 生物学分野)
email:西村芳樹
DOI: 10.7875/first.author.2017.043
Holliday junction resolvases mediate chloroplast nucleoid segregation.
Yusuke Kobayashi, Osami Misumi, Masaki Odahara, Kota Ishibashi, Masafumi Hirono, Kumi Hidaka, Masayuki Endo, Hiroshi Sugiyama, Hiroshi Iwasaki, Tsuneyoshi Kuroiwa, Toshiharu Shikanai, Yoshiki Nishimura
Science, 356, 631-634 (2017)
ゲノムを次世代へと確実に分配するためには,DNAの複製や修復の際に生じる相同組換えの中間体であるHollidayジャンクションの適切な解消が必要である.今回,筆者らは,葉緑体の核様体の形態および分配に異常を示す緑藻クラミドモナスの変異体の解析から,葉緑体のHollidayジャンクション解離酵素MOC1を発見した.MOC1の活性について,人工のHollidayジャンクションを基質として用いた生化学的な解析,および,DNAオリガミ技術と高速原子間力顕微鏡を用いた解析により,MOC1はHollidayジャンクションの中央部に特異的に結合し,コア配列を点対称に切断することが証明された.MOC1は葉緑体DNAに形成されたHollidayジャンクションを解消することにより葉緑体の核様体の凝集をふせぐと考えられる.MOC1は緑色植物に広く保存されており,シロイヌナズナにおいてもMOC1のノックダウンにより葉緑体の核様体は凝集し,さらに,遺伝子破壊株は致死となった.このことから,緑藻から陸上植物まで,葉緑体の増殖にともなう葉緑体ゲノムの正確な分配が葉緑体のHollidayジャンクション解離酵素MOC1により保障されることが示された.
藻類や植物のもつ葉緑体は,光合成により二酸化炭素を固定し酸素を放出するとともに,有機物を合成することで地球上のほぼすべての生命活動をささえる.葉緑体にはシアノバクテリア様の祖先からひき継がれた独自の葉緑体DNAがあり,これらは光合成装置の構築や植物の生存において必須である.一般に,ひとつの葉緑体あたり約80コピーの相同な葉緑体DNAが存在し,それらは多様なタンパク質により折りたたまれて核様体を構築する.葉緑体の核様体は,いわば葉緑体にとっての核であり,葉緑体DNAの複製および分配の基盤である1).
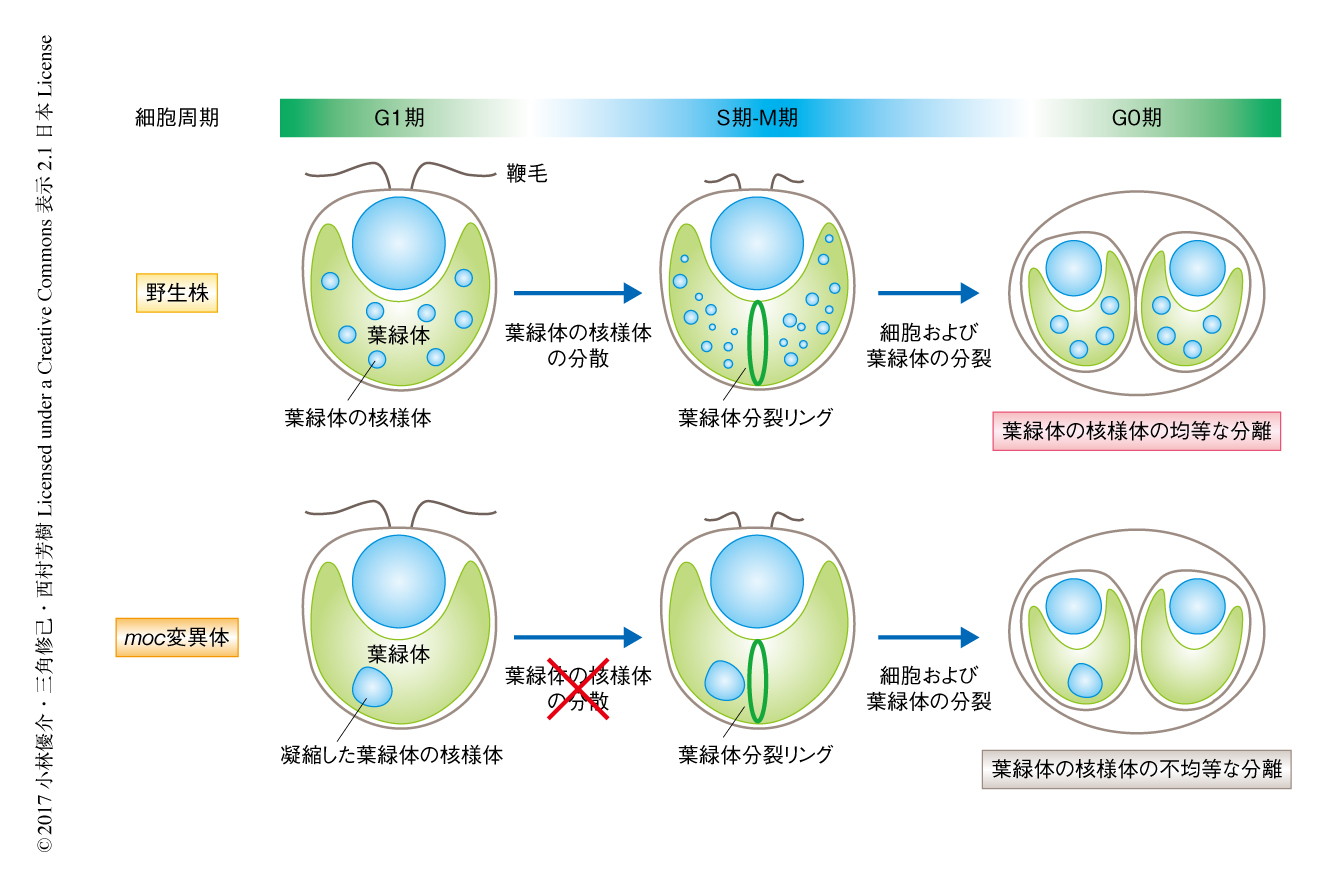
葉緑体の核様体はダイナミックに挙動する.たとえば,緑藻クラミドモナスにおいては,間期には葉緑体の核様体は5~10個ほどのかたまりとして観察されるが,葉緑体の分裂の直前に拡散することにより葉緑体ゲノムの分配を保障すると考えられている2)(図1).同様の形態の変化は陸上植物シロイヌナズナにおいても観察されている3).しかし,このような葉緑体の核様体における形態の制御がどのようなしくみにより制御されるのかは不明であった.
約20年前,緑藻クラミドモナスにおいて葉緑体の核様体の形態に異常を示すmoc変異体が単離された4).moc変異体においては葉緑体の核様体がひとつの大きなかたまりになってしまい,娘細胞に均等に分配されない(図1).こうした明瞭な表現型にもかかわらず,その原因遺伝子は不明であった.そこで,最新のゲノムデータを基盤とし,遺伝子マッピング,TAIL-PCR法,外来遺伝子の導入による相補実験をくり返すことにより,moc1変異体の原因遺伝子として機能未知のMOC1遺伝子を同定することに成功した.
BLAST検索により,MOC1遺伝子は緑色植物に広く保存されていることが明らかにされた.クラミドモナスのMOC1は非常に不安定であったため,シロイヌナズナのMOC1について解析した.蛍光タンパク質との融合タンパク質を用いた解析の結果,シロイヌナズナにおいてMOC1は葉緑体に局在し,さらに,その一部は葉緑体の核様体と共局在した.RNAi法によりMOC1をノックダウンしたところ,クラミドモナスのmoc変異体と同様に,シロイヌナズナにおいても葉緑体の核様体はひとつに凝集した.さらに,シロイヌナズナにおいて遺伝子破壊株はアルビノ致死であり,葉緑体DNAのコピー数は野生株の約4%にまで減少した.このことから,シロイヌナズナにおいてもMOC1は葉緑体の核様体の分離および葉緑体DNAの維持にきわめて重要であることが示された.
MOC1の機能について手がかりを得るため,SWISSホモロジーモデリングにより構造を予測したところ,細菌のRuvCとのあいだに構造的な類似性が示唆された.RuvCは相同組換えの最終の段階において機能するHollidayジャンクション解離酵素であり,これまで,ファージ,細菌,真核生物の核およびミトコンドリアにおいて報告されていたが,葉緑体においては知られていなかった.そこで,MOC1にHollidayジャンクション解離酵素としての活性が存在するかどうか検証した.シロイヌナズナのMOC1を大腸菌において可溶化させるため,マルトース結合タンパク質との融合タンパク質として発現させ,アフィニティークロマトグラフィーにより精製した.ゲルシフトアッセイにより,MOC1はHollidayジャンクションと特異的に結合することがわかった.人工のHollidayジャンクションを基質として解析したところ,MOC1は補因子としてMg2+およびMn2+を要求し,25~35℃において強いエンドヌクレアーゼ活性を示すことが明らかにされた.さらに,さまざまな構造や配列をもつ人工のHollidayジャンクションを作製し解析したところ,MOC1はシス配列として長い相同配列は必要としないが,コア配列CCを点対称に切断することが示された.MOC1の機能を別の角度から検証するためDNAオリガミ技術と高速原子間力顕微鏡を用いて解析した結果,MOC1がHollidayジャンクションの中央部に特異的に結合しそれを点対称に切断する過程を直接にとらえることに成功した.
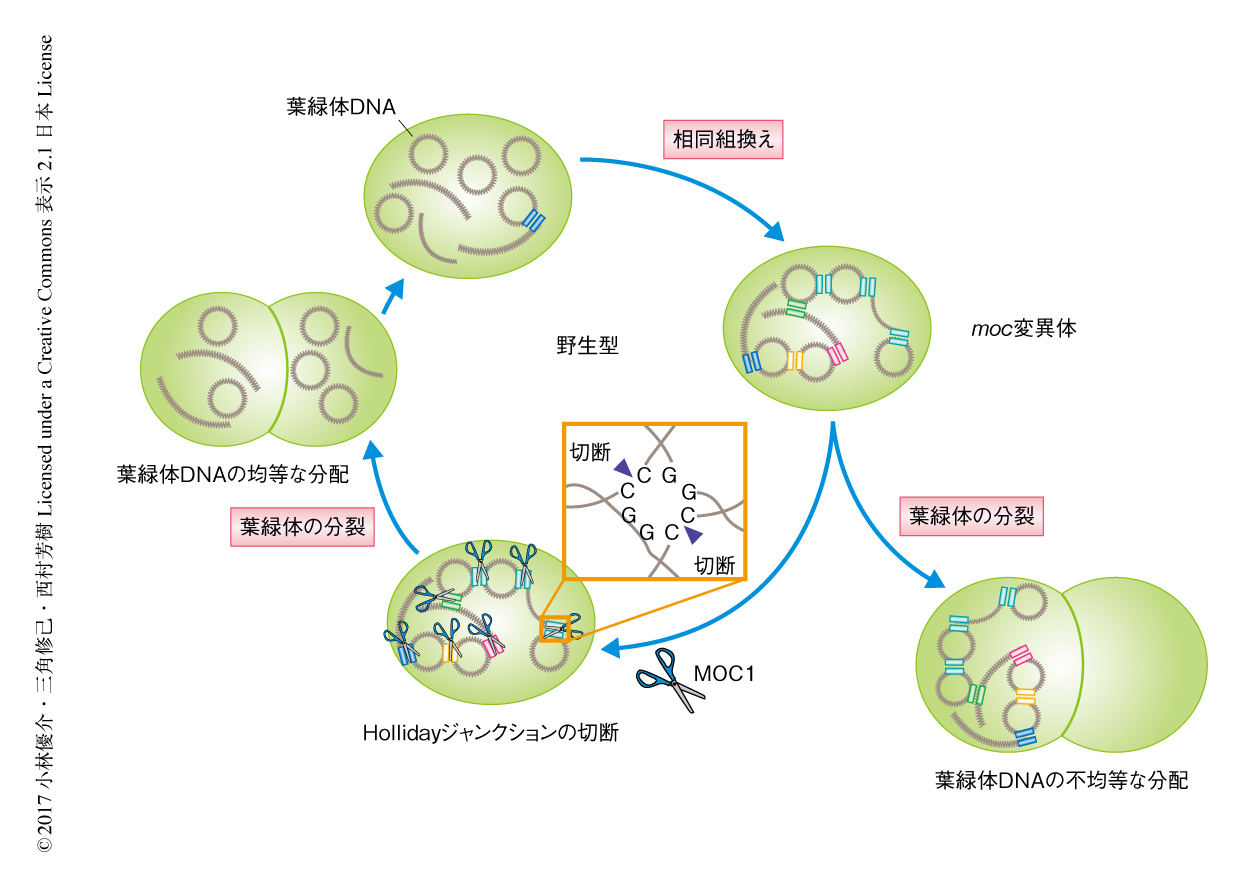
葉緑体には約80コピーの相同な葉緑体DNAが存在する.葉緑体DNAは光合成により発生する活性酸素種などによりつねに二本鎖DNA切断などの障害をうけると考えられるが,これらの損傷を修復するうえで相同組換えは重要な役割をはたすとされる.つまり,葉緑体においては頻繁に相同組換えが起こっており,その結果,葉緑体DNAどうしがHollidayジャンクションによりつながったDNAコンカテマーを形成すると考えられている5).葉緑体の核様体は葉緑体DNAおよびさまざまなタンパク質から構成されており,その可動性は葉緑体DNAに影響されると考えられる.すなわち,MOC1は葉緑体DNAに形成されたHollidayジャンクションを解消することにより葉緑体の核様体の可動性を保障すると推測される.一方,moc1欠損株においてはHollidayジャンクションを解消することができず,葉緑体の核様体の可動性がいちじるしく低下するため,葉緑体の核様体の凝集や不均等な分配がひき起こされるのであろう(図2).
これまで,Hollidayジャンクション解離酵素は,ファージ6),細菌7,8),真核生物のミトコンドリア9) および核10) において報告されていたが,葉緑体においては知られていなかった.この研究により,ようやくDNAをもつすべての細胞あるいはオルガネラにHollidayジャンクション解離酵素の存在することが証明された.さらに,葉緑体のHollidayジャンクション解離酵素MOC1は葉緑体の核様体を正確に分離するうえで欠かせないことがわかった.MOC1がどのようにしてHollidayジャンクションを正確に認識し,結合し,切断するのか,くわえて,どのような因子と相互作用して相同組換えを実現するのかを調べていくことにより,葉緑体における相同組換えの機構の理解が進むはずである.これにより,葉緑体におけるゲノムの修復の効率化や,相同組換えの効率の改善による葉緑体の形質転換技術の発展などが期待される.
略歴:2017年 京都大学大学院理学研究科博士課程 修了,同年より国立遺伝学研究所 博士研究員.
研究テーマ:葉緑体DNAの遺伝および葉緑体の細胞内共生の分子機構.
三角 修己(Osami Misumi)
山口大学大学院創成科学研究科 准教授.
西村 芳樹(Yoshiki Nishimura)
京都大学大学院理学研究科 助教.
© 2017 小林優介・三角修己・西村芳樹 Licensed under CC 表示 2.1 日本
(1京都大学大学院理学研究科生物科学専攻 植物学教室植物分子遺伝学分科,2山口大学大学院創成科学研究科理学系学域 生物学分野)
email:西村芳樹
DOI: 10.7875/first.author.2017.043
Holliday junction resolvases mediate chloroplast nucleoid segregation.
Yusuke Kobayashi, Osami Misumi, Masaki Odahara, Kota Ishibashi, Masafumi Hirono, Kumi Hidaka, Masayuki Endo, Hiroshi Sugiyama, Hiroshi Iwasaki, Tsuneyoshi Kuroiwa, Toshiharu Shikanai, Yoshiki Nishimura
Science, 356, 631-634 (2017)
要 約
ゲノムを次世代へと確実に分配するためには,DNAの複製や修復の際に生じる相同組換えの中間体であるHollidayジャンクションの適切な解消が必要である.今回,筆者らは,葉緑体の核様体の形態および分配に異常を示す緑藻クラミドモナスの変異体の解析から,葉緑体のHollidayジャンクション解離酵素MOC1を発見した.MOC1の活性について,人工のHollidayジャンクションを基質として用いた生化学的な解析,および,DNAオリガミ技術と高速原子間力顕微鏡を用いた解析により,MOC1はHollidayジャンクションの中央部に特異的に結合し,コア配列を点対称に切断することが証明された.MOC1は葉緑体DNAに形成されたHollidayジャンクションを解消することにより葉緑体の核様体の凝集をふせぐと考えられる.MOC1は緑色植物に広く保存されており,シロイヌナズナにおいてもMOC1のノックダウンにより葉緑体の核様体は凝集し,さらに,遺伝子破壊株は致死となった.このことから,緑藻から陸上植物まで,葉緑体の増殖にともなう葉緑体ゲノムの正確な分配が葉緑体のHollidayジャンクション解離酵素MOC1により保障されることが示された.
はじめに
藻類や植物のもつ葉緑体は,光合成により二酸化炭素を固定し酸素を放出するとともに,有機物を合成することで地球上のほぼすべての生命活動をささえる.葉緑体にはシアノバクテリア様の祖先からひき継がれた独自の葉緑体DNAがあり,これらは光合成装置の構築や植物の生存において必須である.一般に,ひとつの葉緑体あたり約80コピーの相同な葉緑体DNAが存在し,それらは多様なタンパク質により折りたたまれて核様体を構築する.葉緑体の核様体は,いわば葉緑体にとっての核であり,葉緑体DNAの複製および分配の基盤である1).
葉緑体の核様体はダイナミックに挙動する.たとえば,緑藻クラミドモナスにおいては,間期には葉緑体の核様体は5~10個ほどのかたまりとして観察されるが,葉緑体の分裂の直前に拡散することにより葉緑体ゲノムの分配を保障すると考えられている2)(図1).同様の形態の変化は陸上植物シロイヌナズナにおいても観察されている3).しかし,このような葉緑体の核様体における形態の制御がどのようなしくみにより制御されるのかは不明であった.
1.葉緑体の核様体の形態に異常を示すmoc1変異体の原因遺伝子の同定
約20年前,緑藻クラミドモナスにおいて葉緑体の核様体の形態に異常を示すmoc変異体が単離された4).moc変異体においては葉緑体の核様体がひとつの大きなかたまりになってしまい,娘細胞に均等に分配されない(図1).こうした明瞭な表現型にもかかわらず,その原因遺伝子は不明であった.そこで,最新のゲノムデータを基盤とし,遺伝子マッピング,TAIL-PCR法,外来遺伝子の導入による相補実験をくり返すことにより,moc1変異体の原因遺伝子として機能未知のMOC1遺伝子を同定することに成功した.
2.MOC1は陸上植物においても葉緑体の核様体の分離に必須である
BLAST検索により,MOC1遺伝子は緑色植物に広く保存されていることが明らかにされた.クラミドモナスのMOC1は非常に不安定であったため,シロイヌナズナのMOC1について解析した.蛍光タンパク質との融合タンパク質を用いた解析の結果,シロイヌナズナにおいてMOC1は葉緑体に局在し,さらに,その一部は葉緑体の核様体と共局在した.RNAi法によりMOC1をノックダウンしたところ,クラミドモナスのmoc変異体と同様に,シロイヌナズナにおいても葉緑体の核様体はひとつに凝集した.さらに,シロイヌナズナにおいて遺伝子破壊株はアルビノ致死であり,葉緑体DNAのコピー数は野生株の約4%にまで減少した.このことから,シロイヌナズナにおいてもMOC1は葉緑体の核様体の分離および葉緑体DNAの維持にきわめて重要であることが示された.
3.MOC1は葉緑体のHollidayジャンクション解離酵素である
MOC1の機能について手がかりを得るため,SWISSホモロジーモデリングにより構造を予測したところ,細菌のRuvCとのあいだに構造的な類似性が示唆された.RuvCは相同組換えの最終の段階において機能するHollidayジャンクション解離酵素であり,これまで,ファージ,細菌,真核生物の核およびミトコンドリアにおいて報告されていたが,葉緑体においては知られていなかった.そこで,MOC1にHollidayジャンクション解離酵素としての活性が存在するかどうか検証した.シロイヌナズナのMOC1を大腸菌において可溶化させるため,マルトース結合タンパク質との融合タンパク質として発現させ,アフィニティークロマトグラフィーにより精製した.ゲルシフトアッセイにより,MOC1はHollidayジャンクションと特異的に結合することがわかった.人工のHollidayジャンクションを基質として解析したところ,MOC1は補因子としてMg2+およびMn2+を要求し,25~35℃において強いエンドヌクレアーゼ活性を示すことが明らかにされた.さらに,さまざまな構造や配列をもつ人工のHollidayジャンクションを作製し解析したところ,MOC1はシス配列として長い相同配列は必要としないが,コア配列CCを点対称に切断することが示された.MOC1の機能を別の角度から検証するためDNAオリガミ技術と高速原子間力顕微鏡を用いて解析した結果,MOC1がHollidayジャンクションの中央部に特異的に結合しそれを点対称に切断する過程を直接にとらえることに成功した.
4.MOC1はHollidayジャンクションを解消することにより葉緑体の核様体の可動性を保障する
葉緑体には約80コピーの相同な葉緑体DNAが存在する.葉緑体DNAは光合成により発生する活性酸素種などによりつねに二本鎖DNA切断などの障害をうけると考えられるが,これらの損傷を修復するうえで相同組換えは重要な役割をはたすとされる.つまり,葉緑体においては頻繁に相同組換えが起こっており,その結果,葉緑体DNAどうしがHollidayジャンクションによりつながったDNAコンカテマーを形成すると考えられている5).葉緑体の核様体は葉緑体DNAおよびさまざまなタンパク質から構成されており,その可動性は葉緑体DNAに影響されると考えられる.すなわち,MOC1は葉緑体DNAに形成されたHollidayジャンクションを解消することにより葉緑体の核様体の可動性を保障すると推測される.一方,moc1欠損株においてはHollidayジャンクションを解消することができず,葉緑体の核様体の可動性がいちじるしく低下するため,葉緑体の核様体の凝集や不均等な分配がひき起こされるのであろう(図2).
おわりに
これまで,Hollidayジャンクション解離酵素は,ファージ6),細菌7,8),真核生物のミトコンドリア9) および核10) において報告されていたが,葉緑体においては知られていなかった.この研究により,ようやくDNAをもつすべての細胞あるいはオルガネラにHollidayジャンクション解離酵素の存在することが証明された.さらに,葉緑体のHollidayジャンクション解離酵素MOC1は葉緑体の核様体を正確に分離するうえで欠かせないことがわかった.MOC1がどのようにしてHollidayジャンクションを正確に認識し,結合し,切断するのか,くわえて,どのような因子と相互作用して相同組換えを実現するのかを調べていくことにより,葉緑体における相同組換えの機構の理解が進むはずである.これにより,葉緑体におけるゲノムの修復の効率化や,相同組換えの効率の改善による葉緑体の形質転換技術の発展などが期待される.
文 献
- Kuroiwa, T., Suzuki, T., Ogawa, K. et al.: The chloroplast nucleus: distribution, number, size, and shape, and a model for the multiplication of the chloroplast genome during chloroplast development. Plant Cell Physiol., 22, 381-396 (1981)
- Ehara, T., Ogasawara, Y., Osafune, T. et al.: Behavior of chloroplast nucleoids during the cell cycle of Chlamydomonas reinhardtii in synchronized culture. in Current Research in Photosynthesis (Baltscheffsky, M. ed.), pp. 2535-2538, Kluwer Academic Publishers, Dordrecht (1990)
- Terasawa, K. & Sato, H.: Plastid localization of the PEND protein is mediated by a noncanonical transit peptide. FEBS J., 276, 1709-1719 (2009)[PubMed]
- Misumi, O., Suzuki, L., Nishimura, Y. et al.: Isolation and phenotypic characterization of Chlamydomonas reinhardtii mutants defective in chloroplast DNA segregation. Protoplasma, 209, 207-282 (1999)
- Bendich, A. J.: Circular chloroplast chromosomes: the grand illusion. Plant Cell, 16, 1661-1666 (2004)[PubMed]
- Mizuuchi, K., Kemper, B., Hays, J. et al.: T4 endonuclease VII cleaves holliday structures. Cell, 29, 357-365 (1982)[PubMed]
- Dunderdale, H. J., Benson, F. E., Parsons, C. A. et al.: Formation and resolution of recombination intermediates by E. coli RecA and RuvC proteins. Nature, 354, 506-510 (1991)[PubMed]
- Iwasaki, H., Takahagi, M., Shiba, T. et al.: Escherichia coli RuvC protein is an endonuclease that resolves the Holliday structure. EMBO J., 10, 4381-4389 (1991)[PubMed]
- Kleff, S., Kemper, B. & Sternglanz, R.: Identification and characterization of yeast mutants and the gene for a cruciform cutting endonuclease. EMBO J., 11, 699-704 (1992)[PubMed]
- Ip, S. C., Rass, U., Blanco, M. G. et al.: Identification of Holliday junction resolvases from humans and yeast. Nature, 456, 357-361 (2008)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 京都大学大学院理学研究科博士課程 修了,同年より国立遺伝学研究所 博士研究員.
研究テーマ:葉緑体DNAの遺伝および葉緑体の細胞内共生の分子機構.
三角 修己(Osami Misumi)
山口大学大学院創成科学研究科 准教授.
西村 芳樹(Yoshiki Nishimura)
京都大学大学院理学研究科 助教.
© 2017 小林優介・三角修己・西村芳樹 Licensed under CC 表示 2.1 日本