Sirt3はカロリー制限下において酸化ストレス損傷の低下と加齢性難聴の抑制を仲介する
染谷 慎一
(米国Wisconsin大学Madison校Departments of Genetics and Medical Genetics)
email:染谷慎一
DOI: 10.7875/first.author.2010.064
Sirt3 mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction.
Shinichi Someya, Wei Yu, William C. Hallows, Jinze Xu, James M. Vann, Christiaan Leeuwenburgh, Masaru Tanokura, John M. Denu, Tomas A. Prolla
Cell, 143, 802-812 (2010)
カロリー制限は哺乳類の寿命を延長し加齢性難聴の発症を抑制することができる唯一確実な方法として知られているが,その分子機構については不明な点が多い.脱アセチル化酵素であるSirtuinは下等生物において重要な老化制御タンパク質としてはたらくことが知られているが,哺乳類における抗老化および寿命延長への役割については不明である.筆者らは,ミトコンドリアに局在し哺乳類Sirtuinの一員であるSirt3がカロリー制限によるマウスの加齢性難聴の発症抑制に必須であることを明らかにした.Sirt3ノックアウトマウスの聴力測定を行ったところ,カロリー制限下において中年齢の野生型マウスはほぼ正常な聴力を示したが,同じ月齢のSirt3ノックアウトマウスでは中等度の難聴が出現した.また,これらマウスの蝸牛,脳,肝臓を摘出してDNA酸化損傷の程度を調べたところ,Sirt3ノックアウトマウスの組織ではDNA酸化損傷が野生型マウスの組織に比べ有意に高い結果が示された.さらに,カロリー制限下ではSirt3はイソクエン酸脱水酵素2を脱アセチル化することによりこれを活性化させ,その結果,NADPH値および還元型グルタチオンの酸化型グルタチオンに対する比率が増加することが明らかになった.ヒト腎臓細胞を用いた培養細胞実験では,Sirt3の過剰発現がNADPH値を増加させ酸化ストレス性の細胞死を抑制した.これらの結果から,カロリー制限による加齢性の蝸牛の細胞死および加齢性難聴の抑制にミトコンドリアに局在する哺乳類Sirtuinが重要な役割をはたすことが明らかになった.
老人性難聴とは両側耳にほぼ対称に生じる老化にともなう進行的な感音性難聴であり,内耳の末梢感覚器である蝸牛の有毛細胞やラセン神経節細胞の障害がおもな原因である1).カロリー制限は哺乳類の老化を抑制する唯一確実な方法として知られており,その老化関連疾患の抑制や寿命延長の効果について数多くの報告がなされている2).これまでのマウスを用いた研究から,カロリー制限下では加齢による蝸牛のラセン神経節細胞の細胞死が有意に抑制され加齢性難聴の進行を遅延することが明らかとなっているが3),分子レベルでの加齢性難聴の抑制機構については不明である.脱アセチル化酵素であるSirtuinは酵母,線虫,ショウジョウバエにおいて重要な老化制御タンパク質としてはたらくことが多く報告されている4).しかしながら,哺乳類における抗老化および寿命延長への役割については不明である.この研究では,ミトコンドリアに局在し哺乳類Sirtuinの一員であるSirt3がカロリー制限によるマウスの加齢性難聴の発症の抑制に必須であることを示した.
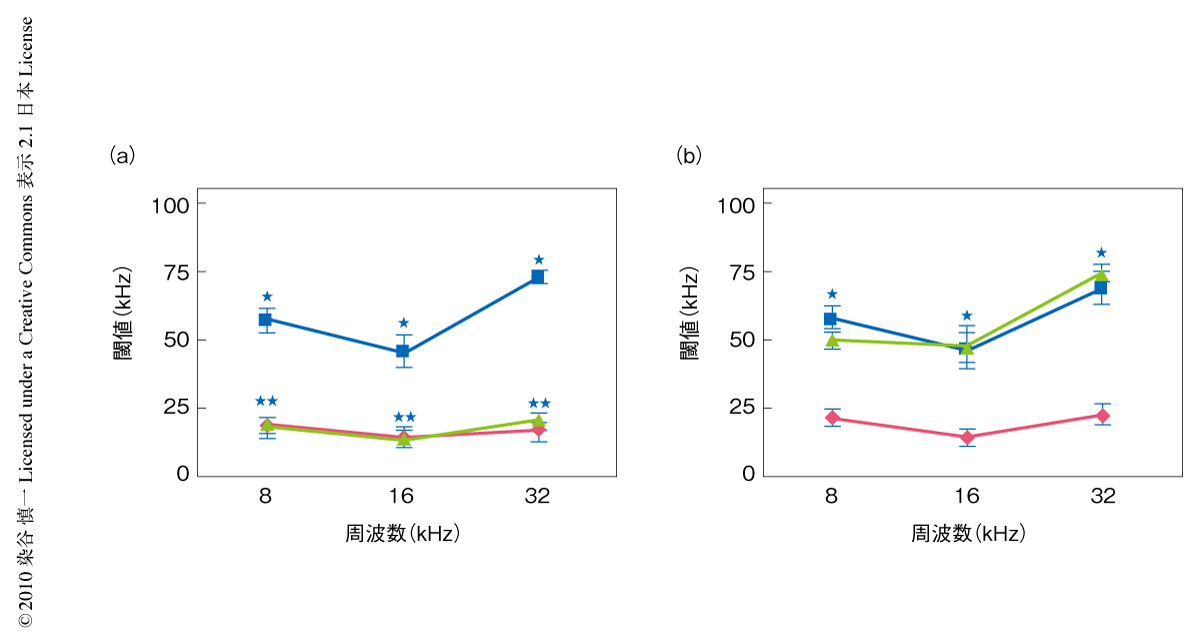
カロリー制限による加齢性難聴の抑制の分子機構を明らかにするために,Sirt3ノックアウトマウスの聴力測定を行った.野生型マウスとSirt3ノックアウトマウスを生後2ヵ月齢から4群に分け,対照群に与える餌の総カロリーを25%減じた餌をカロリー制限群に与える餌とし,2月齢時および12月齢時に8 kHz,16 kHz,32 kHzでの聴力閾値を測定した.その結果,カロリー制限下において中年齢の野生型マウスはほぼ正常の聴力閾値を示したが,同じ月齢のSirt3ノックアウトマウスではすべての周波数において中等度の難聴が出現した(図1).また,蝸牛を摘出してその組織切片を光学顕微鏡下で観察したところ,カロリー制限された中年齢の野生型マウスに明らかな異常はなかったが,カロリー制限された同じ月齢のSirt3ノックアウトマウスではラセン神経節細胞および有毛細胞に著明な変性が観察された.以上の結果から,カロリー制限による加齢性難聴の発症の抑制にSirt3が必須であることが明らかになった.
これまでの研究から,酸化ストレスは蝸牛において細胞障害あるいは細胞死をひき起こすと考えられている5).そこで,Sirt3ノックアウトマウスから蝸牛,大脳皮質,肝臓を摘出し,カロリー制限が酸化ストレス性の細胞死を抑制するかどうかを検討した.その結果,カロリー制限されたSirt3ノックアウトマウスのすべての組織において,核DNAの酸化ストレス障害が野生型マウスと比べ有意に高いという結果が示された.また,蝸牛の組織切片を光学顕微鏡下で観察したところ,カロリー制限されたSirt3ノックアウトマウスのラセン神経節細胞と有毛細胞の細胞数は,同じ月齢の野生型マウスと比べ有意に低いという結果が示された.以上の結果から,カロリー制限による酸化ストレス性の細胞死の抑制にSirt3が必須であることが明らかになった.
グルタチオンはミトコンドリアにおいて活性酸素種を消去する主要な抗酸化物質であり,還元型グルタチオンの酸化型グルタチオンに対する比率は細胞内の酸化ストレスの主要なマーカーと考えられている6).そこで,Sirt3ノックアウトマウスから内耳,大脳皮質,肝臓を摘出してミトコンドリアを抽出し,カロリー制限がミトコンドリアにおけるグルタチオンの抗酸化防御機能を強化するかどうかを検討した.その結果,カロリー制限された野生型マウスのすべての組織における還元型グルタチオンの酸化型グルタチオンに対する比率の増加が示されたが,カロリー制限されたSirt3ノックアウトマウスの組織において変化は示されなかった.以上の結果から,Sirt3はカロリー制限下においてミトコンドリアにおけるグルタチオンの抗酸化防御機能を強化することが明らかになった.
グルタチオンはNADPH依存性グルタチオン還元酵素により酸化型から還元型へと変換され7),NADPHはミトコンドリアに局在するNADP+依存性のイソクエン酸脱水酵素2により合成される8).そこで,カロリー制限下においてSirt3がイソクエン酸脱水酵素2を活性化してNADPH値を増加させるかどうかを検討した.カロリー制限されたマウスの内耳,大脳皮質,肝臓を摘出してミトコンドリアを抽出しイソクエン酸脱水酵素2の活性を測定したところ,野生型マウスのすべての組織においてカロリー制限によるイソクエン酸脱水酵素2活性の増加が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による増加は示されなかった.つぎに,NADPH値を調べたところ,野生型マウスのすべての組織においてカロリー制限によるNADPH値の増加が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による増加は示されなかった.さらに,肝臓におけるイソクエン酸脱水酵素2のアセチル化を調べたところ,野生型マウスの組織においてはカロリー制限によるアセチル化の著明な低下が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による変化は示されなかった.また,カロリー制限によりSirt3のタンパク質値が増加することもウェスタンブロットにより確認された.以上の結果を総合した結果,Sirt3はカロリー制限下において内耳,大脳皮質,肝臓のミトコンドリアにおいてイソクエン酸脱水酵素2を活性化しNADPH値を増加させることが明らかになった.
つぎに,ヒト腎臓に由来する培養細胞においてSirt3あるいはイソクエン酸脱水酵素2を過剰発現させ,NADPH値への影響を検討した.その結果,Sirt3あるいはイソクエン酸脱水酵素2の過剰発現は細胞内NADPH値を増加させることが明らかとなった.また,Sirt3あるいはイソクエン酸脱水酵素2の過剰発現は酸化ストレス性の細胞死を抑制することが明らかになった.以上の結果から,Sirt3の過剰発現はNADPH値を増加させ酸化ストレス性の細胞死を抑制することが明らかになった.
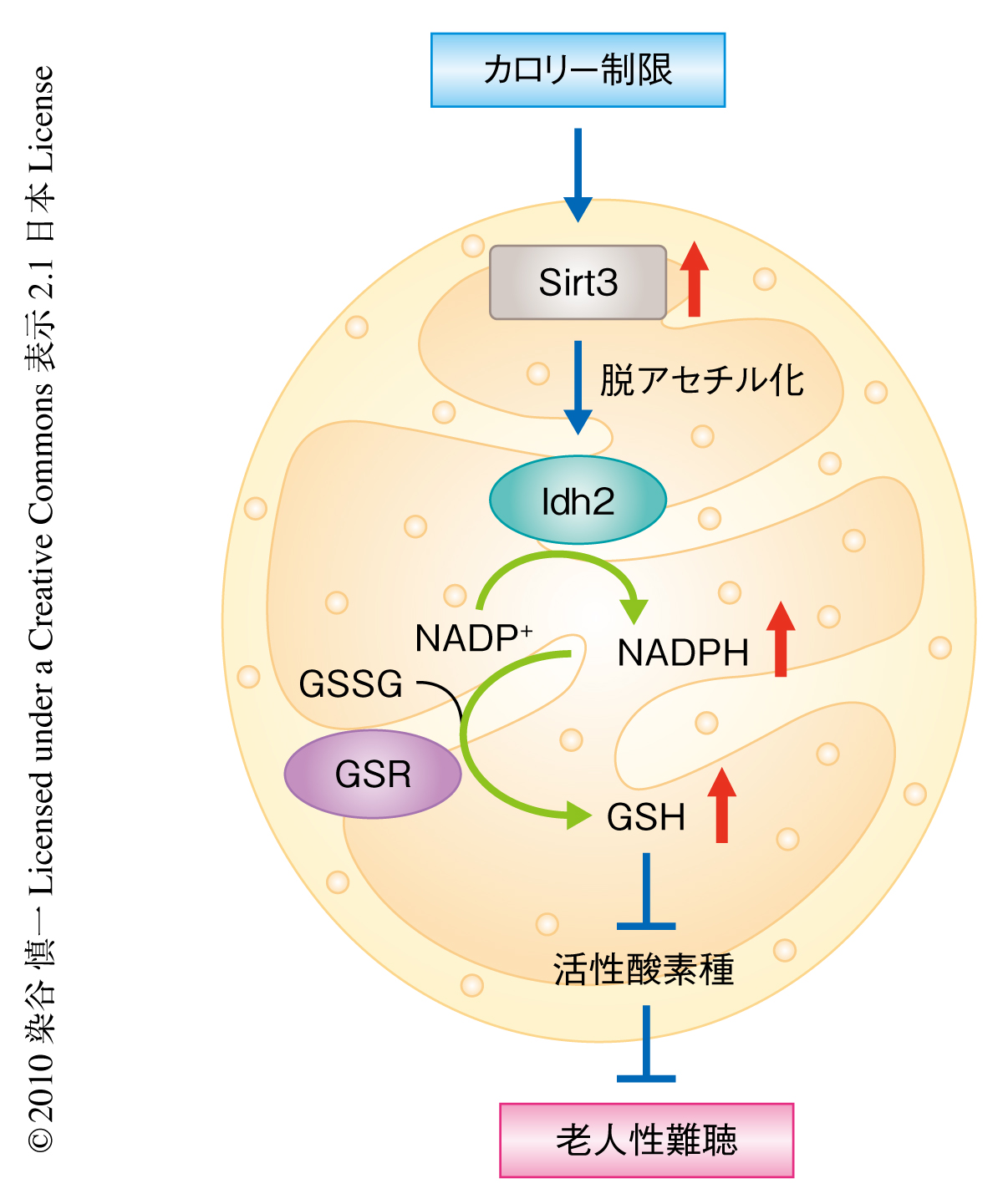
以上の結果をもとに,カロリー制限による老人性難聴の抑制の分子機構を提案した(図2).カロリー制限により活性化されたSirt3がイソクエン酸脱水酵素2を活性化することでNADPH値を増加させる.つぎに,NADPH依存性のグルタチオン還元酵素が活性化され,還元型グルタチオンの酸化型グルタチオンに対する比率が増加することで活性酸素種の濃度が低下する.その結果,蝸牛の細胞死が抑制され加齢性難聴の進行が遅延する.現在,わが国では5人に1人が65歳以上の高齢者であり,2040年には3人に1人が高齢者となると予測されている9).この高齢者人口の増加にともない老人性難聴の患者人口の大幅な増加も予測される.今回の研究成果が老人性難聴の予防法あるいは治療法の確立に役立つものと期待したい.
略歴:2005年 東京大学大学院農学生命科学研究科博士課程 修了,同年 同 特任助手(特任助教)を経て,米国Wisconsin大学Madison校 特別研究員.
研究テーマ:内耳老化および加齢性難聴の分子機構,カロリー制限による加齢性難聴の抑制の分子機構の解明.
© 2010 染谷 慎一 Licensed under CC 表示 2.1 日本
(米国Wisconsin大学Madison校Departments of Genetics and Medical Genetics)
email:染谷慎一
DOI: 10.7875/first.author.2010.064
Sirt3 mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction.
Shinichi Someya, Wei Yu, William C. Hallows, Jinze Xu, James M. Vann, Christiaan Leeuwenburgh, Masaru Tanokura, John M. Denu, Tomas A. Prolla
Cell, 143, 802-812 (2010)
要 約
カロリー制限は哺乳類の寿命を延長し加齢性難聴の発症を抑制することができる唯一確実な方法として知られているが,その分子機構については不明な点が多い.脱アセチル化酵素であるSirtuinは下等生物において重要な老化制御タンパク質としてはたらくことが知られているが,哺乳類における抗老化および寿命延長への役割については不明である.筆者らは,ミトコンドリアに局在し哺乳類Sirtuinの一員であるSirt3がカロリー制限によるマウスの加齢性難聴の発症抑制に必須であることを明らかにした.Sirt3ノックアウトマウスの聴力測定を行ったところ,カロリー制限下において中年齢の野生型マウスはほぼ正常な聴力を示したが,同じ月齢のSirt3ノックアウトマウスでは中等度の難聴が出現した.また,これらマウスの蝸牛,脳,肝臓を摘出してDNA酸化損傷の程度を調べたところ,Sirt3ノックアウトマウスの組織ではDNA酸化損傷が野生型マウスの組織に比べ有意に高い結果が示された.さらに,カロリー制限下ではSirt3はイソクエン酸脱水酵素2を脱アセチル化することによりこれを活性化させ,その結果,NADPH値および還元型グルタチオンの酸化型グルタチオンに対する比率が増加することが明らかになった.ヒト腎臓細胞を用いた培養細胞実験では,Sirt3の過剰発現がNADPH値を増加させ酸化ストレス性の細胞死を抑制した.これらの結果から,カロリー制限による加齢性の蝸牛の細胞死および加齢性難聴の抑制にミトコンドリアに局在する哺乳類Sirtuinが重要な役割をはたすことが明らかになった.
はじめに
老人性難聴とは両側耳にほぼ対称に生じる老化にともなう進行的な感音性難聴であり,内耳の末梢感覚器である蝸牛の有毛細胞やラセン神経節細胞の障害がおもな原因である1).カロリー制限は哺乳類の老化を抑制する唯一確実な方法として知られており,その老化関連疾患の抑制や寿命延長の効果について数多くの報告がなされている2).これまでのマウスを用いた研究から,カロリー制限下では加齢による蝸牛のラセン神経節細胞の細胞死が有意に抑制され加齢性難聴の進行を遅延することが明らかとなっているが3),分子レベルでの加齢性難聴の抑制機構については不明である.脱アセチル化酵素であるSirtuinは酵母,線虫,ショウジョウバエにおいて重要な老化制御タンパク質としてはたらくことが多く報告されている4).しかしながら,哺乳類における抗老化および寿命延長への役割については不明である.この研究では,ミトコンドリアに局在し哺乳類Sirtuinの一員であるSirt3がカロリー制限によるマウスの加齢性難聴の発症の抑制に必須であることを示した.
1.Sirt3はカロリー制限による加齢性難聴の発症の抑制に必須である
カロリー制限による加齢性難聴の抑制の分子機構を明らかにするために,Sirt3ノックアウトマウスの聴力測定を行った.野生型マウスとSirt3ノックアウトマウスを生後2ヵ月齢から4群に分け,対照群に与える餌の総カロリーを25%減じた餌をカロリー制限群に与える餌とし,2月齢時および12月齢時に8 kHz,16 kHz,32 kHzでの聴力閾値を測定した.その結果,カロリー制限下において中年齢の野生型マウスはほぼ正常の聴力閾値を示したが,同じ月齢のSirt3ノックアウトマウスではすべての周波数において中等度の難聴が出現した(図1).また,蝸牛を摘出してその組織切片を光学顕微鏡下で観察したところ,カロリー制限された中年齢の野生型マウスに明らかな異常はなかったが,カロリー制限された同じ月齢のSirt3ノックアウトマウスではラセン神経節細胞および有毛細胞に著明な変性が観察された.以上の結果から,カロリー制限による加齢性難聴の発症の抑制にSirt3が必須であることが明らかになった.
2.Sirt3はカロリー制限による酸化ストレス性の細胞死の抑制に必須である
これまでの研究から,酸化ストレスは蝸牛において細胞障害あるいは細胞死をひき起こすと考えられている5).そこで,Sirt3ノックアウトマウスから蝸牛,大脳皮質,肝臓を摘出し,カロリー制限が酸化ストレス性の細胞死を抑制するかどうかを検討した.その結果,カロリー制限されたSirt3ノックアウトマウスのすべての組織において,核DNAの酸化ストレス障害が野生型マウスと比べ有意に高いという結果が示された.また,蝸牛の組織切片を光学顕微鏡下で観察したところ,カロリー制限されたSirt3ノックアウトマウスのラセン神経節細胞と有毛細胞の細胞数は,同じ月齢の野生型マウスと比べ有意に低いという結果が示された.以上の結果から,カロリー制限による酸化ストレス性の細胞死の抑制にSirt3が必須であることが明らかになった.
3.Sirt3はカロリー制限下においてグルタチオンの抗酸化防御機能を強化する
グルタチオンはミトコンドリアにおいて活性酸素種を消去する主要な抗酸化物質であり,還元型グルタチオンの酸化型グルタチオンに対する比率は細胞内の酸化ストレスの主要なマーカーと考えられている6).そこで,Sirt3ノックアウトマウスから内耳,大脳皮質,肝臓を摘出してミトコンドリアを抽出し,カロリー制限がミトコンドリアにおけるグルタチオンの抗酸化防御機能を強化するかどうかを検討した.その結果,カロリー制限された野生型マウスのすべての組織における還元型グルタチオンの酸化型グルタチオンに対する比率の増加が示されたが,カロリー制限されたSirt3ノックアウトマウスの組織において変化は示されなかった.以上の結果から,Sirt3はカロリー制限下においてミトコンドリアにおけるグルタチオンの抗酸化防御機能を強化することが明らかになった.
4.Sirt3はカロリー制限下においてイソクエン酸脱水酵素2を活性化しNADPH値を増加させる
グルタチオンはNADPH依存性グルタチオン還元酵素により酸化型から還元型へと変換され7),NADPHはミトコンドリアに局在するNADP+依存性のイソクエン酸脱水酵素2により合成される8).そこで,カロリー制限下においてSirt3がイソクエン酸脱水酵素2を活性化してNADPH値を増加させるかどうかを検討した.カロリー制限されたマウスの内耳,大脳皮質,肝臓を摘出してミトコンドリアを抽出しイソクエン酸脱水酵素2の活性を測定したところ,野生型マウスのすべての組織においてカロリー制限によるイソクエン酸脱水酵素2活性の増加が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による増加は示されなかった.つぎに,NADPH値を調べたところ,野生型マウスのすべての組織においてカロリー制限によるNADPH値の増加が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による増加は示されなかった.さらに,肝臓におけるイソクエン酸脱水酵素2のアセチル化を調べたところ,野生型マウスの組織においてはカロリー制限によるアセチル化の著明な低下が示されたが,Sirt3ノックアウトマウスの組織においてはカロリー制限による変化は示されなかった.また,カロリー制限によりSirt3のタンパク質値が増加することもウェスタンブロットにより確認された.以上の結果を総合した結果,Sirt3はカロリー制限下において内耳,大脳皮質,肝臓のミトコンドリアにおいてイソクエン酸脱水酵素2を活性化しNADPH値を増加させることが明らかになった.
5.Sirt3の過剰発現はNADPH値を増加させ酸化ストレス性の細胞死を抑制する
つぎに,ヒト腎臓に由来する培養細胞においてSirt3あるいはイソクエン酸脱水酵素2を過剰発現させ,NADPH値への影響を検討した.その結果,Sirt3あるいはイソクエン酸脱水酵素2の過剰発現は細胞内NADPH値を増加させることが明らかとなった.また,Sirt3あるいはイソクエン酸脱水酵素2の過剰発現は酸化ストレス性の細胞死を抑制することが明らかになった.以上の結果から,Sirt3の過剰発現はNADPH値を増加させ酸化ストレス性の細胞死を抑制することが明らかになった.
おわりに
以上の結果をもとに,カロリー制限による老人性難聴の抑制の分子機構を提案した(図2).カロリー制限により活性化されたSirt3がイソクエン酸脱水酵素2を活性化することでNADPH値を増加させる.つぎに,NADPH依存性のグルタチオン還元酵素が活性化され,還元型グルタチオンの酸化型グルタチオンに対する比率が増加することで活性酸素種の濃度が低下する.その結果,蝸牛の細胞死が抑制され加齢性難聴の進行が遅延する.現在,わが国では5人に1人が65歳以上の高齢者であり,2040年には3人に1人が高齢者となると予測されている9).この高齢者人口の増加にともない老人性難聴の患者人口の大幅な増加も予測される.今回の研究成果が老人性難聴の予防法あるいは治療法の確立に役立つものと期待したい.
文 献
- Liu, X. Z., & Yan, D.: Ageing and hearing loss. J. Pathol., 211, 188-197 (2007)[PubMed]
- Sohal, R. S. & Weindruch, R.: Oxidative stress, caloric restriction, and aging. Science, 273, 59-63 (1996)[PubMed]
- Someya, S., Yamasoba, T., Weindruch, R. et al.: Caloric restriction suppresses apoptotic cell death in the mammalian cochlea and leads to prevention of presbycusis. Neurobiol. Aging, 28, 1613-1622 (2007)[PubMed]
- Finkel, T., Deng, C. X. & Mostoslavsky, R.: Recent progress in the biology and physiology of sirtuins. Nature, 460, 587-591 (2009)[PubMed]
- Someya, S., Xu, J., Kondo, K. et al.: Age-related hearing loss in C57BL/6J mice is mediated by Bak-dependent mitochondrial apoptosis. Proc. Natl. Acad. Sci. USA, 106, 19432-19437 (2009)[PubMed]
- Rebrin, I., Kamzalov, S. & Sohal, R. S.: Effects of age and caloric restriction on glutathione redox state in mice. Free. Radic. Biol. Med., 35, 626-635 (2003)[PubMed]
- Mari, M., Morales, A., Colell, A. et al.: Mitochondrial glutathione, a key survival antioxidant. Antioxid. Redox. Signal., 11, 2685-2700 (2009)[PubMed]
- Jo, S. H., Son, M. K., Koh, H. J. et al.: Control of mitochondrial redox balance and cellular defense against oxidative damage by mitochondrial NADP+-dependent isocitrate dehydrogenase. J. Biol. Chem., 276, 16168-16176 (2001)[PubMed]
- Yamasoba, T., Someya, S., Yamada, C. et al.: Role of mitochondrial dysfunction and mitochondrial DNA mutations in age-related hearing loss. Hear. Res., 226, 185-193 (2007)[PubMed]
著者プロフィール
略歴:2005年 東京大学大学院農学生命科学研究科博士課程 修了,同年 同 特任助手(特任助教)を経て,米国Wisconsin大学Madison校 特別研究員.
研究テーマ:内耳老化および加齢性難聴の分子機構,カロリー制限による加齢性難聴の抑制の分子機構の解明.
© 2010 染谷 慎一 Licensed under CC 表示 2.1 日本