ヒトの多能性幹細胞からの造血幹細胞および造血前駆細胞の分化
杉村 竜一
(米国Harvard Medical School,Department of Biological Chemistry and Molecular Pharmacology)
email:杉村竜一
DOI: 10.7875/first.author.2017.042
Haematopoietic stem and progenitor cells from human pluripotent stem cells.
Ryohichi Sugimura, Deepak Kumar Jha, Areum Han, Clara Soria-Valles, Edroaldo Lummertz da Rocha, Yi-Fen Lu, Jeremy A. Goettel, Erik Serrao, R. Grant Rowe, Mohan Malleshaiah, Irene Wong, Patricia Sousa, Ted N. Zhu, Andrea Ditadi, Gordon Keller, Alan N. Engelman, Scott B. Snapper, Sergei Doulatov, George Q. Daley
Nature, 545, 432-438 (2017)
多能性幹細胞からさまざまな種の細胞を分化させるには,モルフォゲンへの段階的な曝露により胚の発生を模倣する,あるいは,マスター転写因子を強制的に発現させるといったアプローチがとられてきた.この研究においては,ヒトの機能的な造血幹細胞を得るため,ヒトの多能性幹細胞を造血性内皮細胞へと分化させ,さらに,造血を促進する能力をもつ26の候補となる転写因子をスクリーニングしこれを発現させた.その結果,造血性内皮細胞をマウスにおいて骨髄球,B細胞,T細胞に分化の可能な造血幹細胞および造血前駆細胞へと分化させるのに十分な7つの転写因子,ERG,HOXA5,HOXA9,HOXA10,LCOR,RUNX1,SPI1が同定された.モルフォゲンによる分化の駆動およびマスター転写因子による細胞運命の変換を組み合わせたこのアプローチは,ヒトの多能性幹細胞から造血幹細胞および造血前駆細胞を分化させ,ヒト化マウスにおける造血性の疾患のモデル化,および,遺伝的な血液疾患における治療の戦略を促進すると考えられる.
細胞のアイデンティティは転写因子により制御される遺伝子発現制御ネットワークにより定義される.造血遺伝子の発現制御ネットワークを駆動するマスター転写因子を導入することにより,線維芽細胞,内皮細胞,分化した血液細胞など,多様な細胞から造血幹細胞が分化されてきた1-3).しかし,ヒトの多能性幹細胞からのマウスに生着する能力のある造血幹細胞の分化はこれまで報告されていない.以前に,筆者らは,ヒトの多能性幹細胞から造血性内皮細胞を分化させたが4),そこに造血幹細胞に特異的な転写因子を導入することにより,マウスに生着する能力のある造血幹細胞を分化させることができると考えた.
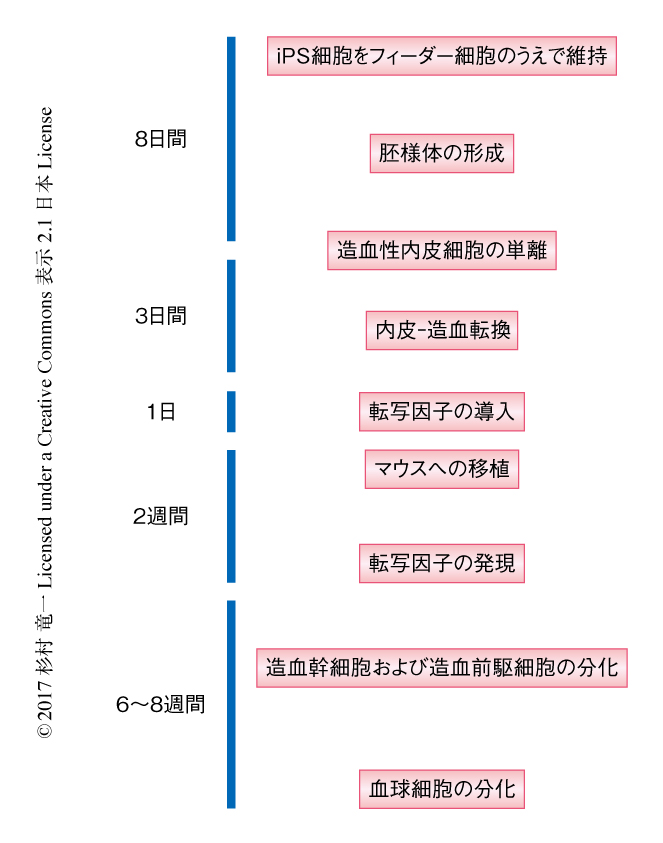
胎児の肝臓のもつ造血幹細胞と造血性の内皮細胞とのあいだで遺伝子の発現を比較することにより得られた転写因子にくわえ,内皮細胞,骨髄細胞,リンパ球から造血前駆細胞を分化させるために使用された26の転写因子を組み合わせたライブラリーを作製した.このライブラリーを発現させた造血性の内皮細胞を免疫不全マウスに移植したところ,移植ののち最長で12週間にわたり,ヒトの血球がマウスの血中にて観察された.さらに,移植マウスの骨髄および胸腺を解析したところ,ヒトの赤血球系細胞,骨髄系細胞,B細胞,T細胞が検出された.とくに,形質導入された造血性の内皮細胞を片側の大腿骨に注射したところ,両側の大腿骨において同等のヒトの造血生着が観察されたことから,造血幹細胞の移動およびホーミングによる対側の大腿骨の再形成が示された.分化したヒトの骨髄球細胞,B細胞,T細胞においてライブラリーを構成する26の転写因子のうちどの転写因子が発現しているかをPCR法により解析した.その結果,ERG,HOXA5,HOXA9,HOXA10,LCOR,RUNX1,SPI1の7つの転写因子が一貫して検出された.この7つの転写因子を造血性の内皮細胞に発現させマウスに移植したところ,造血幹細胞が分化した(図1).
同定された7つの転写因子を発現させた造血性の内皮細胞をマウスに移植し,8週目および12週目に多系統の生着を示したマウスから2次宿主となるマウスに骨髄を移植したところ,複数のマウスにおいて8週目,14週目,16週目に多系列の生着が確認された.初代マウスの骨髄から単離された3000個のCD34陽性細胞を注射した2次宿主マウス10匹のうち,独立した実験において3匹が多系統の再構成を示した.造血幹細胞の分化の頻度を計算したところ,10,093細胞のうち1細胞であった.同定された転写因子の2次移植マウスにおけるうちわけを決定するため,2匹の2次宿主マウスの骨髄球,B細胞,T細胞をPCR法により解析したところ,共通してLCOR,HOXA5,HOXA9,RUNX1が検出され,ERGは骨髄球およびB細胞のみに認められたが,SPI1およびHOXA10は検出されなかった.LCOR,HOXA5,HOXA9,RUNX1,ERGの5つの転写因子が多系統の生着を付与するのに十分であるかどうかを調べるため,2種のポリシストロニックなレンチウイルスベクターを作製して5つの転写因子を発現させたところ,複数の宿主マウスにおいて赤血球,好中球,B細胞,T細胞が検出された.
7つの転写因子を発現させた造血性の内皮細胞が造血幹細胞に固有の遺伝子発現プログラムを再現する程度を調べるため,移植ののち12週目に骨髄から採取した造血幹細胞の集団においてRNA配列を決定し,造血幹細胞および造血前駆細胞の利用可能なデータセットと比較したところ,造血幹細胞と強く相関した.遺伝子の発現パターンは,ケモカイン受容体シグナル伝達およびインテグリンシグナル伝達,造血幹細胞のホーミングおよび生着に影響することが知られている経路の活性化と相関した.さらに,7つの転写因子を発現させた造血性の内皮細胞におけるHOXA5,HOXA9,HOXA10,SPI1の導入遺伝子の発現レベルは,造血幹細胞における発現レベルと同等であった.臍帯血を移植したマウスから得られた造血幹細胞と7つの転写因子を発現させた造血性の内皮細胞との異種性について調べるため,それぞれの単一の細胞においてRNA配列を決定した.もっとも可変性の500の遺伝子を比較したところ明確な差があったが,62個の標準的な造血遺伝子に限定した場合には相同性のあることがわかった.これらの結果から全体として,7つの転写因子を発現させた造血性の内皮細胞は多系列の造血生着をサポートする遺伝子発現パターンをもつが,臍帯血を移植したマウスから得られた造血幹細胞とは分子的な相違点も大きいことが示された.
7つの転写因子を発現させた造血性の内皮細胞を移植したマウスから回収された赤血球系細胞,骨髄系細胞,リンパ系細胞の表現型および機能的な特性を,臍帯血を移植したマウスから得られた造血幹細胞に由来する細胞と比較した.その結果,赤血球の形成に重要なグロビン遺伝子の発現パターンの切り替えおよび脱核が認められる発達の成熟を示した.移植マウスの骨髄からヒトの好中球を単離しホルボールミリステートアセテートにより刺激したところ,ミエロペルオキシダーゼの産生を示した.移植マウスの血清において免疫グロブリンクラススイッチおよび抗体の分泌を媒介するT細胞およびB細胞の協同的な活性を示すヒトの免疫グロブリンMおよび免疫グロブリンGが検出された.さらに,外来のアルブミンタンパク質を接種したところ特異的な免疫グロブリンMおよび免疫グロブリンGのレベルが上昇し,タンパク質抗原に対する機能的な免疫応答が示された.移植マウスの骨髄から成熟したCD3陽性T細胞を単離し,ホルボールミリステートアセテートにより再刺激したところインターフェロンγの産生がみられた.
抗原に特異的な多様なT細胞はおもにTCRA遺伝子およびTCRB遺伝子のもつ可変遺伝子セグメントCDR3の組換えにより起こるTCR遺伝子の再編成により形成される.T細胞の多様性を決定するため,移植マウスから単離されたT細胞においてTCRB遺伝子のCDR3の配列をプロファイリングしたところ,臍帯血を移植したマウスあるいは7つの転写因子を発現させた造血性の内皮細胞を移植したマウスから単離されたT細胞の可変遺伝子セグメントにおいて組合せの高度の多様性がみられた.さらに,7つの転写因子を発現させた造血性の内皮細胞を移植した脾細胞は,ヒトのB細胞,ナイーブT細胞,メモリーT細胞を保持していた.レンチウイルスの組み込み部位の配列を比較することにより,7つの転写因子を発現させた造血性の内皮細胞の骨髄系の子孫細胞およびリンパ系の子孫細胞がクローン起源であるかどうかを決定した.骨髄に由来する骨髄球,B細胞,T細胞においてゲノムDNAの配列を決定したところ,同定されたすべての組み込み部位において骨髄球,B細胞,T細胞に共通する配列は合計の10%をしめ,個々の宿主において見い出された.このことから,少なくとも部分的に多系統の可能性をもつ単一クローン性の造血幹細胞が得られたことが示された.組み込み部位の近傍の遺伝子はいずれも,以前のHIVの研究においてがん化とは関連していなかった.
マウスのES細胞が世界ではじめて作製されたときから,造血幹細胞の分化は血液学の研究において長年の目標であった.ヒトの多能性幹細胞の造血性の内皮細胞への段階的な分化につづく,造血遺伝子の発現制御ネットワークを駆動するマスター転写因子のスクリーニングにより7つの転写因子が同定された.今回の研究において見い出された方法により分化させた細胞と造血幹細胞とのあいだにはまだ分子的および機能的なギャップがあり,その改善が今後の課題である.同定された転写因子おのおのは造血幹細胞の発生,長期にわたる維持,分化の系譜の決定において役割をはたし,それぞれがある程度の重複性をもつ共通の遺伝子制御ネットワークに寄与することが示唆された.
今回の研究により,ヒトの多能性幹細胞からの造血幹細胞の分化の実現が実際に近いことが示唆された.そのような細胞は,遺伝性の血液疾患の患者に由来した場合にはヒトの血液疾患をモデル化するため,および,ドラッグスクリーンや遺伝子治療のためのマイルストーンとなるだろう.筆者らの最終的な目標は,研究と治療における応用のために,ウイルスベクターを用いない手法により造血幹細胞を分化させることである.
略歴:2012年 米国Stowers Institute for Medical ResearchにてPh.D取得,2014年より米国Harvard Medical School博士研究員.
関心事:基礎科学の発見を臨床につなげたいと思い大学院に留学し,その接点として,臨床的に重要かつ基礎研究のモデルとして確立された造血幹細胞および造血前駆細胞を研究の対象として選択しました.大学院では造血幹細胞および造血前駆細胞を維持する骨髄の微小環境因子について研究し,ポスドクでは発生の過程を参考にすることにより多能性幹細胞から造血幹細胞および造血前駆細胞を分化させる方法を開発しました.つぎのステップは,これらの経験を組み合わせて人工骨髄を作製することです.
© 2017 杉村 竜一 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Biological Chemistry and Molecular Pharmacology)
email:杉村竜一
DOI: 10.7875/first.author.2017.042
Haematopoietic stem and progenitor cells from human pluripotent stem cells.
Ryohichi Sugimura, Deepak Kumar Jha, Areum Han, Clara Soria-Valles, Edroaldo Lummertz da Rocha, Yi-Fen Lu, Jeremy A. Goettel, Erik Serrao, R. Grant Rowe, Mohan Malleshaiah, Irene Wong, Patricia Sousa, Ted N. Zhu, Andrea Ditadi, Gordon Keller, Alan N. Engelman, Scott B. Snapper, Sergei Doulatov, George Q. Daley
Nature, 545, 432-438 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
モルフォゲン, ERG(P11308), HOXA5(P20719), HOXA9(P31269), HOXA10(P31260), LCOR(Q96JN0), RUNX1(Q01196), SPI1(P17947), CD34(Q64314), ケモカイン受容体, インテグリン, グロビン, ミエロペルオキシダーゼ(P05164), 免疫グロブリン, 免疫グロブリンM, 免疫グロブリンG, アルブミン, CD3, インターフェロンγ(P01580), TCRA(P01849), TCRB, TCR
要 約
多能性幹細胞からさまざまな種の細胞を分化させるには,モルフォゲンへの段階的な曝露により胚の発生を模倣する,あるいは,マスター転写因子を強制的に発現させるといったアプローチがとられてきた.この研究においては,ヒトの機能的な造血幹細胞を得るため,ヒトの多能性幹細胞を造血性内皮細胞へと分化させ,さらに,造血を促進する能力をもつ26の候補となる転写因子をスクリーニングしこれを発現させた.その結果,造血性内皮細胞をマウスにおいて骨髄球,B細胞,T細胞に分化の可能な造血幹細胞および造血前駆細胞へと分化させるのに十分な7つの転写因子,ERG,HOXA5,HOXA9,HOXA10,LCOR,RUNX1,SPI1が同定された.モルフォゲンによる分化の駆動およびマスター転写因子による細胞運命の変換を組み合わせたこのアプローチは,ヒトの多能性幹細胞から造血幹細胞および造血前駆細胞を分化させ,ヒト化マウスにおける造血性の疾患のモデル化,および,遺伝的な血液疾患における治療の戦略を促進すると考えられる.
はじめに
細胞のアイデンティティは転写因子により制御される遺伝子発現制御ネットワークにより定義される.造血遺伝子の発現制御ネットワークを駆動するマスター転写因子を導入することにより,線維芽細胞,内皮細胞,分化した血液細胞など,多様な細胞から造血幹細胞が分化されてきた1-3).しかし,ヒトの多能性幹細胞からのマウスに生着する能力のある造血幹細胞の分化はこれまで報告されていない.以前に,筆者らは,ヒトの多能性幹細胞から造血性内皮細胞を分化させたが4),そこに造血幹細胞に特異的な転写因子を導入することにより,マウスに生着する能力のある造血幹細胞を分化させることができると考えた.
1.造血性内皮細胞を造血幹細胞および造血前駆細胞へと分化させる転写因子の同定
胎児の肝臓のもつ造血幹細胞と造血性の内皮細胞とのあいだで遺伝子の発現を比較することにより得られた転写因子にくわえ,内皮細胞,骨髄細胞,リンパ球から造血前駆細胞を分化させるために使用された26の転写因子を組み合わせたライブラリーを作製した.このライブラリーを発現させた造血性の内皮細胞を免疫不全マウスに移植したところ,移植ののち最長で12週間にわたり,ヒトの血球がマウスの血中にて観察された.さらに,移植マウスの骨髄および胸腺を解析したところ,ヒトの赤血球系細胞,骨髄系細胞,B細胞,T細胞が検出された.とくに,形質導入された造血性の内皮細胞を片側の大腿骨に注射したところ,両側の大腿骨において同等のヒトの造血生着が観察されたことから,造血幹細胞の移動およびホーミングによる対側の大腿骨の再形成が示された.分化したヒトの骨髄球細胞,B細胞,T細胞においてライブラリーを構成する26の転写因子のうちどの転写因子が発現しているかをPCR法により解析した.その結果,ERG,HOXA5,HOXA9,HOXA10,LCOR,RUNX1,SPI1の7つの転写因子が一貫して検出された.この7つの転写因子を造血性の内皮細胞に発現させマウスに移植したところ,造血幹細胞が分化した(図1).
2.7つの転写因子は多系統の生着をあたえる
同定された7つの転写因子を発現させた造血性の内皮細胞をマウスに移植し,8週目および12週目に多系統の生着を示したマウスから2次宿主となるマウスに骨髄を移植したところ,複数のマウスにおいて8週目,14週目,16週目に多系列の生着が確認された.初代マウスの骨髄から単離された3000個のCD34陽性細胞を注射した2次宿主マウス10匹のうち,独立した実験において3匹が多系統の再構成を示した.造血幹細胞の分化の頻度を計算したところ,10,093細胞のうち1細胞であった.同定された転写因子の2次移植マウスにおけるうちわけを決定するため,2匹の2次宿主マウスの骨髄球,B細胞,T細胞をPCR法により解析したところ,共通してLCOR,HOXA5,HOXA9,RUNX1が検出され,ERGは骨髄球およびB細胞のみに認められたが,SPI1およびHOXA10は検出されなかった.LCOR,HOXA5,HOXA9,RUNX1,ERGの5つの転写因子が多系統の生着を付与するのに十分であるかどうかを調べるため,2種のポリシストロニックなレンチウイルスベクターを作製して5つの転写因子を発現させたところ,複数の宿主マウスにおいて赤血球,好中球,B細胞,T細胞が検出された.
7つの転写因子を発現させた造血性の内皮細胞が造血幹細胞に固有の遺伝子発現プログラムを再現する程度を調べるため,移植ののち12週目に骨髄から採取した造血幹細胞の集団においてRNA配列を決定し,造血幹細胞および造血前駆細胞の利用可能なデータセットと比較したところ,造血幹細胞と強く相関した.遺伝子の発現パターンは,ケモカイン受容体シグナル伝達およびインテグリンシグナル伝達,造血幹細胞のホーミングおよび生着に影響することが知られている経路の活性化と相関した.さらに,7つの転写因子を発現させた造血性の内皮細胞におけるHOXA5,HOXA9,HOXA10,SPI1の導入遺伝子の発現レベルは,造血幹細胞における発現レベルと同等であった.臍帯血を移植したマウスから得られた造血幹細胞と7つの転写因子を発現させた造血性の内皮細胞との異種性について調べるため,それぞれの単一の細胞においてRNA配列を決定した.もっとも可変性の500の遺伝子を比較したところ明確な差があったが,62個の標準的な造血遺伝子に限定した場合には相同性のあることがわかった.これらの結果から全体として,7つの転写因子を発現させた造血性の内皮細胞は多系列の造血生着をサポートする遺伝子発現パターンをもつが,臍帯血を移植したマウスから得られた造血幹細胞とは分子的な相違点も大きいことが示された.
3.移植マウスにおいて分化した細胞の特徴
7つの転写因子を発現させた造血性の内皮細胞を移植したマウスから回収された赤血球系細胞,骨髄系細胞,リンパ系細胞の表現型および機能的な特性を,臍帯血を移植したマウスから得られた造血幹細胞に由来する細胞と比較した.その結果,赤血球の形成に重要なグロビン遺伝子の発現パターンの切り替えおよび脱核が認められる発達の成熟を示した.移植マウスの骨髄からヒトの好中球を単離しホルボールミリステートアセテートにより刺激したところ,ミエロペルオキシダーゼの産生を示した.移植マウスの血清において免疫グロブリンクラススイッチおよび抗体の分泌を媒介するT細胞およびB細胞の協同的な活性を示すヒトの免疫グロブリンMおよび免疫グロブリンGが検出された.さらに,外来のアルブミンタンパク質を接種したところ特異的な免疫グロブリンMおよび免疫グロブリンGのレベルが上昇し,タンパク質抗原に対する機能的な免疫応答が示された.移植マウスの骨髄から成熟したCD3陽性T細胞を単離し,ホルボールミリステートアセテートにより再刺激したところインターフェロンγの産生がみられた.
抗原に特異的な多様なT細胞はおもにTCRA遺伝子およびTCRB遺伝子のもつ可変遺伝子セグメントCDR3の組換えにより起こるTCR遺伝子の再編成により形成される.T細胞の多様性を決定するため,移植マウスから単離されたT細胞においてTCRB遺伝子のCDR3の配列をプロファイリングしたところ,臍帯血を移植したマウスあるいは7つの転写因子を発現させた造血性の内皮細胞を移植したマウスから単離されたT細胞の可変遺伝子セグメントにおいて組合せの高度の多様性がみられた.さらに,7つの転写因子を発現させた造血性の内皮細胞を移植した脾細胞は,ヒトのB細胞,ナイーブT細胞,メモリーT細胞を保持していた.レンチウイルスの組み込み部位の配列を比較することにより,7つの転写因子を発現させた造血性の内皮細胞の骨髄系の子孫細胞およびリンパ系の子孫細胞がクローン起源であるかどうかを決定した.骨髄に由来する骨髄球,B細胞,T細胞においてゲノムDNAの配列を決定したところ,同定されたすべての組み込み部位において骨髄球,B細胞,T細胞に共通する配列は合計の10%をしめ,個々の宿主において見い出された.このことから,少なくとも部分的に多系統の可能性をもつ単一クローン性の造血幹細胞が得られたことが示された.組み込み部位の近傍の遺伝子はいずれも,以前のHIVの研究においてがん化とは関連していなかった.
おわりに
マウスのES細胞が世界ではじめて作製されたときから,造血幹細胞の分化は血液学の研究において長年の目標であった.ヒトの多能性幹細胞の造血性の内皮細胞への段階的な分化につづく,造血遺伝子の発現制御ネットワークを駆動するマスター転写因子のスクリーニングにより7つの転写因子が同定された.今回の研究において見い出された方法により分化させた細胞と造血幹細胞とのあいだにはまだ分子的および機能的なギャップがあり,その改善が今後の課題である.同定された転写因子おのおのは造血幹細胞の発生,長期にわたる維持,分化の系譜の決定において役割をはたし,それぞれがある程度の重複性をもつ共通の遺伝子制御ネットワークに寄与することが示唆された.
今回の研究により,ヒトの多能性幹細胞からの造血幹細胞の分化の実現が実際に近いことが示唆された.そのような細胞は,遺伝性の血液疾患の患者に由来した場合にはヒトの血液疾患をモデル化するため,および,ドラッグスクリーンや遺伝子治療のためのマイルストーンとなるだろう.筆者らの最終的な目標は,研究と治療における応用のために,ウイルスベクターを用いない手法により造血幹細胞を分化させることである.
文 献
- Pereira, C. F., Chang, B., Qiu, J. et al.: Induction of a hemogenic program in mouse fibroblasts. Cell Stem Cell, 13, 205-218 (2013)[PubMed]
- Sandler, V. M., Lis, R., Liu, Y. et al.: Reprogramming human endothelial cells to haematopoietic cells requires vascular induction. Nature, 511, 312-318 (2014)[PubMed]
- Riddell, J., Gazit, R., Garrison, B. S. et al.: Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell, 157, 549-564 (2014)[PubMed]
- Kennedy, M., Awong, G., Sturgeon, C. M. et al.: T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Rep., 2, 1722-1735 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 米国Stowers Institute for Medical ResearchにてPh.D取得,2014年より米国Harvard Medical School博士研究員.
関心事:基礎科学の発見を臨床につなげたいと思い大学院に留学し,その接点として,臨床的に重要かつ基礎研究のモデルとして確立された造血幹細胞および造血前駆細胞を研究の対象として選択しました.大学院では造血幹細胞および造血前駆細胞を維持する骨髄の微小環境因子について研究し,ポスドクでは発生の過程を参考にすることにより多能性幹細胞から造血幹細胞および造血前駆細胞を分化させる方法を開発しました.つぎのステップは,これらの経験を組み合わせて人工骨髄を作製することです.
© 2017 杉村 竜一 Licensed under CC 表示 2.1 日本