正常な上皮細胞はがん変異細胞にWarburg効果様の代謝の変化をひき起こし上皮層から排除する
昆 俊亮・藤田恭之
(北海道大学遺伝子病制御研究所 分子腫瘍分野)
email:昆 俊亮
DOI: 10.7875/first.author.2017.036
Cell competition with normal epithelial cells promotes apical extrusion of transformed cells through metabolic changes.
Shunsuke Kon, Kojiro Ishibashi, Hiroto Katoh, Sho Kitamoto, Takanobu Shirai, Shinya Tanaka, Mihoko Kajita, Susumu Ishikawa, Hajime Yamauchi, Yuta Yako, Tomoko Kamasaki, Tomohiro Matsumoto, Hirotaka Watanabe, Riku Egami, Ayana Sasaki, Atsuko Nishikawa, Ikumi Kameda, Takeshi Maruyama, Rika Narumi, Tomoko Morita, Yoshiteru Sasaki, Ryosuke Enoki, Sato Honma, Hiromi Imamura, Masanobu Oshima, Tomoyoshi Soga, Jun-ichi Miyazaki, Michael R. Duchen, Jin-Min Nam, Yasuhito Onodera, Shingo Yoshioka, Junichi Kikuta, Masaru Ishii, Masamichi Imajo, Eisuke Nishida, Yoichiro Fujioka, Yusuke Ohba, Toshiro Sato, Yasuyuki Fujita
Nature Cell Biology, 19, 530-541 (2017)
近年の研究により,異なる性質をもつ細胞のあいだには多彩な競合の生じることが明らかにされた.細胞競合と名づけられたこの現象は,生体のさまざまな生理的あるいは病理的な過程において生じる.とくに,がんの超初期の段階においては,正常な上皮細胞と新たに生じたがん変異細胞とのあいだに細胞競合が生じ,がん変異細胞が上皮層から排除されることが示され,その機能的な意義および臨床応用への可能性が注目されている.しかしながら,細胞競合の分子機構についてはほとんどわかっていない.今回,筆者らは,正常な上皮細胞にかこまれたがん変異細胞にWarburg効果様の代謝の変化が生じ,上皮層から排除されることを明らかにした.さらには,細胞競合マウスモデルの解析により,生体においても同様の機構によりがん変異細胞は排除されることが明らかにされた.これらの結果より,がんの超初期の段階において,隣接する正常な細胞によりがん変異細胞にWarburg効果様の代謝の変化がひき起こされ組織から排除されることが示された.
生態系を構成する多様な生物はかぎられた生息域において互いに生存をかけて争い,その結果,競合による適者生存の起こることは広く知られている.一方,個体を構成する細胞の社会においても,異なる性質をもつ細胞が共在するときそれらが生存を争う結果,一方が生存し勝者となり他方が組織から排除され敗者となる“細胞競合”(cell competition)という現象が起こる.細胞競合の現象それ自体は,古くは1975年にショウジョウバエの成虫原基においてはじめて報告されたが1),最近の研究により,哺乳類においてもさまざまな生理的あるいは病理的な過程において細胞競合の起こることが明らかにされた2,3).細胞競合は個体にそなわる基本的な生命現象のひとつと考えられており,潜在的に危険であったり環境に適応していなかったりする細胞を組織から排除することにより生体における恒常性の維持に寄与する.その一例として,筆者らの研究グループは,正常な上皮層に対してRas遺伝子変異やSrc遺伝子変異などのがん原性変異を少数の細胞に起こすと,これらのがん変異細胞と正常な細胞との細胞競合の結果,がん変異細胞は上皮層の管腔の側へ押し出されるように排除されることを見い出した4,5).このことから,上皮層にがん変異細胞が生じたとき,正常な上皮細胞は隣接するがん変異細胞を認識して積極的に排除するという,免疫系を介さない抗腫瘍能(epithelial defense against cancer:EDAC)を担うことが明らかにされた6).しかしながら,この正常な上皮細胞のもつ抗腫瘍能によるがん変異細胞の排除の機構についてはいまだ不明な点が多く,この動的な現象を制御する代謝の機構に着目した.
ミトコンドリア内膜の膜電位に依存してミトコンドリアに集積するTMRMを用いてミトコンドリアの活性を評価したところ,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてTMRMのシグナルが顕著に低下していた.ミトコンドリアに由来するスーパーオキシドアニオンを検出するmitoSOXのシグナルも同様に低下していたことから,正常な細胞にかこまれたがん変異細胞においてミトコンドリアの活性が低下することが示唆された.さらに,ミトコンドリア内膜の膜電位に非依存的にミトコンドリアに集積するMitotracker GreenとTMRMを共染色しそのシグナルの比を測定したところ,正常な細胞にかこまれたがん変異細胞においてはTMRMのシグナルとMitrotracker Greenのシグナルの比が単独にて培養したときと比べ有意に低下したことから,ミトコンドリアには量的な変化ではなく質的な変化の起こることがわかった.また,電子顕微鏡による解析の結果,マイトファゴソーム様の構造が増加していたことから,ミトコンドリアの機能の低下にともないマイトファジーが誘導されることが推察された.
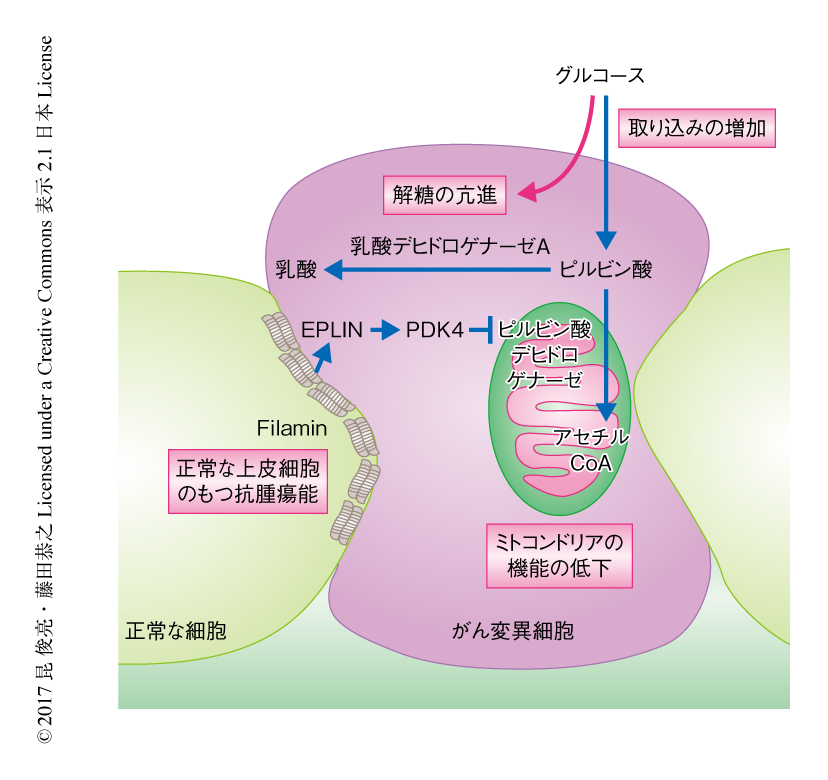
解糖系の代謝経路について評価したところ,正常な細胞と共培養したRas遺伝子変異をもつ細胞においてグルコースの取り込みおよび乳酸デヒドロゲナーゼAの発現が亢進しており,乳酸の産生量が単独にて培養したときと比べて有意に増加していた.これらのデータから,正常な細胞にかこまれたがん変異細胞においてミトコンドリア内膜の膜電位が低下し好気的な解糖が亢進する,すなわち,Warburg効果様の代謝の変化がひき起こされることが示された.
さまざまな代謝関連酵素の発現量を解析した結果,TCA回路へのゲートキーパーであるピルビン酸デヒドロゲナーゼをリン酸化しその活性を阻害するPDK4の発現が有意に上昇していた.実際に,正常な細胞にかこまれたがん変異細胞においてピルビン酸デヒドロゲナーゼのリン酸化が顕著に亢進していた.そこで,CRISPR-Cas9系を用いたゲノム編集によりRas遺伝子変異をもつ細胞においてPDK4を欠損させた細胞株を樹立し,正常な細胞と共培養したところ,ピルビン酸デヒドロゲナーゼのリン酸化は減少しミトコンドリアの機能が回復した.さらに,がん変異細胞の管腔の側への排除はいちじるしく阻害され,基底膜の側において仮足様の構造を形成する細胞が増加した.また,正常な細胞にかこまれたPDK4欠損Ras遺伝子変異細胞において乳酸デヒドロゲナーゼAの発現が亢進しなかったことから,ミトコンドリアの機能の低下が2次的に解糖系を亢進させることが示唆された.また,PDKの阻害剤であり米国では抗がん剤として臨床試験が進められているジクロロ酢酸を添加した際にもPDK4の欠損と同様の効果が認められた.これらの結果より,PDK4が細胞非自律的なミトコンドリアの機能の低下における責任タンパク質のひとつであること,また,ミトコンドリアの機能の低下ががん変異細胞の排除に必要であることがわかった.
がん変異細胞にかこまれた正常な上皮細胞は,細胞骨格に関連するタンパク質であるFilaminを集積させることによりがん変異細胞を上皮層から排除する6).また,正常な上皮細胞はがん変異細胞におけるEPLINの集積を促進することによりがん変異細胞を排除することもわかっている7).そこで,Filaminをノックダウンした,すなわち,正常な上皮細胞のもつ抗腫瘍能が不全である細胞とRas遺伝子変異をもつ細胞とを共培養したところ,がん変異細胞においてミトコンドリア内膜の膜電位は低下せず,また,がん変異細胞は上皮層より排除されなかった.また,EPLINをノックダウンしたがん変異細胞においても同様に,細胞非自律的なミトコンドリア内膜の膜電位の低下は起こらず,さらに,PDK4の発現も亢進しなかった.これらの結果より,正常な上皮細胞はFilamin→EPLIN→PDK4という経路を介して隣接するがん変異細胞にWarburg効果様の代謝の変化をひき起こし上皮層から排除することがわかった(図1).
細胞においてグルコースの量を検出するFRETプローブにより,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてグルコースの量が低下することがわかった.さきに述べたように,グルコースの取り込みは亢進していることからグルコースは解糖系により精力的に代謝されていることが推察された.そこで,FRETプローブであるATeam 8) を用いて細胞におけるATPの量を検討したところ,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてATPは増加することがわかった.このことから,がん変異細胞が上皮層から排除されるために必要なエネルギーはWarburg効果様の代謝の変化により産生される可能性が示唆された.解糖系によるATPの合成は呼吸鎖の酸化的リン酸化反応より約100倍も速いため9),局時的に過剰のATPを産生することががん変異細胞の上皮層からの排除に必要なのかもしれない.
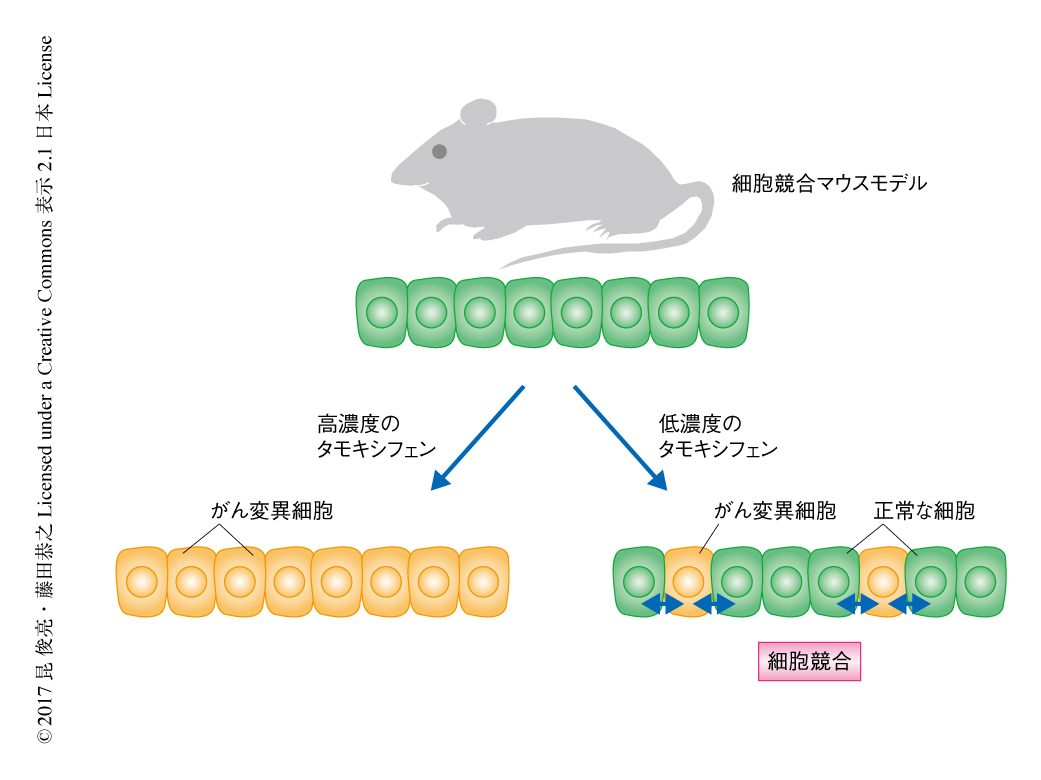
Warburg効果様の代謝の変化の制御によるがん変異細胞の排除が生体においても起こっているかどうか検証するため,細胞競合マウスモデルを構築した.そのために,Creに依存してRas遺伝子変異を誘導することができ,かつ,GFPによりRas遺伝子変異をもつ細胞を追跡できるノックインマウスを樹立して,腸管上皮細胞に特異的にCreを発現するマウスと掛け合わせた.このマウスにタモキシフェンを投与するとCreは核へと移行し,Ras遺伝子変異を誘導する.タモキシフェンによるCreの核への移行は確率論的に起こるため,タモキシフェンの投与量を調節することによりRas遺伝子変異の誘導率を調整できることがこのマウスの重要な特性である.すなわち,低濃度のタモキシフェンを投与した場合には少数だけ腸管上皮にRas遺伝子変異をもつ細胞を発現させることができ,正常な細胞とがん変異細胞との細胞競合を観察できる(図2).この細胞競合マウスモデルの解析により,正常な細胞にかこまれたがん変異細胞のほとんどが腸管上皮層の管腔の側へと排除されることが明らかにされ,哺乳類の生体においても細胞競合によりがん変異細胞が体外に排除されることが世界ではじめて示された.
また,マウスの小腸陰窩のオルガノイドにおいて,ミトコンドリアに集積するTMRMを用いてミトコンドリアの活性を評価したところ,低濃度のタモキシフェンの投与によりRas遺伝子変異をモザイクに発現させたとき,正常な細胞にかこまれたがん変異細胞においてTMRMのシグナルが減弱する,すなわち,ミトコンドリア内膜の膜電位が低下することがわかった.一方,高濃度のタモキシフェンの投与によりRas遺伝子変異の誘導率を上昇させてがん変異細胞の集団を形成させた場合にはミトコンドリアの活性に大きな変化は認められず,排除されることなく上皮層にとどまった.したがって,正常な上皮細胞との細胞競合によりがん変異細胞においてミトコンドリアの機能が低下し,上皮層から排除されることが示された.さらに,iGT(intestine-specific gene transfer)法10) によりマウスの小腸上皮細胞において特異的にPDK4をノックダウンしたところ,Ras遺伝子変異をもつ細胞の排除の効率が有意に低下した.これらの結果より,マウスの個体においても正常な細胞にかこまれたがん変異細胞においてはPDK4を介したWarburg効果様の代謝の変化が起こり,上皮層から排除されることがわかった.
この研究により,正常な細胞にかこまれたがん変異細胞においては細胞非自律的にWarburg効果様の代謝の変化が起こることがわかった.がんの中期および後期において細胞自律的に生じるWarburg効果はがんの進展を促進すると考えられている.しかしながら,がんの超初期の段階においては,Warburg効果様の代謝の変化はむしろ抗腫瘍的に機能することが示された.今後,より詳細な分子機構を解明することにより,正常な上皮細胞のもつ抗腫瘍能の亢進によりがん変異細胞の排除を促進するという,細胞競合を利用した予防的ながん治療薬の開発という新たながん治療戦略が可能になることを期待したい.
略歴:2008年 東北大学大学院生命科学研究科 修了,同年 東北大学加齢医学研究所 博士研究員,2009年 同 助教を経て,2013年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:細胞競合と発がん.
抱負:新しいがん研究を切り開いていきたい.
藤田 恭之(Yasuyuki Fujita)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/oncology/index.html
© 2017 昆 俊亮・藤田恭之 Licensed under CC 表示 2.1 日本
(北海道大学遺伝子病制御研究所 分子腫瘍分野)
email:昆 俊亮
DOI: 10.7875/first.author.2017.036
Cell competition with normal epithelial cells promotes apical extrusion of transformed cells through metabolic changes.
Shunsuke Kon, Kojiro Ishibashi, Hiroto Katoh, Sho Kitamoto, Takanobu Shirai, Shinya Tanaka, Mihoko Kajita, Susumu Ishikawa, Hajime Yamauchi, Yuta Yako, Tomoko Kamasaki, Tomohiro Matsumoto, Hirotaka Watanabe, Riku Egami, Ayana Sasaki, Atsuko Nishikawa, Ikumi Kameda, Takeshi Maruyama, Rika Narumi, Tomoko Morita, Yoshiteru Sasaki, Ryosuke Enoki, Sato Honma, Hiromi Imamura, Masanobu Oshima, Tomoyoshi Soga, Jun-ichi Miyazaki, Michael R. Duchen, Jin-Min Nam, Yasuhito Onodera, Shingo Yoshioka, Junichi Kikuta, Masaru Ishii, Masamichi Imajo, Eisuke Nishida, Yoichiro Fujioka, Yusuke Ohba, Toshiro Sato, Yasuyuki Fujita
Nature Cell Biology, 19, 530-541 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
Ras(Q61411), Src(A0A5F4BT17), 乳酸デヒドロゲナーゼA(F1PVW0), ピルビン酸デヒドロゲナーゼ, PDK4(E2RKY0), PDK, Filamin(F1PWW0), EPLIN(E2QW54)
要 約
近年の研究により,異なる性質をもつ細胞のあいだには多彩な競合の生じることが明らかにされた.細胞競合と名づけられたこの現象は,生体のさまざまな生理的あるいは病理的な過程において生じる.とくに,がんの超初期の段階においては,正常な上皮細胞と新たに生じたがん変異細胞とのあいだに細胞競合が生じ,がん変異細胞が上皮層から排除されることが示され,その機能的な意義および臨床応用への可能性が注目されている.しかしながら,細胞競合の分子機構についてはほとんどわかっていない.今回,筆者らは,正常な上皮細胞にかこまれたがん変異細胞にWarburg効果様の代謝の変化が生じ,上皮層から排除されることを明らかにした.さらには,細胞競合マウスモデルの解析により,生体においても同様の機構によりがん変異細胞は排除されることが明らかにされた.これらの結果より,がんの超初期の段階において,隣接する正常な細胞によりがん変異細胞にWarburg効果様の代謝の変化がひき起こされ組織から排除されることが示された.
はじめに
生態系を構成する多様な生物はかぎられた生息域において互いに生存をかけて争い,その結果,競合による適者生存の起こることは広く知られている.一方,個体を構成する細胞の社会においても,異なる性質をもつ細胞が共在するときそれらが生存を争う結果,一方が生存し勝者となり他方が組織から排除され敗者となる“細胞競合”(cell competition)という現象が起こる.細胞競合の現象それ自体は,古くは1975年にショウジョウバエの成虫原基においてはじめて報告されたが1),最近の研究により,哺乳類においてもさまざまな生理的あるいは病理的な過程において細胞競合の起こることが明らかにされた2,3).細胞競合は個体にそなわる基本的な生命現象のひとつと考えられており,潜在的に危険であったり環境に適応していなかったりする細胞を組織から排除することにより生体における恒常性の維持に寄与する.その一例として,筆者らの研究グループは,正常な上皮層に対してRas遺伝子変異やSrc遺伝子変異などのがん原性変異を少数の細胞に起こすと,これらのがん変異細胞と正常な細胞との細胞競合の結果,がん変異細胞は上皮層の管腔の側へ押し出されるように排除されることを見い出した4,5).このことから,上皮層にがん変異細胞が生じたとき,正常な上皮細胞は隣接するがん変異細胞を認識して積極的に排除するという,免疫系を介さない抗腫瘍能(epithelial defense against cancer:EDAC)を担うことが明らかにされた6).しかしながら,この正常な上皮細胞のもつ抗腫瘍能によるがん変異細胞の排除の機構についてはいまだ不明な点が多く,この動的な現象を制御する代謝の機構に着目した.
1.正常な細胞との細胞競合によりがん変異細胞に生じる代謝の変化
ミトコンドリア内膜の膜電位に依存してミトコンドリアに集積するTMRMを用いてミトコンドリアの活性を評価したところ,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてTMRMのシグナルが顕著に低下していた.ミトコンドリアに由来するスーパーオキシドアニオンを検出するmitoSOXのシグナルも同様に低下していたことから,正常な細胞にかこまれたがん変異細胞においてミトコンドリアの活性が低下することが示唆された.さらに,ミトコンドリア内膜の膜電位に非依存的にミトコンドリアに集積するMitotracker GreenとTMRMを共染色しそのシグナルの比を測定したところ,正常な細胞にかこまれたがん変異細胞においてはTMRMのシグナルとMitrotracker Greenのシグナルの比が単独にて培養したときと比べ有意に低下したことから,ミトコンドリアには量的な変化ではなく質的な変化の起こることがわかった.また,電子顕微鏡による解析の結果,マイトファゴソーム様の構造が増加していたことから,ミトコンドリアの機能の低下にともないマイトファジーが誘導されることが推察された.
解糖系の代謝経路について評価したところ,正常な細胞と共培養したRas遺伝子変異をもつ細胞においてグルコースの取り込みおよび乳酸デヒドロゲナーゼAの発現が亢進しており,乳酸の産生量が単独にて培養したときと比べて有意に増加していた.これらのデータから,正常な細胞にかこまれたがん変異細胞においてミトコンドリア内膜の膜電位が低下し好気的な解糖が亢進する,すなわち,Warburg効果様の代謝の変化がひき起こされることが示された.
2.Warburg効果様の代謝の変化をひき起こす分子機構
さまざまな代謝関連酵素の発現量を解析した結果,TCA回路へのゲートキーパーであるピルビン酸デヒドロゲナーゼをリン酸化しその活性を阻害するPDK4の発現が有意に上昇していた.実際に,正常な細胞にかこまれたがん変異細胞においてピルビン酸デヒドロゲナーゼのリン酸化が顕著に亢進していた.そこで,CRISPR-Cas9系を用いたゲノム編集によりRas遺伝子変異をもつ細胞においてPDK4を欠損させた細胞株を樹立し,正常な細胞と共培養したところ,ピルビン酸デヒドロゲナーゼのリン酸化は減少しミトコンドリアの機能が回復した.さらに,がん変異細胞の管腔の側への排除はいちじるしく阻害され,基底膜の側において仮足様の構造を形成する細胞が増加した.また,正常な細胞にかこまれたPDK4欠損Ras遺伝子変異細胞において乳酸デヒドロゲナーゼAの発現が亢進しなかったことから,ミトコンドリアの機能の低下が2次的に解糖系を亢進させることが示唆された.また,PDKの阻害剤であり米国では抗がん剤として臨床試験が進められているジクロロ酢酸を添加した際にもPDK4の欠損と同様の効果が認められた.これらの結果より,PDK4が細胞非自律的なミトコンドリアの機能の低下における責任タンパク質のひとつであること,また,ミトコンドリアの機能の低下ががん変異細胞の排除に必要であることがわかった.
がん変異細胞にかこまれた正常な上皮細胞は,細胞骨格に関連するタンパク質であるFilaminを集積させることによりがん変異細胞を上皮層から排除する6).また,正常な上皮細胞はがん変異細胞におけるEPLINの集積を促進することによりがん変異細胞を排除することもわかっている7).そこで,Filaminをノックダウンした,すなわち,正常な上皮細胞のもつ抗腫瘍能が不全である細胞とRas遺伝子変異をもつ細胞とを共培養したところ,がん変異細胞においてミトコンドリア内膜の膜電位は低下せず,また,がん変異細胞は上皮層より排除されなかった.また,EPLINをノックダウンしたがん変異細胞においても同様に,細胞非自律的なミトコンドリア内膜の膜電位の低下は起こらず,さらに,PDK4の発現も亢進しなかった.これらの結果より,正常な上皮細胞はFilamin→EPLIN→PDK4という経路を介して隣接するがん変異細胞にWarburg効果様の代謝の変化をひき起こし上皮層から排除することがわかった(図1).
3.Warburg効果様の代謝の変化の生理的な意義
細胞においてグルコースの量を検出するFRETプローブにより,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてグルコースの量が低下することがわかった.さきに述べたように,グルコースの取り込みは亢進していることからグルコースは解糖系により精力的に代謝されていることが推察された.そこで,FRETプローブであるATeam 8) を用いて細胞におけるATPの量を検討したところ,正常な細胞にかこまれたRas遺伝子変異をもつ細胞においてATPは増加することがわかった.このことから,がん変異細胞が上皮層から排除されるために必要なエネルギーはWarburg効果様の代謝の変化により産生される可能性が示唆された.解糖系によるATPの合成は呼吸鎖の酸化的リン酸化反応より約100倍も速いため9),局時的に過剰のATPを産生することががん変異細胞の上皮層からの排除に必要なのかもしれない.
4.細胞競合マウスモデルを用いた解析
Warburg効果様の代謝の変化の制御によるがん変異細胞の排除が生体においても起こっているかどうか検証するため,細胞競合マウスモデルを構築した.そのために,Creに依存してRas遺伝子変異を誘導することができ,かつ,GFPによりRas遺伝子変異をもつ細胞を追跡できるノックインマウスを樹立して,腸管上皮細胞に特異的にCreを発現するマウスと掛け合わせた.このマウスにタモキシフェンを投与するとCreは核へと移行し,Ras遺伝子変異を誘導する.タモキシフェンによるCreの核への移行は確率論的に起こるため,タモキシフェンの投与量を調節することによりRas遺伝子変異の誘導率を調整できることがこのマウスの重要な特性である.すなわち,低濃度のタモキシフェンを投与した場合には少数だけ腸管上皮にRas遺伝子変異をもつ細胞を発現させることができ,正常な細胞とがん変異細胞との細胞競合を観察できる(図2).この細胞競合マウスモデルの解析により,正常な細胞にかこまれたがん変異細胞のほとんどが腸管上皮層の管腔の側へと排除されることが明らかにされ,哺乳類の生体においても細胞競合によりがん変異細胞が体外に排除されることが世界ではじめて示された.
また,マウスの小腸陰窩のオルガノイドにおいて,ミトコンドリアに集積するTMRMを用いてミトコンドリアの活性を評価したところ,低濃度のタモキシフェンの投与によりRas遺伝子変異をモザイクに発現させたとき,正常な細胞にかこまれたがん変異細胞においてTMRMのシグナルが減弱する,すなわち,ミトコンドリア内膜の膜電位が低下することがわかった.一方,高濃度のタモキシフェンの投与によりRas遺伝子変異の誘導率を上昇させてがん変異細胞の集団を形成させた場合にはミトコンドリアの活性に大きな変化は認められず,排除されることなく上皮層にとどまった.したがって,正常な上皮細胞との細胞競合によりがん変異細胞においてミトコンドリアの機能が低下し,上皮層から排除されることが示された.さらに,iGT(intestine-specific gene transfer)法10) によりマウスの小腸上皮細胞において特異的にPDK4をノックダウンしたところ,Ras遺伝子変異をもつ細胞の排除の効率が有意に低下した.これらの結果より,マウスの個体においても正常な細胞にかこまれたがん変異細胞においてはPDK4を介したWarburg効果様の代謝の変化が起こり,上皮層から排除されることがわかった.
おわりに
この研究により,正常な細胞にかこまれたがん変異細胞においては細胞非自律的にWarburg効果様の代謝の変化が起こることがわかった.がんの中期および後期において細胞自律的に生じるWarburg効果はがんの進展を促進すると考えられている.しかしながら,がんの超初期の段階においては,Warburg効果様の代謝の変化はむしろ抗腫瘍的に機能することが示された.今後,より詳細な分子機構を解明することにより,正常な上皮細胞のもつ抗腫瘍能の亢進によりがん変異細胞の排除を促進するという,細胞競合を利用した予防的ながん治療薬の開発という新たながん治療戦略が可能になることを期待したい.
文 献
- Morata, G. & Ripoll, P.: Minutes: mutants of drosophila autonomously affecting cell division rate. Dev. Biol., 42, 211-221 (1975)[PubMed]
- Kajita, M. & Fujita, Y.: EDAC: Epithelial defence against cancer-cell competition between normal and transformed epithelial cells in mammals. J. Biochem., 158, 15-23 (2015)[PubMed]
- Gregorio, A., Bowling, S. & Rodriguez, T. A.: Cell competition and its role in the regulation of cell fitness from development to cancer. Dev. Cell, 38, 621-634 (2016)[PubMed]
- Hogan, C., Dupre-Crochet, S., Norman, M. et al.: Characterization of the interface between normal and transformed epithelial cells. Nat. Cell Biol., 11, 460-467 (2009)[PubMed]
- Kajita, M., Hogan, C., Harris, A. R. et al.: Interaction with surrounding normal epithelial cells influences signalling pathways and behaviour of Src-transformed cells. J. Cell Sci., 123, 171-180 (2010)[PubMed]
- Kajita, M., Sugimura, K., Ohoka, A. et al.: Filamin acts as a key regulator in epithelial defence against transformed cells. Nat. Commun., 5, 4428 (2014)[PubMed]
- Ohoka, A., Kajita, M., Ikenouchi, J. et al.: EPLIN is a crucial regulator for extrusion of RasV12-transformed cells. J. Cell Sci., 128, 781-789 (2015)[PubMed]
- Imamura, H., Nhat, K. P., Togawa, H. et al.: Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proc. Natl. Acad. Sci. USA, 106, 15651-15656 (2009)[PubMed]
- Pfeiffer, T., Schuster, S. & Bonhoeffer, S.: Cooperation and competition in the evolution of ATP-producing pathways. Science, 292, 504-507 (2001)[PubMed]
- Imajo, M., Ebisuya, M. & Nishida, E.: Dual role of YAP and TAZ in renewal of the intestinal epithelium. Nat. Cell Biol., 17, 7-19 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 東北大学大学院生命科学研究科 修了,同年 東北大学加齢医学研究所 博士研究員,2009年 同 助教を経て,2013年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:細胞競合と発がん.
抱負:新しいがん研究を切り開いていきたい.
藤田 恭之(Yasuyuki Fujita)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/oncology/index.html
© 2017 昆 俊亮・藤田恭之 Licensed under CC 表示 2.1 日本