スーパーエンハンサーによるRNAプロセシングの制御
鈴木 洋・Phillip A. Sharp
(米国Massachusetts Institute of Technology,David H. Koch Institute for Integrative Cancer Research)
email:鈴木 洋
DOI: 10.7875/first.author.2017.028
Super-enhancer-mediated RNA processing revealed by integrative microRNA network analysis.
Hiroshi I. Suzuki, Richard A. Young, Phillip A. Sharp
Cell, 168, 1000-1014.e15 (2017)
近年,細胞のアイデンティティの決定や疾患に関連する遺伝子の発現制御にはたらくゲノム領域としてスーパーエンハンサーが提唱された.しかし,スーパーエンハンサーの定義の妥当性や機能的な意義については不明な点が多い.筆者らは,多様な細胞種の機能を制御するmiRNAについて遺伝子制御ネットワークの定量的な特徴に注目し,スーパーエンハンサーとmiRNAとの関係を多角的に解析した.その結果,細胞種に特異的かつ進化的に保存されたマスターmiRNAによる遺伝子制御ネットワークがかたちづくられるうえで,スーパーエンハンサーが中心的な役割をもつことが明らかにされた.また,ゲノム領域のネットワーク解析あるいはゲノム編集の技術を利用した機能ゲノミクスなどにより,スーパーエンハンサーを構成する複数のゲノム領域は協調的に機能し,RNAプロセシングと密接に関係することなどが明らかにされた.さらに,スーパーエンハンサーはがん抑制性あるいはがん促進性の多数のmiRNAと関連していた.この研究において,miRNAによる遺伝子発現制御の階層性が形成される原理,さらに,転写制御のほか,RNAプロセシングの制御というゲノムの非コード領域のもつ重要な機能が明らかにされた.
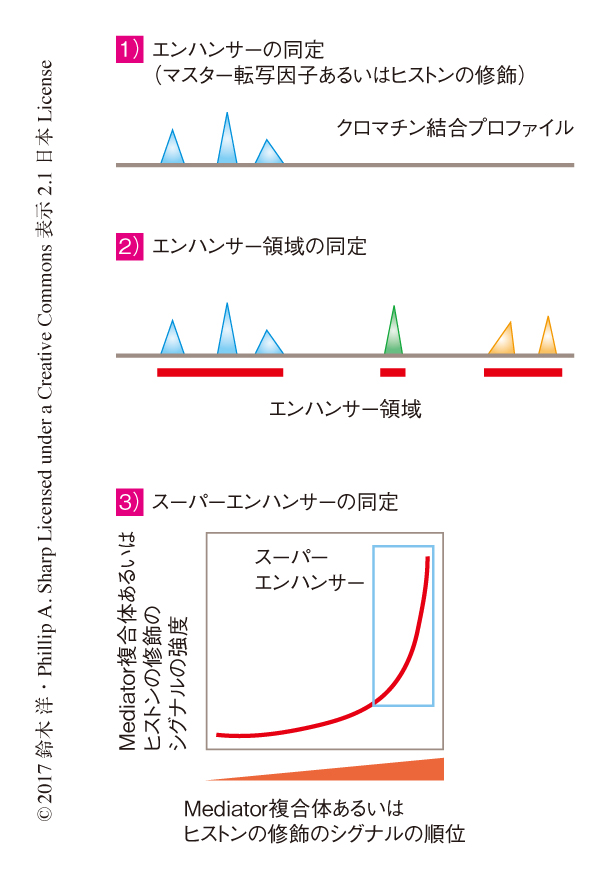
細胞種に特異的なエンハンサーによる遺伝子の発現制御は,細胞のアイデンティティが決定されたり,さまざまな疾患において細胞の特性の脱制御が起こったりする過程において中心的な役割をはたす.近年,スーパーエンハンサーは,細胞種を規定するマスター転写因子と,一般的な転写制御因子であるMediator複合体とが高濃度に集積した複数のエンハンサー領域が,局所的にクラスターを形成したゲノム領域として提案された1,2).従来の典型的なエンハンサーが細胞種あたり1万ほどなのに対し,スーパーエンハンサーはおのおのの細胞種において200~600ほど同定され,これらは細胞の種類や機能に関係する重要な遺伝子の近傍に見い出された.また,スーパーエンハンサーにおいては疾患に関連したゲノム多型が多く見い出され,がん遺伝子の活性化に関連することも報告されている2).このように,スーパーエンハンサーという概念は細胞のアイデンティティの決定や疾患に関連する遺伝子の制御において重要なゲノム制御領域の同定に有用であるが,一方で,スーパーエンハンサーの定義それ自体は,マスター転写因子,Mediator複合体,ヒストンの修飾などについて標準的なChIP-seq(chromatin immunoprecipitation-sequencing)法により得られたデータのバイオインフォマティクスによる再解釈にもとづくため(図1),スーパーエンハンサーは従来の典型的なエンハンサーとは異なる生物学的な機能をもつのか,いい換えると,典型的なエンハンサーがゲノムに単純に連続して配置されているだけなのか,あるいは,新しい機能をもつのかは不明であった.
このような学術的な背景にもとづくと,スーパーエンハンサーは細胞のアイデンティティにかかわる遺伝子を制御する強力なエンハンサーであるといい換えることができるが,スーパーエンハンサーと従来の典型的なエンハンサーとを分ける閾値の妥当性はどのように検証されるのだろうか.タンパク質をコードする遺伝子に注目するなら,遺伝子の機能の解析,すなわち,遺伝子オントロジー解析やパスウェイ解析に依存せざるをえないだろう.ここで,スーパーエンハンサーと同様に,細胞種のあいだで強い発現と機能のバイアスを示す遺伝子の制御因子として,マイクロRNA(miRNA)がある.miRNAはさまざまな転写因子と同様に,細胞種に特異的なトランスクリプトームの形成において重要な役割をはたす.さまざまな細胞種を網羅したmiRNAの発現プロファイリングのほか,miRNAの網羅的な機能スクリーニングやAgo2に対するCLIP-seq(crosslinking and immunoprecipitation-sequencing)法などにより,miRNAは個々の細胞種において同じような強度で発現し機能するのではなく,10以下のごく小数のmiRNAがmiRNAの発現プールおよびAgo2による遺伝子の制御能を占有することが明らかにされている3-5).そこで,筆者らは,スーパーエンハンサーはmiRNAの発現および機能に関する細胞種のあいだの強いバイアスを規定するとの仮説をたて,miRNAに関する多面的な定量データにもとづきスーパーエンハンサーという概念の妥当性を検討できるのではないかと考えた.
近年のゲノムの3次元構造の解析から,エンハンサーはインスレーターにより境界化されたゲノム領域において近傍の遺伝子を活性化することが明らかにされている6).そこで,マウスのES細胞において,スーパーエンハンサーおよび従来の典型的なエンハンサーにより制御されうるmiRNAおよびタンパク質をコードする遺伝子を網羅的に同定し,さらに,これらの位置の関係性とmiRNAの発現量との関係について検討した.同定されたエンハンサーのうちごく少数がmiRNA遺伝子の近傍にあり,また,この位置関係は発現量とよく相関し,miRNAの発現プールの60%がスーパーエンハンサーに関連するmiRNA,20%が典型的なエンハンサーに関連するmiRNAでしめられていた.また,Ago2に対するCLIP-seq法によっても,その約80%のシグナルはスーパーエンハンサーに関連するmiRNAに由来した.筋芽細胞,プロB細胞,T細胞,マクロファージなどにおいても同様に解析したところ,スーパーエンハンサーに関連するmiRNAは細胞の特異性および発現量がきわめて高く,スーパーエンハンサーという概念により組織に特異的なmiRNAの発現プロファイルがよく説明できることが明らかにされた.
がん細胞を含みヒトの26種の組織型をカバーする86の試料に対し,同様にスーパーエンハンサーあるいは従来の典型的なエンハンサーに関連するmiRNAを同定することにより,スーパーエンハンサーに関連するmiRNAのカタログを作成した.スーパーエンハンサーに関連するmiRNAは,これまで報告されてきた,ES細胞の機能,筋肉および心臓の発生,神経機能の制御,炎症および免疫の制御,内皮間葉転換といった,おのおのの細胞種あるいは組織の機能に強く関連する細胞種に特異的な多くのmiRNAを制御していた.miRNAとその標的となる遺伝子はさまざまな組織において相互排他的な発現パターンをとることが知られており,あるmiRNAが発現するのと同じ組織で発現する遺伝子ではそのmiRNAの標的となる部位の存在が進化の過程において抑制されることが知られているが,スーパーエンハンサーにより制御されるmiRNAと標的となる部位の存在に進化的な抑制のみられるmiRNAとの関係性を検討したところ,強い相関が見い出された.このことから,スーパーエンハンサーと組織に特異的なmiRNAとの関係性,および,組織特異的なmiRNAによる遺伝子発現の制御ネットワークが進化的に連携していることが示唆された.
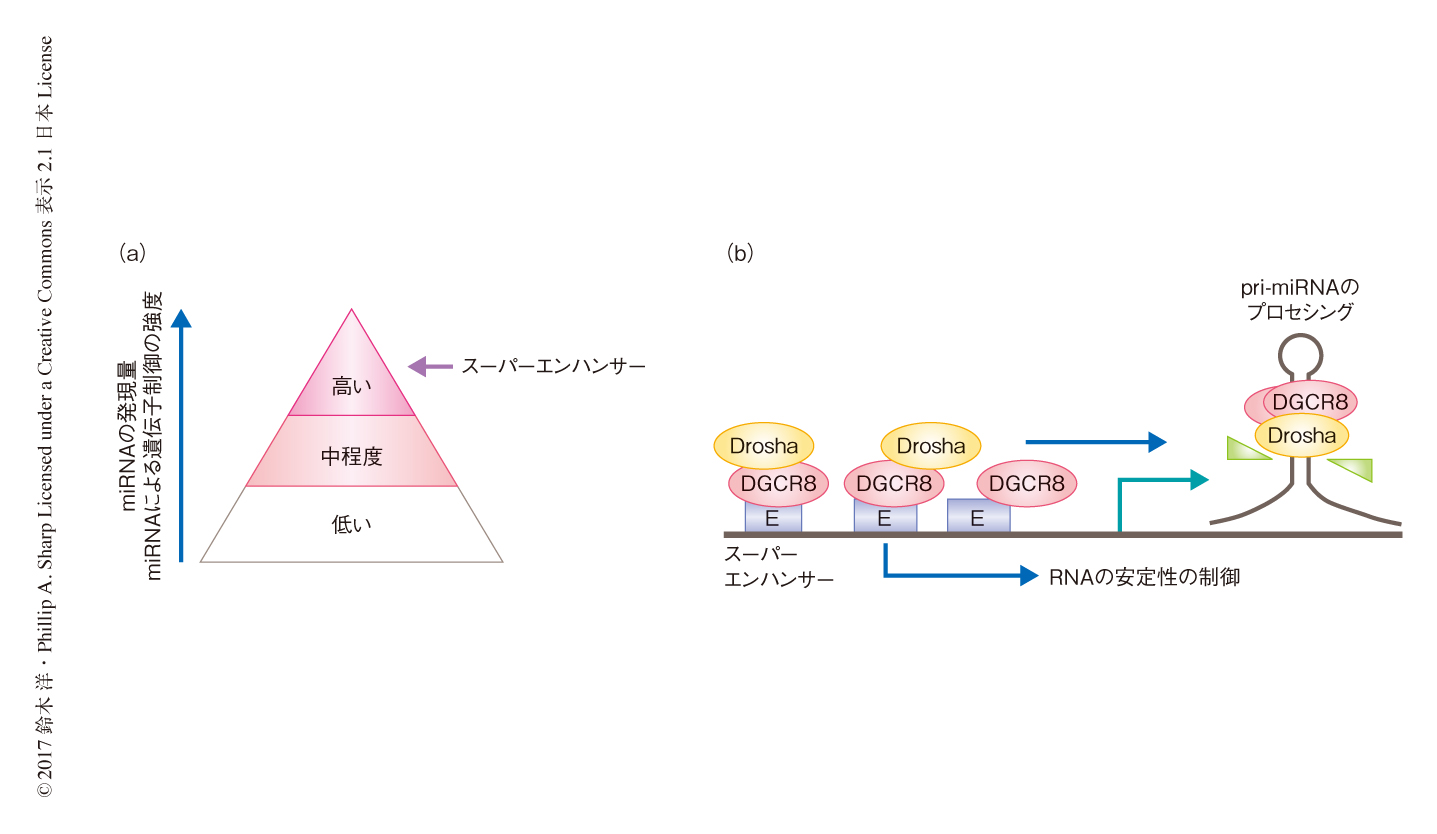
スーパーエンハンサーの定義は,マスター転写因子とMediator複合体,あるいは,ヒストンの修飾のChIP-seq法によるプロファイルにもとづく.マスター転写因子とMediator複合体から定義されたスーパーエンハンサーに関連したmiRNAと比べて,ヒストンの修飾により定義されたスーパーエンハンサーに関連したmiRNAには,中間の発現量を示すmiRNAがより幅広く含まれたことから,Mediator複合体の結合とヒストンの修飾がわずかに異なる特性をもつゲノム領域と関連する可能性を考慮した.スーパーエンハンサーおよび従来の典型的なエンハンサーにおけるさまざまな転写因子などの結合パターンをネットワーク解析したところ,スーパーエンハンサーが,マスター転写因子とMediator複合体が協調的に結合する複数のゲノム領域,プロモーターおよびエンハンサーのヒストンの修飾パターンの両方の特徴をもつゲノム領域など,異なる特徴をもつゲノム領域から構成されることが見い出され,とくに,この2つの情報がmiRNAの発現パターンの階層性を決定することが明らかにされた(図2a).
スーパーエンハンサーによる遺伝子発現の活性化に関する分子生物学的な解析については,これまでにいくつかの報告があるだけである.ES細胞,筋芽細胞,プロB細胞において,それぞれの細胞種にて重要なマスターmiRNAに関連したスーパーエンハンサーについて,CRISPR-Cas9系を用いてそのゲノム領域を欠損させることによりスーパーエンハンサーの機能を解析した.その結果,スーパーエンハンサーがマスターmiRNAの発現誘導,および,下流の遺伝子の発現制御に重要であることが明らかにされた.さらに,スーパーエンハンサーに含まれる複数のゲノム領域の単独の欠損によりmiRNAの発現が大きく低下したことから,スーパーエンハンサーを構成するおのおののゲノム領域が協調的に機能することが示唆され,さらに,スーパーエンハンサーがmiRNA前駆体から成熟型miRNAへのプロセシングの効率を促進し,miRNAの1次転写産物であるpri-miRNAをプロセシングするDroshaおよびDGCR8のクロマチンへのリクルートを促進することが見い出された.これらの結果から,スーパーエンハンサーそれ自体が効率のよいpri-miRNAのプロセシングのプラットフォームとなることが示唆された(図2b).実際,DroshaおよびDGCR8のゲノムワイドなクロマチン結合プロファイルから,関連するmiRNA遺伝子の有無にかかわらずスーパーエンハンサーの大部分にDGCR8およびDroshaが結合することが明らかにされ,DGCR8およびDroshaがスーパーエンハンサーに関連した遺伝子の半減期の制御に関係する可能性も示唆された.
以前より,がん細胞のエピジェネティクスを標的にしたがんの治療の候補として,Brd4といったクロマチン制御タンパク質が注目されている7).こういったクロマチン制御タンパク質は遺伝子発現の一般的な制御タンパク質であるが,Brd4などのもつBETブロモドメインの阻害剤であるJQ1はMyc遺伝子などのがん遺伝子の発現をより選択的に抑制することが知られていた.この機構として,スーパーエンハンサーがJQ1などに対する遺伝子の感受性の違いを規定することが提唱されている7).すなわち,がん細胞においてMyc遺伝子などのがん遺伝子の発現はスーパーエンハンサーに依存しており,スーパーエンハンサーは従来の典型的なエンハンサーよりもその活性化におけるBrd4などへの依存度が強いため,JQ1による選択的な抑制がみられるというものである7).今回の解析においてはさらに,JQ1がスーパーエンハンサーによるmiRNAのプロセシング制御を抑制することが見い出され,スーパーエンハンサーの有無によるJQ1への転写抑制の応答性の違いがmiRNAのプロセシングにもあてはまることが明らかにされた.
がんにおいては,さまざまながん遺伝子がさまざまな機構により活性化される.その新しい機構として,がん遺伝子の近傍にがん細胞に特異的にスーパーエンハンサーが形成されることにより,がん遺伝子が活性化されるというモデルが提案されている8).そこで,スーパーエンハンサーに関連するmiRNAとがんとの関係について解析した.正常な細胞あるいは組織とがん細胞のスーパーエンハンサーを比較したところ,がん細胞においてはがん抑制性のmiRNAに関連したスーパーエンハンサーの喪失,および,がん促進性のmiRNAに関連したスーパーエンハンサーの形成がみられた.スーパーエンハンサーの異常のみられるmiRNAには,これまでに報告されたがんに関連するmiRNAが多く含まれており,“がんのホールマーク”において提案されている9),がんのさまざまな生物学的な特徴と密接に関連していた.また,とくに,がん細胞においてスーパーエンハンサーの形成のみられるmiRNAは,がんの予後の予測において有用なバイオマーカーとなりうることが明らかにされた.
スーパーエンハンサーとmiRNAとの関係を多角的に解析することにより,細胞種に特異的なmiRNAの遺伝子制御ネットワークの形成において,スーパーエンハンサーが中心的な役割をもつことが明らかにされた.この研究において提示された多様な細胞種におけるスーパーエンハンサーに関連するmiRNAは,再生医学あるいは合成生物学における標的となる細胞のマニピュレーション,および,がんに対するバイオマーカーの開発などに役だつと期待される.また,スーパーエンハンサーの機能の解析により,ゲノムの非コード領域,とくにエンハンサーがRNAプロセシングの制御という新しい機能をもつことが明らかにされた.ゲノム医学が進展する一方で,ゲノムの非コード領域の機能の理解は不十分であり,今後のゲノム医療あるいはprecision medicine(精密医療)の進展にはこういった基礎的な機能の検証が重要であると考えられる.
略歴:2010年 東京大学大学院医学研究科 早期修了,同年 同 特任助教を経て,2014年より米国Massachusetts Institute of Technology客員研究員.
Phillip A. Sharp
米国Massachusetts Institute of TechnologyにてInstitute Professor.
研究室URL:http://web.mit.edu/sharplab/
© 2017 鈴木 洋・Phillip A. Sharp Licensed under CC 表示 2.1 日本
(米国Massachusetts Institute of Technology,David H. Koch Institute for Integrative Cancer Research)
email:鈴木 洋
DOI: 10.7875/first.author.2017.028
Super-enhancer-mediated RNA processing revealed by integrative microRNA network analysis.
Hiroshi I. Suzuki, Richard A. Young, Phillip A. Sharp
Cell, 168, 1000-1014.e15 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
近年,細胞のアイデンティティの決定や疾患に関連する遺伝子の発現制御にはたらくゲノム領域としてスーパーエンハンサーが提唱された.しかし,スーパーエンハンサーの定義の妥当性や機能的な意義については不明な点が多い.筆者らは,多様な細胞種の機能を制御するmiRNAについて遺伝子制御ネットワークの定量的な特徴に注目し,スーパーエンハンサーとmiRNAとの関係を多角的に解析した.その結果,細胞種に特異的かつ進化的に保存されたマスターmiRNAによる遺伝子制御ネットワークがかたちづくられるうえで,スーパーエンハンサーが中心的な役割をもつことが明らかにされた.また,ゲノム領域のネットワーク解析あるいはゲノム編集の技術を利用した機能ゲノミクスなどにより,スーパーエンハンサーを構成する複数のゲノム領域は協調的に機能し,RNAプロセシングと密接に関係することなどが明らかにされた.さらに,スーパーエンハンサーはがん抑制性あるいはがん促進性の多数のmiRNAと関連していた.この研究において,miRNAによる遺伝子発現制御の階層性が形成される原理,さらに,転写制御のほか,RNAプロセシングの制御というゲノムの非コード領域のもつ重要な機能が明らかにされた.
はじめに
細胞種に特異的なエンハンサーによる遺伝子の発現制御は,細胞のアイデンティティが決定されたり,さまざまな疾患において細胞の特性の脱制御が起こったりする過程において中心的な役割をはたす.近年,スーパーエンハンサーは,細胞種を規定するマスター転写因子と,一般的な転写制御因子であるMediator複合体とが高濃度に集積した複数のエンハンサー領域が,局所的にクラスターを形成したゲノム領域として提案された1,2).従来の典型的なエンハンサーが細胞種あたり1万ほどなのに対し,スーパーエンハンサーはおのおのの細胞種において200~600ほど同定され,これらは細胞の種類や機能に関係する重要な遺伝子の近傍に見い出された.また,スーパーエンハンサーにおいては疾患に関連したゲノム多型が多く見い出され,がん遺伝子の活性化に関連することも報告されている2).このように,スーパーエンハンサーという概念は細胞のアイデンティティの決定や疾患に関連する遺伝子の制御において重要なゲノム制御領域の同定に有用であるが,一方で,スーパーエンハンサーの定義それ自体は,マスター転写因子,Mediator複合体,ヒストンの修飾などについて標準的なChIP-seq(chromatin immunoprecipitation-sequencing)法により得られたデータのバイオインフォマティクスによる再解釈にもとづくため(図1),スーパーエンハンサーは従来の典型的なエンハンサーとは異なる生物学的な機能をもつのか,いい換えると,典型的なエンハンサーがゲノムに単純に連続して配置されているだけなのか,あるいは,新しい機能をもつのかは不明であった.
このような学術的な背景にもとづくと,スーパーエンハンサーは細胞のアイデンティティにかかわる遺伝子を制御する強力なエンハンサーであるといい換えることができるが,スーパーエンハンサーと従来の典型的なエンハンサーとを分ける閾値の妥当性はどのように検証されるのだろうか.タンパク質をコードする遺伝子に注目するなら,遺伝子の機能の解析,すなわち,遺伝子オントロジー解析やパスウェイ解析に依存せざるをえないだろう.ここで,スーパーエンハンサーと同様に,細胞種のあいだで強い発現と機能のバイアスを示す遺伝子の制御因子として,マイクロRNA(miRNA)がある.miRNAはさまざまな転写因子と同様に,細胞種に特異的なトランスクリプトームの形成において重要な役割をはたす.さまざまな細胞種を網羅したmiRNAの発現プロファイリングのほか,miRNAの網羅的な機能スクリーニングやAgo2に対するCLIP-seq(crosslinking and immunoprecipitation-sequencing)法などにより,miRNAは個々の細胞種において同じような強度で発現し機能するのではなく,10以下のごく小数のmiRNAがmiRNAの発現プールおよびAgo2による遺伝子の制御能を占有することが明らかにされている3-5).そこで,筆者らは,スーパーエンハンサーはmiRNAの発現および機能に関する細胞種のあいだの強いバイアスを規定するとの仮説をたて,miRNAに関する多面的な定量データにもとづきスーパーエンハンサーという概念の妥当性を検討できるのではないかと考えた.
1.スーパーエンハンサーによるmiRNAの発現の制御
近年のゲノムの3次元構造の解析から,エンハンサーはインスレーターにより境界化されたゲノム領域において近傍の遺伝子を活性化することが明らかにされている6).そこで,マウスのES細胞において,スーパーエンハンサーおよび従来の典型的なエンハンサーにより制御されうるmiRNAおよびタンパク質をコードする遺伝子を網羅的に同定し,さらに,これらの位置の関係性とmiRNAの発現量との関係について検討した.同定されたエンハンサーのうちごく少数がmiRNA遺伝子の近傍にあり,また,この位置関係は発現量とよく相関し,miRNAの発現プールの60%がスーパーエンハンサーに関連するmiRNA,20%が典型的なエンハンサーに関連するmiRNAでしめられていた.また,Ago2に対するCLIP-seq法によっても,その約80%のシグナルはスーパーエンハンサーに関連するmiRNAに由来した.筋芽細胞,プロB細胞,T細胞,マクロファージなどにおいても同様に解析したところ,スーパーエンハンサーに関連するmiRNAは細胞の特異性および発現量がきわめて高く,スーパーエンハンサーという概念により組織に特異的なmiRNAの発現プロファイルがよく説明できることが明らかにされた.
2.スーパーエンハンサーとmiRNAとの関係性の進化的な変遷
がん細胞を含みヒトの26種の組織型をカバーする86の試料に対し,同様にスーパーエンハンサーあるいは従来の典型的なエンハンサーに関連するmiRNAを同定することにより,スーパーエンハンサーに関連するmiRNAのカタログを作成した.スーパーエンハンサーに関連するmiRNAは,これまで報告されてきた,ES細胞の機能,筋肉および心臓の発生,神経機能の制御,炎症および免疫の制御,内皮間葉転換といった,おのおのの細胞種あるいは組織の機能に強く関連する細胞種に特異的な多くのmiRNAを制御していた.miRNAとその標的となる遺伝子はさまざまな組織において相互排他的な発現パターンをとることが知られており,あるmiRNAが発現するのと同じ組織で発現する遺伝子ではそのmiRNAの標的となる部位の存在が進化の過程において抑制されることが知られているが,スーパーエンハンサーにより制御されるmiRNAと標的となる部位の存在に進化的な抑制のみられるmiRNAとの関係性を検討したところ,強い相関が見い出された.このことから,スーパーエンハンサーと組織に特異的なmiRNAとの関係性,および,組織特異的なmiRNAによる遺伝子発現の制御ネットワークが進化的に連携していることが示唆された.
3.ネットワーク解析により明らかにされたスーパーエンハンサーのゲノム領域としての特徴
スーパーエンハンサーの定義は,マスター転写因子とMediator複合体,あるいは,ヒストンの修飾のChIP-seq法によるプロファイルにもとづく.マスター転写因子とMediator複合体から定義されたスーパーエンハンサーに関連したmiRNAと比べて,ヒストンの修飾により定義されたスーパーエンハンサーに関連したmiRNAには,中間の発現量を示すmiRNAがより幅広く含まれたことから,Mediator複合体の結合とヒストンの修飾がわずかに異なる特性をもつゲノム領域と関連する可能性を考慮した.スーパーエンハンサーおよび従来の典型的なエンハンサーにおけるさまざまな転写因子などの結合パターンをネットワーク解析したところ,スーパーエンハンサーが,マスター転写因子とMediator複合体が協調的に結合する複数のゲノム領域,プロモーターおよびエンハンサーのヒストンの修飾パターンの両方の特徴をもつゲノム領域など,異なる特徴をもつゲノム領域から構成されることが見い出され,とくに,この2つの情報がmiRNAの発現パターンの階層性を決定することが明らかにされた(図2a).
4.スーパーエンハンサーとRNAプロセシング
スーパーエンハンサーによる遺伝子発現の活性化に関する分子生物学的な解析については,これまでにいくつかの報告があるだけである.ES細胞,筋芽細胞,プロB細胞において,それぞれの細胞種にて重要なマスターmiRNAに関連したスーパーエンハンサーについて,CRISPR-Cas9系を用いてそのゲノム領域を欠損させることによりスーパーエンハンサーの機能を解析した.その結果,スーパーエンハンサーがマスターmiRNAの発現誘導,および,下流の遺伝子の発現制御に重要であることが明らかにされた.さらに,スーパーエンハンサーに含まれる複数のゲノム領域の単独の欠損によりmiRNAの発現が大きく低下したことから,スーパーエンハンサーを構成するおのおののゲノム領域が協調的に機能することが示唆され,さらに,スーパーエンハンサーがmiRNA前駆体から成熟型miRNAへのプロセシングの効率を促進し,miRNAの1次転写産物であるpri-miRNAをプロセシングするDroshaおよびDGCR8のクロマチンへのリクルートを促進することが見い出された.これらの結果から,スーパーエンハンサーそれ自体が効率のよいpri-miRNAのプロセシングのプラットフォームとなることが示唆された(図2b).実際,DroshaおよびDGCR8のゲノムワイドなクロマチン結合プロファイルから,関連するmiRNA遺伝子の有無にかかわらずスーパーエンハンサーの大部分にDGCR8およびDroshaが結合することが明らかにされ,DGCR8およびDroshaがスーパーエンハンサーに関連した遺伝子の半減期の制御に関係する可能性も示唆された.
以前より,がん細胞のエピジェネティクスを標的にしたがんの治療の候補として,Brd4といったクロマチン制御タンパク質が注目されている7).こういったクロマチン制御タンパク質は遺伝子発現の一般的な制御タンパク質であるが,Brd4などのもつBETブロモドメインの阻害剤であるJQ1はMyc遺伝子などのがん遺伝子の発現をより選択的に抑制することが知られていた.この機構として,スーパーエンハンサーがJQ1などに対する遺伝子の感受性の違いを規定することが提唱されている7).すなわち,がん細胞においてMyc遺伝子などのがん遺伝子の発現はスーパーエンハンサーに依存しており,スーパーエンハンサーは従来の典型的なエンハンサーよりもその活性化におけるBrd4などへの依存度が強いため,JQ1による選択的な抑制がみられるというものである7).今回の解析においてはさらに,JQ1がスーパーエンハンサーによるmiRNAのプロセシング制御を抑制することが見い出され,スーパーエンハンサーの有無によるJQ1への転写抑制の応答性の違いがmiRNAのプロセシングにもあてはまることが明らかにされた.
5.スーパーエンハンサーによるmiRNAの制御とがん
がんにおいては,さまざまながん遺伝子がさまざまな機構により活性化される.その新しい機構として,がん遺伝子の近傍にがん細胞に特異的にスーパーエンハンサーが形成されることにより,がん遺伝子が活性化されるというモデルが提案されている8).そこで,スーパーエンハンサーに関連するmiRNAとがんとの関係について解析した.正常な細胞あるいは組織とがん細胞のスーパーエンハンサーを比較したところ,がん細胞においてはがん抑制性のmiRNAに関連したスーパーエンハンサーの喪失,および,がん促進性のmiRNAに関連したスーパーエンハンサーの形成がみられた.スーパーエンハンサーの異常のみられるmiRNAには,これまでに報告されたがんに関連するmiRNAが多く含まれており,“がんのホールマーク”において提案されている9),がんのさまざまな生物学的な特徴と密接に関連していた.また,とくに,がん細胞においてスーパーエンハンサーの形成のみられるmiRNAは,がんの予後の予測において有用なバイオマーカーとなりうることが明らかにされた.
おわりに
スーパーエンハンサーとmiRNAとの関係を多角的に解析することにより,細胞種に特異的なmiRNAの遺伝子制御ネットワークの形成において,スーパーエンハンサーが中心的な役割をもつことが明らかにされた.この研究において提示された多様な細胞種におけるスーパーエンハンサーに関連するmiRNAは,再生医学あるいは合成生物学における標的となる細胞のマニピュレーション,および,がんに対するバイオマーカーの開発などに役だつと期待される.また,スーパーエンハンサーの機能の解析により,ゲノムの非コード領域,とくにエンハンサーがRNAプロセシングの制御という新しい機能をもつことが明らかにされた.ゲノム医学が進展する一方で,ゲノムの非コード領域の機能の理解は不十分であり,今後のゲノム医療あるいはprecision medicine(精密医療)の進展にはこういった基礎的な機能の検証が重要であると考えられる.
文 献
- Whyte, W. A., Orlando, D. A., Hnisz, D. et al.: Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell, 153, 307-319 (2013)[PubMed]
- Hnisz, D., Abraham, B. J., Lee, T. I. et al.: Super-enhancers in the control of cell identity and disease. Cell, 155, 934-947 (2013)[PubMed]
- Bosson, A. D., Zamudio, J. R. & Sharp, P. A.: Endogenous miRNA and target concentrations determine susceptibility to potential ceRNA competition. Mol. Cell, 56, 347-359 (2014)[PubMed]
- Mullokandov, G., Baccarini, A., Ruzo, A. et al.: High-throughput assessment of microRNA activity and function using microRNA sensor and decoy libraries. Nat. Methods, 9, 840-846 (2012)[PubMed]
- Landgraf, P., Rusu, M., Sheridan, R. et al.: A mammalian microRNA expression atlas based on small RNA library sequencing. Cell, 129, 1401-1414 (2007)[PubMed]
- Dowen, J. M., Fan, Z. P., Hnisz, D. et al.: Control of cell identity genes occurs in insulated neighborhoods in mammalian chromosomes. Cell, 159, 374-387 (2014)[PubMed]
- Loven, J., Hoke, H. A., Lin, C. Y. et al.: Selective inhibition of tumor oncogenes by disruption of super-enhancers. Cell, 153, 320-334 (2013)[PubMed]
- Mansour, M. R., Abraham, B. J., Anders, L. et al.: An oncogenic super-enhancer formed through somatic mutation of a noncoding intergenic element. Science, 346, 1373-1377 (2014)[PubMed]
- Hanahan, D. & Weinberg, R. A.: Hallmarks of cancer: the next generation. Cell, 144, 646-674 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京大学大学院医学研究科 早期修了,同年 同 特任助教を経て,2014年より米国Massachusetts Institute of Technology客員研究員.
Phillip A. Sharp
米国Massachusetts Institute of TechnologyにてInstitute Professor.
研究室URL:http://web.mit.edu/sharplab/
© 2017 鈴木 洋・Phillip A. Sharp Licensed under CC 表示 2.1 日本