自律神経の活性化による腎臓における虚血再灌流障害の抑制には延髄のC1ニューロンが関与する
安部 力1・井上 剛2・Patrice G. Guyenet 1
(米国Virginia大学School of Medicine,1 Department of Pharmacology,2 Department of Medicine)
email:安部 力
DOI: 10.7875/first.author.2017.026
C1 neurons mediate a stress-induced anti-inflammatory reflex in mice.
Chikara Abe, Tsuyoshi Inoue, Mabel A. Inglis, Kenneth E. Viar, Liping Huang, Hong Ye, Diane L. Rosin, Ruth L. Stornetta, Mark D. Okusa, Patrice G. Guyenet
Nature Neuroscience, 20, 700-707 (2017)
炎症の過度な亢進は自律神経系や視床下部-下垂体-副腎系と免疫細胞との相互作用により抑制される.この抗炎症作用のうち,迷走神経の遠心路および脾交感神経を介する経路はコリン作動性抗炎症反応経路とよばれる.今回,筆者らは,拘束ストレスによる自律神経系の活性化により,コリン作動性抗炎症反応経路を介して腎臓における虚血再灌流障害が軽減されることを発見した.延髄のC1ニューロンは中間帯外側細胞柱や迷走神経背側核に投射し交感神経や迷走神経を制御する.延髄のC1ニューロンを光遺伝学的な手法により選択的に興奮させたところ,腎臓における虚血再灌流障害が軽減した.さらに,延髄のC1ニューロンを抑制あるいは除去したところ,腎臓における虚血再灌流障害の軽減は部分的あるいは完全に消失した.これらの結果から,自律神経の活性化による腎臓における虚血再灌流障害の軽減には延髄C1ニューロンが関与することがわかった.
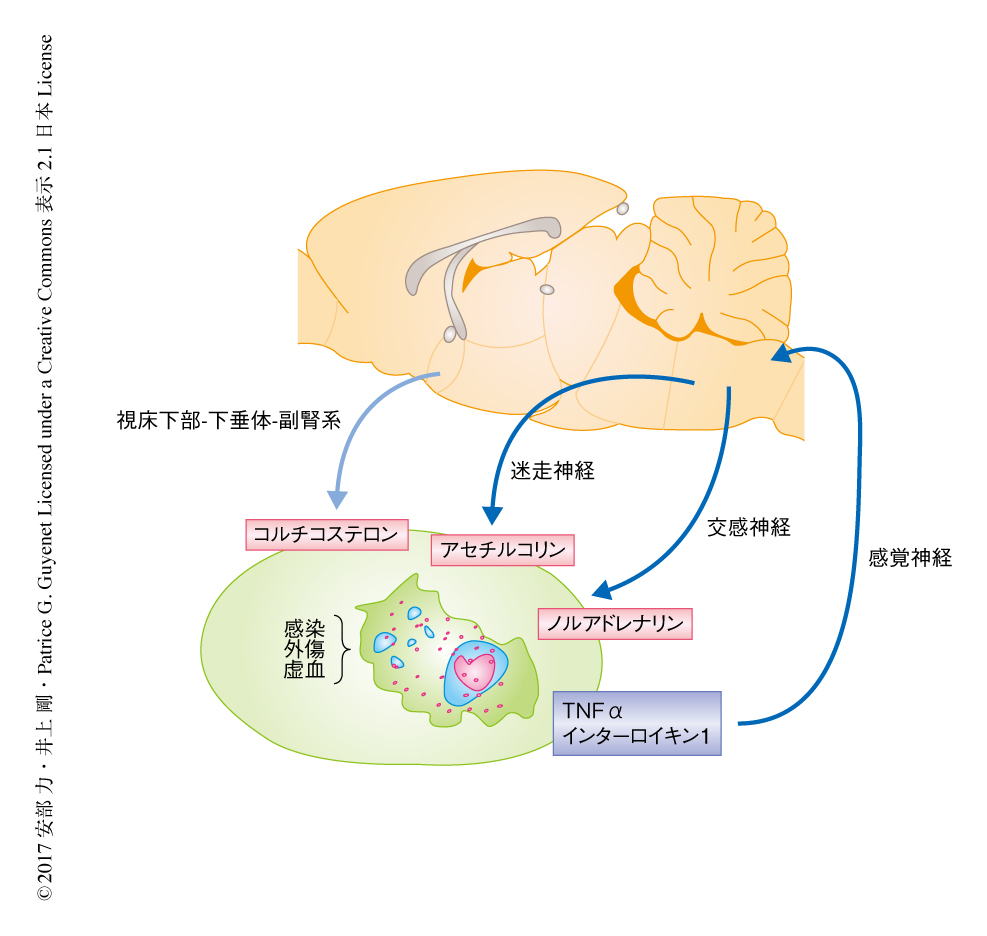
自律神経系や視床下部-下垂体-副腎系により産生されるグルココルチコイドは炎症の過度な亢進を抑制することが知られている1)(図1).また,自律神経系の活性化は免疫系を活性化し,抗炎症作用を起こすことが知られている2).とくに,副交感神経のひとつである迷走神経においては遠心路の電気刺激により抗炎症作用がひき起こされ,この経路はコリン作動性抗炎症反応経路とよばれる2,3).迷走神経の遠心路から脾交感神経への経路についてはいまだ不明であるが,コリン作動性抗炎症反応経路においては脾交感神経を介する脾臓における免疫細胞の活性化が重要であると考えられている.コリンアセチルトランスフェラーゼ陽性の脾臓メモリーT細胞のβ2アドレナリン受容体に脾交感神経から放出されたノルアドレナリンが結合することによりアセチルコリンが放出され,近接するマクロファージのα7ニコチン性受容体と結合することにより炎症性サイトカインの放出が制御される4).これまで,さまざまな疾患モデルにおいてコリン作動性抗炎症反応経路を介した抗炎症作用が報告されている.
自律神経系,とくに交感神経は,低酸素,低血圧,低血糖,感染などの身体的および心理的なストレスにより動員されることがよく知られている5).急性のストレスは胸腺や脾臓からの免疫細胞の放出を促進することが知られており,自律神経系の関与が示唆される6).これら自律神経の応答の一部は延髄のC1ニューロンが担い,中間帯外側細胞柱,迷走神経背側核,室傍核に投射することにより自律神経系や視床下部-下垂体-副腎系を制御する7).この延髄のC1ニューロンの一部は炎症性サイトカイン,リポ多糖,フットショックなどのストレッサーにより活動が亢進することから8),拘束ストレスなどの急性のストレスにより延髄のC1ニューロンを介してコリン作動性抗炎症反応経路が活性化され抗炎症作用を呈すると考えられた.そこで,この研究においては,腎臓における虚血再灌流障害の軽減に対する拘束ストレスの効果に延髄のC1ニューロンが関与するかどうか調べた.
短時間の拘束ストレスにより腎臓における虚血再灌流障害は軽減するかどうか,また,その軽減にコリン作動性抗炎症反応経路が関与するかどうか調べた.10分間の拘束ストレスから24時間のち,両側の腎動静脈クランプにより26分間にわたり血流を停止し,そののち,再灌流した.それから24時間のちに採血および腎臓の組織を採取し,血中のクレアチニンの濃度,腎臓におけるKim-1遺伝子の発現,腎尿細管の壊死について測定した.拘束ストレスによりおのおのの項目の値が有意に低下したことから,短時間の拘束ストレスにより腎臓における虚血再灌流障害は軽減することがわかった.一方,α7ニコチン性受容体ノックアウトマウスにおいては拘束ストレスによる腎臓における虚血再灌流障害は軽減しなかったことから,コリン作動性抗炎症反応経路の関与が示唆された.
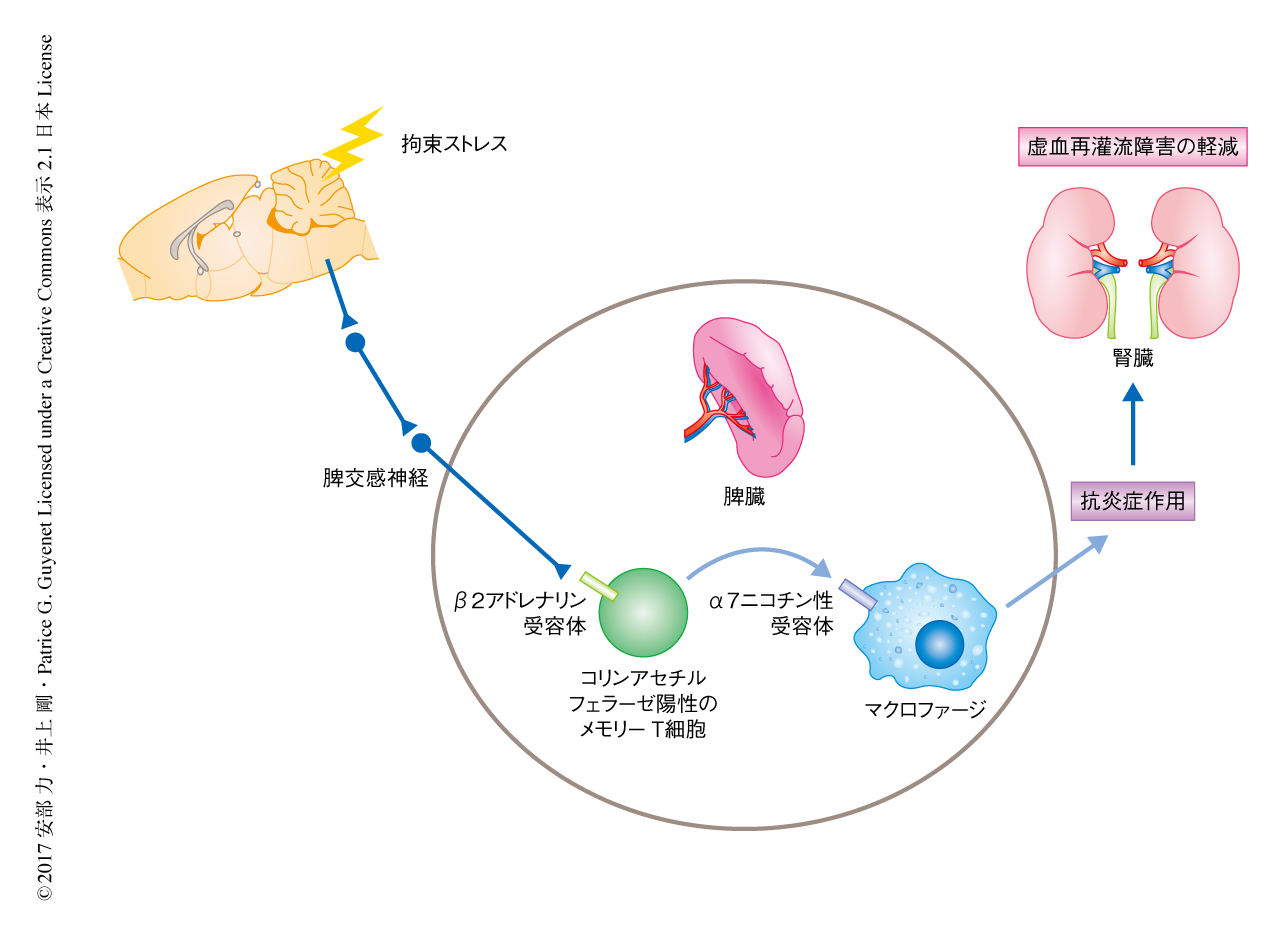
腎臓における虚血再灌流障害の軽減に対するコリン作動性抗炎症反応経路の関与についてさらに調べるため,拘束ストレスをあたえたマウスの脾細胞をレシピエントマウスに移植したとき,腎臓における虚血再灌流障害が軽減するかどうか調べた.10分間の拘束ストレスののち脾細胞を取り出してレシピエントマウスに投与し,24時間のちに血流の停止および再灌流を行った.その結果,5×106個の脾細胞の投与により腎臓における虚血再灌流障害が軽減した.脾交感神経の末端から放出されるノルアドレナリンの関与について調べるため,マウスの脾細胞からCD4陽性T細胞だけを取り出してノルアドレナリンを投与した.それらをレシピエントマウスに投与し,24時間のちに血流の停止および再灌流を行ったところ,血中のクレアチニンの濃度の有意な低下がみられた.これらの結果から,拘束ストレスによる腎臓における虚血再灌流障害の軽減はコリン作動性抗炎症反応経路を介することがわかった(図2).
延髄のC1ニューロンの選択的な刺激により自律神経系や視床下部-下垂体-副腎系が活性化するかどうか調べた.光遺伝学的な手法により延髄のC1ニューロンを選択的に興奮させたところ,迷走神経の活動の増加,交感神経における誘発電位,血中のコルチコステロンの濃度の上昇がみられた.延髄のC1ニューロンを10分間にわたり刺激し,24時間のちに血流の停止および再灌流を行ったところ,血中のクレアチニンの濃度,腎臓におけるKim-1遺伝子の発現,腎尿細管の壊死は有意に抑制されたことから,延髄のC1ニューロンの光遺伝学的な刺激により腎臓における虚血再灌流障害が軽減されることがわかった.横隔膜における迷走神経の切断,あるいは,コルチコステロン受容体の阻害剤の投与により,この軽減は消失しなかったことから,延髄のC1ニューロンの光遺伝学的な刺激による腎臓における虚血再灌流障害の軽減は交感神経系を介することが示唆された.また,β2アドレナリン受容体の阻害剤,神経節の阻害剤,脾臓の摘出により,延髄のC1ニューロンの光遺伝学的な刺激による腎臓における虚血再灌流障害の軽減が消失したことから,この軽減はコリン作動性抗炎症反応経路を介することがわかった.
拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与するかどうかをみるため,延髄のC1ニューロンを抑制あるいは除去したとき,拘束ストレスによる腎臓における虚血再灌流障害が軽減するかどうか調べた.延髄のC1ニューロンを選択的に抑制しながら拘束ストレスをあたえたところ腎臓における虚血再灌流障害の軽減は部分的に消失し,また,延髄のC1ニューロンを選択的に除去したマウスにおいて腎臓における虚血再灌流障害の軽減は完全に消失した.このことから,拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与することがわかった.
われわれの生活環境におけるストレスは急性ストレスと慢性ストレスとに大別される.免疫系において,慢性ストレスは悪のイメージが強いのに対し急性ストレスには良の部分のあることが知られている6).たとえば,日常の運動は心循環器系や呼吸器系に対し急性のストレスとなるが,定期的に運動することにより病気になりにくくなることは周知の事実である.このような例から考えると,自律神経系や視床下部-下垂体-副腎系の定期的な活性化が免疫細胞のプライムな状態をつくりだし,疾患や障害に対しいつでも戦えるよう準備されている可能性が考えられる.
今回の研究において,拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与することがわかった.腎臓における虚血再灌流障害の軽減に対しおもに交感神経系の関与することがわかったが,そのほかの疾患や障害において,延髄のC1ニューロンからどの系への出力が重要であるかは不明である.また,今回の研究においては,延髄C1ニューロンから自律神経系や視床下部-下垂体-副腎系への投射,すなわち,出力系に注目したが,疾患や障害が生じてからの延髄のC1ニューロンへの入力系についてはいまだに謎である.これまでの数多くの研究により,末梢レベルにおけるコリン作動性抗炎症反応経路の解明は進んだが,今後は,中枢レベルにおける解明が重要になると考えられ,今回の研究がその切り口になることを願う.
略歴:2008年 岐阜大学大学院医学系研究科 修了,同 研究員,同 助教,同 講師を経て,同 准教授.2014年~2016年 米国Virginia大学School of Medicine研究員.
関心事:宇宙空間などにおける重力環境の変化に対する自律神経の応答.この機構の解明がヒトが月や火星で生きていくカギになると信じています.
井上 剛(Tsuyoshi Inoue)
米国Virginia大学School of Medicineリサーチフェロー.
Patrice G. Guyenet
米国Virginia大学School of Medicine教授.
© 2017 安部 力・井上 剛・Patrice G. Guyenet Licensed under CC 表示 2.1 日本
(米国Virginia大学School of Medicine,1 Department of Pharmacology,2 Department of Medicine)
email:安部 力
DOI: 10.7875/first.author.2017.026
C1 neurons mediate a stress-induced anti-inflammatory reflex in mice.
Chikara Abe, Tsuyoshi Inoue, Mabel A. Inglis, Kenneth E. Viar, Liping Huang, Hong Ye, Diane L. Rosin, Ruth L. Stornetta, Mark D. Okusa, Patrice G. Guyenet
Nature Neuroscience, 20, 700-707 (2017)
要 約
炎症の過度な亢進は自律神経系や視床下部-下垂体-副腎系と免疫細胞との相互作用により抑制される.この抗炎症作用のうち,迷走神経の遠心路および脾交感神経を介する経路はコリン作動性抗炎症反応経路とよばれる.今回,筆者らは,拘束ストレスによる自律神経系の活性化により,コリン作動性抗炎症反応経路を介して腎臓における虚血再灌流障害が軽減されることを発見した.延髄のC1ニューロンは中間帯外側細胞柱や迷走神経背側核に投射し交感神経や迷走神経を制御する.延髄のC1ニューロンを光遺伝学的な手法により選択的に興奮させたところ,腎臓における虚血再灌流障害が軽減した.さらに,延髄のC1ニューロンを抑制あるいは除去したところ,腎臓における虚血再灌流障害の軽減は部分的あるいは完全に消失した.これらの結果から,自律神経の活性化による腎臓における虚血再灌流障害の軽減には延髄C1ニューロンが関与することがわかった.
はじめに
自律神経系や視床下部-下垂体-副腎系により産生されるグルココルチコイドは炎症の過度な亢進を抑制することが知られている1)(図1).また,自律神経系の活性化は免疫系を活性化し,抗炎症作用を起こすことが知られている2).とくに,副交感神経のひとつである迷走神経においては遠心路の電気刺激により抗炎症作用がひき起こされ,この経路はコリン作動性抗炎症反応経路とよばれる2,3).迷走神経の遠心路から脾交感神経への経路についてはいまだ不明であるが,コリン作動性抗炎症反応経路においては脾交感神経を介する脾臓における免疫細胞の活性化が重要であると考えられている.コリンアセチルトランスフェラーゼ陽性の脾臓メモリーT細胞のβ2アドレナリン受容体に脾交感神経から放出されたノルアドレナリンが結合することによりアセチルコリンが放出され,近接するマクロファージのα7ニコチン性受容体と結合することにより炎症性サイトカインの放出が制御される4).これまで,さまざまな疾患モデルにおいてコリン作動性抗炎症反応経路を介した抗炎症作用が報告されている.
自律神経系,とくに交感神経は,低酸素,低血圧,低血糖,感染などの身体的および心理的なストレスにより動員されることがよく知られている5).急性のストレスは胸腺や脾臓からの免疫細胞の放出を促進することが知られており,自律神経系の関与が示唆される6).これら自律神経の応答の一部は延髄のC1ニューロンが担い,中間帯外側細胞柱,迷走神経背側核,室傍核に投射することにより自律神経系や視床下部-下垂体-副腎系を制御する7).この延髄のC1ニューロンの一部は炎症性サイトカイン,リポ多糖,フットショックなどのストレッサーにより活動が亢進することから8),拘束ストレスなどの急性のストレスにより延髄のC1ニューロンを介してコリン作動性抗炎症反応経路が活性化され抗炎症作用を呈すると考えられた.そこで,この研究においては,腎臓における虚血再灌流障害の軽減に対する拘束ストレスの効果に延髄のC1ニューロンが関与するかどうか調べた.
1.拘束ストレスによる腎臓における虚血再灌流障害の軽減
短時間の拘束ストレスにより腎臓における虚血再灌流障害は軽減するかどうか,また,その軽減にコリン作動性抗炎症反応経路が関与するかどうか調べた.10分間の拘束ストレスから24時間のち,両側の腎動静脈クランプにより26分間にわたり血流を停止し,そののち,再灌流した.それから24時間のちに採血および腎臓の組織を採取し,血中のクレアチニンの濃度,腎臓におけるKim-1遺伝子の発現,腎尿細管の壊死について測定した.拘束ストレスによりおのおのの項目の値が有意に低下したことから,短時間の拘束ストレスにより腎臓における虚血再灌流障害は軽減することがわかった.一方,α7ニコチン性受容体ノックアウトマウスにおいては拘束ストレスによる腎臓における虚血再灌流障害は軽減しなかったことから,コリン作動性抗炎症反応経路の関与が示唆された.
腎臓における虚血再灌流障害の軽減に対するコリン作動性抗炎症反応経路の関与についてさらに調べるため,拘束ストレスをあたえたマウスの脾細胞をレシピエントマウスに移植したとき,腎臓における虚血再灌流障害が軽減するかどうか調べた.10分間の拘束ストレスののち脾細胞を取り出してレシピエントマウスに投与し,24時間のちに血流の停止および再灌流を行った.その結果,5×106個の脾細胞の投与により腎臓における虚血再灌流障害が軽減した.脾交感神経の末端から放出されるノルアドレナリンの関与について調べるため,マウスの脾細胞からCD4陽性T細胞だけを取り出してノルアドレナリンを投与した.それらをレシピエントマウスに投与し,24時間のちに血流の停止および再灌流を行ったところ,血中のクレアチニンの濃度の有意な低下がみられた.これらの結果から,拘束ストレスによる腎臓における虚血再灌流障害の軽減はコリン作動性抗炎症反応経路を介することがわかった(図2).
2.拘束ストレスによる腎臓における虚血再灌流障害の軽減における延髄のC1ニューロンの役割
延髄のC1ニューロンの選択的な刺激により自律神経系や視床下部-下垂体-副腎系が活性化するかどうか調べた.光遺伝学的な手法により延髄のC1ニューロンを選択的に興奮させたところ,迷走神経の活動の増加,交感神経における誘発電位,血中のコルチコステロンの濃度の上昇がみられた.延髄のC1ニューロンを10分間にわたり刺激し,24時間のちに血流の停止および再灌流を行ったところ,血中のクレアチニンの濃度,腎臓におけるKim-1遺伝子の発現,腎尿細管の壊死は有意に抑制されたことから,延髄のC1ニューロンの光遺伝学的な刺激により腎臓における虚血再灌流障害が軽減されることがわかった.横隔膜における迷走神経の切断,あるいは,コルチコステロン受容体の阻害剤の投与により,この軽減は消失しなかったことから,延髄のC1ニューロンの光遺伝学的な刺激による腎臓における虚血再灌流障害の軽減は交感神経系を介することが示唆された.また,β2アドレナリン受容体の阻害剤,神経節の阻害剤,脾臓の摘出により,延髄のC1ニューロンの光遺伝学的な刺激による腎臓における虚血再灌流障害の軽減が消失したことから,この軽減はコリン作動性抗炎症反応経路を介することがわかった.
拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与するかどうかをみるため,延髄のC1ニューロンを抑制あるいは除去したとき,拘束ストレスによる腎臓における虚血再灌流障害が軽減するかどうか調べた.延髄のC1ニューロンを選択的に抑制しながら拘束ストレスをあたえたところ腎臓における虚血再灌流障害の軽減は部分的に消失し,また,延髄のC1ニューロンを選択的に除去したマウスにおいて腎臓における虚血再灌流障害の軽減は完全に消失した.このことから,拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与することがわかった.
おわりに
われわれの生活環境におけるストレスは急性ストレスと慢性ストレスとに大別される.免疫系において,慢性ストレスは悪のイメージが強いのに対し急性ストレスには良の部分のあることが知られている6).たとえば,日常の運動は心循環器系や呼吸器系に対し急性のストレスとなるが,定期的に運動することにより病気になりにくくなることは周知の事実である.このような例から考えると,自律神経系や視床下部-下垂体-副腎系の定期的な活性化が免疫細胞のプライムな状態をつくりだし,疾患や障害に対しいつでも戦えるよう準備されている可能性が考えられる.
今回の研究において,拘束ストレスによる腎臓における虚血再灌流障害の軽減に延髄のC1ニューロンが関与することがわかった.腎臓における虚血再灌流障害の軽減に対しおもに交感神経系の関与することがわかったが,そのほかの疾患や障害において,延髄のC1ニューロンからどの系への出力が重要であるかは不明である.また,今回の研究においては,延髄C1ニューロンから自律神経系や視床下部-下垂体-副腎系への投射,すなわち,出力系に注目したが,疾患や障害が生じてからの延髄のC1ニューロンへの入力系についてはいまだに謎である.これまでの数多くの研究により,末梢レベルにおけるコリン作動性抗炎症反応経路の解明は進んだが,今後は,中枢レベルにおける解明が重要になると考えられ,今回の研究がその切り口になることを願う.
文 献
- Tracey, K. J.: The inflammatory reflex. Nature, 420, 853-859 (2002)[PubMed]
- Tracey, K. J.: Reflex control of immunity. Nat. Rev. Immunol., 9, 418-428 (2009)[PubMed]
- Inoue, T., Abe, C., Sung, S. S. et al.: Vagus nerve stimulation mediates protection from kidney ischemia-reperfusion injury through α7nAChR+ splenocytes. J. Clin. Invest., 126, 1939-1952 (2016)[PubMed]
- Pavlov, V. A. & Tracey, K. J.: Neural regulation of immunity: molecular mechanisms and clinical translation. Nat. Neurosci., 20, 156-166 (2017)[PubMed]
- Guyenet, P. G.: The sympathetic control of blood pressure. Nat. Rev. Neurosci., 7, 335-346 (2006)[PubMed]
- Dhabhar, F. S.: Effects of stress on immune function: the good, the bad, and the beautiful. Immunol. Res., 58, 193-210 (2014)[PubMed]
- Guyenet, P. G., Stornetta, R. L., Bochorishvili, G. et al.: C1 neurons: the body’s EMTs. Am. J. Physiol. Regul. Integr. Comp. Physiol., 305, R187-R204 (2013)[PubMed]
- Li, H. Y., Ericsson, A. & Sawchenko, P. E.: Distinct mechanisms underlie activation of hypothalamic neurosecretory neurons and their medullary catecholaminergic afferents in categorically different stress paradigms. Proc. Natl. Acad. Sci. USA, 93, 2359-2364 (1996)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 岐阜大学大学院医学系研究科 修了,同 研究員,同 助教,同 講師を経て,同 准教授.2014年~2016年 米国Virginia大学School of Medicine研究員.
関心事:宇宙空間などにおける重力環境の変化に対する自律神経の応答.この機構の解明がヒトが月や火星で生きていくカギになると信じています.
井上 剛(Tsuyoshi Inoue)
米国Virginia大学School of Medicineリサーチフェロー.
Patrice G. Guyenet
米国Virginia大学School of Medicine教授.
© 2017 安部 力・井上 剛・Patrice G. Guyenet Licensed under CC 表示 2.1 日本