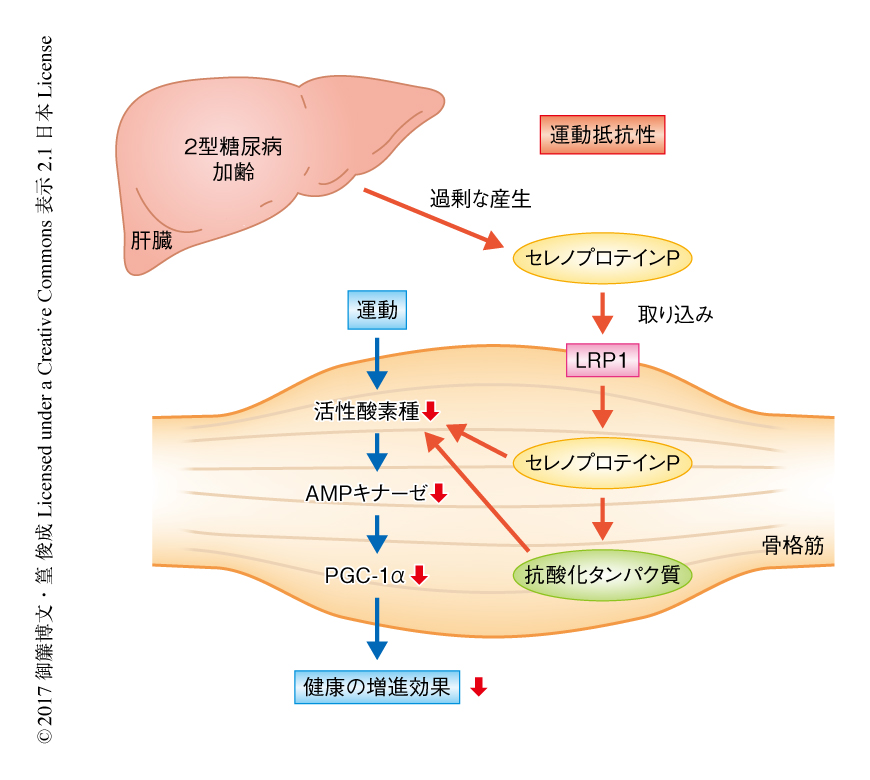
セレノプロテインPおよび受容体LRP1による運動抵抗性の誘発
御簾博文・篁 俊成
(金沢大学大学院医学系研究科 内分泌・代謝内科学分野)
email:御簾博文,篁 俊成
DOI: 10.7875/first.author.2017.025
Deficiency of the hepatokine selenoprotein P increases responsiveness to exercise in mice through upregulation of reactive oxygen species and AMP-activated protein kinase in muscle.
Hirofumi Misu, Hiroaki Takayama, Yoshiro Saito, Yuichiro Mita, Akihiro Kikuchi, Kiyo-aki Ishii, Keita Chikamoto, Takehiro Kanamori, Natsumi Tajima, Fei Lan, Yumie Takeshita, Masao Honda, Mutsumi Tanaka, Seiji Kato, Naoto Matsuyama, Yuya Yoshioka, Kaito Iwayama, Kumpei Tokuyama, Nobuhiko Akazawa, Seiji Maeda, Kazuhiro Takekoshi, Seiichi Matsugo, Noriko Noguchi, Shuichi Kaneko, Toshinari Takamura
Nature Medicine, 23, 508-516 (2017)
運動は健康の増進においてさまざまな効果をもつ.しかし,運動に対する反応性は人により著明に異なる.この運動抵抗性は先天的と考えられており,後天的な運動抵抗性の原因となる因子は知られていなかった.今回,筆者らは,抗酸化能をもつヘパトカインであるセレノプロテインPがその受容体であるLRP1を介し運動抵抗性を誘発することを示した.セレノプロテインPのノックアウトマウスは運動トレーニングの負荷ののち運動持久力が上昇するという表現型を呈し,急性運動ののちの骨格筋においては,活性酸素種の産生,AMPキナーゼのリン酸化,PGC-1αの発現が増強していた.セレノプロテインPの投与はLRP1を介し,培養筋管細胞においては過酸化水素水による細胞適応を障害し,マウスの骨格筋においては運動により誘導されるAMPキナーゼのリン酸化を抑制した.さらに,臨床においては血中のセレノプロテインP濃度の上昇した被験者は運動トレーニングによる有酸素運動能の向上が乏しかった.今回の研究により,セレノプロテインP-LRP1経路に対する阻害剤が身体活動の低下に関連した疾患を治療する“運動増強薬”になりうることが示唆された.
身体運動はヒトにおいてさまざまな健康増進の効果を発揮する1).しかし,すべての人が等しく運動により持久力の向上や代謝的な健康を得られるわけではない.ヒトにおいて運動トレーニングによる有酸素運動能の上昇には大きなばらつきがある2).たとえば,運動をしても有酸素運動能がまったく改善しない人のいることが知られている.同様に,2型糖尿病の患者の15~20%は定期的な運動療法によっても血糖の低下の効果に乏しいことが報告されている3).これらの先行研究からは,運動抵抗性に苦しむ人のいること,そのような人は身体活動による健康増進の効果から得られる利益が限定的であることが示される.運動抵抗性の原因となる因子,とくに,後天的な因子を同定することにより,身体活動の低下に関連した疾患に対峙するうえで画期的な新しい診断法あるいは治療法の提供される可能性がある.
運動による活性酸素種の産生は,酸化的な損傷の原因になるだけではなく,有益な分子生物学的な適応の仲介にも機能する4).たとえば,AMPキナーゼおよびPGC-1αは運動による骨格筋の適応反応に大きな役割を担うが,これらは活性酸素種の急性の暴露により活性化することが報告されている.近年の研究において,ヒトにおいてはビタミンCなど抗酸化物質の摂取により運動により誘発される分子的な変化が消失し,運動トレーニングによるよい効果が限定されることが示されている5).これらの研究から,急性に発生した活性酸素種が骨格筋においてAMPキナーゼやPGC-1αなどのいくつかのタンパク質を活性化することにより運動の正の効果を促進することが示唆される.しかしながら,外因性に投与された抗酸化物質とは異なり,運動により産生される活性酸素種を減少させ運動の効果を負に制御するような抗酸化能をもつ内因性の阻害物質に関する報告は多くない.
筆者らは,2型糖尿病の患者においてインスリン抵抗性および高血糖の発症に寄与するヘパトカインとしてセレノプロテインPを同定した6)(新着論文レビュー でも掲載).セレノプロテインPはおもに肝臓において産生される分泌タンパク質であり,セレン輸送タンパク質として機能する7).セレノプロテインPの産生は耐糖能に障害をもつ人や2型糖尿病の患者において増加する.セレノプロテインPは酸化ストレスを軽減させることがもともと報告されており,これは,セレノプロテインPが直接的に活性酸素種を減少させる酵素としてはたらくこと,および,セレノプロテインPが標的となる細胞にセレンを供給することによる.筆者らは,これら過去の報告を基盤として,抗酸化能をもつセレノプロテインPが骨格筋において運動により産生される活性酸素種を抑制することにより運動抵抗性に関与するとの仮説をたてた.
セレノプロテインPの運動反応性に対する効果について検討するため,セレノプロテインPのノックアウトマウスに高脂肪食と同時に定期的な運動トレーニングを負荷した.1カ月間の高脂肪食の負荷により肥満としたのち,半分のマウスには4週間にわたり有酸素運動のトレーニングを負荷し,もう半分のマウスは運動トレーニングを負荷しなかった.運動トレーニングなしのマウスにおいてはセレノプロテインPの欠損は体重や運動持久力に影響しなかったが,運動トレーニングを負荷したセレノプロテインPノックアウトマウスは野生型のマウスと比較して運動持久力の増強およびインスリンの負荷ののちの血糖の低下作用の増強が認められた.運動トレーニングを負荷したセレノプロテインPノックアウトマウスの骨格筋においてはミトコンドリアDNAの量および遅筋に関連する遺伝子の発現量が増加していた.
セレノプロテインPノックアウトマウスに3時間の単回の急性運動を負荷したところ,酸化ストレスのマーカーであるTBARSの量が増加し,AMPキナーゼのリン酸化およびPGC-1αの発現が増強した.セレノプロテインPノックアウトマウスにおいては抗酸化剤の前投与により,急性運動ののちの骨格筋においてTBARSおよびAMPキナーゼのリン酸化が減少し運動持久力が低下した.これらの結果から,セレノプロテインPの欠損により急性運動により骨格筋において活性酸素種の産生によるAMPキナーゼのリン酸化が増強し,その結果,運動反応性が増強することが示された.
C2C12培養筋管細胞を用いて運動を擬態するような実験を行った.活性酸素種のひとつである過酸化水素により筋管細胞を刺激するとAMPキナーゼのリン酸化は増強した.精製したセレノプロテインPの前処置により過酸化水素の刺激によるAMPキナーゼのリン酸化は有意に抑制され,セレン含有タンパク質のうちGPX1およびセレノプロテインWの産生が増加し,このとき,AMPキナーゼの下流において制御されるPGC-1αの発現は有意に低下した.AMPキナーゼのノックダウンによりセレノプロテインPによるPGC-1αの発現の抑制は消失した.これらの結果から,培養筋管細胞においてセレノプロテインPは活性酸素によるAMPキナーゼのリン酸化およびPGC-1αの発現に対する作用を抑制することが示された.
培養筋管細胞においてセレノプロテインPの受容体を探索した.これまでに,ApoE受容体2およびmegalinというLDL受容体ファミリーに属する2つの膜タンパク質が精巣および腎尿細管においてセレノプロテインPの取り込み受容体として機能することが報告されていた.そこで,C2C12筋管細胞においてLDL受容体ファミリーの発現について検討した.その結果,ApoE受容体2あるいはmegalinの発現はごくわずかであり,LRP1およびLDL受容体の発現量がきわめて高いことが見い出された.C2C12筋管細胞においてLRP1あるいはLDL受容体をノックダウンしたところ,LRP1のノックダウンによりセレノプロテインPによるGPX1の発現の誘導が低下した.同様に,LRP1のノックダウンにより過酸化水素の刺激によるAMPキナーゼのリン酸化に対するセレノプロテインPによる抑制は消失した.また,LRP1のノックダウンにより筋細胞とセレノプロテインPとの結合は有意に低下した.これらの結果から,培養筋管細胞においてLRP1がセレノプロテインPの受容体として機能することが示された.
骨格筋に特異的なLRP1ノックアウトマウスを作製したところ,骨格筋においてインスリンにより誘導されるAktのリン酸化が亢進しており,末梢における糖の利用率の上昇が認められた.精製したセレノプロテインPを腹腔内に投与したところ,野生型のマウスにおいては骨格筋へのセレノプロテインPの取り込みが確認されたが,骨格筋に特異的なLRP1ノックアウトマウスにおいては骨格筋へのセレノプロテインPの取り込みは有意に低下していた.また,野生型のマウスにおいては骨格筋における運動によるAMPキナーゼのリン酸化はセレノプロテインPの前投与により抑制されたが,骨格筋に特異的なLRP1ノックアウトマウスにおいてはこの抑制は消失した.これらの結果から,マウスの骨格筋においてLRP1がセレノプロテインPの取り込み受容体として機能することが示された.
骨格筋に特異的なLRP1ノックアウトマウスに高脂肪食と同時に定期的な運動トレーニングを負荷したところ,セレノプロテインPノックアウトマウスと同様に,4週間にわたる有酸素運動のトレーニングののち運動持久力の上昇およびインスリンの負荷ののちの血糖の降下作用の増強が認められた.これらの結果から,骨格筋におけるLRP1の欠損によりセレノプロテインPの欠損と同様に運動反応性が増強することが示された.
ヒトの横紋筋細胞であるRD細胞においてLRP1がセレノプロテインPの受容体として機能するかどうか検討した.RD細胞においては,LRP1およびApoE受容体2(LRP8)の発現が同等に認められた.LRP1のノックダウンあるいはApoE受容体2のノックダウンにより,セレノプロテインPの取り込みおよびGPX1の発現が有意に消失した.これらの結果から,ヒトの筋細胞においても少なくとも部分的には,LRP1がセレノプロテインPの受容体として機能することが示された.
ヒトにおいて,血中のセレノプロテインPの濃度と運動トレーニングによる運動能の向上効果との関連について検討した.31人の運動習慣のない健康な閉経後の女性が週3日以上の有酸素運動のトレーニングをした.8週間の運動トレーニングにより最大酸素摂取量は有意に上昇したが,血中のセレノプロテインPの濃度に影響はなかった.運動トレーニングのまえには最大酸素摂取量と血中のセレノプロテインP濃度とのあいだに有意な相関はなかったが,運動トレーニングのまえの血中のセレノプロテインP濃度は運動トレーニングによる最大酸素摂取量の増加量と負に相関した.運動トレーニングにより最大酸素摂取量が1.5以上増加した運動反応性の高い人と比較すると,最大酸素摂取量が0.2以上低下した運動反応性の低い人は運動トレーニングのまえの血中のセレノプロテインPの濃度が有意に高値であった.多変量解析により,年齢や体重のようなほかのパラメーターとは独立して,運動トレーニングのまえの血中のセレノプロテインPの濃度から運動トレーニングによる最大酸素摂取量の変化量が予測された.これらの結果から,ヒトにおいて運動トレーニングのまえの血中のセレノプロテインPの濃度から運動トレーニングの無効性が予測されることが示された.
今回,筆者らは,ヘパトカインであるセレノプロテインPがその受容体LRP1を介して骨格筋において運動により誘発される分子適応を障害することにより,運動抵抗性の原因になることを示した(図1).核内受容体や補因子を標的とした運動擬態薬の開発においては多くの進展がなされてきたが8),これまで,生体において運動により誘発される分子適応をさまたげるような阻害物質についてはほとんど注目されていなかった.今回の結果から,セレノプロテインP-LRP1経路に対する阻害薬を探索することにより,将来的に2型糖尿病を代表とする身体活動の低下に関連する疾患を治療する“運動増強薬”の同定につながることが示唆された.
デンマーク人を対象とした先行研究において,血中のセレノプロテインPの濃度と年齢とのあいだに正の相関があることが報告されている9).現時点では,加齢により血中のセレノプロテインPの濃度が上昇する機序は不明であるが,セレノプロテインPはヒトにおいて加齢や老化に関連した運動抵抗性の誘発に寄与する可能性がある.
セレノプロテインPは抗酸化能に関連して運動の効果を阻害するという点に特徴がある.同様に,ヒトにおいてはビタミンCなど抗酸化物質の摂取により運動による有益な効果が消失する.その機序として,運動にひきつづきミトコンドリアにおいて産生される活性酸素種がシグナル分子として機能して健康の増進効果を発揮すると信じられており,この概念はミトコンドリアホルミシスあるいはミトホルミシスとよばれている10).この概念と一致して,セレノプロテインPのノックアウトマウスにおいては運動ののちに骨格筋において活性酸素種が増加するとともに,健康長寿のマーカーとして臨床的に確立されている有酸素運動能が上昇した.骨格筋におけるセレノプロテインPの作用を低下させることにより,運動による寿命の延長効果をも増強する新たな治療法が提供される可能性がある.
略歴:2007年 金沢大学大学院医学系研究科にて博士号取得,2008年 金沢大学医薬保健研究域医学系 特任助教を経て,2014年より同 准教授.2014年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:ヘパトカインの同定および機能の解析.ヘパトカインを標的とした新たな診断法および治療法の開発.
抱負:ヘパトカインの研究がたくさんの患者を救うことを夢みて,日夜研究に邁進しています.
篁 俊成(Toshinari Takamura)
金沢大学医薬保健研究域医学系 教授.
研究室URL:http://metabology.w3.kanazawa-u.ac.jp/
© 2017 御簾博文・篁 俊成 Licensed under CC 表示 2.1 日本
(金沢大学大学院医学系研究科 内分泌・代謝内科学分野)
email:御簾博文,篁 俊成
DOI: 10.7875/first.author.2017.025
Deficiency of the hepatokine selenoprotein P increases responsiveness to exercise in mice through upregulation of reactive oxygen species and AMP-activated protein kinase in muscle.
Hirofumi Misu, Hiroaki Takayama, Yoshiro Saito, Yuichiro Mita, Akihiro Kikuchi, Kiyo-aki Ishii, Keita Chikamoto, Takehiro Kanamori, Natsumi Tajima, Fei Lan, Yumie Takeshita, Masao Honda, Mutsumi Tanaka, Seiji Kato, Naoto Matsuyama, Yuya Yoshioka, Kaito Iwayama, Kumpei Tokuyama, Nobuhiko Akazawa, Seiji Maeda, Kazuhiro Takekoshi, Seiichi Matsugo, Noriko Noguchi, Shuichi Kaneko, Toshinari Takamura
Nature Medicine, 23, 508-516 (2017)
要 約
運動は健康の増進においてさまざまな効果をもつ.しかし,運動に対する反応性は人により著明に異なる.この運動抵抗性は先天的と考えられており,後天的な運動抵抗性の原因となる因子は知られていなかった.今回,筆者らは,抗酸化能をもつヘパトカインであるセレノプロテインPがその受容体であるLRP1を介し運動抵抗性を誘発することを示した.セレノプロテインPのノックアウトマウスは運動トレーニングの負荷ののち運動持久力が上昇するという表現型を呈し,急性運動ののちの骨格筋においては,活性酸素種の産生,AMPキナーゼのリン酸化,PGC-1αの発現が増強していた.セレノプロテインPの投与はLRP1を介し,培養筋管細胞においては過酸化水素水による細胞適応を障害し,マウスの骨格筋においては運動により誘導されるAMPキナーゼのリン酸化を抑制した.さらに,臨床においては血中のセレノプロテインP濃度の上昇した被験者は運動トレーニングによる有酸素運動能の向上が乏しかった.今回の研究により,セレノプロテインP-LRP1経路に対する阻害剤が身体活動の低下に関連した疾患を治療する“運動増強薬”になりうることが示唆された.
はじめに
身体運動はヒトにおいてさまざまな健康増進の効果を発揮する1).しかし,すべての人が等しく運動により持久力の向上や代謝的な健康を得られるわけではない.ヒトにおいて運動トレーニングによる有酸素運動能の上昇には大きなばらつきがある2).たとえば,運動をしても有酸素運動能がまったく改善しない人のいることが知られている.同様に,2型糖尿病の患者の15~20%は定期的な運動療法によっても血糖の低下の効果に乏しいことが報告されている3).これらの先行研究からは,運動抵抗性に苦しむ人のいること,そのような人は身体活動による健康増進の効果から得られる利益が限定的であることが示される.運動抵抗性の原因となる因子,とくに,後天的な因子を同定することにより,身体活動の低下に関連した疾患に対峙するうえで画期的な新しい診断法あるいは治療法の提供される可能性がある.
運動による活性酸素種の産生は,酸化的な損傷の原因になるだけではなく,有益な分子生物学的な適応の仲介にも機能する4).たとえば,AMPキナーゼおよびPGC-1αは運動による骨格筋の適応反応に大きな役割を担うが,これらは活性酸素種の急性の暴露により活性化することが報告されている.近年の研究において,ヒトにおいてはビタミンCなど抗酸化物質の摂取により運動により誘発される分子的な変化が消失し,運動トレーニングによるよい効果が限定されることが示されている5).これらの研究から,急性に発生した活性酸素種が骨格筋においてAMPキナーゼやPGC-1αなどのいくつかのタンパク質を活性化することにより運動の正の効果を促進することが示唆される.しかしながら,外因性に投与された抗酸化物質とは異なり,運動により産生される活性酸素種を減少させ運動の効果を負に制御するような抗酸化能をもつ内因性の阻害物質に関する報告は多くない.
筆者らは,2型糖尿病の患者においてインスリン抵抗性および高血糖の発症に寄与するヘパトカインとしてセレノプロテインPを同定した6)(新着論文レビュー でも掲載).セレノプロテインPはおもに肝臓において産生される分泌タンパク質であり,セレン輸送タンパク質として機能する7).セレノプロテインPの産生は耐糖能に障害をもつ人や2型糖尿病の患者において増加する.セレノプロテインPは酸化ストレスを軽減させることがもともと報告されており,これは,セレノプロテインPが直接的に活性酸素種を減少させる酵素としてはたらくこと,および,セレノプロテインPが標的となる細胞にセレンを供給することによる.筆者らは,これら過去の報告を基盤として,抗酸化能をもつセレノプロテインPが骨格筋において運動により産生される活性酸素種を抑制することにより運動抵抗性に関与するとの仮説をたてた.
1.セレノプロテインPの欠損は運動トレーニングに対する反応性を増強する
セレノプロテインPの運動反応性に対する効果について検討するため,セレノプロテインPのノックアウトマウスに高脂肪食と同時に定期的な運動トレーニングを負荷した.1カ月間の高脂肪食の負荷により肥満としたのち,半分のマウスには4週間にわたり有酸素運動のトレーニングを負荷し,もう半分のマウスは運動トレーニングを負荷しなかった.運動トレーニングなしのマウスにおいてはセレノプロテインPの欠損は体重や運動持久力に影響しなかったが,運動トレーニングを負荷したセレノプロテインPノックアウトマウスは野生型のマウスと比較して運動持久力の増強およびインスリンの負荷ののちの血糖の低下作用の増強が認められた.運動トレーニングを負荷したセレノプロテインPノックアウトマウスの骨格筋においてはミトコンドリアDNAの量および遅筋に関連する遺伝子の発現量が増加していた.
2.セレノプロテインPの欠損により急性運動ののちの活性酸素種の産生,AMPキナーゼのリン酸化,PGC-1αの発現が増強する
セレノプロテインPノックアウトマウスに3時間の単回の急性運動を負荷したところ,酸化ストレスのマーカーであるTBARSの量が増加し,AMPキナーゼのリン酸化およびPGC-1αの発現が増強した.セレノプロテインPノックアウトマウスにおいては抗酸化剤の前投与により,急性運動ののちの骨格筋においてTBARSおよびAMPキナーゼのリン酸化が減少し運動持久力が低下した.これらの結果から,セレノプロテインPの欠損により急性運動により骨格筋において活性酸素種の産生によるAMPキナーゼのリン酸化が増強し,その結果,運動反応性が増強することが示された.
3.セレノプロテインPは培養筋管細胞において活性酸素種によるAMPキナーゼのリン酸化およびPGC-1αの発現を抑制する
C2C12培養筋管細胞を用いて運動を擬態するような実験を行った.活性酸素種のひとつである過酸化水素により筋管細胞を刺激するとAMPキナーゼのリン酸化は増強した.精製したセレノプロテインPの前処置により過酸化水素の刺激によるAMPキナーゼのリン酸化は有意に抑制され,セレン含有タンパク質のうちGPX1およびセレノプロテインWの産生が増加し,このとき,AMPキナーゼの下流において制御されるPGC-1αの発現は有意に低下した.AMPキナーゼのノックダウンによりセレノプロテインPによるPGC-1αの発現の抑制は消失した.これらの結果から,培養筋管細胞においてセレノプロテインPは活性酸素によるAMPキナーゼのリン酸化およびPGC-1αの発現に対する作用を抑制することが示された.
4.培養筋管細胞におけるセレノプロテインPの作用は受容体LRP1を介する
培養筋管細胞においてセレノプロテインPの受容体を探索した.これまでに,ApoE受容体2およびmegalinというLDL受容体ファミリーに属する2つの膜タンパク質が精巣および腎尿細管においてセレノプロテインPの取り込み受容体として機能することが報告されていた.そこで,C2C12筋管細胞においてLDL受容体ファミリーの発現について検討した.その結果,ApoE受容体2あるいはmegalinの発現はごくわずかであり,LRP1およびLDL受容体の発現量がきわめて高いことが見い出された.C2C12筋管細胞においてLRP1あるいはLDL受容体をノックダウンしたところ,LRP1のノックダウンによりセレノプロテインPによるGPX1の発現の誘導が低下した.同様に,LRP1のノックダウンにより過酸化水素の刺激によるAMPキナーゼのリン酸化に対するセレノプロテインPによる抑制は消失した.また,LRP1のノックダウンにより筋細胞とセレノプロテインPとの結合は有意に低下した.これらの結果から,培養筋管細胞においてLRP1がセレノプロテインPの受容体として機能することが示された.
5.LRP1の欠損により運動によるAMPキナーゼのリン酸化に対するセレノプロテインPによる抑制は消失し運動トレーニングへの反応性は増強する
骨格筋に特異的なLRP1ノックアウトマウスを作製したところ,骨格筋においてインスリンにより誘導されるAktのリン酸化が亢進しており,末梢における糖の利用率の上昇が認められた.精製したセレノプロテインPを腹腔内に投与したところ,野生型のマウスにおいては骨格筋へのセレノプロテインPの取り込みが確認されたが,骨格筋に特異的なLRP1ノックアウトマウスにおいては骨格筋へのセレノプロテインPの取り込みは有意に低下していた.また,野生型のマウスにおいては骨格筋における運動によるAMPキナーゼのリン酸化はセレノプロテインPの前投与により抑制されたが,骨格筋に特異的なLRP1ノックアウトマウスにおいてはこの抑制は消失した.これらの結果から,マウスの骨格筋においてLRP1がセレノプロテインPの取り込み受容体として機能することが示された.
骨格筋に特異的なLRP1ノックアウトマウスに高脂肪食と同時に定期的な運動トレーニングを負荷したところ,セレノプロテインPノックアウトマウスと同様に,4週間にわたる有酸素運動のトレーニングののち運動持久力の上昇およびインスリンの負荷ののちの血糖の降下作用の増強が認められた.これらの結果から,骨格筋におけるLRP1の欠損によりセレノプロテインPの欠損と同様に運動反応性が増強することが示された.
6.セレノプロテインPはヒトの筋細胞において機能する
ヒトの横紋筋細胞であるRD細胞においてLRP1がセレノプロテインPの受容体として機能するかどうか検討した.RD細胞においては,LRP1およびApoE受容体2(LRP8)の発現が同等に認められた.LRP1のノックダウンあるいはApoE受容体2のノックダウンにより,セレノプロテインPの取り込みおよびGPX1の発現が有意に消失した.これらの結果から,ヒトの筋細胞においても少なくとも部分的には,LRP1がセレノプロテインPの受容体として機能することが示された.
7.ヒトにおいて血中のセレノプロテインPの濃度から運動トレーニングの無効性が予測される
ヒトにおいて,血中のセレノプロテインPの濃度と運動トレーニングによる運動能の向上効果との関連について検討した.31人の運動習慣のない健康な閉経後の女性が週3日以上の有酸素運動のトレーニングをした.8週間の運動トレーニングにより最大酸素摂取量は有意に上昇したが,血中のセレノプロテインPの濃度に影響はなかった.運動トレーニングのまえには最大酸素摂取量と血中のセレノプロテインP濃度とのあいだに有意な相関はなかったが,運動トレーニングのまえの血中のセレノプロテインP濃度は運動トレーニングによる最大酸素摂取量の増加量と負に相関した.運動トレーニングにより最大酸素摂取量が1.5以上増加した運動反応性の高い人と比較すると,最大酸素摂取量が0.2以上低下した運動反応性の低い人は運動トレーニングのまえの血中のセレノプロテインPの濃度が有意に高値であった.多変量解析により,年齢や体重のようなほかのパラメーターとは独立して,運動トレーニングのまえの血中のセレノプロテインPの濃度から運動トレーニングによる最大酸素摂取量の変化量が予測された.これらの結果から,ヒトにおいて運動トレーニングのまえの血中のセレノプロテインPの濃度から運動トレーニングの無効性が予測されることが示された.
おわりに
今回,筆者らは,ヘパトカインであるセレノプロテインPがその受容体LRP1を介して骨格筋において運動により誘発される分子適応を障害することにより,運動抵抗性の原因になることを示した(図1).核内受容体や補因子を標的とした運動擬態薬の開発においては多くの進展がなされてきたが8),これまで,生体において運動により誘発される分子適応をさまたげるような阻害物質についてはほとんど注目されていなかった.今回の結果から,セレノプロテインP-LRP1経路に対する阻害薬を探索することにより,将来的に2型糖尿病を代表とする身体活動の低下に関連する疾患を治療する“運動増強薬”の同定につながることが示唆された.
デンマーク人を対象とした先行研究において,血中のセレノプロテインPの濃度と年齢とのあいだに正の相関があることが報告されている9).現時点では,加齢により血中のセレノプロテインPの濃度が上昇する機序は不明であるが,セレノプロテインPはヒトにおいて加齢や老化に関連した運動抵抗性の誘発に寄与する可能性がある.
セレノプロテインPは抗酸化能に関連して運動の効果を阻害するという点に特徴がある.同様に,ヒトにおいてはビタミンCなど抗酸化物質の摂取により運動による有益な効果が消失する.その機序として,運動にひきつづきミトコンドリアにおいて産生される活性酸素種がシグナル分子として機能して健康の増進効果を発揮すると信じられており,この概念はミトコンドリアホルミシスあるいはミトホルミシスとよばれている10).この概念と一致して,セレノプロテインPのノックアウトマウスにおいては運動ののちに骨格筋において活性酸素種が増加するとともに,健康長寿のマーカーとして臨床的に確立されている有酸素運動能が上昇した.骨格筋におけるセレノプロテインPの作用を低下させることにより,運動による寿命の延長効果をも増強する新たな治療法が提供される可能性がある.
文 献
- Bishop-Bailey, D.: Mechanisms governing the health and performance benefits of exercise. Br. J. Pharmacol., 170, 1153-1166 (2013)[PubMed]
- Bouchard, C., Rankinen, T. & Timmons, J. A.: Genomics and genetics in the biology of adaptation to exercise. Compr. Physiol., 1, 1603-1648 (2011)[PubMed]
- Stephens, N. A. & Sparks, L. M.: Resistance to the beneficial effects of exercise in type 2 diabetes: are some individuals programmed to fail? J. Clin. Endocrinol. Metab., 100, 43-52 (2015)[PubMed]
- Niess, A. M. & Simon, P.: Response and adaptation of skeletal muscle to exercise; the role of reactive oxygen species. Front. Biosci., 12, 4826-4838 (2007)[PubMed]
- Ristow, M., Zarse, K., Oberbach, A. et al.: Antioxidants prevent health-promoting effects of physical exercise in humans. Proc. Natl. Acad. Sci. USA, 106, 8665-8670 (2009)[PubMed]
- Misu, H., Takamura, T., Takayama, H. et al.: A liver-derived secretory protein, selenoprotein P, causes insulin resistance. Cell Metab., 12, 483-495 (2010)[PubMed] [新着論文レビュー]
- Saito, Y. & Takahashi, K.: Characterization of selenoprotein P as a selenium supply protein. Eur. J. Biochem., 269, 5746-5751 (2002)[PubMed]
- Narkar, V. A., Downes, M., Yu, R. T. et al.: AMPK and PPARδ agonists are exercise mimetics. Cell, 134, 405-415 (2008)[PubMed]
- Rasmussen, L. B., Hollenbach, B., Laurberg, P. et al.: Serum selenium and selenoprotein P status in adult Danes: 8-year followup. J. Trace Elem. Med. Biol.,23, 265-271 (2009)[PubMed]
- Ristow, M.: Unraveling the truth about antioxidants: mitohormesis explains ROS-induced health benefits. Nat. Med., 20, 709-711 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 金沢大学大学院医学系研究科にて博士号取得,2008年 金沢大学医薬保健研究域医学系 特任助教を経て,2014年より同 准教授.2014年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:ヘパトカインの同定および機能の解析.ヘパトカインを標的とした新たな診断法および治療法の開発.
抱負:ヘパトカインの研究がたくさんの患者を救うことを夢みて,日夜研究に邁進しています.
篁 俊成(Toshinari Takamura)
金沢大学医薬保健研究域医学系 教授.
研究室URL:http://metabology.w3.kanazawa-u.ac.jp/
© 2017 御簾博文・篁 俊成 Licensed under CC 表示 2.1 日本