X線自由電子レーザーにより明らかにされた光化学系II複合体の反応中間体の構造と水の分解および酸素の発生の反応機構
菅 倫寛・秋田総理・沈 建仁
(岡山大学異分野基礎科学研究所 光合成・構造生物学研究コア構造解析研究分野)
email:沈 建仁
DOI: 10.7875/first.author.2017.023
Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL.
Michihiro Suga, Fusamichi Akita, Michihiro Sugahara, Minoru Kubo, Yoshiki Nakajima, Takanori Nakane, Keitaro Yamashita, Yasufumi Umena, Makoto Nakabayashi, Takahiro Yamane, Takamitsu Nakano, Mamoru Suzuki, Tetsuya Masuda, Shigeyuki Inoue, Tetsunari Kimura, Takashi Nomura, Shinichiro Yonekura, Long-Jiang Yu, Tomohiro Sakamoto, Taiki Motomura, Jing-Hua Chen, Yuki Kato, Takumi Noguchi, Kensuke Tono, Yasumasa Joti, Takashi Kameshima, Takaki Hatsui, Eriko Nango, Rie Tanaka, Hisashi Naitow, Yoshinori Matsuura, Ayumi Yamashita, Masaki Yamamoto, Osamu Nureki, Makina Yabashi, Tetsuya Ishikawa, So Iwata, Jian-Ren Shen
Nature, 543, 131-135 (2017)
光化学系II複合体は酸素発生型の光合成において最初の反応を担い,光のエネルギーを利用して水分子を電子,プロトン,酸素に分解し分子状酸素を放出する.筆者らは,この水の分解および酸素の発生の反応機構を明らかにするため,X線自由電子レーザーおよび光化学系II複合体の微小結晶を用いて,2回の閃光の照射により光励起させた光化学系II複合体の反応中間体についてS3状態に相当する構造を2.35Å分解能で決定した.暗黒において安定なS1状態の構造との比較および同型差フーリエ電子密度図により,光励起により起こる構造の変化が電子供与側および電子授与側において確認された.とりわけ,酸素発生中心の周辺において,プロトンの放出,および,これまで基質の候補とされていたオキソ酸素のひとつO5の近辺への新しい水分子に相当するO6の挿入が確認された.これにより,Si状態が遷移するときのプロトンの放出の経路,および,O5とO6がO=O結合を形成する反応機構が提唱された.
酸素発生型の光合成においては,光化学系II複合体および光化学系I複合体が中心となり,光のエネルギーを利用して水を電子供与体とする一連の電子伝達反応およびプロトンの輸送により糖の合成に必要な還元力およびATPが得られる.光化学系II複合体の酸素発生中心においては,基質である水分子が酸素,プロトン,電子へと分解され分子状酸素が放出される水の分解がSi状態とよばれる5つの酸化状態をへて触媒される.Si状態のi(i = 0, 1, 2, 3, 4)は酸素発生中心に蓄積された酸化数を表わし,光化学系II複合体において光励起した反応中心クロロフィルの電子が,電子授与体であるQBキノンまで伝達されたことにより生じる正孔を,酸素発生中心がおぎなうことにより順に増加する.反応開始の状態であるS1状態から反応遷移の状態であるS4状態へと達すると,酸素発生中心に蓄積された酸化力は水分子の酸化および分子状酸素の発生を起こし,酸素発生中心をS0状態へともどす.
酸素発生中心のS1状態に相当する構造は1.9Å分解能で決定され,その正体はMn4CaO5の組成をもつ“ゆがんだイス”のようなかたちであることが明らかにされた1).さらに,X線による損傷をうけていない1.95Å分解能の構造から,酸素発生中心の“ゆがんだイス”を構成するMn原子の価数およびおのおのの原子のあいだの正確な距離が明らかにされたが2)(新着論文レビュー でも掲載),水の分解の反応機構への考察はこれら反応開始の状態の立体構造およびそれらに関連した理論計算や分光学的な知見などから導き出されたものにすぎなかった.とくに,酸素発生中心にあるO5とよばれるオキソ酸素はほかのオキソ酸素と比べ周囲のMn原子との結合距離が長く,ゆえに,反応性に富む環境にあると推定されたことから,O5が酸素の発生の基質のひとつとなる反応機構が提唱されていたが,そのような反応機構が実際に存在するかどうかは不明であった.かりに存在したとしても,O5の近くには酸素の発生に必要なもうひとつの基質である水分子を収容できるだけの空間がないため,S1状態の構造だけからは反応機構をうまく説明できない.このため,O5とは異なる部位において分子状酸素が発生する反応機構もいくつか提案され,多くの議論がなされている.さらに,水の分解の反応においては水分子から引き抜かれたプロトンを放出しなければならないが,その経路がどこであるか,また,どうして放出されたプロトンは逆流しないのか,といった疑問に対する実験的な証拠もほとんど存在しなかった.
近年,いちじるしく発展したX線自由電子レーザーは,超高輝度のX線をフェムト秒のパルスとして発振するため,壊れるまえに回折するという原理にもとづくタンパク質の構造決定を実現させた3).時分割シリアルフェムト秒結晶学を用いれば,タンパク質を損傷させることなく駆動する酵素反応をフェムト秒の時間分解能でとらえることが可能になる.光化学系II複合体は光の照射によりSi状態が遷移するため,レーザーの照射による光励起と時分割シリアルフェムト秒結晶学とを組み合わせたポンプ-プローブ実験により反応中間体の回折データの取得が可能である.米国のX線自由電子レーザー施設LCLSが稼動をはじめて以来,その重要性から,米国の研究グループから光化学系II複合体の反応中間体の構造がつぎつぎと報告されていたが4,5),いずれも分解能は約4.5Åにとどまり,反応機構の核心にせまることはできなかった.このため,高分解能での光化学系II複合体の反応中間体の構造解析が待ち望まれていた.
好熱性シアノバクテリアThermosynechococcus vulcanusから単離した光化学系II複合体を結晶化し,わが国のX線自由電子レーザー施設であるSACLAにて時分割シリアルフェムト秒結晶学の実験を行った.光励起の効率をよくするため,100μm以下の大きさの微小結晶を用いた.微小結晶は溶液の組成や温度などの変化による品質の劣化が起こりやすく,結晶の大きさが小さくなることによりX線の回折に寄与する結晶の体積も減少するため,高い分解能の回折斑点をあたえる結晶を調製することに苦労した.結晶化の方法,結晶化ののちに用いる溶液の組成と処理の方法,時分割シリアルフェムト秒結晶学の実験に使用する結晶輸送媒体などを細かく検討して,2Å分解能まで回折し,かつ,レーザーの照射によりS3状態までの励起が十分に起こるような結晶を得る条件を見い出した.時分割シリアルフェムト秒結晶学の実験には大量の試料を必要とする.おおよそ浴槽3杯分に相当する600リットルの細胞培養から得られた1 gの光化学系II複合体を用い,光励起していないS1状態の光化学系II複合体,および,2回の閃光の照射により励起されたS3状態の光化学系II複合体から合計68万枚の回折イメージを得て,ともに2.35Å分解能で構造を解析した.
2回の閃光の照射により励起した微小結晶はフーリエ変換赤外分光法により約半分の光化学系II複合体がS3状態をしめることが明らかにされたことなどから,観測された構造は水分子の分解の直前の状態を反映すると考えられた.ただし,光励起の効率は完全ではなくS2状態やS1状態の混入のあることをふまえ,ここでは,2回の閃光を照射した状態とよぶ.2回の閃光を照射した状態の光化学系II複合体の全体の構造はS1状態とほとんど同じであった.2回の閃光を照射した状態およびS1状態の回折データを用いて計算した同型差フーリエ電子密度図に注目したところ,Si状態の遷移による構造の変化は酸素発生中心の周辺およびQBキノンの周辺に局在することがわかった.すなわち,期待したとおりに光励起によるS3状態への遷移が起こり,その結果,電子供与側および電子授与側において起こった酸化還元反応およびプロトンの移動を構造の変化として観察することに成功したと考えられた.
光化学系II複合体の電子授与体であるQBキノンは,2つの電子とプロトンを受け取ったのちチラコイド膜にある酸化型のプラストキノンと置き換わることが知られている.QBキノンは光化学系II複合体の内部ではピンと伸びたオタマジャクシのような構造をとり,キノンの頭部はD1サブユニットのHis215およびSer264と水素結合を形成し,キノンの尾部に相当するイソプレノイド鎖はD1サブユニットのPhe211,Met214,Phe255,Phe265,Phe274,D2サブユニットのフェオフィチン,脂質の分子などにかこまれた疎水的な環境にあった.これまでに報告されたS1状態の結晶構造におけるQBキノンは熱振動の指標となる温度因子の値が高かったことから,プロトン化の状態の異なるものが存在する可能性やQBキノンが動きやすい環境にあることが推定されていた.今回の2回の閃光を照射した状態とS1状態の同型差フーリエ電子密度図およびそれぞれの結晶構造を比較したところ,電子授与体の周辺における光励起による構造の変化は,以下のように説明された(図1a).はじめにQBキノンが還元されたことにより,キノンの頭部はベンゼン環に垂直な軸の方向に約10度回転しHis215とSer264との水素結合が強化されて0.1~0.2Å短くなり,キノンの頭部は安定化して温度因子が低下する.この水素結合の強化によるキノンの頭部の安定化はイソプレノイド鎖をよじらせるという構造の変化をひき起こし,それに適応するためイソプレノイド鎖の周囲にある疎水的な環境はわずかに構造を変化する.そして,これらの疎水的な環境が変化することにより,S1状態ではQBキノンを周囲の溶媒の環境から遮蔽しているAsn266およびAsn267を含むループ領域の部分が約0.8Å動き,QBキノンが光化学系II複合体の外部に出ていくための経路が開かれる.くわえて,QBキノンをプロトン化するためのプロトンはTyr246,Glu244,D2サブユニットのLys264を含めた経路を通ること,QBキノンの近くに位置する重炭酸イオンもプロトンの移動に関与する可能性があることなどが構造の解析から明らかにされた.
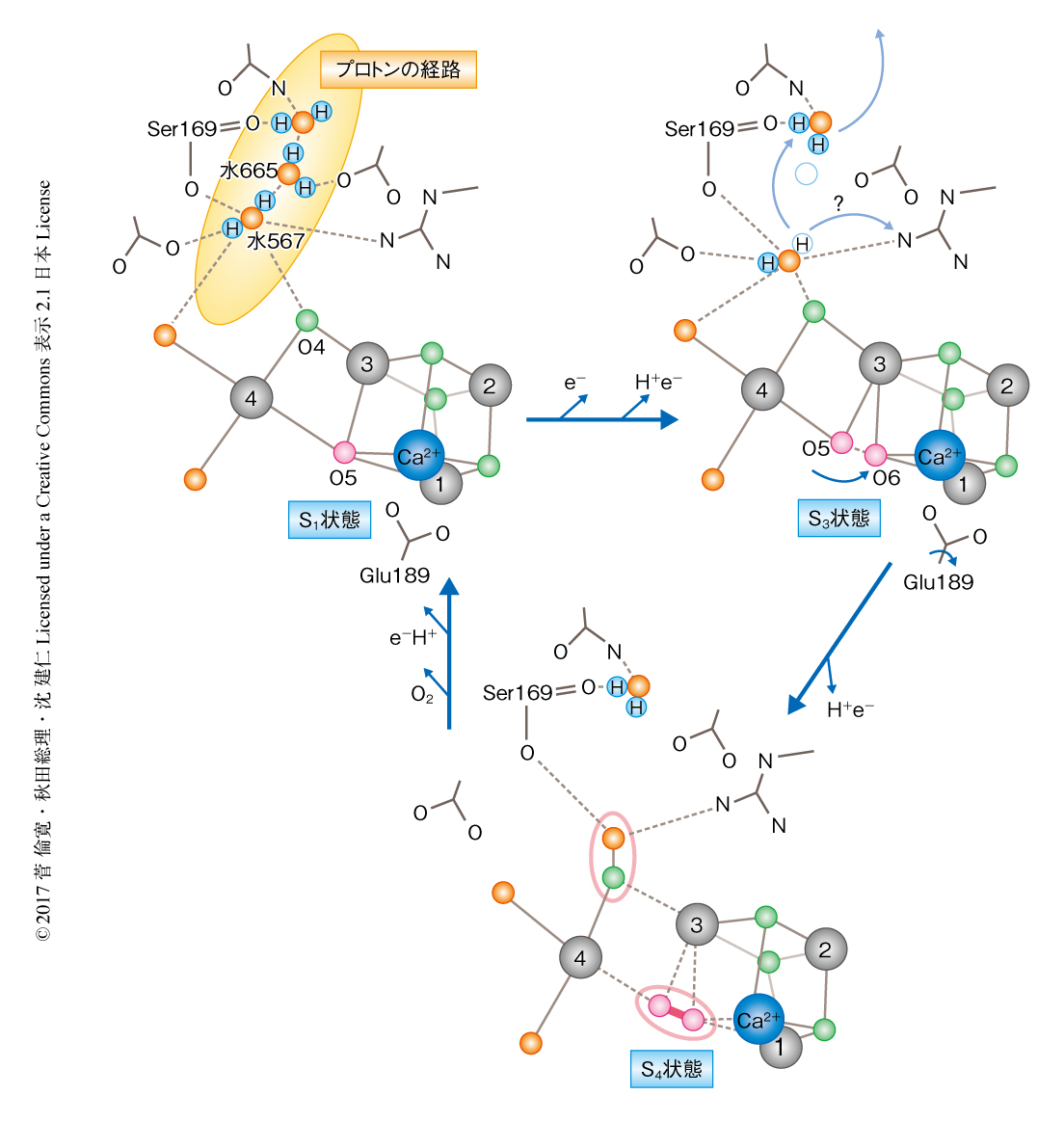
2回の閃光を照射した状態とS1状態の同型差フーリエ電子密度図およびそれぞれの結晶構造を比較したところ,少なくとも以下の顕著な構造の変化が酸素発生中心の周辺にみられ,それらは水の分解の反応機構をうまく説明した(図1b).1)Mn4がわずかに酸素発生中心のキュバン部分から離れるよう外側に動きMn4とMn1との距離は0.1~0.2Å長くなる.2)キュバン部分を構成するCa2+がMn4から離れるように動く.3)新規の基質の水分子に相当するO6の強い電子密度がO5の近くに現われる.4)Glu189がキュバン部分から遠ざかりO5とMn1とのあいだにO6を収容できる空間が現われる.5)水665とよばれる水分子の移動性が増加することによりO4を基点とする15Åにもおよぶ長い水素結合ネットワークが遮断される.6)以上の5点の構造の変化にともない,酸素発生中心の配位子であるAsp61,Asp170,His332,Ala344がわずかに動く.
酸素発生中心の周辺における構造の変化のうち,とくに水665の移動性の増加およびO6の挿入について,水の分解の反応機構の観点から述べる(図2).水665の移動性の増加により水665と水567とのあいだの水素結合がなくなり,水567はもう一方で水素結合しているO4へ0.1~0.2Å近づく.このとき,水567とO4との距離は通常の水素結合よりもずっと短くなる.これは,O4が基質でありO=O結合のための準備の段階をみている可能性が考えられたが,結晶構造解析における距離の誤差を考慮し,S3状態への遷移にともなうプロトンの放出の過程をみていると考えている.そして,水665の移動性の増加による水素結合ネットワークの分断こそが,放出されたプロトンの逆流がふせがれる理由と考えられた.なお,このプロトンの放出の経路については理論計算からもアプローチされており6),今回の結果と大方で一致した.
新しい水分子に相当するO6は基質の候補とされているO5との距離が1.5Åと,O=O結合を形成するのに適した位置に挿入された.これは,O5およびO6が酸素の発生する部位であることを強く印象づけた.S1状態から2回の閃光を照射した状態への遷移にともない,O6が挿入されて酸素発生中心はMn4CaO5クラスター構造からMn4CaO6クラスター構造へと変化し酸素が発生すると結論された.この反応機構のモデルは,S1状態の結晶の構造や損傷をうけていない結晶の構造において発見された“ゆがんだイス”におけるO5の特異な環境にもとづき提案された反応機構1,2) を実証しただけでなく,理論計算7) や電子スピン共鳴8) による提案とも大方で一致した.
この研究分野においては熾烈な競争がある.筆者らは,この論文を投稿する1カ月前に国際会議において今回の研究の内容を発表した.その時点においてはO5の反応機構に疑問をいだいており,“O5以外を基質とする反応機構があるかもしれない”と,今回の論文とは一部異なる内容を発表した.帰り急いで論文を投稿したが,査読中に競争相手の論文がNature誌に掲載されてしまった9).この論文は,国際会議での筆者らの発表の内容とよく一致していたため,ひどく落胆したものである.ところが,この話にはつづきがある.競争相手が発表した論文をよくみると,実験の結果はO5の反応機構を支持しないことがかなりはっきりと書かれていた.一方,筆者らは,国際会議での発表のあとも反応機構に自信がもてず,もういちど見直してみようと再実験を行った.その際,試料の調製の方法を再検討し励起の効率および回折データを改善した.得られたデータから電子密度図を計算したところ,反応機構の核心にせまる,O6に相当する強い正の電子密度がO5のとなりに観測されたのである.得られた電子密度にもとづきあらためて反応機構を見直すと,それまで解釈に悩んでいた構造の変化に対する納得のいく答がみつかった.競争相手にさきをこされて悔しい思いもしたが,正しい結論が導かれたことを満足している.再実験を行わずあのまま無理に解釈をつづけていても,まちがった結論しか得られなかったであろう.
今回,筆者らにより明らかにされた光化学系II複合体による水の分解の反応機構は,可視光により水を分解する人工触媒をデザインするための基本原理を世界ではじめて実証したものといえる.この反応機構の原理が環境負荷のないエネルギー源を提供するための青写真となり人工光合成の研究へと展開されることを切に願う.
略歴:2009年 大阪大学大学院理学研究科 修了,大阪大学蛋白質研究所 研究員,米国Oregon Health & Science大学 博士研究員,岡山大学大学院自然科学研究科 特任助教を経て,岡山大学異分野基礎科学研究所 助教.
研究テーマ:膜タンパク質の構造生物学.
秋田 総理(Fusamichi Akita)
岡山大学異分野基礎科学研究所 助教.
沈 建仁(Jian-Ren Shen)
岡山大学異分野基礎科学研究所 教授.
© 2017 菅 倫寛・秋田総理・沈 建仁 Licensed under CC 表示 2.1 日本
(岡山大学異分野基礎科学研究所 光合成・構造生物学研究コア構造解析研究分野)
email:沈 建仁
DOI: 10.7875/first.author.2017.023
Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL.
Michihiro Suga, Fusamichi Akita, Michihiro Sugahara, Minoru Kubo, Yoshiki Nakajima, Takanori Nakane, Keitaro Yamashita, Yasufumi Umena, Makoto Nakabayashi, Takahiro Yamane, Takamitsu Nakano, Mamoru Suzuki, Tetsuya Masuda, Shigeyuki Inoue, Tetsunari Kimura, Takashi Nomura, Shinichiro Yonekura, Long-Jiang Yu, Tomohiro Sakamoto, Taiki Motomura, Jing-Hua Chen, Yuki Kato, Takumi Noguchi, Kensuke Tono, Yasumasa Joti, Takashi Kameshima, Takaki Hatsui, Eriko Nango, Rie Tanaka, Hisashi Naitow, Yoshinori Matsuura, Ayumi Yamashita, Masaki Yamamoto, Osamu Nureki, Makina Yabashi, Tetsuya Ishikawa, So Iwata, Jian-Ren Shen
Nature, 543, 131-135 (2017)
要 約
光化学系II複合体は酸素発生型の光合成において最初の反応を担い,光のエネルギーを利用して水分子を電子,プロトン,酸素に分解し分子状酸素を放出する.筆者らは,この水の分解および酸素の発生の反応機構を明らかにするため,X線自由電子レーザーおよび光化学系II複合体の微小結晶を用いて,2回の閃光の照射により光励起させた光化学系II複合体の反応中間体についてS3状態に相当する構造を2.35Å分解能で決定した.暗黒において安定なS1状態の構造との比較および同型差フーリエ電子密度図により,光励起により起こる構造の変化が電子供与側および電子授与側において確認された.とりわけ,酸素発生中心の周辺において,プロトンの放出,および,これまで基質の候補とされていたオキソ酸素のひとつO5の近辺への新しい水分子に相当するO6の挿入が確認された.これにより,Si状態が遷移するときのプロトンの放出の経路,および,O5とO6がO=O結合を形成する反応機構が提唱された.
はじめに
酸素発生型の光合成においては,光化学系II複合体および光化学系I複合体が中心となり,光のエネルギーを利用して水を電子供与体とする一連の電子伝達反応およびプロトンの輸送により糖の合成に必要な還元力およびATPが得られる.光化学系II複合体の酸素発生中心においては,基質である水分子が酸素,プロトン,電子へと分解され分子状酸素が放出される水の分解がSi状態とよばれる5つの酸化状態をへて触媒される.Si状態のi(i = 0, 1, 2, 3, 4)は酸素発生中心に蓄積された酸化数を表わし,光化学系II複合体において光励起した反応中心クロロフィルの電子が,電子授与体であるQBキノンまで伝達されたことにより生じる正孔を,酸素発生中心がおぎなうことにより順に増加する.反応開始の状態であるS1状態から反応遷移の状態であるS4状態へと達すると,酸素発生中心に蓄積された酸化力は水分子の酸化および分子状酸素の発生を起こし,酸素発生中心をS0状態へともどす.
酸素発生中心のS1状態に相当する構造は1.9Å分解能で決定され,その正体はMn4CaO5の組成をもつ“ゆがんだイス”のようなかたちであることが明らかにされた1).さらに,X線による損傷をうけていない1.95Å分解能の構造から,酸素発生中心の“ゆがんだイス”を構成するMn原子の価数およびおのおのの原子のあいだの正確な距離が明らかにされたが2)(新着論文レビュー でも掲載),水の分解の反応機構への考察はこれら反応開始の状態の立体構造およびそれらに関連した理論計算や分光学的な知見などから導き出されたものにすぎなかった.とくに,酸素発生中心にあるO5とよばれるオキソ酸素はほかのオキソ酸素と比べ周囲のMn原子との結合距離が長く,ゆえに,反応性に富む環境にあると推定されたことから,O5が酸素の発生の基質のひとつとなる反応機構が提唱されていたが,そのような反応機構が実際に存在するかどうかは不明であった.かりに存在したとしても,O5の近くには酸素の発生に必要なもうひとつの基質である水分子を収容できるだけの空間がないため,S1状態の構造だけからは反応機構をうまく説明できない.このため,O5とは異なる部位において分子状酸素が発生する反応機構もいくつか提案され,多くの議論がなされている.さらに,水の分解の反応においては水分子から引き抜かれたプロトンを放出しなければならないが,その経路がどこであるか,また,どうして放出されたプロトンは逆流しないのか,といった疑問に対する実験的な証拠もほとんど存在しなかった.
近年,いちじるしく発展したX線自由電子レーザーは,超高輝度のX線をフェムト秒のパルスとして発振するため,壊れるまえに回折するという原理にもとづくタンパク質の構造決定を実現させた3).時分割シリアルフェムト秒結晶学を用いれば,タンパク質を損傷させることなく駆動する酵素反応をフェムト秒の時間分解能でとらえることが可能になる.光化学系II複合体は光の照射によりSi状態が遷移するため,レーザーの照射による光励起と時分割シリアルフェムト秒結晶学とを組み合わせたポンプ-プローブ実験により反応中間体の回折データの取得が可能である.米国のX線自由電子レーザー施設LCLSが稼動をはじめて以来,その重要性から,米国の研究グループから光化学系II複合体の反応中間体の構造がつぎつぎと報告されていたが4,5),いずれも分解能は約4.5Åにとどまり,反応機構の核心にせまることはできなかった.このため,高分解能での光化学系II複合体の反応中間体の構造解析が待ち望まれていた.
1.光化学系II複合体の反応中間体の構造の捕捉を目的とした時分割シリアルフェムト秒結晶学
好熱性シアノバクテリアThermosynechococcus vulcanusから単離した光化学系II複合体を結晶化し,わが国のX線自由電子レーザー施設であるSACLAにて時分割シリアルフェムト秒結晶学の実験を行った.光励起の効率をよくするため,100μm以下の大きさの微小結晶を用いた.微小結晶は溶液の組成や温度などの変化による品質の劣化が起こりやすく,結晶の大きさが小さくなることによりX線の回折に寄与する結晶の体積も減少するため,高い分解能の回折斑点をあたえる結晶を調製することに苦労した.結晶化の方法,結晶化ののちに用いる溶液の組成と処理の方法,時分割シリアルフェムト秒結晶学の実験に使用する結晶輸送媒体などを細かく検討して,2Å分解能まで回折し,かつ,レーザーの照射によりS3状態までの励起が十分に起こるような結晶を得る条件を見い出した.時分割シリアルフェムト秒結晶学の実験には大量の試料を必要とする.おおよそ浴槽3杯分に相当する600リットルの細胞培養から得られた1 gの光化学系II複合体を用い,光励起していないS1状態の光化学系II複合体,および,2回の閃光の照射により励起されたS3状態の光化学系II複合体から合計68万枚の回折イメージを得て,ともに2.35Å分解能で構造を解析した.
2.光励起およびS3状態への遷移にともなう光化学系II複合体の構造の変化
2回の閃光の照射により励起した微小結晶はフーリエ変換赤外分光法により約半分の光化学系II複合体がS3状態をしめることが明らかにされたことなどから,観測された構造は水分子の分解の直前の状態を反映すると考えられた.ただし,光励起の効率は完全ではなくS2状態やS1状態の混入のあることをふまえ,ここでは,2回の閃光を照射した状態とよぶ.2回の閃光を照射した状態の光化学系II複合体の全体の構造はS1状態とほとんど同じであった.2回の閃光を照射した状態およびS1状態の回折データを用いて計算した同型差フーリエ電子密度図に注目したところ,Si状態の遷移による構造の変化は酸素発生中心の周辺およびQBキノンの周辺に局在することがわかった.すなわち,期待したとおりに光励起によるS3状態への遷移が起こり,その結果,電子供与側および電子授与側において起こった酸化還元反応およびプロトンの移動を構造の変化として観察することに成功したと考えられた.
3.電子授与体の周辺におけるS3状態への遷移による構造の変化
光化学系II複合体の電子授与体であるQBキノンは,2つの電子とプロトンを受け取ったのちチラコイド膜にある酸化型のプラストキノンと置き換わることが知られている.QBキノンは光化学系II複合体の内部ではピンと伸びたオタマジャクシのような構造をとり,キノンの頭部はD1サブユニットのHis215およびSer264と水素結合を形成し,キノンの尾部に相当するイソプレノイド鎖はD1サブユニットのPhe211,Met214,Phe255,Phe265,Phe274,D2サブユニットのフェオフィチン,脂質の分子などにかこまれた疎水的な環境にあった.これまでに報告されたS1状態の結晶構造におけるQBキノンは熱振動の指標となる温度因子の値が高かったことから,プロトン化の状態の異なるものが存在する可能性やQBキノンが動きやすい環境にあることが推定されていた.今回の2回の閃光を照射した状態とS1状態の同型差フーリエ電子密度図およびそれぞれの結晶構造を比較したところ,電子授与体の周辺における光励起による構造の変化は,以下のように説明された(図1a).はじめにQBキノンが還元されたことにより,キノンの頭部はベンゼン環に垂直な軸の方向に約10度回転しHis215とSer264との水素結合が強化されて0.1~0.2Å短くなり,キノンの頭部は安定化して温度因子が低下する.この水素結合の強化によるキノンの頭部の安定化はイソプレノイド鎖をよじらせるという構造の変化をひき起こし,それに適応するためイソプレノイド鎖の周囲にある疎水的な環境はわずかに構造を変化する.そして,これらの疎水的な環境が変化することにより,S1状態ではQBキノンを周囲の溶媒の環境から遮蔽しているAsn266およびAsn267を含むループ領域の部分が約0.8Å動き,QBキノンが光化学系II複合体の外部に出ていくための経路が開かれる.くわえて,QBキノンをプロトン化するためのプロトンはTyr246,Glu244,D2サブユニットのLys264を含めた経路を通ること,QBキノンの近くに位置する重炭酸イオンもプロトンの移動に関与する可能性があることなどが構造の解析から明らかにされた.
4.酸素発生中心の周辺におけるS3状態への遷移による構造の変化
2回の閃光を照射した状態とS1状態の同型差フーリエ電子密度図およびそれぞれの結晶構造を比較したところ,少なくとも以下の顕著な構造の変化が酸素発生中心の周辺にみられ,それらは水の分解の反応機構をうまく説明した(図1b).1)Mn4がわずかに酸素発生中心のキュバン部分から離れるよう外側に動きMn4とMn1との距離は0.1~0.2Å長くなる.2)キュバン部分を構成するCa2+がMn4から離れるように動く.3)新規の基質の水分子に相当するO6の強い電子密度がO5の近くに現われる.4)Glu189がキュバン部分から遠ざかりO5とMn1とのあいだにO6を収容できる空間が現われる.5)水665とよばれる水分子の移動性が増加することによりO4を基点とする15Åにもおよぶ長い水素結合ネットワークが遮断される.6)以上の5点の構造の変化にともない,酸素発生中心の配位子であるAsp61,Asp170,His332,Ala344がわずかに動く.
5.水の分解および酸素の発生の反応機構
酸素発生中心の周辺における構造の変化のうち,とくに水665の移動性の増加およびO6の挿入について,水の分解の反応機構の観点から述べる(図2).水665の移動性の増加により水665と水567とのあいだの水素結合がなくなり,水567はもう一方で水素結合しているO4へ0.1~0.2Å近づく.このとき,水567とO4との距離は通常の水素結合よりもずっと短くなる.これは,O4が基質でありO=O結合のための準備の段階をみている可能性が考えられたが,結晶構造解析における距離の誤差を考慮し,S3状態への遷移にともなうプロトンの放出の過程をみていると考えている.そして,水665の移動性の増加による水素結合ネットワークの分断こそが,放出されたプロトンの逆流がふせがれる理由と考えられた.なお,このプロトンの放出の経路については理論計算からもアプローチされており6),今回の結果と大方で一致した.
新しい水分子に相当するO6は基質の候補とされているO5との距離が1.5Åと,O=O結合を形成するのに適した位置に挿入された.これは,O5およびO6が酸素の発生する部位であることを強く印象づけた.S1状態から2回の閃光を照射した状態への遷移にともない,O6が挿入されて酸素発生中心はMn4CaO5クラスター構造からMn4CaO6クラスター構造へと変化し酸素が発生すると結論された.この反応機構のモデルは,S1状態の結晶の構造や損傷をうけていない結晶の構造において発見された“ゆがんだイス”におけるO5の特異な環境にもとづき提案された反応機構1,2) を実証しただけでなく,理論計算7) や電子スピン共鳴8) による提案とも大方で一致した.
おわりに
この研究分野においては熾烈な競争がある.筆者らは,この論文を投稿する1カ月前に国際会議において今回の研究の内容を発表した.その時点においてはO5の反応機構に疑問をいだいており,“O5以外を基質とする反応機構があるかもしれない”と,今回の論文とは一部異なる内容を発表した.帰り急いで論文を投稿したが,査読中に競争相手の論文がNature誌に掲載されてしまった9).この論文は,国際会議での筆者らの発表の内容とよく一致していたため,ひどく落胆したものである.ところが,この話にはつづきがある.競争相手が発表した論文をよくみると,実験の結果はO5の反応機構を支持しないことがかなりはっきりと書かれていた.一方,筆者らは,国際会議での発表のあとも反応機構に自信がもてず,もういちど見直してみようと再実験を行った.その際,試料の調製の方法を再検討し励起の効率および回折データを改善した.得られたデータから電子密度図を計算したところ,反応機構の核心にせまる,O6に相当する強い正の電子密度がO5のとなりに観測されたのである.得られた電子密度にもとづきあらためて反応機構を見直すと,それまで解釈に悩んでいた構造の変化に対する納得のいく答がみつかった.競争相手にさきをこされて悔しい思いもしたが,正しい結論が導かれたことを満足している.再実験を行わずあのまま無理に解釈をつづけていても,まちがった結論しか得られなかったであろう.
今回,筆者らにより明らかにされた光化学系II複合体による水の分解の反応機構は,可視光により水を分解する人工触媒をデザインするための基本原理を世界ではじめて実証したものといえる.この反応機構の原理が環境負荷のないエネルギー源を提供するための青写真となり人工光合成の研究へと展開されることを切に願う.
文 献
- Umena, Y., Kawakami, K., Shen, J. R. et al.: Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9Å. Nature, 473, 55-60 (2011)[PubMed]
- Suga, M., Akita, F., Hirata, K. et al.: Native structure of photosystem II at 1.95Å resolution viewed by femtosecond X-ray pulses. Nature, 517, 99-103 (2015)[PubMed] [新着論文レビュー]
- Neutze, R., Wouts, R., van der Spoel, D. et al.: Potential for biomolecular imaging with femtosecond X-ray pulses. Nature, 406, 752-757 (2000)[PubMed]
- Kern, J., Tran, R., Alonso-Mori, R. et al.: Taking snapshots of photosynthetic water oxidation using femtosecond X-ray diffraction and spectroscopy. Nat. Commun., 5, 4371 (2014)[PubMed]
- Kupitz, C., Basu, S., Grotjohann, I. et al.: Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature, 513, 261-265 (2014)[PubMed]
- Saito, K., Rutherford, A. W. & Ishikita, H.: Energetics of proton release on the first oxidation step in the water-oxidizing enzyme. Nat. Commun., 6, 9488 (2015)[PubMed]
- Siegbahn, P. E.: Water oxidation mechanism in photosystem II, including oxidations, proton release pathways, O-O bond formation and O2 release. Biochim. Biophys. Acta, 1827, 1003-1019 (2013)[PubMed]
- Cox, N., Retegan, M., Neese, F. et al.: Electronic structure of the oxygen-evolving complex in photosystem II prior to O-O bond formation. Science, 345, 804-808 (2014)[PubMed]
- Young, I. D., Ibrahim, M., Chatterjee, R. et al.: Structure of photosystem II and substrate binding at room temperature. Nature, 540, 453-457 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2009年 大阪大学大学院理学研究科 修了,大阪大学蛋白質研究所 研究員,米国Oregon Health & Science大学 博士研究員,岡山大学大学院自然科学研究科 特任助教を経て,岡山大学異分野基礎科学研究所 助教.
研究テーマ:膜タンパク質の構造生物学.
秋田 総理(Fusamichi Akita)
岡山大学異分野基礎科学研究所 助教.
沈 建仁(Jian-Ren Shen)
岡山大学異分野基礎科学研究所 教授.
© 2017 菅 倫寛・秋田総理・沈 建仁 Licensed under CC 表示 2.1 日本