USP18によるI型インターフェロンシグナルの抑制においてSTAT2は必須である
有元 啓一郎
(米国California大学San Diego校Moores UCSD Cancer Center)
email:有元啓一郎
DOI: 10.7875/first.author.2017.022
STAT2 is an essential adaptor in USP18-mediated suppression of type I interferon signaling.
Kei-ichiro Arimoto, Sara Löchte, Samuel A. Stoner, Christoph Burkart, Yue Zhang, Sayuri Miyauchi, Stephan Wilmes, Jun-Bao Fan, Jürgen J. Heinisch, Zhi Li, Ming Yan, Sandra Pellegrini, Frédéric Colland, Jacob Piehler, Dong-Er Zhang
Nature Structural & Molecular Biology, 24, 279-289 (2017)
I型インターフェロンは感染症,がん,自己免疫疾患に対しすでに幅広く臨床応用されているサイトカインである.I型インターフェロンシグナルの伝達に対しては,STAT2は正に,USP18は負に作用することが知られている.筆者らは,このUSP18によるI型インターフェロンシグナルの抑制において,正に作用するはずのSTAT2が必須であることを発見した.STAT2を欠損した細胞においてUSP18によるI型インターフェロンシグナルの抑制はみられなかった.STAT2はUSP18と結合し,USP18をI型インターフェロン受容体へとリクルートした.STAT2が存在のもとでは,USP18によりI型インターフェロンとI型インターフェロン受容体との結合が顕著に減少した.このことから,USP18-STAT2複合体によりI型インターフェロン受容体に構造変化がひき起こされることが示唆された.以上の結果より,USP18とSTAT2との結合はI型インターフェロンシグナルに関連する疾患に対する創薬の新たな標的となる可能性が示唆された.
これまでの多くの研究より,インターフェロンαやインターフェロンβなどI型インターフェロンが感染症,がん,自己免疫疾患の治療に有益であることが示されてきた1,2).しかしながら,I型インターフェロンは高い効果をもつ一方,副作用も大きいことが問題となっており,低用量のI型インターフェロンにより大きな効果を持続させることが必要と考えられる.最近,がん細胞におけるI型インターフェロンに対する応答それ自体が,化学治療,放射線治療,免疫治療を含むがん治療に重要であると報告された3).これらの結果からもまた,増強あるいは持続したI型インターフェロンに対する応答が抗腫瘍効果をさらに高めることが示唆される.
I型インターフェロンシグナルの伝達は,I型インターフェロンがIFNAR1とIFNAR2からなるI型インターフェロン受容体と結合することにはじまる.I型インターフェロンとの結合によりI型インターフェロン受容体は活性化され,JAK1およびTYK2をリン酸化する.リン酸化されたJAK1はSTAT2およびSTAT1をリン酸化することにより活性化する.そののち,STAT1-STAT2-IRF9複合体あるいはSTAT1ホモ二量体が核へと移行することにより,I型インターフェロンにより発現の誘導される遺伝子の転写が活性化される4-6).
以前に,筆者らの研究グループは,脱ISG15化修飾にはたらくとされるUSP18が,I型インターフェロン受容体と結合することによりI型インターフェロンシグナルの抑制にはたらくことを報告した7).しかしながら,これまで,USP18によるI型インターフェロンシグナルの抑制の分子機構は明らかにされていなかった.この分子機構の詳細を明らかにすることにより,効果的なUSP18阻害剤,すなわち,副作用の少ない低用量のI型インターフェロンとの併用において高い抗腫瘍効果をもつ薬剤の開発につながることが期待される.そこで,筆者らは,USP18をデコイにした酵母ツーハイブリッド法によりUSP18と結合するタンパク質を探索し,そのなかからSTAT2が見い出された.
GST-プルダウン法,免疫沈降法,1細胞パターニング法などさらなる結合実験により,STAT2とUSP18は直接的に結合していることが確認された.STAT2とUSP18との結合の生理的な意義について調べるため,野生型の細胞およびSTAT2を欠損した細胞を用いてUSP18によるI型インターフェロンシグナルの抑制について検証したところ,野生型の細胞においてはUSP18によりI型インターフェロンシグナルは抑制されたのに対し,STAT2欠損細胞においては抑制されなかった.このことから,STAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に重要であることが示唆された.
実際にSTAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に重要であるかどうかを検証するため,STAT2のドメイン欠失変異体を作製し,免疫沈降法によりUSP18との結合部位について調べた.その結果,STAT2のコイルドコイルドメインおよびDNA結合ドメインがUSP18との結合に必要であることが判明した.野生型のSTAT2を発現させたSTAT2欠損細胞においてはUSP18によりI型インターフェロンシグナルは抑制されたのに対し,コイルドコイルドメインおよびDNA結合ドメインを欠失させたSTAT2変異体を発現させたSTAT2欠損細胞においては抑制されなかった.このことから,STAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に必須であることが明らかにされた.
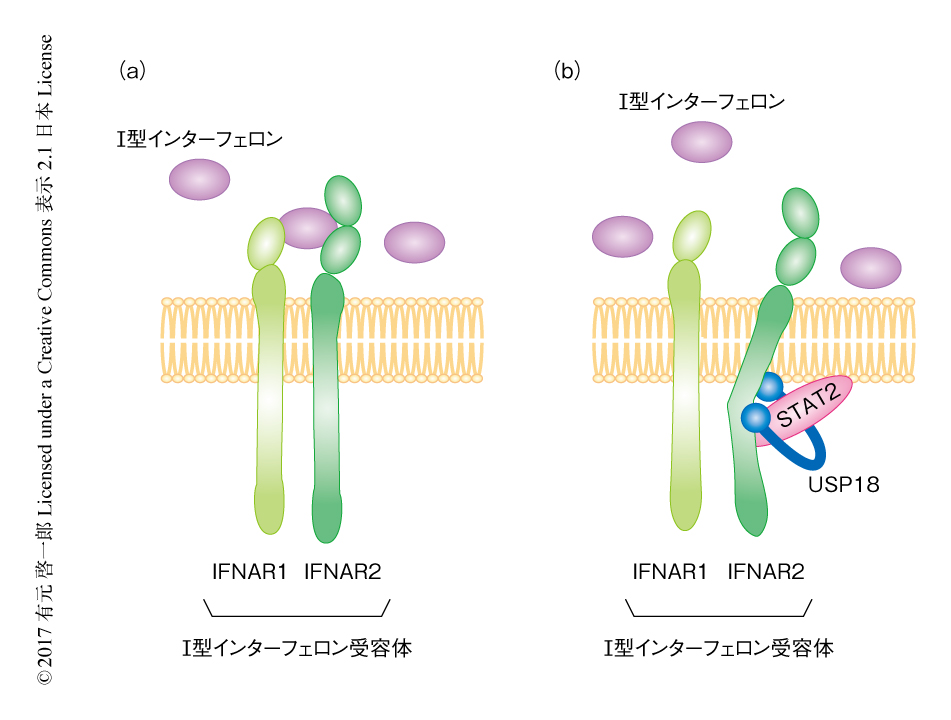
STAT2もUSP18もそれぞれI型インターフェロン受容体を構成するIFNAR2と結合することが知られている.STAT2,USP18,IFNAR2がどのように複合体を形成するかを免疫沈降法および1細胞パターニング法により調べた.STAT2欠損細胞においてUSP18はIFNAR2と弱く結合していたが,STAT2の発現量に依存的してUSP18とIFNAR2の結合量は増加した.このことから,STAT2はUSP18をIFNAR2へとリクルートするのに重要であることが示唆された.
野生型の細胞においてはUSP18の発現によりJAK1のリン酸化の減少が認められたが,I型インターフェロンを処理したSTAT2欠損細胞において,USP18の発現はJAK1のリン酸化に影響しなかったことに注目した.なぜなら,I型インターフェロンシグナル伝達系においてJAK1の上流はI型インターフェロンとI型インターフェロン受容体との結合しか考えられなかったためである.実際に,蛍光色素により標識したインターフェロンαの蛍光セルソーターによる解析および1細胞リアルタイムイメージング法による解析において,STAT2欠損細胞においてUSP18によりインターフェロンαとIFNAR2との結合は変化しなかったが,野生型のSTAT2の存在のもとではインターフェロンαとIFNAR2との結合は減少した.このことから,USP18-STAT2複合体はI型インターフェロンとI型インターフェロン受容体との結合を減弱させることが示唆された(図1).
STAT2とUSP18との結合の阻害の生理的な機能について調べた.STAT2のコイルドコイルドメインおよびDNA結合ドメインがUSP18と結合することから,この領域がUSP18の機能を阻害するかどうか検討した.その結果,USP18によるI型インターフェロンシグナルの抑制はSTAT2のコイルドコイルドメインおよびDNA結合ドメインにより完全に阻害された.また,詳細な結合実験によりUSP18の302番目~313番目の残基がSTAT2と結合することが明らかにされたため,このペプチドのI型インターフェロンシグナルに対する効果について検証した.その結果,ヒトの急性白血病に由来するTHP-1細胞およびヒトの慢性骨髄性白血病に由来するKT-1細胞に対し,USP18の302番目~313番目の残基からなるペプチドに膜透過性をもたせるためTATペプチドを融合したものを処理したところ,I型インターフェロンシグナルは増強された.I型インターフェロンはTHP-1細胞やKT-1細胞にアポトーシスを誘導する.USP18の302番目~313番目の残基からなるペプチドを処理したところ,THP-1細胞およびKT-1細胞においてI型インターフェロンによりアポトーシスが増加した.このことから,STAT2とUSP18との結合を阻害することによりI型インターフェロンシグナルを機能的にさらに増強できることが証明された.
STAT2がI型インターフェロンシグナルの活性化に重要であることを考慮すると,USP18によるI型インターフェロンシグナルの抑制にSTAT2が必須であったことは,STAT2がある意味ではI型インターフェロンシグナルの抑制タンパク質でもあることを示し,免疫学的に意義深い新しい知見といえる.また,STAT2もUSP18もI型インターフェロンシグナルのみならずIII型インターフェロンシグナルの制御にもはたらく8).このことから,III型インターフェロンシグナルに関しても,I型インターフェロンシグナルと同様の分子機構がはたらいている可能性が高い.実際に,筆者らによる予備実験において,STAT2欠損細胞においてUSP18によりIII型インターフェロンシグナルは抑制されなかった.III型インターフェロンはI型インターフェロンと同様の抗腫瘍効果をもつとみられているが,I型インターフェロンに比べ副作用が少ないため,USP18とSTAT2との結合を標的としたIII型インターフェロンシグナルの増強は非常に魅力的である.さらに,USP18-STAT2結合阻害剤の最大の利点は,副作用の少ない低用量のI型インターフェロンにより大きな効果を持続させることが期待される点である.
今回の発見により,STAT2とUSP18との結合がI型インターフェロンシグナルを増強させる重要な標的のひとつとなったが,臨床に応用するためには,ドラッグデリバリーの問題にくわえ,USP18の詳細な構造解析も必要になる.タイムリーなことに,この論文との発表と同じ時期にUSP18-ISG15複合体の結晶構造解析が報告され9),筆者らも大きな関心をもっている.
近年,いくつかの免疫チェックポイント阻害剤が実際のがん患者を対象として大きな成果をあげている.しかしながら,すべてのがん患者に対し効果があるわけではなく,自発的な免疫応答の活性化,つまり,がんの免疫原性の増強が必要と考えられている.この点について,最近,STINGシグナル伝達系の活性化によるI型インターフェロンの産生の誘導が着目され,免疫チェックポイント阻害剤およびSTINGアゴニストの併用治療の研究がはじまっている.このことから,副作用の少ない低用量のI型インターフェロンおよびUSP18阻害剤あるいはSTAT2-USP18結合阻害剤を併用するがん免疫療法も,第3の併用療法としておおいに期待できるのではないかと考えている.
略歴:2009年 京都大学大学院医学研究科博士課程 修了,同年 京都大学ウイルス研究所 博士研究員,2011年 米国California大学San Diego校 博士研究員を経て,2015年より同Project Scientist.
研究テーマ:ISG15化修飾に関連するタンパク質の生理的な意義.
関心事:ドラッグデリバリー.
© 2017 有元 啓一郎 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Moores UCSD Cancer Center)
email:有元啓一郎
DOI: 10.7875/first.author.2017.022
STAT2 is an essential adaptor in USP18-mediated suppression of type I interferon signaling.
Kei-ichiro Arimoto, Sara Löchte, Samuel A. Stoner, Christoph Burkart, Yue Zhang, Sayuri Miyauchi, Stephan Wilmes, Jun-Bao Fan, Jürgen J. Heinisch, Zhi Li, Ming Yan, Sandra Pellegrini, Frédéric Colland, Jacob Piehler, Dong-Er Zhang
Nature Structural & Molecular Biology, 24, 279-289 (2017)
要 約
I型インターフェロンは感染症,がん,自己免疫疾患に対しすでに幅広く臨床応用されているサイトカインである.I型インターフェロンシグナルの伝達に対しては,STAT2は正に,USP18は負に作用することが知られている.筆者らは,このUSP18によるI型インターフェロンシグナルの抑制において,正に作用するはずのSTAT2が必須であることを発見した.STAT2を欠損した細胞においてUSP18によるI型インターフェロンシグナルの抑制はみられなかった.STAT2はUSP18と結合し,USP18をI型インターフェロン受容体へとリクルートした.STAT2が存在のもとでは,USP18によりI型インターフェロンとI型インターフェロン受容体との結合が顕著に減少した.このことから,USP18-STAT2複合体によりI型インターフェロン受容体に構造変化がひき起こされることが示唆された.以上の結果より,USP18とSTAT2との結合はI型インターフェロンシグナルに関連する疾患に対する創薬の新たな標的となる可能性が示唆された.
はじめに
これまでの多くの研究より,インターフェロンαやインターフェロンβなどI型インターフェロンが感染症,がん,自己免疫疾患の治療に有益であることが示されてきた1,2).しかしながら,I型インターフェロンは高い効果をもつ一方,副作用も大きいことが問題となっており,低用量のI型インターフェロンにより大きな効果を持続させることが必要と考えられる.最近,がん細胞におけるI型インターフェロンに対する応答それ自体が,化学治療,放射線治療,免疫治療を含むがん治療に重要であると報告された3).これらの結果からもまた,増強あるいは持続したI型インターフェロンに対する応答が抗腫瘍効果をさらに高めることが示唆される.
I型インターフェロンシグナルの伝達は,I型インターフェロンがIFNAR1とIFNAR2からなるI型インターフェロン受容体と結合することにはじまる.I型インターフェロンとの結合によりI型インターフェロン受容体は活性化され,JAK1およびTYK2をリン酸化する.リン酸化されたJAK1はSTAT2およびSTAT1をリン酸化することにより活性化する.そののち,STAT1-STAT2-IRF9複合体あるいはSTAT1ホモ二量体が核へと移行することにより,I型インターフェロンにより発現の誘導される遺伝子の転写が活性化される4-6).
以前に,筆者らの研究グループは,脱ISG15化修飾にはたらくとされるUSP18が,I型インターフェロン受容体と結合することによりI型インターフェロンシグナルの抑制にはたらくことを報告した7).しかしながら,これまで,USP18によるI型インターフェロンシグナルの抑制の分子機構は明らかにされていなかった.この分子機構の詳細を明らかにすることにより,効果的なUSP18阻害剤,すなわち,副作用の少ない低用量のI型インターフェロンとの併用において高い抗腫瘍効果をもつ薬剤の開発につながることが期待される.そこで,筆者らは,USP18をデコイにした酵母ツーハイブリッド法によりUSP18と結合するタンパク質を探索し,そのなかからSTAT2が見い出された.
1.STAT2を欠損した細胞においてUSP18によるI型インターフェロンシグナルの抑制はみられない
GST-プルダウン法,免疫沈降法,1細胞パターニング法などさらなる結合実験により,STAT2とUSP18は直接的に結合していることが確認された.STAT2とUSP18との結合の生理的な意義について調べるため,野生型の細胞およびSTAT2を欠損した細胞を用いてUSP18によるI型インターフェロンシグナルの抑制について検証したところ,野生型の細胞においてはUSP18によりI型インターフェロンシグナルは抑制されたのに対し,STAT2欠損細胞においては抑制されなかった.このことから,STAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に重要であることが示唆された.
2.STAT2とUSP18との結合はUSP18によるI型インターフェロンシグナルの抑制に必須である
実際にSTAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に重要であるかどうかを検証するため,STAT2のドメイン欠失変異体を作製し,免疫沈降法によりUSP18との結合部位について調べた.その結果,STAT2のコイルドコイルドメインおよびDNA結合ドメインがUSP18との結合に必要であることが判明した.野生型のSTAT2を発現させたSTAT2欠損細胞においてはUSP18によりI型インターフェロンシグナルは抑制されたのに対し,コイルドコイルドメインおよびDNA結合ドメインを欠失させたSTAT2変異体を発現させたSTAT2欠損細胞においては抑制されなかった.このことから,STAT2とUSP18との結合がUSP18によるI型インターフェロンシグナルの抑制に必須であることが明らかにされた.
3.STAT2はUSP18をI型インターフェロン受容体へとリクルートする
STAT2もUSP18もそれぞれI型インターフェロン受容体を構成するIFNAR2と結合することが知られている.STAT2,USP18,IFNAR2がどのように複合体を形成するかを免疫沈降法および1細胞パターニング法により調べた.STAT2欠損細胞においてUSP18はIFNAR2と弱く結合していたが,STAT2の発現量に依存的してUSP18とIFNAR2の結合量は増加した.このことから,STAT2はUSP18をIFNAR2へとリクルートするのに重要であることが示唆された.
4.STAT2-USP18複合体はI型インターフェロンとI型インターフェロン受容体との結合を減弱させる
野生型の細胞においてはUSP18の発現によりJAK1のリン酸化の減少が認められたが,I型インターフェロンを処理したSTAT2欠損細胞において,USP18の発現はJAK1のリン酸化に影響しなかったことに注目した.なぜなら,I型インターフェロンシグナル伝達系においてJAK1の上流はI型インターフェロンとI型インターフェロン受容体との結合しか考えられなかったためである.実際に,蛍光色素により標識したインターフェロンαの蛍光セルソーターによる解析および1細胞リアルタイムイメージング法による解析において,STAT2欠損細胞においてUSP18によりインターフェロンαとIFNAR2との結合は変化しなかったが,野生型のSTAT2の存在のもとではインターフェロンαとIFNAR2との結合は減少した.このことから,USP18-STAT2複合体はI型インターフェロンとI型インターフェロン受容体との結合を減弱させることが示唆された(図1).
5.STAT2とUSP18との結合の阻害はI型インターフェロンシグナルを増強する
STAT2とUSP18との結合の阻害の生理的な機能について調べた.STAT2のコイルドコイルドメインおよびDNA結合ドメインがUSP18と結合することから,この領域がUSP18の機能を阻害するかどうか検討した.その結果,USP18によるI型インターフェロンシグナルの抑制はSTAT2のコイルドコイルドメインおよびDNA結合ドメインにより完全に阻害された.また,詳細な結合実験によりUSP18の302番目~313番目の残基がSTAT2と結合することが明らかにされたため,このペプチドのI型インターフェロンシグナルに対する効果について検証した.その結果,ヒトの急性白血病に由来するTHP-1細胞およびヒトの慢性骨髄性白血病に由来するKT-1細胞に対し,USP18の302番目~313番目の残基からなるペプチドに膜透過性をもたせるためTATペプチドを融合したものを処理したところ,I型インターフェロンシグナルは増強された.I型インターフェロンはTHP-1細胞やKT-1細胞にアポトーシスを誘導する.USP18の302番目~313番目の残基からなるペプチドを処理したところ,THP-1細胞およびKT-1細胞においてI型インターフェロンによりアポトーシスが増加した.このことから,STAT2とUSP18との結合を阻害することによりI型インターフェロンシグナルを機能的にさらに増強できることが証明された.
おわりに
STAT2がI型インターフェロンシグナルの活性化に重要であることを考慮すると,USP18によるI型インターフェロンシグナルの抑制にSTAT2が必須であったことは,STAT2がある意味ではI型インターフェロンシグナルの抑制タンパク質でもあることを示し,免疫学的に意義深い新しい知見といえる.また,STAT2もUSP18もI型インターフェロンシグナルのみならずIII型インターフェロンシグナルの制御にもはたらく8).このことから,III型インターフェロンシグナルに関しても,I型インターフェロンシグナルと同様の分子機構がはたらいている可能性が高い.実際に,筆者らによる予備実験において,STAT2欠損細胞においてUSP18によりIII型インターフェロンシグナルは抑制されなかった.III型インターフェロンはI型インターフェロンと同様の抗腫瘍効果をもつとみられているが,I型インターフェロンに比べ副作用が少ないため,USP18とSTAT2との結合を標的としたIII型インターフェロンシグナルの増強は非常に魅力的である.さらに,USP18-STAT2結合阻害剤の最大の利点は,副作用の少ない低用量のI型インターフェロンにより大きな効果を持続させることが期待される点である.
今回の発見により,STAT2とUSP18との結合がI型インターフェロンシグナルを増強させる重要な標的のひとつとなったが,臨床に応用するためには,ドラッグデリバリーの問題にくわえ,USP18の詳細な構造解析も必要になる.タイムリーなことに,この論文との発表と同じ時期にUSP18-ISG15複合体の結晶構造解析が報告され9),筆者らも大きな関心をもっている.
近年,いくつかの免疫チェックポイント阻害剤が実際のがん患者を対象として大きな成果をあげている.しかしながら,すべてのがん患者に対し効果があるわけではなく,自発的な免疫応答の活性化,つまり,がんの免疫原性の増強が必要と考えられている.この点について,最近,STINGシグナル伝達系の活性化によるI型インターフェロンの産生の誘導が着目され,免疫チェックポイント阻害剤およびSTINGアゴニストの併用治療の研究がはじまっている.このことから,副作用の少ない低用量のI型インターフェロンおよびUSP18阻害剤あるいはSTAT2-USP18結合阻害剤を併用するがん免疫療法も,第3の併用療法としておおいに期待できるのではないかと考えている.
文 献
- Zitvogel, L., Galluzzi, L., Kepp, O. et al.: Type I interferons in anticancer immunity. Nat. Rev. Immunol., 15, 405-414 (2015)[PubMed]
- Borden, E. C., Sen, G. C., Uze, G. et al.: Interferons at age 50: past, current and future impact on biomedicine. Nat. Rev. Drug Discov., 6, 975-990 (2007)[PubMed]
- Sistigu, A., Yamazaki, T., Vacchelli, E. et al.: Cancer cell-autonomous contribution of type I interferon signaling to the efficacy of chemotherapy. Nat. Med., 20, 1301-1309 (2014)[PubMed]
- Uze, G., Lutfalla, G. & Mogensen, K. E.: α and β interferons and their receptor and their friends and relations. J. Interferon Cytokine Res., 15, 3-26 (1995)[PubMed]
- Li, X., Leung, S., Qureshi, S. et al.: Formation of STAT1-STAT2 heterodimers and their role in the activation of IRF-1 gene transcription by interferon-α. J. Biol. Chem., 271, 5790-5794 (1996)[PubMed]
- Platanias, L. C.: Mechanisms of type-I- and type-II-interferon-mediated signalling. Nat. Rev. Immunol., 5, 375-386 (2005)[PubMed]
- Malakhova, O. A., Kim, K. I., Luo, J. K. et al.: UBP43 is a novel regulator of interferon signaling independent of its ISG15 isopeptidase activity. EMBO J., 25, 2358-2367 (2006)[PubMed]
- Burkart, C., Arimoto, K., Tang, T. et al.: Usp18 deficient mammary epithelial cells create an antitumour environment driven by hypersensitivity to IFN-λ and elevated secretion of Cxcl10. EMBO Mol. Med., 5, 1035-1050 (2013)[PubMed]
- Basters, A., Geurink, P. P., Rocker, A. et al.: Structural basis of the specificity of USP18 toward ISG15. Nat. Struct. Mol. Biol., 24, 270-278 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2009年 京都大学大学院医学研究科博士課程 修了,同年 京都大学ウイルス研究所 博士研究員,2011年 米国California大学San Diego校 博士研究員を経て,2015年より同Project Scientist.
研究テーマ:ISG15化修飾に関連するタンパク質の生理的な意義.
関心事:ドラッグデリバリー.
© 2017 有元 啓一郎 Licensed under CC 表示 2.1 日本