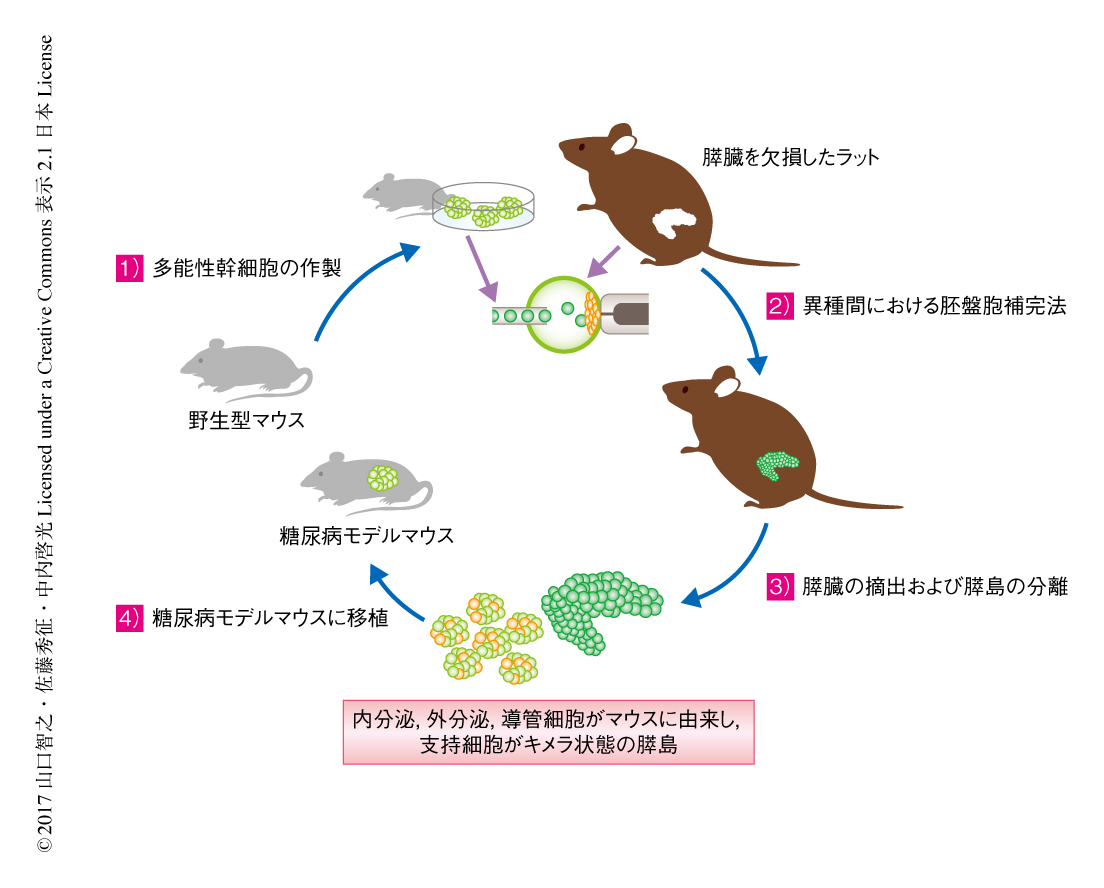
異種の動物の体内において自己の多能性幹細胞に由来する機能的な膵島が作製された
山口智之・佐藤秀征・中内啓光
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:山口智之
DOI: 10.7875/first.author.2017.018
Interspecies organogenesis generates autologous functional islets.
Tomoyuki Yamaguchi, Hideyuki Sato, Megumi Kato-Itoh, Teppei Goto, Hiromasa Hara, Makoto Sanbo, Naoaki Mizuno, Toshihiro Kobayashi, Ayaka Yanagida, Ayumi Umino, Yasunori Ota, Sanae Hamanaka, Hideki Masaki, Sheikh Tamir Rashid, Masumi Hirabayashi, Hiromitsu Nakauchi
Nature, 542, 191-196 (2017)
胚盤胞補完法は特定の細胞を作製する能力を欠失した動物に由来する胚盤胞に正常な多能性幹細胞を注入し,得られたキメラ動物の体内において注入した多能性幹細胞に完全に由来する臓器を作製する手法である.筆者らは,この手法を用いて,膵臓を欠損したラットの体内においてマウスの多能性幹細胞に由来する膵臓を作製した.さらに,このマウスの膵臓から膵島を分離し糖尿病モデルマウスに移植したところ,移植の直後の5日間を除き,免疫抑制剤なしで1年以上にわたり正常な血糖値が維持された.この研究により,異種の動物の体内において作製された臓器を利用した移植治療の有効性および安全性が示され,胚盤胞補完法により作製された臓器の移植治療についての概念が実証された.
胚盤胞補完法は動物の体内において多能性幹細胞に完全に由来する機能的な臓器を作製する手法のひとつであり,これまで,筆者らは,同種間における胚盤胞補完法により,マウスの膵臓,マウスの腎臓,ブタの膵臓を作製した1-3)(文献1) は新着論文レビュー でも掲載).さらに,異種間における胚盤胞補完法により,膵臓を欠損したマウスの体内においてラットの多能性幹細胞に由来する膵臓を作製した1).この膵臓は形態的にも機能的にも正常であったが,マウスの膵臓と同じ程度に小さく,マウスよりからだが10倍ほど大きい糖尿病モデルラットに移植し治療するのに十分な膵島は得られなかった.また,胚盤胞補完法を利用して異種の動物の体内において作製された臓器に含まれる血管や神経などの支持組織は異種の細胞が混在したキメラ状態であったが1,2),これらの異種の細胞が臓器を移植したときどのように影響するかについても検討されていなかった.この研究においては,移植治療に十分な量の膵島を得るため,マウスよりからだが10倍ほど大きいラットを用い,膵臓を欠損したラットの体内において胚盤胞補完法を利用してマウスの多能性幹細胞に由来する膵臓の作製を試み,移植ののちの機能および安全性について検討した(図1).
Pdx1ホモノックアウトマウスは膵臓が完全に欠損しており,胚盤胞補完法のホストになることがすでに示されている1,4).マウスおよびラットのPdx1遺伝子のコード領域はDNAレベルで93%,アミノ酸レベルでも93%と高い相同性をもち,さらに,Pdx1の機能の発現に重要なホメオドメインはアミノ酸の配列が完全に一致することから,ラットにおいてもPdx1は膵臓の発生に必須のタンパク質であると予想した.そこで,ゲノム編集技術を利用してラットのPdx1遺伝子に変異を導入することを試みた.TALENをPdx1遺伝子の開始コドンより3 bp下流および35 bp下流に設計し,TALENをコードするmRNAおよびラットのExo1をコードするmRNAを同時にラットの受精卵の前核に注入しPdx1変異ラットを作製した5).その結果,得られた産仔のうち,注入したTALENをコードするmRNAの濃度が3 ng/μlの場合には4匹(5%),10 ng/μlの場合には3匹(9%)のPdx1ヘテロ変異ラットが得られた.さらに,Pdx1ヘテロ変異ラットどうしを交配したところ,メンデルの法則にしたがいPdx1ホモ変異ラットが得られ,これらはPdx1ホモノックアウトマウスの表現型と同じく,膵臓を完全に欠損した表現型を示し生後2日から3日で死亡した.Pdx1ホモ変異ラットの十二指腸に由来するPdx1の完全長cDNAの配列から予測されたアミノ酸配列において,ホメオドメインおよび核移行シグナルは完全に欠損していた6,7).これらの結果から,Pdx1がラットの膵臓の発生において必須のタンパク質であることが明らかにされた.
Pdx1ホモ変異ラットに由来する胚盤胞も,Pdx1ホモノックアウトマウスに由来する胚盤胞と同様に,多能性幹細胞を注入することにより多能性幹細胞に由来する膵臓を作製できるのかどうか確かめた.Pdx1ヘテロ変異ラットどうしの交配により得られた胚盤胞に,蛍光タンパク質EGFPにより標識されたラットの野生型のES細胞を注入し膵臓の作製を試みた結果,得られたキメララットのうち15%がPdx1ホモ変異の遺伝子型を示し成体まで生育し,開腹すると臓器の全体が一様にEGFPの蛍光を発する,正常なラットと同じ程度の大きさの膵臓が確認された.また,免疫組織染色法および画像解析の結果,内分泌組織,外分泌組織,導管組織は注入したラットのES細胞に完全に由来することがわかった.さらに,Pdx1ホモ変異キメララットの糖負荷能試験の結果,野生型のラットと同様に,正常に糖を代謝することが確認された.この結果から,Pdx1ホモ変異ラットは膵臓の作製のための胚盤胞補完法のホストになりうること,胚盤胞補完法により形態的にも機能的にも正常な膵臓を作製できることが証明された.
異種間における胚盤胞補完法によりPdx1ホモ変異ラットの体内においてマウスの多能性幹細胞に由来する膵臓を作製できるか,また,その機能や大きさについて確かめるため,Pdx1ヘテロ変異ラットどうしの交配により得られた胚盤胞に,EGFPにより標識されたマウスの野生型の多能性幹細胞(iPS細胞あるいはES細胞)を注入し異種キメララットを作製した.その結果,iPS細胞を注入した場合には10%,ES細胞を注入した場合には約20%の確率でPdx1ホモ変異キメララットが得られた.これらの異種キメララットの耐糖能試験の結果,Pdx1ホモ変異キメララットはPdx1ヘテロ変異ラット,野生型のPdx1キメララット,野生型のラットと比較して,糖負荷の直後は血糖値が高く糖負荷ののちの回復も遅い傾向がみられたが,血糖値は時間の経過とともにゆるやかに正常な範囲になった.開腹して注入したマウスの多能性幹細胞の膵臓への寄与について調べた結果,Pdx1ヘテロ変異キメララットの膵臓はEGFP陽性細胞がモザイク状に寄与していたのに対し,Pdx1ホモ変異キメララットにおいては膵臓の全体が一様にEGFPの蛍光を発することが確認された.さらに,免疫組織染色法および画像解析の結果,膵臓の内分泌組織,外分泌組織,導管組織は注入したマウスの多能性幹細胞に完全に由来することがわかった.そして,11匹中9匹のPdx1ホモ変異キメララットの膵臓の大きさは同じ週齢の野生型のマウスの膵臓の10倍ほど大きく,同じ週齢の野生型のラットの膵臓と同じ程度の大きさであった.これらの結果から,ラットの体内においてラットの正常な発生機構および臓器の大きさの制御機構により,マウスの多能性幹細胞から機能的な膵臓が作製されることがわかった.
ラットの体内において作製されたマウスの多能性幹細胞に由来する膵臓より膵島を単離し,膵β細胞に毒性をもつ薬剤ストレプトゾシンの投与により作製した糖尿病モデルラットに移植し治療を試みた.Pdx1ホモ変異キメララット2匹より約300個の膵島を分離し,一部を蛍光顕微鏡により観察したところ,Pdx1ヘテロ変異キメララットの膵島はEGFP陽性細胞がモザイク状に寄与していたのに対し,Pdx1ホモ変異キメララットにおいては膵臓の全体が一様にEGFPの蛍光を発することが確認された.一方で,蛍光セルソーターを用いて膵島に含まれる血管内皮細胞の由来を詳細に解析したところ,Pdx1ホモ変異キメララットの膵島にも約6%のラットの血管内皮細胞が混在していた.この異種の細胞の混在するマウスの多能性幹細胞に由来する膵島をストレプトゾシンの投与により作製した糖尿病モデルマウスの腎皮膜下に100個ずつ移植し治療の効果について検証した.対照として,野生型のラット,ホストと同じ系統の野生型のマウス,Pdx1ヘテロ変異キメララットの膵島でも同様に実験した.また,移植ののちの炎症反応を抑制するため移植の直後の5日間のみ免疫抑制剤タクロリムスを投与したが,それ以降,免疫抑制剤は投与しなかった.
血糖値の推移を経時的におったところ,野生型のラットの膵島あるいはPdx1ヘテロ変異キメララットの膵島を移植した糖尿病モデルマウスは一時的に血糖が低下したものの,移植ののち5日には拒絶され血糖値を制御できなくなった.一方で,Pdx1ホモ変異キメララットの膵島を移植した糖尿病モデルマウスは1年以上の長期にわたり血糖値が正常に制御され,移植の部位を摘出すると高血糖になった.移植ののち60日の糖負荷試験において,野生型のラットの膵島を移植した糖尿病モデルマウスは血糖値を低下させることができなかったが,Pdx1ホモ変異キメララットの膵島を移植した糖尿病モデルマウスは正常に糖を代謝した.この結果から,異種の体内において作製された自己の多能性幹細胞に由来する膵島は移植ののちにも正常に機能を発揮し,異種に由来する微小な支持細胞は移植片の生着や機能に影響を及ぼさないことが明らかにされた.
筆者らは,胚盤胞補完法により異種の動物の体内においてヒトの臓器を作製し移植治療に用いることをめざしているが,今回の成果により,胚盤胞補完法により作製した臓器に含まれる異種に由来する微小な支持細胞は移植片の生着や機能に影響を及ぼさないことが明らかにされ,異種の動物の体内において作製された臓器を移植した際の有効性および安全性が確認された.また,胚盤胞補完法は臓器の作製のほかにもさまざまな研究において有用である.たとえば,ラットの体内において作製したマウスの多能性幹細胞に由来する膵臓は,ラットの膵臓と同じ程度の大きさになった.これは,臓器の大きさの制御には外部からの刺激も重要であることを直接的に示した最初の知見である.今後,この系を利用して,再生医療のみならず臓器の大きさの制御機構など生物学的な疑問が解明されることも期待される.
略歴:2001年 筑波大学大学院医学研究科博士課程 修了,米国Minnesota大学 博士研究員,2004年 理化学研究所バイオリソースセンター 研究員,2007年 科学技術振興機構ERATO中内幹細胞制御プロジェクト 研究員,2013年 東京大学医科学研究所 助教を経て,2015年より同 特任准教授.
研究テーマ:多能性幹細胞からの臓器の作製.
抱負:万里一空.
佐藤 秀征(Hideyuki Sato)
東京大学医科学研究所 学術支援専門職員.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2017 山口智之・佐藤秀征・中内啓光 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:山口智之
DOI: 10.7875/first.author.2017.018
Interspecies organogenesis generates autologous functional islets.
Tomoyuki Yamaguchi, Hideyuki Sato, Megumi Kato-Itoh, Teppei Goto, Hiromasa Hara, Makoto Sanbo, Naoaki Mizuno, Toshihiro Kobayashi, Ayaka Yanagida, Ayumi Umino, Yasunori Ota, Sanae Hamanaka, Hideki Masaki, Sheikh Tamir Rashid, Masumi Hirabayashi, Hiromitsu Nakauchi
Nature, 542, 191-196 (2017)
要 約
胚盤胞補完法は特定の細胞を作製する能力を欠失した動物に由来する胚盤胞に正常な多能性幹細胞を注入し,得られたキメラ動物の体内において注入した多能性幹細胞に完全に由来する臓器を作製する手法である.筆者らは,この手法を用いて,膵臓を欠損したラットの体内においてマウスの多能性幹細胞に由来する膵臓を作製した.さらに,このマウスの膵臓から膵島を分離し糖尿病モデルマウスに移植したところ,移植の直後の5日間を除き,免疫抑制剤なしで1年以上にわたり正常な血糖値が維持された.この研究により,異種の動物の体内において作製された臓器を利用した移植治療の有効性および安全性が示され,胚盤胞補完法により作製された臓器の移植治療についての概念が実証された.
はじめに
胚盤胞補完法は動物の体内において多能性幹細胞に完全に由来する機能的な臓器を作製する手法のひとつであり,これまで,筆者らは,同種間における胚盤胞補完法により,マウスの膵臓,マウスの腎臓,ブタの膵臓を作製した1-3)(文献1) は新着論文レビュー でも掲載).さらに,異種間における胚盤胞補完法により,膵臓を欠損したマウスの体内においてラットの多能性幹細胞に由来する膵臓を作製した1).この膵臓は形態的にも機能的にも正常であったが,マウスの膵臓と同じ程度に小さく,マウスよりからだが10倍ほど大きい糖尿病モデルラットに移植し治療するのに十分な膵島は得られなかった.また,胚盤胞補完法を利用して異種の動物の体内において作製された臓器に含まれる血管や神経などの支持組織は異種の細胞が混在したキメラ状態であったが1,2),これらの異種の細胞が臓器を移植したときどのように影響するかについても検討されていなかった.この研究においては,移植治療に十分な量の膵島を得るため,マウスよりからだが10倍ほど大きいラットを用い,膵臓を欠損したラットの体内において胚盤胞補完法を利用してマウスの多能性幹細胞に由来する膵臓の作製を試み,移植ののちの機能および安全性について検討した(図1).
1.ゲノム編集技術を利用した膵臓を欠損したラットの作製
Pdx1ホモノックアウトマウスは膵臓が完全に欠損しており,胚盤胞補完法のホストになることがすでに示されている1,4).マウスおよびラットのPdx1遺伝子のコード領域はDNAレベルで93%,アミノ酸レベルでも93%と高い相同性をもち,さらに,Pdx1の機能の発現に重要なホメオドメインはアミノ酸の配列が完全に一致することから,ラットにおいてもPdx1は膵臓の発生に必須のタンパク質であると予想した.そこで,ゲノム編集技術を利用してラットのPdx1遺伝子に変異を導入することを試みた.TALENをPdx1遺伝子の開始コドンより3 bp下流および35 bp下流に設計し,TALENをコードするmRNAおよびラットのExo1をコードするmRNAを同時にラットの受精卵の前核に注入しPdx1変異ラットを作製した5).その結果,得られた産仔のうち,注入したTALENをコードするmRNAの濃度が3 ng/μlの場合には4匹(5%),10 ng/μlの場合には3匹(9%)のPdx1ヘテロ変異ラットが得られた.さらに,Pdx1ヘテロ変異ラットどうしを交配したところ,メンデルの法則にしたがいPdx1ホモ変異ラットが得られ,これらはPdx1ホモノックアウトマウスの表現型と同じく,膵臓を完全に欠損した表現型を示し生後2日から3日で死亡した.Pdx1ホモ変異ラットの十二指腸に由来するPdx1の完全長cDNAの配列から予測されたアミノ酸配列において,ホメオドメインおよび核移行シグナルは完全に欠損していた6,7).これらの結果から,Pdx1がラットの膵臓の発生において必須のタンパク質であることが明らかにされた.
2.膵臓を欠損したラットを利用した同種間における胚盤胞補完法
Pdx1ホモ変異ラットに由来する胚盤胞も,Pdx1ホモノックアウトマウスに由来する胚盤胞と同様に,多能性幹細胞を注入することにより多能性幹細胞に由来する膵臓を作製できるのかどうか確かめた.Pdx1ヘテロ変異ラットどうしの交配により得られた胚盤胞に,蛍光タンパク質EGFPにより標識されたラットの野生型のES細胞を注入し膵臓の作製を試みた結果,得られたキメララットのうち15%がPdx1ホモ変異の遺伝子型を示し成体まで生育し,開腹すると臓器の全体が一様にEGFPの蛍光を発する,正常なラットと同じ程度の大きさの膵臓が確認された.また,免疫組織染色法および画像解析の結果,内分泌組織,外分泌組織,導管組織は注入したラットのES細胞に完全に由来することがわかった.さらに,Pdx1ホモ変異キメララットの糖負荷能試験の結果,野生型のラットと同様に,正常に糖を代謝することが確認された.この結果から,Pdx1ホモ変異ラットは膵臓の作製のための胚盤胞補完法のホストになりうること,胚盤胞補完法により形態的にも機能的にも正常な膵臓を作製できることが証明された.
3.膵臓を欠損したラットを利用した異種間における胚盤胞補完法
異種間における胚盤胞補完法によりPdx1ホモ変異ラットの体内においてマウスの多能性幹細胞に由来する膵臓を作製できるか,また,その機能や大きさについて確かめるため,Pdx1ヘテロ変異ラットどうしの交配により得られた胚盤胞に,EGFPにより標識されたマウスの野生型の多能性幹細胞(iPS細胞あるいはES細胞)を注入し異種キメララットを作製した.その結果,iPS細胞を注入した場合には10%,ES細胞を注入した場合には約20%の確率でPdx1ホモ変異キメララットが得られた.これらの異種キメララットの耐糖能試験の結果,Pdx1ホモ変異キメララットはPdx1ヘテロ変異ラット,野生型のPdx1キメララット,野生型のラットと比較して,糖負荷の直後は血糖値が高く糖負荷ののちの回復も遅い傾向がみられたが,血糖値は時間の経過とともにゆるやかに正常な範囲になった.開腹して注入したマウスの多能性幹細胞の膵臓への寄与について調べた結果,Pdx1ヘテロ変異キメララットの膵臓はEGFP陽性細胞がモザイク状に寄与していたのに対し,Pdx1ホモ変異キメララットにおいては膵臓の全体が一様にEGFPの蛍光を発することが確認された.さらに,免疫組織染色法および画像解析の結果,膵臓の内分泌組織,外分泌組織,導管組織は注入したマウスの多能性幹細胞に完全に由来することがわかった.そして,11匹中9匹のPdx1ホモ変異キメララットの膵臓の大きさは同じ週齢の野生型のマウスの膵臓の10倍ほど大きく,同じ週齢の野生型のラットの膵臓と同じ程度の大きさであった.これらの結果から,ラットの体内においてラットの正常な発生機構および臓器の大きさの制御機構により,マウスの多能性幹細胞から機能的な膵臓が作製されることがわかった.
4.膵島の移植による糖尿病の治療
ラットの体内において作製されたマウスの多能性幹細胞に由来する膵臓より膵島を単離し,膵β細胞に毒性をもつ薬剤ストレプトゾシンの投与により作製した糖尿病モデルラットに移植し治療を試みた.Pdx1ホモ変異キメララット2匹より約300個の膵島を分離し,一部を蛍光顕微鏡により観察したところ,Pdx1ヘテロ変異キメララットの膵島はEGFP陽性細胞がモザイク状に寄与していたのに対し,Pdx1ホモ変異キメララットにおいては膵臓の全体が一様にEGFPの蛍光を発することが確認された.一方で,蛍光セルソーターを用いて膵島に含まれる血管内皮細胞の由来を詳細に解析したところ,Pdx1ホモ変異キメララットの膵島にも約6%のラットの血管内皮細胞が混在していた.この異種の細胞の混在するマウスの多能性幹細胞に由来する膵島をストレプトゾシンの投与により作製した糖尿病モデルマウスの腎皮膜下に100個ずつ移植し治療の効果について検証した.対照として,野生型のラット,ホストと同じ系統の野生型のマウス,Pdx1ヘテロ変異キメララットの膵島でも同様に実験した.また,移植ののちの炎症反応を抑制するため移植の直後の5日間のみ免疫抑制剤タクロリムスを投与したが,それ以降,免疫抑制剤は投与しなかった.
血糖値の推移を経時的におったところ,野生型のラットの膵島あるいはPdx1ヘテロ変異キメララットの膵島を移植した糖尿病モデルマウスは一時的に血糖が低下したものの,移植ののち5日には拒絶され血糖値を制御できなくなった.一方で,Pdx1ホモ変異キメララットの膵島を移植した糖尿病モデルマウスは1年以上の長期にわたり血糖値が正常に制御され,移植の部位を摘出すると高血糖になった.移植ののち60日の糖負荷試験において,野生型のラットの膵島を移植した糖尿病モデルマウスは血糖値を低下させることができなかったが,Pdx1ホモ変異キメララットの膵島を移植した糖尿病モデルマウスは正常に糖を代謝した.この結果から,異種の体内において作製された自己の多能性幹細胞に由来する膵島は移植ののちにも正常に機能を発揮し,異種に由来する微小な支持細胞は移植片の生着や機能に影響を及ぼさないことが明らかにされた.
おわりに
筆者らは,胚盤胞補完法により異種の動物の体内においてヒトの臓器を作製し移植治療に用いることをめざしているが,今回の成果により,胚盤胞補完法により作製した臓器に含まれる異種に由来する微小な支持細胞は移植片の生着や機能に影響を及ぼさないことが明らかにされ,異種の動物の体内において作製された臓器を移植した際の有効性および安全性が確認された.また,胚盤胞補完法は臓器の作製のほかにもさまざまな研究において有用である.たとえば,ラットの体内において作製したマウスの多能性幹細胞に由来する膵臓は,ラットの膵臓と同じ程度の大きさになった.これは,臓器の大きさの制御には外部からの刺激も重要であることを直接的に示した最初の知見である.今後,この系を利用して,再生医療のみならず臓器の大きさの制御機構など生物学的な疑問が解明されることも期待される.
文 献
- Kobayashi, T., Yamaguchi, T., Hamanaka, S. et al.: Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell, 142, 787-799 (2010)[PubMed] [新着論文レビュー]
- Usui, J., Kobayashi, T., Yamaguchi, T. et al.: Generation of kidney from pluripotent stem cells via blastocyst complementation. Am. J. Pathol., 180, 2417-2426 (2012)[PubMed]
- Matsunari, H., Nagashima, H., Watanabe, M. et al.: Blastocyst complementation generates exogenic pancreas in vivo in apancreatic cloned pigs. Proc. Natl. Acad. Sci. USA, 110, 4557-4562 (2013)[PubMed]
- Ahlgren, U., Jonsson, J., Jonsson, L. et al.: β-cell-specific inactivation of the mouse Ipf1/Pdx1 gene results in loss of the β-cell phenotype and maturity onset diabetes. Genes Dev., 12, 1763-1768 (1998)[PubMed]
- Takahashi, R., Hirabayashi, M. & Ueda, M.: Production of transgenic rats using cryopreserved pronuclear-stage zygotes. Transgenic Res., 8, 397-400 (1999)[PubMed]
- Oliver-Krasinski, J. M., Kasner, M. T., Yang, J. et al.: The diabetes gene Pdx1 regulates the transcriptional network of pancreatic endocrine progenitor cells in mice. J. Clin. Invest., 119, 1888-1898 (2009)[PubMed]
- Moede, T., Leibiger, B., Pour, H. G. et al.: Identification of a nuclear localization signal, RRMKWKK, in the homeodomain transcription factor PDX-1. FEBS Lett., 461, 229-234 (1999)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2001年 筑波大学大学院医学研究科博士課程 修了,米国Minnesota大学 博士研究員,2004年 理化学研究所バイオリソースセンター 研究員,2007年 科学技術振興機構ERATO中内幹細胞制御プロジェクト 研究員,2013年 東京大学医科学研究所 助教を経て,2015年より同 特任准教授.
研究テーマ:多能性幹細胞からの臓器の作製.
抱負:万里一空.
佐藤 秀征(Hideyuki Sato)
東京大学医科学研究所 学術支援専門職員.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2017 山口智之・佐藤秀征・中内啓光 Licensed under CC 表示 2.1 日本