シロイヌナズナの根における拡散障壁であるカスパリー線の形成に必要なペプチドホルモン
篠原秀文・松林嘉克
(名古屋大学大学院理学研究科 生命理学専攻細胞間シグナル研究グループ)
email:松林嘉克
DOI: 10.7875/first.author.2017.016
A peptide hormone required for Casparian strip diffusion barrier formation in Arabidopsis roots.
Takuya Nakayama, Hidefumi Shinohara, Mina Tanaka, Koki Baba, Mari Ogawa-Ohnishi, Yoshikatsu Matsubayashi
Science, 355, 284-286 (2017)
この研究において,植物の根において維管束の周囲に形成される疎水性の拡散障壁であるカスパリー線の形成に必要なペプチドホルモンCIFが発見された.CIFは根の中心柱において発現し,根の内皮細胞に発現する受容体GSO1/SGN3およびGSO2と結合してカスパリー線の形成を正に制御した.このペプチドホルモンを欠損した植物においてはカスパリー線に多数の穴があき,根から栄養分が漏れ出たり土壌から有害な成分が侵入したりするため,植物体は土壌成分の変動にたえられず正常に生育できない.これらの結果は,刻々と変動する土壌環境への植物の適応のしくみを理解するうえで重要な手がかりとなる.
植物は根から栄養分を吸収して成長するが,土壌には生育に必須な成分のみならず有害な成分も存在し,それらの濃度は降水や乾燥などの環境要因によっても大きく変動する.植物において細胞と細胞のすきまの細胞間隙には細胞壁が存在するが,細胞壁は全透性のため,そのままでは細胞間隙をとおって組織の内部にまで各種のイオンが侵入する.約150年まえに発見されたカスパリー線は,根の内側の内皮細胞の周囲に形成される疎水性の拡散障壁であり,細胞どうしのすきまを完全に埋めることにより,栄養分の輸送にかかわる道管と外界とのあいだの分子の自由な行き来をふせぐ1).カスパリー線が障壁となるため,植物は変動する土壌環境の影響をうけることなく道管に安定して栄養分を取り込むことができる.
では,カスパリー線はどのような分子機構により形成されるのだろうか.いくつかの研究グループにより,複数の因子がカスパリー線の形成に関与することが報告されている2-7).近年,根の内皮細胞の表面に発現するロイシンリッチリピート型受容体キナーゼGSO1/SGN3の欠損株においては,カスパリー線が正常に形成されずに多数の穴のあいた状態になっていることが報告され,GSO1/SGN3がカスパリー線の形成に必要であることが示唆された8).この受容体が属する受容体キナーゼファミリーにはペプチドホルモンの認識に関与するものが多く含まれることから,カスパリー線の形成を制御する未知のペプチドホルモンの存在が予想されていたが,その実体は明らかにされていなかった.
筆者らの研究グループにおいては,モデル植物であるシロイヌナズナのゲノム情報を利用してペプチドホルモンをコードする可能性の高い遺伝子を選び出しそれらの機能を解析している.これまで,この系を用いて,根のメリステムの形成に必要なペプチドホルモンRGF 9)(新着論文レビュー でも掲載)や,窒素の吸収の全身的な制御にかかわるペプチドホルモンCEP 10)(新着論文レビュー でも掲載)を同定している.
At2g16385遺伝子はこの研究の過程において見い出されたペプチドホルモンの候補遺伝子である.At2g16385遺伝子を過剰に発現させた形質転換シロイヌナズナを液体培地にて培養し,培地に分泌されたペプチドの構造をナノ液体クロマトグラフィー-タンデム質量分析計により解析した結果,At2g16385遺伝子にコードされる成熟型のペプチドの構造は,1残基の硫酸化チロシン残基を含む21アミノ酸残基からなるペプチドであることが確かめられた.このペプチドには,At4g34600遺伝子にコードされる,成熟型のペプチドの構造が非常に類似したもうひとつのペプチドが存在し,この2つのペプチドはファミリーとして機能すると考えられた.
At2g16385ペプチドの構造は決定されたものの,その過剰発現株にはわずかな生育の阻害や不稔性が観察されるほかにはめだった異常は現われず,その生理機能は未知のままであった.そこで,At2g16385ペプチドの機能を探るため,このペプチドと直接に結合する受容体を探索した.
筆者らの研究グループにおいては,新たなペプチドホルモンの探索法とあわせて,数多く存在する受容体キナーゼファミリーを個々に発現させた受容体発現ライブラリーを使ってペプチドホルモンの受容体を迅速にみつけだす系を確立している.さきに述べたRGFやCEPの受容体もこの系を用いて同定している10,11).
そこで,At2g16385ペプチドについてもこの系を応用した.光反応基を導入したAt2g16385ペプチドを作製し,受容体発現ライブラリーに対し光アフィニティー標識による網羅的な結合実験を行った.その結果,At2g16385ペプチドは,さきに述べたカスパリー線の形成にかかわる受容体GSO1/SGN3,および,そのホモログであるGSO2と直接に結合することが示された.この受容体へはAt2g16385ペプチドのみならず,ファミリーであるAt4g34600ペプチドも結合することが確かめられ,この2つのペプチドに対する受容体はGSO1/SGN3およびGSO2であることが明らかにされた.
At2g16385ペプチドおよびAt4g34600ペプチドの受容体がカスパリー線の形成に必要なGSO1/SGN3であることが示されたため,これら2つのペプチドの機能もカスパリー線の形成に関与する可能性が高まった.そこで,At2g16385ペプチドとAt4g34600ペプチドの二重欠損株を作出して根を観察した結果,GSO1/SGN3の欠損株と同様に,カスパリー線が正しく形成されず多数の途切れが観察された.At2g16385ペプチドおよびAt4g34600ペプチドを欠損した株に対して,合成したAt2g16385ペプチドを培地からあたえるとカスパリー線は正常な状態に回復したが,GSO1/SGN3の欠損株ではAt2g16385ペプチドをあたえても回復しないことも確かめられた.これらの結果から,At2g16385ペプチドおよびAt4g346002ペプチドはカスパリー線の形成において重要なペプチドホルモンであると結論づけ,CIF1およびCIF2(CIF:Casparian strip integrity factor)と命名した.CIFの欠損株にCIFをあたえた場合,およそ6時間で連続したカスパリー線が回復し,活性は1 nMレベルの低濃度でも検出された.
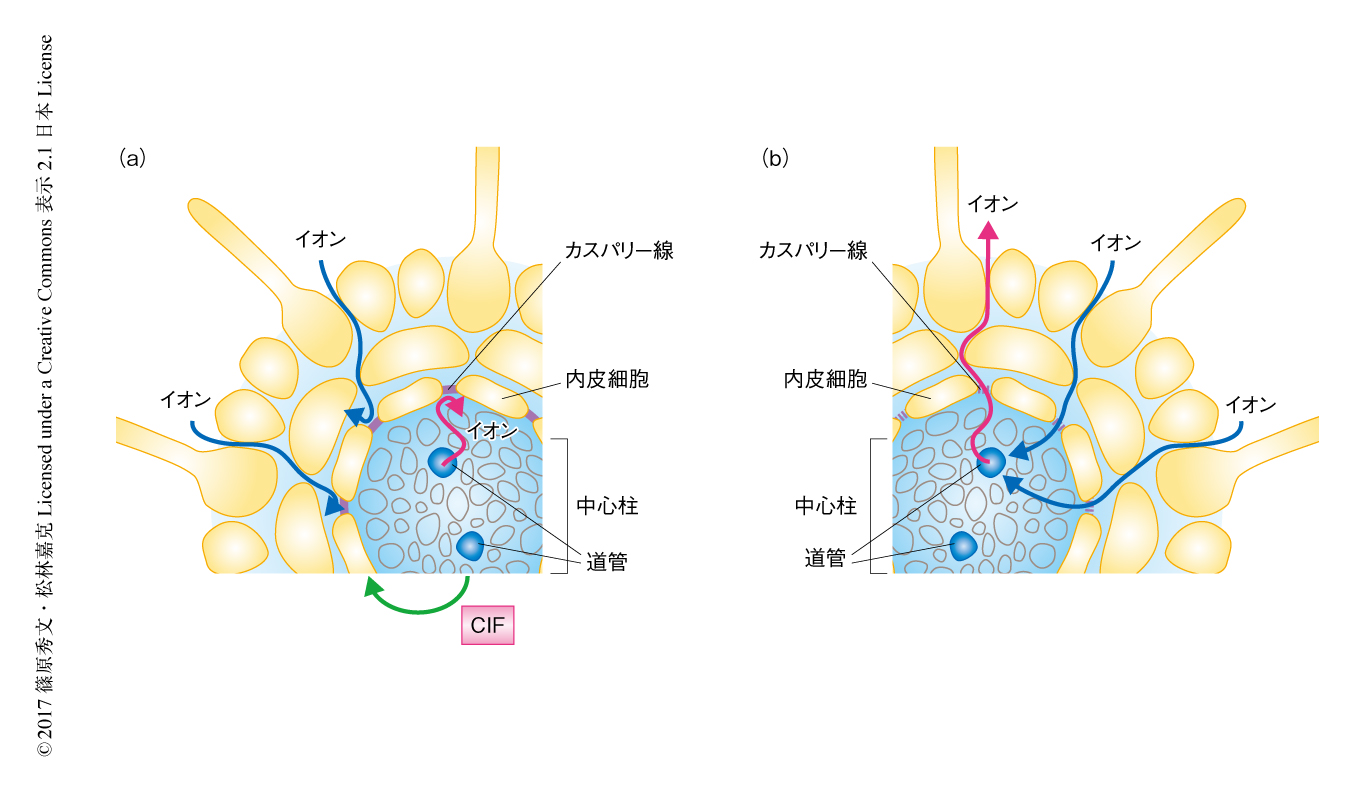
遺伝子プロモーター解析により,CIF1遺伝子およびCIF2遺伝子はいずれも根のカスパリー線が形成される内皮細胞よりも内側の細胞層である中心柱において発現することが示された.受容体であるGSO1/SGN3は内皮細胞に発現することが知られているため,中心柱で産生されるCIFが内皮細胞の細胞膜に発現する受容体GSO1/SGN3およびGSO2に認識されることによりカスパリー線の形成は制御されると考えられた(図1).なお,側根が形成されるときにはカスパリー線は一時的に崩壊することが知られているが,実際に,側根の形成の初期段階においてCIF2遺伝子の発現の一過的な消失が観察された.
カスパリー線が機能しないCIFの欠損株が土壌のイオンの濃度変化にどのような応答を示すか検討した.さまざまなイオンについて培地における濃度を上昇させた場合の植物体の成長を観察したところ,CIFの欠損株は過剰な鉄イオンの存在のもとでは枯れてしまった.道管液を回収してシンクロトロンX線蛍光分析により鉄イオンの濃度を定量したところ,野生株では外界の鉄イオンの濃度が上昇しても道管における鉄イオンの濃度は一定に維持されるが,CIFの欠損株では過剰の鉄イオンがそのまま流入することが確かめられた.土壌における濃度の比較的高いカリウムイオンについて培地における濃度を低下させた場合の道管液における濃度を定量したところ,野生株では外界のカリウムイオンの濃度が低下しても道管における濃度は高濃度に維持されていたが,CIFの欠損株では濃度勾配にしたがい一部が流出することが明らかにされた.この結果から,カスパリー線に異常があるとカリウム欠乏症を示すという報告がうまく説明された8).以上を総合すると,カスパリー線は根からの安定的な栄養の吸収,すなわち,イオンホメオスタシスの維持に重要な役割を担うことが明らかにされた(図1).
植物は動物のように動きまわることはできないが,変動する自然環境にたくみに適応するしくみをもつ.今回のペプチドホルモンCIFの発見は,つねに至適な栄養条件とはかぎらない自然界において植物が生き延びるための戦略の一端を解明したものとして大きな意義がある.また,カスパリー線は植物の耐塩性と密接に関連すると考えられている.国土を海にかこまれたわが国では耕作地の塩害がしばしば問題になるが,今回,得られた知見はカスパリー線の機能の人為的な改変を可能にするものであり,今後の農業分野への応用が期待される.
今回の筆者らの報告と同時に,スイスの研究グループからもカスパリー線の形成を制御するペプチドホルモンが報告された12).研究のアプローチはまったく異なるにもかかわらず,同じペプチドホルモンの同定にいたっていた.
略歴:2009年 名古屋大学大学院生命農学研究科 修了,名古屋大学グローバルCOE博士研究員,基礎生物学研究所 助教を経て,2014年より名古屋大学大学院理学研究科 助教.
研究テーマ:ペプチドホルモンと受容体とのペアを介した細胞間シグナル伝達機構.
関心事:さまざまな植物種におけるペプチドホルモンと受容体とのペアの生理機能.野外で音楽鑑賞,スタジアムでサッカー観戦,および,それらの現場で飲むビール.
松林 嘉克(Yoshikatsu Matsubayashi)
名古屋大学大学院理学研究科 教授.
研究室URL:http://www.bio.nagoya-u.ac.jp/~b2
© 2017 篠原秀文・松林嘉克 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻細胞間シグナル研究グループ)
email:松林嘉克
DOI: 10.7875/first.author.2017.016
A peptide hormone required for Casparian strip diffusion barrier formation in Arabidopsis roots.
Takuya Nakayama, Hidefumi Shinohara, Mina Tanaka, Koki Baba, Mari Ogawa-Ohnishi, Yoshikatsu Matsubayashi
Science, 355, 284-286 (2017)
要 約
この研究において,植物の根において維管束の周囲に形成される疎水性の拡散障壁であるカスパリー線の形成に必要なペプチドホルモンCIFが発見された.CIFは根の中心柱において発現し,根の内皮細胞に発現する受容体GSO1/SGN3およびGSO2と結合してカスパリー線の形成を正に制御した.このペプチドホルモンを欠損した植物においてはカスパリー線に多数の穴があき,根から栄養分が漏れ出たり土壌から有害な成分が侵入したりするため,植物体は土壌成分の変動にたえられず正常に生育できない.これらの結果は,刻々と変動する土壌環境への植物の適応のしくみを理解するうえで重要な手がかりとなる.
はじめに
植物は根から栄養分を吸収して成長するが,土壌には生育に必須な成分のみならず有害な成分も存在し,それらの濃度は降水や乾燥などの環境要因によっても大きく変動する.植物において細胞と細胞のすきまの細胞間隙には細胞壁が存在するが,細胞壁は全透性のため,そのままでは細胞間隙をとおって組織の内部にまで各種のイオンが侵入する.約150年まえに発見されたカスパリー線は,根の内側の内皮細胞の周囲に形成される疎水性の拡散障壁であり,細胞どうしのすきまを完全に埋めることにより,栄養分の輸送にかかわる道管と外界とのあいだの分子の自由な行き来をふせぐ1).カスパリー線が障壁となるため,植物は変動する土壌環境の影響をうけることなく道管に安定して栄養分を取り込むことができる.
では,カスパリー線はどのような分子機構により形成されるのだろうか.いくつかの研究グループにより,複数の因子がカスパリー線の形成に関与することが報告されている2-7).近年,根の内皮細胞の表面に発現するロイシンリッチリピート型受容体キナーゼGSO1/SGN3の欠損株においては,カスパリー線が正常に形成されずに多数の穴のあいた状態になっていることが報告され,GSO1/SGN3がカスパリー線の形成に必要であることが示唆された8).この受容体が属する受容体キナーゼファミリーにはペプチドホルモンの認識に関与するものが多く含まれることから,カスパリー線の形成を制御する未知のペプチドホルモンの存在が予想されていたが,その実体は明らかにされていなかった.
1.At2g16385遺伝子にコードされる硫酸化ペプチドの同定
筆者らの研究グループにおいては,モデル植物であるシロイヌナズナのゲノム情報を利用してペプチドホルモンをコードする可能性の高い遺伝子を選び出しそれらの機能を解析している.これまで,この系を用いて,根のメリステムの形成に必要なペプチドホルモンRGF 9)(新着論文レビュー でも掲載)や,窒素の吸収の全身的な制御にかかわるペプチドホルモンCEP 10)(新着論文レビュー でも掲載)を同定している.
At2g16385遺伝子はこの研究の過程において見い出されたペプチドホルモンの候補遺伝子である.At2g16385遺伝子を過剰に発現させた形質転換シロイヌナズナを液体培地にて培養し,培地に分泌されたペプチドの構造をナノ液体クロマトグラフィー-タンデム質量分析計により解析した結果,At2g16385遺伝子にコードされる成熟型のペプチドの構造は,1残基の硫酸化チロシン残基を含む21アミノ酸残基からなるペプチドであることが確かめられた.このペプチドには,At4g34600遺伝子にコードされる,成熟型のペプチドの構造が非常に類似したもうひとつのペプチドが存在し,この2つのペプチドはファミリーとして機能すると考えられた.
2.At2g16385ペプチドの受容体はGSO1/SGN3およびGSO2である
At2g16385ペプチドの構造は決定されたものの,その過剰発現株にはわずかな生育の阻害や不稔性が観察されるほかにはめだった異常は現われず,その生理機能は未知のままであった.そこで,At2g16385ペプチドの機能を探るため,このペプチドと直接に結合する受容体を探索した.
筆者らの研究グループにおいては,新たなペプチドホルモンの探索法とあわせて,数多く存在する受容体キナーゼファミリーを個々に発現させた受容体発現ライブラリーを使ってペプチドホルモンの受容体を迅速にみつけだす系を確立している.さきに述べたRGFやCEPの受容体もこの系を用いて同定している10,11).
そこで,At2g16385ペプチドについてもこの系を応用した.光反応基を導入したAt2g16385ペプチドを作製し,受容体発現ライブラリーに対し光アフィニティー標識による網羅的な結合実験を行った.その結果,At2g16385ペプチドは,さきに述べたカスパリー線の形成にかかわる受容体GSO1/SGN3,および,そのホモログであるGSO2と直接に結合することが示された.この受容体へはAt2g16385ペプチドのみならず,ファミリーであるAt4g34600ペプチドも結合することが確かめられ,この2つのペプチドに対する受容体はGSO1/SGN3およびGSO2であることが明らかにされた.
3.ペプチドホルモンCIF1およびCIF2は受容体GSO1/SGN3およびGSO2を介してカスパリー線の形成を制御する
At2g16385ペプチドおよびAt4g34600ペプチドの受容体がカスパリー線の形成に必要なGSO1/SGN3であることが示されたため,これら2つのペプチドの機能もカスパリー線の形成に関与する可能性が高まった.そこで,At2g16385ペプチドとAt4g34600ペプチドの二重欠損株を作出して根を観察した結果,GSO1/SGN3の欠損株と同様に,カスパリー線が正しく形成されず多数の途切れが観察された.At2g16385ペプチドおよびAt4g34600ペプチドを欠損した株に対して,合成したAt2g16385ペプチドを培地からあたえるとカスパリー線は正常な状態に回復したが,GSO1/SGN3の欠損株ではAt2g16385ペプチドをあたえても回復しないことも確かめられた.これらの結果から,At2g16385ペプチドおよびAt4g346002ペプチドはカスパリー線の形成において重要なペプチドホルモンであると結論づけ,CIF1およびCIF2(CIF:Casparian strip integrity factor)と命名した.CIFの欠損株にCIFをあたえた場合,およそ6時間で連続したカスパリー線が回復し,活性は1 nMレベルの低濃度でも検出された.
4.ペプチドホルモンCIF1およびCIF2は根の中心柱において発現する
遺伝子プロモーター解析により,CIF1遺伝子およびCIF2遺伝子はいずれも根のカスパリー線が形成される内皮細胞よりも内側の細胞層である中心柱において発現することが示された.受容体であるGSO1/SGN3は内皮細胞に発現することが知られているため,中心柱で産生されるCIFが内皮細胞の細胞膜に発現する受容体GSO1/SGN3およびGSO2に認識されることによりカスパリー線の形成は制御されると考えられた(図1).なお,側根が形成されるときにはカスパリー線は一時的に崩壊することが知られているが,実際に,側根の形成の初期段階においてCIF2遺伝子の発現の一過的な消失が観察された.
5.カスパリー線は根のイオンホメオスタシスの維持に必要である
カスパリー線が機能しないCIFの欠損株が土壌のイオンの濃度変化にどのような応答を示すか検討した.さまざまなイオンについて培地における濃度を上昇させた場合の植物体の成長を観察したところ,CIFの欠損株は過剰な鉄イオンの存在のもとでは枯れてしまった.道管液を回収してシンクロトロンX線蛍光分析により鉄イオンの濃度を定量したところ,野生株では外界の鉄イオンの濃度が上昇しても道管における鉄イオンの濃度は一定に維持されるが,CIFの欠損株では過剰の鉄イオンがそのまま流入することが確かめられた.土壌における濃度の比較的高いカリウムイオンについて培地における濃度を低下させた場合の道管液における濃度を定量したところ,野生株では外界のカリウムイオンの濃度が低下しても道管における濃度は高濃度に維持されていたが,CIFの欠損株では濃度勾配にしたがい一部が流出することが明らかにされた.この結果から,カスパリー線に異常があるとカリウム欠乏症を示すという報告がうまく説明された8).以上を総合すると,カスパリー線は根からの安定的な栄養の吸収,すなわち,イオンホメオスタシスの維持に重要な役割を担うことが明らかにされた(図1).
おわりに
植物は動物のように動きまわることはできないが,変動する自然環境にたくみに適応するしくみをもつ.今回のペプチドホルモンCIFの発見は,つねに至適な栄養条件とはかぎらない自然界において植物が生き延びるための戦略の一端を解明したものとして大きな意義がある.また,カスパリー線は植物の耐塩性と密接に関連すると考えられている.国土を海にかこまれたわが国では耕作地の塩害がしばしば問題になるが,今回,得られた知見はカスパリー線の機能の人為的な改変を可能にするものであり,今後の農業分野への応用が期待される.
今回の筆者らの報告と同時に,スイスの研究グループからもカスパリー線の形成を制御するペプチドホルモンが報告された12).研究のアプローチはまったく異なるにもかかわらず,同じペプチドホルモンの同定にいたっていた.
文 献
- Geldner, N.: The endodermis. Annu. Rev. Plant Biol., 64, 531-558 (2013)[PubMed]
- Liberman, L. M., Sparks, E. E., Moreno-Risueno, M. A. et al.: MYB36 regulates the transition from proliferation to differentiation in the Arabidopsis root. Proc. Natl. Acad. Sci. USA, 112, 12099-12104 (2015)[PubMed]
- Kamiya, T., Borghi, M., Wang, P. et al.: The MYB36 transcription factor orchestrates Casparian strip formation. Proc. Natl. Acad. Sci. USA, 112, 10533-10538 (2015)[PubMed]
- Hosmani, P. S., Kamiya, T., Danku, J. et al.: Dirigent domain-containing protein is part of the machinery required for formation of the lignin-based Casparian strip in the root. Proc. Natl. Acad. Sci. USA, 110, 14498-14503 (2013)[PubMed]
- Alassimone, J., Fujita, S., Doblas, V. G. et al.: Polarly localized kinase SGN1 is required for Casparian strip integrity and positioning. Nat. Plants, 2, 16113 (2016)[PubMed]
- Lee, Y., Rubio, M. C., Alassimone, J. et al.: A mechanism for localized lignin deposition in the endodermis. Cell, 153, 402-412 (2013)[PubMed]
- Roppolo, D., De Rybel, B., Denervaud Tendon, V. et al.: A novel protein family mediates Casparian strip formation in the endodermis. Nature, 473, 380-383 (2011)[PubMed]
- Pfister, A., Barberon, M., Alassimone, J. et al.: A receptor-like kinase mutant with absent endodermal diffusion barrier displays selective nutrient homeostasis defects. Elife, 3, e03115 (2014)[PubMed]
- Matsuzaki, Y., Ogawa-Ohnishi, M., Mori, A. et al.: Secreted peptide signals required for maintenance of root stem cell niche in Arabidopsis. Science, 329, 1065-1067 (2010)[PubMed] [新着論文レビュー]
- Tabata, R., Sumida, K., Yoshii, T. et al.: Perception of root-derived peptides by shoot LRR-RKs mediates systemic N-demand signaling. Science, 346, 343-346 (2014)[PubMed] [新着論文レビュー]
- Shinohara, H., Mori, A., Yasue, N. et al.: Identification of three LRR-RKs involved in perception of root meristem growth factor in Arabidopsis. Proc. Natl. Acad. Sci. USA, 113, 3897-3902 (2016)[PubMed]
- Doblas, V. G., Smakowska-Luzan, E., Fujita, S. et al.: Root diffusion barrier control by a vasculature-derived peptide binding to the SGN3 receptor. Science, 355, 280-284 (2017)[PubMed]
著者プロフィール
略歴:2009年 名古屋大学大学院生命農学研究科 修了,名古屋大学グローバルCOE博士研究員,基礎生物学研究所 助教を経て,2014年より名古屋大学大学院理学研究科 助教.
研究テーマ:ペプチドホルモンと受容体とのペアを介した細胞間シグナル伝達機構.
関心事:さまざまな植物種におけるペプチドホルモンと受容体とのペアの生理機能.野外で音楽鑑賞,スタジアムでサッカー観戦,および,それらの現場で飲むビール.
松林 嘉克(Yoshikatsu Matsubayashi)
名古屋大学大学院理学研究科 教授.
研究室URL:http://www.bio.nagoya-u.ac.jp/~b2
© 2017 篠原秀文・松林嘉克 Licensed under CC 表示 2.1 日本