抗菌レクチンRegIIIβは腸管へのネズミチフス菌の定着および腸炎を長びかせる
三木剛志1・Wolf-Dietrich Hardt 2
(1北里大学薬学部 微生物学教室,2スイスFederal Institute of Technology Zurich校Institute of Microbiology)
email:三木剛志
DOI: 10.7875/first.author.2017.015
The bactericidal lectin RegIIIβ prolongs gut colonization and enteropathy in the streptomycin mouse model for Salmonella diarrhea.
Tsuyoshi Miki, Ryosuke Goto, Mayuka Fujimoto, Nobuhiko Okada, Wolf-Dietrich Hardt
Cell Host & Microbe, 21, 195-207 (2017)
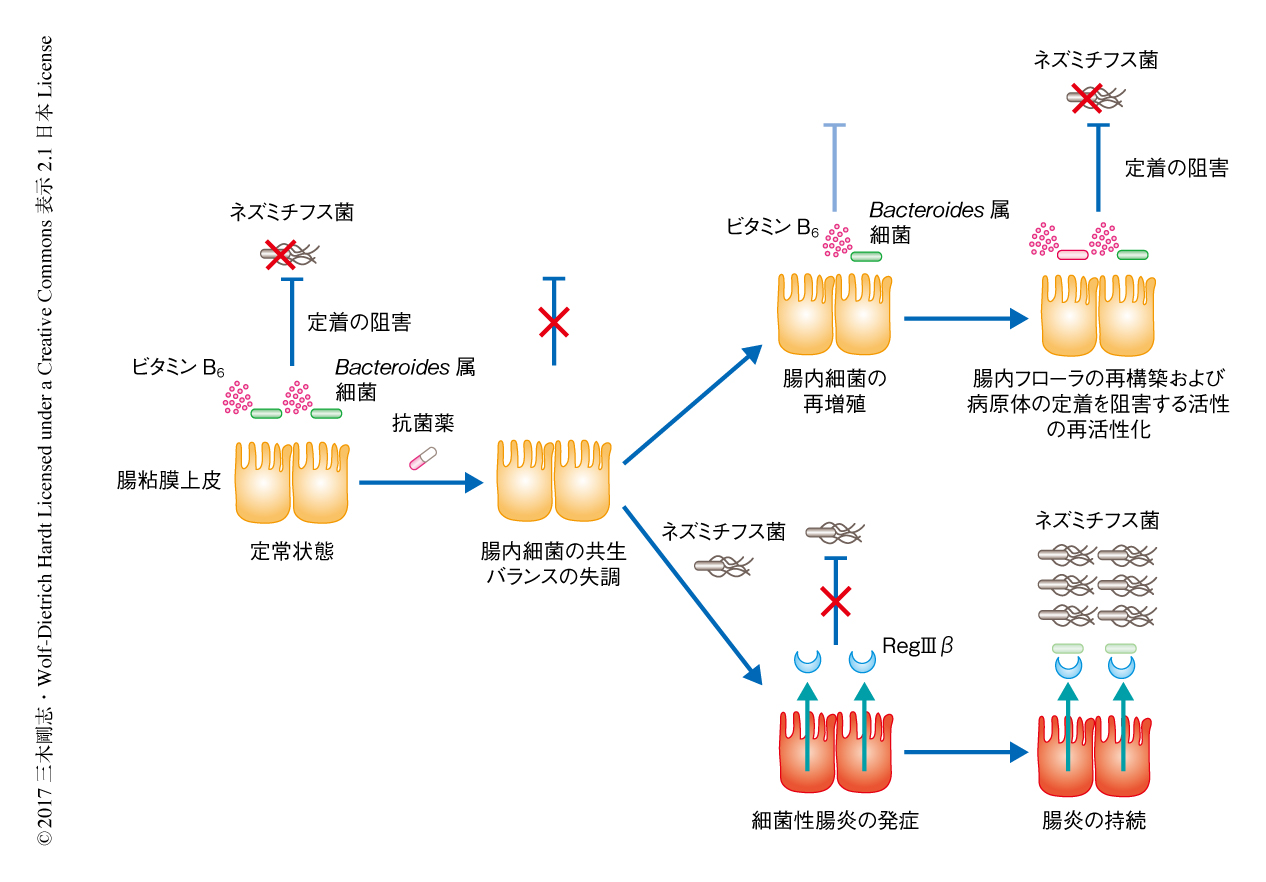
腸粘膜上皮に由来する抗菌レクチンRegIIIβは常在する腸内細菌および外来の病原体の殺菌にはたらくことから,腸の恒常性にかかわる自然免疫エフェクターのひとつと考えられる.この研究において,ネズミチフス菌腸炎モデルマウスを用いた解析により,RegIIIβは感染した病原細菌の排除にはたらくより,むしろ,その腸管への定着および腸炎を長びかせることが明らかにされた.腸へのネズミチフス菌の感染により発現の誘導されたRegIIIβは主要な腸内細菌であるBacteroides属細菌の殺菌にはたらき,さらには,腸の代謝に変化をもたらした.Bacteroides属細菌あるいはその代謝産物であるビタミンB6の投与は腸管へのネズミチフス菌の定着および腸炎に対し防御的にはたらいた.この研究により,RegIIIβの発現量や活性の制御,あるいは,Bacteroides属細菌やビタミンB6の投与が細菌性腸炎に対する新たな治療法になる可能性が示唆された.
非チフス性のSalmonella属細菌の腸への感染は細菌性腸炎をひき起こすが,多くの場合は自然に回復する自己制限的なものである.しかし,たとえば,乳児,高齢者,免疫不全症の患者など重症化する危険性のある場合には抗菌薬の投与といった積極的な治療が必要であるが,これは腸炎の回復に対しあまり効果がない1).また,常在する腸内細菌の殺菌にもはたらく結果,むしろ,再感染の原因になる場合もある.すなわち,細菌性腸炎には抗菌薬に依存しない治療法が必要である.さきに述べたように,細菌性腸炎は自己制限的であることから,回復を促進する宿主の免疫反応が重要な役割を担う.宿主の免疫反応のうちもっとも重要なのは病原体の定着を阻止する活性である2).腸炎は腸内細菌の共生バランスの失調をともない,これにより病原体の定着を阻止する活性がいちじるしく低下することから,この活性の回復の機構を明らかにすることは細菌性腸炎の治療において重要である.そこで,この研究においては,病原体の定着を阻止する活性にかかわる宿主因子として腸粘膜上皮に由来する抗菌レクチンRegIIIβに着目し,ネズミチフス菌腸炎モデルマウスを用いた解析により3),細菌性腸炎におけるRegIIIβの役割について明らかにした.
ネズミチフス菌腸炎モデルを用いて,野生型のマウスとRegIIIβノックアウトマウスとで腸管におけるネズミチフス菌の菌数および腸粘膜上皮の炎症度について比較した.感染の2日後および4日後において菌数に違いはみられず,盲腸組織に強い炎症が認められた.一方,感染の10日後ではRegIIIβノックアウトマウスにおいて菌数および炎症度はともに有意に低く,腸病原体の定着を阻止する活性および炎症の回復が認められた.以上の結果より,RegIIIβは病原体であるネズミチフス菌に対して,防御的にはたらくより,むしろ,腸管への定着を促進し炎症を長びかせることが示唆された.
感染したネズミチフス菌の腸管からの排除には,腸内細菌が共生バランスの失調から回復し,再増殖した腸内細菌による病原体の定着を阻害する活性を発揮することが必要である4).したがって,RegIIIβノックアウトマウスにおいてみられた細菌性腸炎からの回復は腸内細菌の再増殖による病原体の定着を阻害する活性の再活性化によるものと考えられた.そこで,ネズミチフス菌腸炎モデルにおいて野生型のマウスとRegIIIβノックアウトマウスの腸内フローラを16S rRNAアンプリコン解析により比較した.その結果,ネズミチフス菌を感染させるまえの腸内フローラに違いは認められなかったが,感染の2日後ではRegIIIβノックアウトマウスにおいてBacteroides属細菌の構成比が高かった.また,この構成比は感染の10日後まで同様であった.以上の結果より,RegIIIβはBacteroides属細菌の再増殖を抑制することにより腸内細菌の共生バランスの失調からの回復を遅延させる可能性が示唆された.また,RegIIIβノックアウトマウスにおいてみられた細菌性腸炎からの回復は,Bacteroides属細菌の再増殖による病原体の定着を阻害する活性の再活性化によるものと考えられた.
Bacteroides属細菌の再増殖がネズミチフス菌のひき起こす細菌性腸炎に及ぼす影響について検討した.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスにBacteroides属細菌を経口投与したのち,腸管におけるネズミチフス菌の菌数を測定した結果,Bacteroides属細菌を投与しなかったときと比較して,明らかに腸管へのネズミチフス菌の定着が低下した.同様に,Bacteroides属細菌の投与により腸粘膜上皮の炎症の回復が認められた.以上の結果より,Bacteroides属細菌は腸管へのネズミチフス菌の定着を低下させ腸炎からの回復に寄与することが明らかにされた.
腸における代謝産物は腸の恒常性の維持に重要な役割を担う.そこで,RegIIIβに依存したネズミチフス菌とBacteroides属細菌の腸管におけるバランスの変化に対し,腸における代謝産物が関与するかどうか検討した.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスおよびRegIIIβノックアウトマウスの大腸の内容物のメタボローム解析の結果,RegIIIβノックアウトマウスにおいてビタミンB6の代謝の亢進がみられた.さらに,大腸の内容物におけるビタミンB6の量を測定したところ,RegIIIβノックアウトマウスは野生型のマウスと比較して有意に増加していた.
腸管のビタミンB6は食餌から得るか,あるいは,腸内細菌により産生される.そこで,ビタミンB6の供給源としてBacteroides属細菌に着目した.まず,抗菌薬を投与し腸内細菌の共生バランスを失調させた野生型のマウスにおいて大腸の内容物のビタミンB6の量を測定した結果,抗菌薬を投与していないマウスと比較して大きく減少していたが,抗菌薬を投与したマウスにBacteroides属細菌を経口投与したところ,ビタミンB6の量の部分的な回復が認められた.
腸管へのネズミチフス菌の定着および腸炎の制御におけるビタミンB6の役割について調べた.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスにビタミンB6を経口投与し,腸管におけるネズミチフス菌の菌数を測定した結果,ビタミンB6を投与していないマウスと比較して有意に減少していた.また,同様に,ビタミンB6を投与したマウスにおいて盲腸組織の炎症度も有意に低下した.
以上の結果より,少なくとも供給源のひとつとしてBacteroides属細菌から産生されたビタミンB6は,ネズミチフス菌の腸管への定着の制御に必要な腸における代謝産物であることが示唆された.
RegIIIβはその抗菌活性により腸管において病原細菌の感染に対し防御的にはたらくと考えられていた.しかし,この研究により,RegIIIβはこれまでに報告された感染防御とは逆に,腸炎を長びかせることが明らかにされた(図1).腸粘膜上皮における主要な抗菌因子であるディフェンシンは腸内細菌の殺菌にははたらかない5).この報告とこの研究の結果とをあわせて考えると,ディフェンシンはおもに腸内細菌の恒常性の維持に寄与する一方,RegIIIβは腸内細菌の恒常性の維持にはほとんど関与しないが,腸炎のときにはBacteroides属細菌の殺菌にはたらき腸内フローラのバランスに大きな影響を及ぼすと推察される.このように,腸粘膜上皮に由来する異なる抗菌因子が異なるステージで役割を担うことは興味深い.
この研究において,腸管へのネズミチフス菌の定着および腸炎の制御にかかわる因子として,Bacteroides属細菌およびビタミンB6が同定された(図1).潰瘍性大腸炎の患者においてはBacteroides属細菌の減少6) およびビタミンB6の欠乏7) がみられる.さらに,Bacteroides属細菌の特定の菌株は慢性腸炎やClostridium difficileによる下痢や腸炎に対し防御的にはたらき8,9),また,ビタミンB6の投与は潰瘍性大腸炎モデルマウスにおいて腸炎からの回復を促進することが報告されている10).細菌性腸炎の制御におけるBacteroides属細菌およびビタミンB6の分子機構を明らかにすることは今後の研究の重要なトピックである.この研究の成果から,RegIIIβの発現量や活性の制御,あるいは,Bacteroides属細菌やビタミンB6の投与が細菌性腸炎に対する新たな治療法として期待される.
略歴:2004年 北里大学大学院薬学研究科博士課程 修了,同年 北里大学薬学部 研究員,同 助手,2011年 スイスFederal Institute of Technology Zurich校 博士研究員を経て,2013年より北里大学薬学部 講師.
研究テーマ:病原細菌の感染の機構およびその制御.
Wolf-Dietrich Hardt
スイスFederal Institute of Technology Zurich校 教授.
© 2017 三木剛志・Wolf-Dietrich Hardt Licensed under CC 表示 2.1 日本
(1北里大学薬学部 微生物学教室,2スイスFederal Institute of Technology Zurich校Institute of Microbiology)
email:三木剛志
DOI: 10.7875/first.author.2017.015
The bactericidal lectin RegIIIβ prolongs gut colonization and enteropathy in the streptomycin mouse model for Salmonella diarrhea.
Tsuyoshi Miki, Ryosuke Goto, Mayuka Fujimoto, Nobuhiko Okada, Wolf-Dietrich Hardt
Cell Host & Microbe, 21, 195-207 (2017)
要 約
腸粘膜上皮に由来する抗菌レクチンRegIIIβは常在する腸内細菌および外来の病原体の殺菌にはたらくことから,腸の恒常性にかかわる自然免疫エフェクターのひとつと考えられる.この研究において,ネズミチフス菌腸炎モデルマウスを用いた解析により,RegIIIβは感染した病原細菌の排除にはたらくより,むしろ,その腸管への定着および腸炎を長びかせることが明らかにされた.腸へのネズミチフス菌の感染により発現の誘導されたRegIIIβは主要な腸内細菌であるBacteroides属細菌の殺菌にはたらき,さらには,腸の代謝に変化をもたらした.Bacteroides属細菌あるいはその代謝産物であるビタミンB6の投与は腸管へのネズミチフス菌の定着および腸炎に対し防御的にはたらいた.この研究により,RegIIIβの発現量や活性の制御,あるいは,Bacteroides属細菌やビタミンB6の投与が細菌性腸炎に対する新たな治療法になる可能性が示唆された.
はじめに
非チフス性のSalmonella属細菌の腸への感染は細菌性腸炎をひき起こすが,多くの場合は自然に回復する自己制限的なものである.しかし,たとえば,乳児,高齢者,免疫不全症の患者など重症化する危険性のある場合には抗菌薬の投与といった積極的な治療が必要であるが,これは腸炎の回復に対しあまり効果がない1).また,常在する腸内細菌の殺菌にもはたらく結果,むしろ,再感染の原因になる場合もある.すなわち,細菌性腸炎には抗菌薬に依存しない治療法が必要である.さきに述べたように,細菌性腸炎は自己制限的であることから,回復を促進する宿主の免疫反応が重要な役割を担う.宿主の免疫反応のうちもっとも重要なのは病原体の定着を阻止する活性である2).腸炎は腸内細菌の共生バランスの失調をともない,これにより病原体の定着を阻止する活性がいちじるしく低下することから,この活性の回復の機構を明らかにすることは細菌性腸炎の治療において重要である.そこで,この研究においては,病原体の定着を阻止する活性にかかわる宿主因子として腸粘膜上皮に由来する抗菌レクチンRegIIIβに着目し,ネズミチフス菌腸炎モデルマウスを用いた解析により3),細菌性腸炎におけるRegIIIβの役割について明らかにした.
1.RegIIIβノックアウトマウスは細菌性腸炎からの回復が早い
ネズミチフス菌腸炎モデルを用いて,野生型のマウスとRegIIIβノックアウトマウスとで腸管におけるネズミチフス菌の菌数および腸粘膜上皮の炎症度について比較した.感染の2日後および4日後において菌数に違いはみられず,盲腸組織に強い炎症が認められた.一方,感染の10日後ではRegIIIβノックアウトマウスにおいて菌数および炎症度はともに有意に低く,腸病原体の定着を阻止する活性および炎症の回復が認められた.以上の結果より,RegIIIβは病原体であるネズミチフス菌に対して,防御的にはたらくより,むしろ,腸管への定着を促進し炎症を長びかせることが示唆された.
2.RegIIIβは腸内細菌の殺菌にはたらきBacteroides属細菌の再増殖を遅延させる
感染したネズミチフス菌の腸管からの排除には,腸内細菌が共生バランスの失調から回復し,再増殖した腸内細菌による病原体の定着を阻害する活性を発揮することが必要である4).したがって,RegIIIβノックアウトマウスにおいてみられた細菌性腸炎からの回復は腸内細菌の再増殖による病原体の定着を阻害する活性の再活性化によるものと考えられた.そこで,ネズミチフス菌腸炎モデルにおいて野生型のマウスとRegIIIβノックアウトマウスの腸内フローラを16S rRNAアンプリコン解析により比較した.その結果,ネズミチフス菌を感染させるまえの腸内フローラに違いは認められなかったが,感染の2日後ではRegIIIβノックアウトマウスにおいてBacteroides属細菌の構成比が高かった.また,この構成比は感染の10日後まで同様であった.以上の結果より,RegIIIβはBacteroides属細菌の再増殖を抑制することにより腸内細菌の共生バランスの失調からの回復を遅延させる可能性が示唆された.また,RegIIIβノックアウトマウスにおいてみられた細菌性腸炎からの回復は,Bacteroides属細菌の再増殖による病原体の定着を阻害する活性の再活性化によるものと考えられた.
3.Bacteroides属細菌の投与は腸管へのネズミチフス菌の定着を低下させ腸炎からの回復を促進する
Bacteroides属細菌の再増殖がネズミチフス菌のひき起こす細菌性腸炎に及ぼす影響について検討した.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスにBacteroides属細菌を経口投与したのち,腸管におけるネズミチフス菌の菌数を測定した結果,Bacteroides属細菌を投与しなかったときと比較して,明らかに腸管へのネズミチフス菌の定着が低下した.同様に,Bacteroides属細菌の投与により腸粘膜上皮の炎症の回復が認められた.以上の結果より,Bacteroides属細菌は腸管へのネズミチフス菌の定着を低下させ腸炎からの回復に寄与することが明らかにされた.
4.ビタミンB6はRegIIIβに依存した腸管へのネズミチフス菌の定着および腸炎の制御に寄与する腸における代謝産物である
腸における代謝産物は腸の恒常性の維持に重要な役割を担う.そこで,RegIIIβに依存したネズミチフス菌とBacteroides属細菌の腸管におけるバランスの変化に対し,腸における代謝産物が関与するかどうか検討した.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスおよびRegIIIβノックアウトマウスの大腸の内容物のメタボローム解析の結果,RegIIIβノックアウトマウスにおいてビタミンB6の代謝の亢進がみられた.さらに,大腸の内容物におけるビタミンB6の量を測定したところ,RegIIIβノックアウトマウスは野生型のマウスと比較して有意に増加していた.
腸管のビタミンB6は食餌から得るか,あるいは,腸内細菌により産生される.そこで,ビタミンB6の供給源としてBacteroides属細菌に着目した.まず,抗菌薬を投与し腸内細菌の共生バランスを失調させた野生型のマウスにおいて大腸の内容物のビタミンB6の量を測定した結果,抗菌薬を投与していないマウスと比較して大きく減少していたが,抗菌薬を投与したマウスにBacteroides属細菌を経口投与したところ,ビタミンB6の量の部分的な回復が認められた.
腸管へのネズミチフス菌の定着および腸炎の制御におけるビタミンB6の役割について調べた.ネズミチフス菌により細菌性腸炎を発症させた野生型のマウスにビタミンB6を経口投与し,腸管におけるネズミチフス菌の菌数を測定した結果,ビタミンB6を投与していないマウスと比較して有意に減少していた.また,同様に,ビタミンB6を投与したマウスにおいて盲腸組織の炎症度も有意に低下した.
以上の結果より,少なくとも供給源のひとつとしてBacteroides属細菌から産生されたビタミンB6は,ネズミチフス菌の腸管への定着の制御に必要な腸における代謝産物であることが示唆された.
おわりに
RegIIIβはその抗菌活性により腸管において病原細菌の感染に対し防御的にはたらくと考えられていた.しかし,この研究により,RegIIIβはこれまでに報告された感染防御とは逆に,腸炎を長びかせることが明らかにされた(図1).腸粘膜上皮における主要な抗菌因子であるディフェンシンは腸内細菌の殺菌にははたらかない5).この報告とこの研究の結果とをあわせて考えると,ディフェンシンはおもに腸内細菌の恒常性の維持に寄与する一方,RegIIIβは腸内細菌の恒常性の維持にはほとんど関与しないが,腸炎のときにはBacteroides属細菌の殺菌にはたらき腸内フローラのバランスに大きな影響を及ぼすと推察される.このように,腸粘膜上皮に由来する異なる抗菌因子が異なるステージで役割を担うことは興味深い.
この研究において,腸管へのネズミチフス菌の定着および腸炎の制御にかかわる因子として,Bacteroides属細菌およびビタミンB6が同定された(図1).潰瘍性大腸炎の患者においてはBacteroides属細菌の減少6) およびビタミンB6の欠乏7) がみられる.さらに,Bacteroides属細菌の特定の菌株は慢性腸炎やClostridium difficileによる下痢や腸炎に対し防御的にはたらき8,9),また,ビタミンB6の投与は潰瘍性大腸炎モデルマウスにおいて腸炎からの回復を促進することが報告されている10).細菌性腸炎の制御におけるBacteroides属細菌およびビタミンB6の分子機構を明らかにすることは今後の研究の重要なトピックである.この研究の成果から,RegIIIβの発現量や活性の制御,あるいは,Bacteroides属細菌やビタミンB6の投与が細菌性腸炎に対する新たな治療法として期待される.
文 献
- Onwuezobe, I. A., Oshun, P. O. & Odigwe, C. C.: Antimicrobials for treating symptomatic non-typhoidal Salmonella infection. Cochrane Database Syst. Rev., 11, CD001167 (2012)[PubMed]
- Stecher, B. & Hardt, W. D.: Mechanisms controlling pathogen colonization of the gut. Curr. Opin. Microbiol., 14, 82-91 (2011)[PubMed]
- Kaiser, P., Diard, M., Stecher, B. et al.: The streptomycin mouse model for Salmonella diarrhea: functional analysis of the microbiota, the pathogen's virulence factors, and the host's mucosal immune response. Immunol. Rev., 245, 56-83 (2012)[PubMed]
- Endt, K., Stecher, B., Chaffron, S. et al.: The microbiota mediates pathogen clearance from the gut lumen after non-typhoidal Salmonella diarrhea. PLoS Pathog., 6, e1001097 (2010)[PubMed]
- Cullen, T. W., Schofield, W. B., Barry, N. A. et al.: Antimicrobial peptide resistance mediates resilience of prominent gut commensals during inflammation. Science, 347, 170-175 (2015)[PubMed]
- Peterson, D. A., Frank, D. N., Pace, N. R. et al.: Metagenomic approaches for defining the pathogenesis of inflammatory bowel diseases. Cell Host Microbe, 3, 417-427 (2008)[PubMed]
- Vagianos, K., Bector, S., McConnell, J. et al.: Nutrition assessment of patients with inflammatory bowel disease. J. Parenter. Enteral. Nutr., 31, 311-319 (2007)[PubMed]
- Round, J. L., Lee, S. M., Li, J. et al.: The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota. Science, 332, 974-977 (2011)[PubMed]
- Waidmann, M., Bechtold, O., Frick, J. S. et al.: Bacteroides vulgatus protects against Escherichia coli-induced colitis in gnotobiotic interleukin-2-deficient mice. Gastroenterology, 125, 162-177 (2003)[PubMed]
- Selhub, J., Byun, A., Liu, Z. et al.: Dietary vitamin B6 intake modulates colonic inflammation in the IL10-/- model of inflammatory bowel disease. J. Nutr. Biochem., 24, 2138-2143 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 北里大学大学院薬学研究科博士課程 修了,同年 北里大学薬学部 研究員,同 助手,2011年 スイスFederal Institute of Technology Zurich校 博士研究員を経て,2013年より北里大学薬学部 講師.
研究テーマ:病原細菌の感染の機構およびその制御.
Wolf-Dietrich Hardt
スイスFederal Institute of Technology Zurich校 教授.
© 2017 三木剛志・Wolf-Dietrich Hardt Licensed under CC 表示 2.1 日本