SIRT3はヒドロキシメチルグルタリルCoA合成酵素の脱アセチル化によりケトン体の合成を調節する
島津忠広・Eric M. Verdin
(米国California大学San Francisco校Gladstone Institute of Virology and Immunology)
email:島津忠広
DOI: 10.7875/first.author.2010.063
SIRT3 deacetylates mitochondrial 3-hydroxy-3-methylglutaryl CoA synthase 2 and regulates ketone body production.
Tadahiro Shimazu, Matthew D. Hirschey, Lan Hua, Kristin E. Dittenhafer-Reed, Bjoern Schwer, David B. Lombard, Yu Li, Jakob Bunkenborg, Frederick W. Alt, John M. Denu, Matthew P. Jacobson, Eric Verdin
Cell Metabolism, 12, 654-661 (2010)
SIRT3はミトコンドリアに局在しそこでのタンパク質の脱アセチル化を担うNAD+依存性の酵素であり,とくに,貧栄養環境における代謝調節に深く関与することが明らかになってきている.この論文では,飢餓状態におけるエネルギーとして重要なケトン体,βヒドロキシ酪酸の合成酵素のひとつであるヒドロキシメチルグルタリルCoA合成酵素の活性がSIRT3を介した脱アセチル化修飾によって調節されていることを明らかにした.この酵素のアセチル化はLys310,Lys447およびLys473で起こり,マウスを用いた実験では飢餓に応答してSIRT3に依存的にこれらの部位が脱アセチル化された.さらに,SIRT3の存在下でのヒドロキシメチルグルタリルCoA合成酵素の酵素活性は,SIRT3非存在下での酵素活性に比べ高まることを突き止めた.結晶構造にもとづく構造変化予測により,アセチル化修飾はヒドロキシメチルグルタリルCoA合成酵素の部分的な構造変化をひき起こし,基質であるアセチルCoAとの結合や活性部位の構造に影響をあたえることが示唆された.さらに,SIRT3ノックアウトマウスでは飢餓時におけるケトン体の血中濃度が野生型マウスに比べ低下していることが判明し,SIRT3は飢餓刺激に応答してケトン体の合成を促進するはたらきのあることを明らかにした.
生物には貧栄養状態においてもエネルギー生産を維持するための代謝調節機構が備わっており,飢餓時には糖質の代謝および脂肪酸の合成が抑制され,代わりのエネルギーの供給として脂肪酸の酸化およびケトン体の合成の促進することが知られている1).とくに,ケトン体であるβヒドロキシ酪酸あるいはアセト酢酸はグルコースの代替となる飢餓時のエネルギー源として用いられ,その合成経路の律速段階を触媒するミトコンドリア局在酵素,ヒドロキシメチルグルタリルCoA合成酵素には厳密な調節機構が存在する2).この酵素はグルカゴンあるいはcAMPにより転写レベルでの発現調節をうけるほか,スクシニルCoAが競合的に活性部位に結合することでタンパク質レベルでの活性調節のなされることが知られている3).最近では,パルミトイル化修飾をうけることでも活性の調節されていることが示されるなど4),翻訳後修飾による調節機構も注目されている.
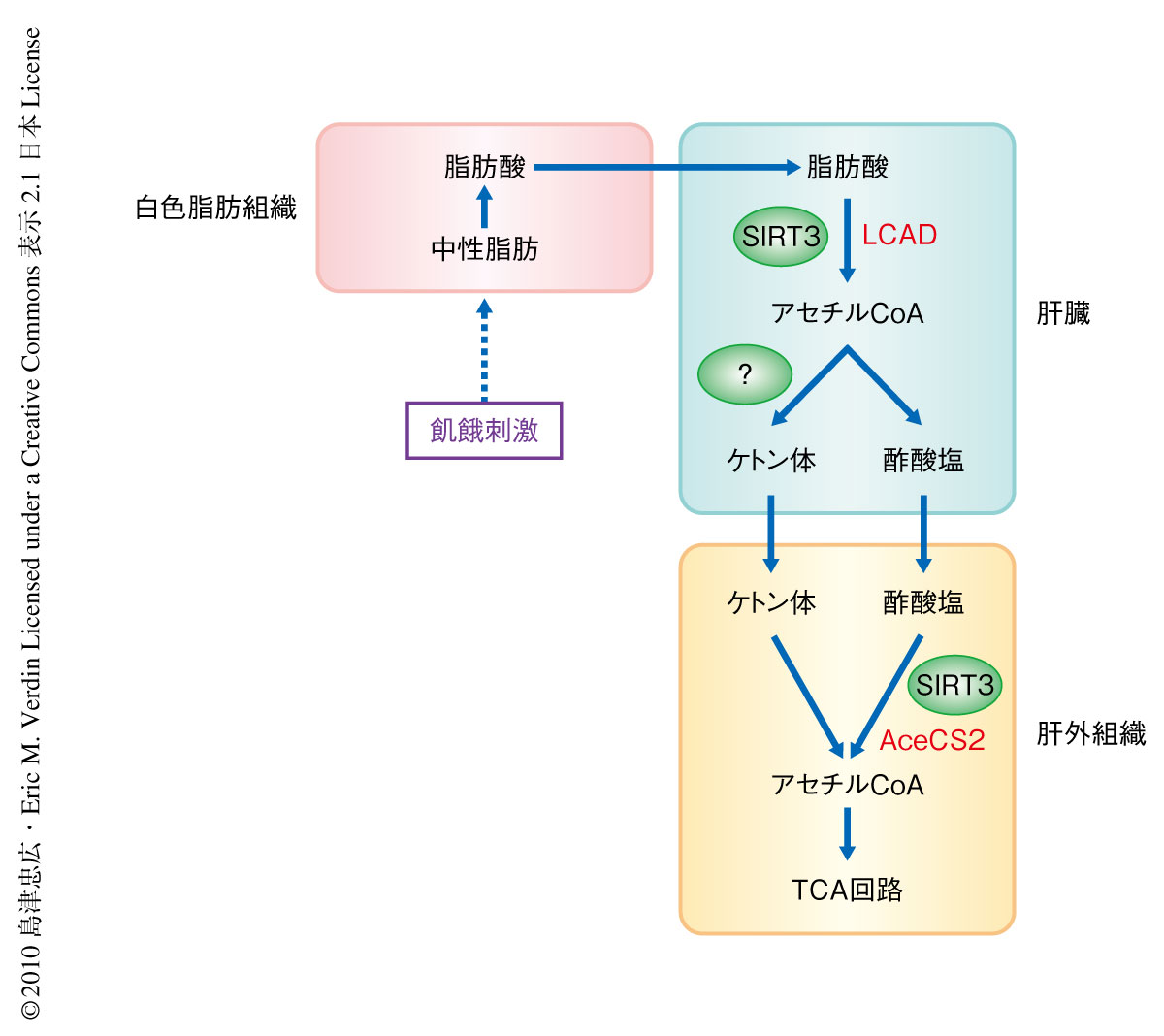
リシン残基のアセチル化はタンパク質の翻訳後修飾のひとつであり,最近では,細菌のみならずヒトにおいても代謝調節に関与することが示されている5,6).SirtuinはNAD+依存的な脱アセチル化酵素であり,そのうちとくに,SIRT3はミトコンドリアに局在するNAD+依存的なリシン脱アセチル化酵素である7).これまでの筆者らのグループの研究により,飢餓に応じてSIRT3の発現量が亢進し,脂肪酸の酸化を触媒する長鎖アシルCoA脱水素酵素を脱アセチル化することで脂肪酸の酸化を促進していることが明らかになった8).また,飢餓応答にかかわる別の酵素,アセチルCoA合成酵素もSIRT3による活性調節をうけることも以前に報告した9).これらのことから,筆者らは,飢餓状態においてSIRT3がさらなるミトコンドリア代謝を調節している可能性を検証することにした(図1).
SIRT3の標的タンパク質を同定するため,SIRT3ノックアウトマウスの肝臓に由来するミトコンドリアからアセチル化ペプチドを精製し質量分析に供した.その結果,ヒドロキシメチルグルタリルCoA合成酵素はノックアウトマウスにおいて顕著にアセチル化修飾をうけているタンパク質のひとつであることを見い出した.筆者らの研究によりSIRT3は飢餓刺激によって活性化することが明らかとなっていたことから8),ヒドロキシメチルグルタリルCoA合成酵素のアセチル化も飢餓状態において変化するのかどうか検証した.その結果,マウスの肝臓において飢餓刺激はヒドロキシメチルグルタリルCoA合成酵素のアセチル化修飾を顕著に減少させることが明らかとなった.一方で,SIRT3ノックアウトマウスでは飢餓刺激とは無関係に高アセチル化したヒドロキシメチルグルタリルCoA合成酵素が存在し,SIRT3がこの酵素の脱アセチル化を担う責任酵素であることが示唆された.SIRT3が直接の脱アセチル化酵素であるのかどうかを検証するため,大腸菌から精製したヒトヒドロキシメチルグルタリルCoA合成酵素とSIRT3とを用いてin vitro脱アセチル化実験を行ったところ,野生型SIRT3はNAD+の存在下でヒドロキシメチルグルタリルCoA合成酵素を顕著に脱アセチル化することを確かめた.また,同じくミトコンドリアに局在するSirtuinであるSIRT4あるいはSIRT5がヒドロキシメチルグルタリルCoA合成酵素を脱アセチル化する活性をもつのかどうか検証したが,これらの酵素の過剰発現ではアセチル化に顕著な差異は認められなかったため,SIRT3がヒドロキシメチルグルタリルCoA合成酵素のリシン残基の脱アセチル化を担う酵素であると結論づけた.
質量分析によりヒドロキシメチルグルタリルCoA合成酵素のアセチル化部位を同定したところ,ヒトとマウスにおいて9つのリシン残基が共通にアセチル化修飾をうけていることがわかった.このうち,Lys310,Lys447,Lys473がSIRT3ノックアウトマウスにおいて顕著に高アセチル化していたことから,これら3つのリシン残基のアセチル化がSIRT3による脱アセチル化調節をうけることが示唆された.そこで,これら3つのリシン残基をアルギニン残基に置換した変異体を作製しその酵素活性を測定したところ,この変異体では野生型に比べ酵素活性が顕著に亢進していることが判明した.さらに,SIRT3とヒドロキシメチルグルタリルCoA合成酵素を共発現した培養細胞から精製したヒドロキシメチルグルタリルCoA合成酵素の酵素活性は単独で発現させた場合に比べ顕著に亢進しており,逆に,SIRT3ノックダウン細胞から精製したヒドロキシメチルグルタリルCoA合成酵素の酵素活性は低下していた.以上のことから,ヒドロキシメチルグルタリルCoA合成酵素のリシン残基のアセチル化は酵素活性を負に制御しており,SIRT3による脱アセチル化はこの酵素を活性化することが明らかとなった.
リシン残基のアセチル化がどのように活性調節にかかわるのかを明らかにするため,ヒドロキシメチルグルタリルCoA合成酵素の3つのリシン残基のアセチル化体および非アセチル化体に関して結晶構造にもとづく構造変化予測を行った.その結果,全体のおよそ80%のCα原子の位置はアセチル化による影響をうけずに立体構造を保つ一方,2つの領域で顕著に構造変化をひき起こすことが予測された.
そのひとつはアセチルCoA結合領域であった.この領域に含まれるLys310はアセチルCoAの3’リン酸基とイオン結合を形成していたが,このリシン残基がアセチル化をうけることによりイオン結合の阻害されることが示唆された.これとは別の構造変化がヒドロキシメチルグルタリルCoA合成酵素の2つのループ領域でもひき起こされた.このループ領域は3つのアセチル化部位から遠く離れ,また,酵素活性部位とも離れているにもかかわらず,ループ領域に起こった構造変化は活性部位にまで波及することが予測された.このアセチル化による構造変化はヒドロキシメチルグルタリルCoA合成酵素の活性に必須のアミノ酸残基,His301とCys166との分子間距離,あるいは,Cys166とアセチルCoAとの分子間距離を増加させた.以上のことから,リシン残基のアセチル化がヒドロキシメチルグルタリルCoA合成酵素の部分的な構造変化をひき起こし酵素活性を負に制御していることが示唆された.
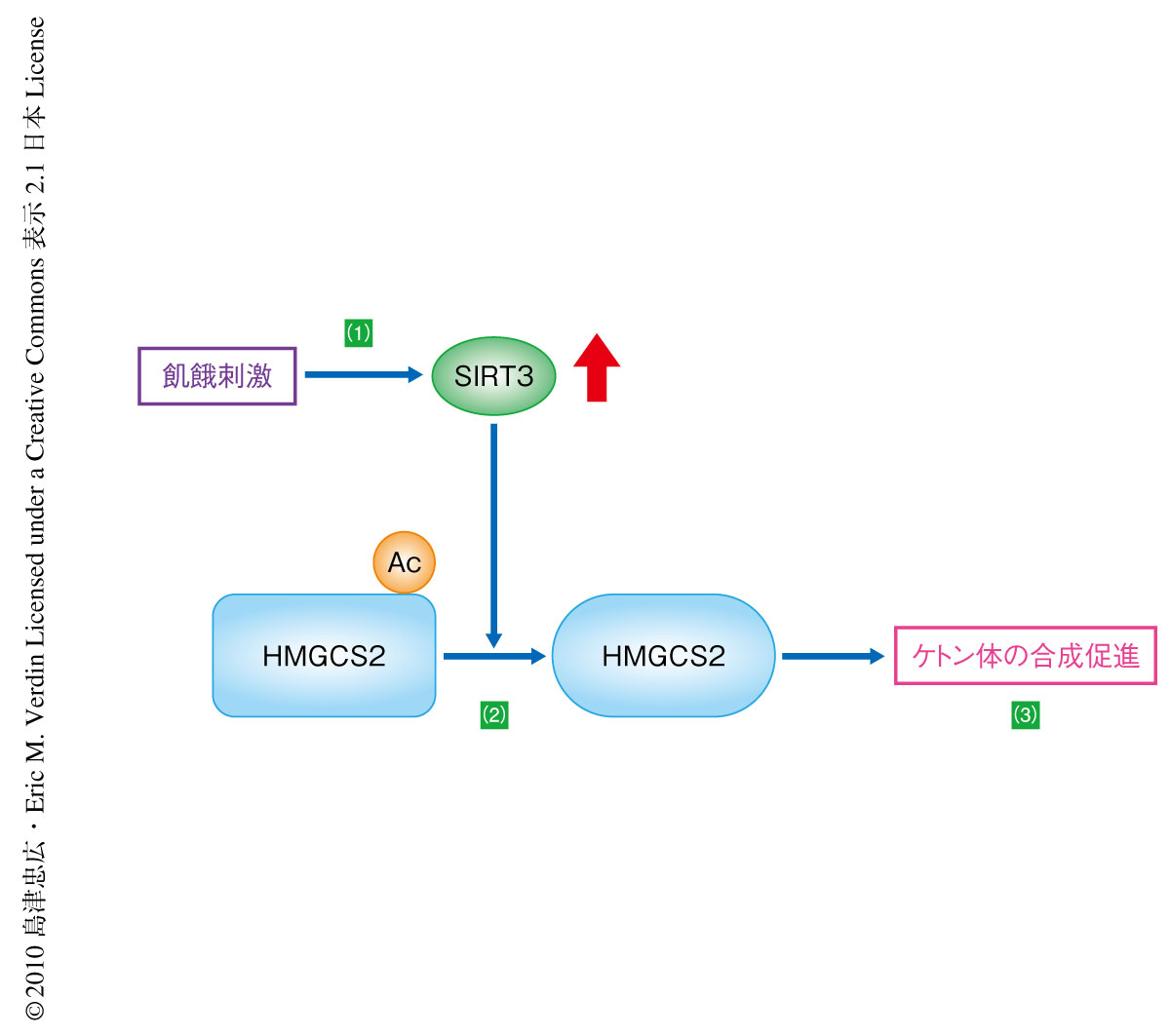
ヒドロキシメチルグルタリルCoA合成酵素はβヒドロキシ酪酸の合成経路の律速断階を担う酵素であることから,SIRT3ノックアウトマウスにおいてケトン体の濃度が低下する可能性を検証した.その結果,自由給餌下では血中のケトン体濃度に顕著な差異は認められなかった一方,飢餓条件下ではSIRT3ノックアウトマウスのケトン体濃度が有意に減少した.さらに,細胞内のケトン体濃度を反映するβヒドロキシブチリルカルニチンの血中濃度も同様の傾向を示したことから,SIRT3は飢餓状態におけるケトン体の合成を正に調節する脱アセチル化酵素であると結論づけた(図2).
SirtuinはNAD+依存的な脱アセチル化酵素であり,近年,酵母,線虫,ショウジョウバエにおいて寿命をつかさどるタンパク質として注目を集めている.哺乳類のミトコンドリアにはSIRT3,SIRT4,SIRT5の3つのSirtuinが局在し,このうちとくにSIRT3がミトコンドリアタンパク質の脱アセチル化を担う主要な酵素であることを以前に報告した10).初期の研究では,SIRT3ノックアウトマウスは正常に発生し顕著な表現型が現れなかったことから10),筆者らは,SIRT3が特定のストレス条件下で機能を発揮する脱アセチル化酵素であると考えた.SIRT3の基質としてはじめて同定されたアセチルCoA合成酵素はとくに飢餓条件下で機能する酵素であること9,11),また,SIRT3の発現量は飢餓状態において亢進することから,飢餓刺激がSIRT3の表現型に重要であると予測し,脂肪酸のβ酸化を触媒する長鎖アシルCoA脱水素酵素がSIRT3による制御をうけていることを見い出すにいたった8).この論文では新たに,飢餓条件下にグルコースの代替エネルギー源となるケトン体の合成がSIRT3による調節をうけていることを明らかにした.興味深いことに,脂肪酸の酸化やケトン体の合成は飢餓だけでなくカロリー制限によっても促進することが知られており,SIRT3がカロリー制限による脂肪酸の酸化促進やケトン体の合成も同様に調節しているのか,さらには,SIRT3とカロリー制限による寿命伸長効果との関連に関しても今後の研究が期待される.
略歴:2007年 東京大学大学院農学生命科学研究科博士課程 修了,同年より米国California大学San Francisco校Gladstone Institute of Virology and Immunology博士研究員.
研究テーマ:ミトコンドリアタンパク質脱アセチル化酵素SIRT3の機能解析.
関心事:タンパク質の翻訳後修飾,とくに,Sirtuinによる脱アセチル化修飾を介した代謝調節機構あるいは寿命調節機構の解明.
Eric M. Verdin
米国California大学San Francisco校Gladstone Institute of Virology and ImmunologyにてSenior Investigator.
研究室URL:http://www.gladstone.ucsf.edu/gladstone/files/verdin/lab/Home/Home.html
© 2010 島津忠広・Eric M. Verdin Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校Gladstone Institute of Virology and Immunology)
email:島津忠広
DOI: 10.7875/first.author.2010.063
SIRT3 deacetylates mitochondrial 3-hydroxy-3-methylglutaryl CoA synthase 2 and regulates ketone body production.
Tadahiro Shimazu, Matthew D. Hirschey, Lan Hua, Kristin E. Dittenhafer-Reed, Bjoern Schwer, David B. Lombard, Yu Li, Jakob Bunkenborg, Frederick W. Alt, John M. Denu, Matthew P. Jacobson, Eric Verdin
Cell Metabolism, 12, 654-661 (2010)
要 約
SIRT3はミトコンドリアに局在しそこでのタンパク質の脱アセチル化を担うNAD+依存性の酵素であり,とくに,貧栄養環境における代謝調節に深く関与することが明らかになってきている.この論文では,飢餓状態におけるエネルギーとして重要なケトン体,βヒドロキシ酪酸の合成酵素のひとつであるヒドロキシメチルグルタリルCoA合成酵素の活性がSIRT3を介した脱アセチル化修飾によって調節されていることを明らかにした.この酵素のアセチル化はLys310,Lys447およびLys473で起こり,マウスを用いた実験では飢餓に応答してSIRT3に依存的にこれらの部位が脱アセチル化された.さらに,SIRT3の存在下でのヒドロキシメチルグルタリルCoA合成酵素の酵素活性は,SIRT3非存在下での酵素活性に比べ高まることを突き止めた.結晶構造にもとづく構造変化予測により,アセチル化修飾はヒドロキシメチルグルタリルCoA合成酵素の部分的な構造変化をひき起こし,基質であるアセチルCoAとの結合や活性部位の構造に影響をあたえることが示唆された.さらに,SIRT3ノックアウトマウスでは飢餓時におけるケトン体の血中濃度が野生型マウスに比べ低下していることが判明し,SIRT3は飢餓刺激に応答してケトン体の合成を促進するはたらきのあることを明らかにした.
はじめに
生物には貧栄養状態においてもエネルギー生産を維持するための代謝調節機構が備わっており,飢餓時には糖質の代謝および脂肪酸の合成が抑制され,代わりのエネルギーの供給として脂肪酸の酸化およびケトン体の合成の促進することが知られている1).とくに,ケトン体であるβヒドロキシ酪酸あるいはアセト酢酸はグルコースの代替となる飢餓時のエネルギー源として用いられ,その合成経路の律速段階を触媒するミトコンドリア局在酵素,ヒドロキシメチルグルタリルCoA合成酵素には厳密な調節機構が存在する2).この酵素はグルカゴンあるいはcAMPにより転写レベルでの発現調節をうけるほか,スクシニルCoAが競合的に活性部位に結合することでタンパク質レベルでの活性調節のなされることが知られている3).最近では,パルミトイル化修飾をうけることでも活性の調節されていることが示されるなど4),翻訳後修飾による調節機構も注目されている.
リシン残基のアセチル化はタンパク質の翻訳後修飾のひとつであり,最近では,細菌のみならずヒトにおいても代謝調節に関与することが示されている5,6).SirtuinはNAD+依存的な脱アセチル化酵素であり,そのうちとくに,SIRT3はミトコンドリアに局在するNAD+依存的なリシン脱アセチル化酵素である7).これまでの筆者らのグループの研究により,飢餓に応じてSIRT3の発現量が亢進し,脂肪酸の酸化を触媒する長鎖アシルCoA脱水素酵素を脱アセチル化することで脂肪酸の酸化を促進していることが明らかになった8).また,飢餓応答にかかわる別の酵素,アセチルCoA合成酵素もSIRT3による活性調節をうけることも以前に報告した9).これらのことから,筆者らは,飢餓状態においてSIRT3がさらなるミトコンドリア代謝を調節している可能性を検証することにした(図1).
1.SIRT3はヒドロキシメチルグルタリルCoA合成酵素のリシン残基のアセチル化を調節する
SIRT3の標的タンパク質を同定するため,SIRT3ノックアウトマウスの肝臓に由来するミトコンドリアからアセチル化ペプチドを精製し質量分析に供した.その結果,ヒドロキシメチルグルタリルCoA合成酵素はノックアウトマウスにおいて顕著にアセチル化修飾をうけているタンパク質のひとつであることを見い出した.筆者らの研究によりSIRT3は飢餓刺激によって活性化することが明らかとなっていたことから8),ヒドロキシメチルグルタリルCoA合成酵素のアセチル化も飢餓状態において変化するのかどうか検証した.その結果,マウスの肝臓において飢餓刺激はヒドロキシメチルグルタリルCoA合成酵素のアセチル化修飾を顕著に減少させることが明らかとなった.一方で,SIRT3ノックアウトマウスでは飢餓刺激とは無関係に高アセチル化したヒドロキシメチルグルタリルCoA合成酵素が存在し,SIRT3がこの酵素の脱アセチル化を担う責任酵素であることが示唆された.SIRT3が直接の脱アセチル化酵素であるのかどうかを検証するため,大腸菌から精製したヒトヒドロキシメチルグルタリルCoA合成酵素とSIRT3とを用いてin vitro脱アセチル化実験を行ったところ,野生型SIRT3はNAD+の存在下でヒドロキシメチルグルタリルCoA合成酵素を顕著に脱アセチル化することを確かめた.また,同じくミトコンドリアに局在するSirtuinであるSIRT4あるいはSIRT5がヒドロキシメチルグルタリルCoA合成酵素を脱アセチル化する活性をもつのかどうか検証したが,これらの酵素の過剰発現ではアセチル化に顕著な差異は認められなかったため,SIRT3がヒドロキシメチルグルタリルCoA合成酵素のリシン残基の脱アセチル化を担う酵素であると結論づけた.
2.3つのリシン残基のアセチル化がヒドロキシメチルグルタリルCoA合成酵素の活性を調節する
質量分析によりヒドロキシメチルグルタリルCoA合成酵素のアセチル化部位を同定したところ,ヒトとマウスにおいて9つのリシン残基が共通にアセチル化修飾をうけていることがわかった.このうち,Lys310,Lys447,Lys473がSIRT3ノックアウトマウスにおいて顕著に高アセチル化していたことから,これら3つのリシン残基のアセチル化がSIRT3による脱アセチル化調節をうけることが示唆された.そこで,これら3つのリシン残基をアルギニン残基に置換した変異体を作製しその酵素活性を測定したところ,この変異体では野生型に比べ酵素活性が顕著に亢進していることが判明した.さらに,SIRT3とヒドロキシメチルグルタリルCoA合成酵素を共発現した培養細胞から精製したヒドロキシメチルグルタリルCoA合成酵素の酵素活性は単独で発現させた場合に比べ顕著に亢進しており,逆に,SIRT3ノックダウン細胞から精製したヒドロキシメチルグルタリルCoA合成酵素の酵素活性は低下していた.以上のことから,ヒドロキシメチルグルタリルCoA合成酵素のリシン残基のアセチル化は酵素活性を負に制御しており,SIRT3による脱アセチル化はこの酵素を活性化することが明らかとなった.
3.リシン残基の脱アセチル化はヒドロキシメチルグルタリルCoA合成酵素の構造変化をひき起こす
リシン残基のアセチル化がどのように活性調節にかかわるのかを明らかにするため,ヒドロキシメチルグルタリルCoA合成酵素の3つのリシン残基のアセチル化体および非アセチル化体に関して結晶構造にもとづく構造変化予測を行った.その結果,全体のおよそ80%のCα原子の位置はアセチル化による影響をうけずに立体構造を保つ一方,2つの領域で顕著に構造変化をひき起こすことが予測された.
そのひとつはアセチルCoA結合領域であった.この領域に含まれるLys310はアセチルCoAの3’リン酸基とイオン結合を形成していたが,このリシン残基がアセチル化をうけることによりイオン結合の阻害されることが示唆された.これとは別の構造変化がヒドロキシメチルグルタリルCoA合成酵素の2つのループ領域でもひき起こされた.このループ領域は3つのアセチル化部位から遠く離れ,また,酵素活性部位とも離れているにもかかわらず,ループ領域に起こった構造変化は活性部位にまで波及することが予測された.このアセチル化による構造変化はヒドロキシメチルグルタリルCoA合成酵素の活性に必須のアミノ酸残基,His301とCys166との分子間距離,あるいは,Cys166とアセチルCoAとの分子間距離を増加させた.以上のことから,リシン残基のアセチル化がヒドロキシメチルグルタリルCoA合成酵素の部分的な構造変化をひき起こし酵素活性を負に制御していることが示唆された.
4.SIRT3ノックアウトマウスでは血中のケトン体濃度が低下する
ヒドロキシメチルグルタリルCoA合成酵素はβヒドロキシ酪酸の合成経路の律速断階を担う酵素であることから,SIRT3ノックアウトマウスにおいてケトン体の濃度が低下する可能性を検証した.その結果,自由給餌下では血中のケトン体濃度に顕著な差異は認められなかった一方,飢餓条件下ではSIRT3ノックアウトマウスのケトン体濃度が有意に減少した.さらに,細胞内のケトン体濃度を反映するβヒドロキシブチリルカルニチンの血中濃度も同様の傾向を示したことから,SIRT3は飢餓状態におけるケトン体の合成を正に調節する脱アセチル化酵素であると結論づけた(図2).
おわりに
SirtuinはNAD+依存的な脱アセチル化酵素であり,近年,酵母,線虫,ショウジョウバエにおいて寿命をつかさどるタンパク質として注目を集めている.哺乳類のミトコンドリアにはSIRT3,SIRT4,SIRT5の3つのSirtuinが局在し,このうちとくにSIRT3がミトコンドリアタンパク質の脱アセチル化を担う主要な酵素であることを以前に報告した10).初期の研究では,SIRT3ノックアウトマウスは正常に発生し顕著な表現型が現れなかったことから10),筆者らは,SIRT3が特定のストレス条件下で機能を発揮する脱アセチル化酵素であると考えた.SIRT3の基質としてはじめて同定されたアセチルCoA合成酵素はとくに飢餓条件下で機能する酵素であること9,11),また,SIRT3の発現量は飢餓状態において亢進することから,飢餓刺激がSIRT3の表現型に重要であると予測し,脂肪酸のβ酸化を触媒する長鎖アシルCoA脱水素酵素がSIRT3による制御をうけていることを見い出すにいたった8).この論文では新たに,飢餓条件下にグルコースの代替エネルギー源となるケトン体の合成がSIRT3による調節をうけていることを明らかにした.興味深いことに,脂肪酸の酸化やケトン体の合成は飢餓だけでなくカロリー制限によっても促進することが知られており,SIRT3がカロリー制限による脂肪酸の酸化促進やケトン体の合成も同様に調節しているのか,さらには,SIRT3とカロリー制限による寿命伸長効果との関連に関しても今後の研究が期待される.
文 献
- McGarry, J. D. & Foster, D. W: Regulation of hepatic fatty acid oxidation and ketone body production. Annu. Rev. Biochem., 49, 395-420 (1980)[PubMed]
- Hegardt, F. G: Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis. Biochem. J., 338(Pt3), 569-582 (1999)[PubMed]
- Quant, P. A., Tubbs, P. K., Brand, M. D: Glucagon activates mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase in vivo by decreasing the extent of succinylation of the enzyme. Eur. J. Biochem., 187, 169-174 (1990)[PubMed]
- Kostiuk, M. A., Corvi, M. M., Keller, B. O. et al: Identification of palmitoylated mitochondrial proteins using a bio-orthogonal azido-palmitate analogue. FASEB J., 22, 721-732 (2008)[PubMed]
- Zhao, S., Xu, W., Jiang, W. et al: Regulation of cellular metabolism by protein lysine acetylation. Science, 327, 1000-1004 (2010)[PubMed]
- Wang, Q., Zhang, Y., Yang, C. et al: Acetylation of metabolic enzymes coordinates carbon source utilization and metabolic flux. Science, 327, 1004-1007 (2010)[PubMed]
- Schwer, B., North, B. J., Frye, R. A. et al: The human silent information regulator (Sir)2 homologue hSIRT3 is a mitochondrial nicotinamide adenine dinucleotide-dependent deacetylase. J. Cell Biol., 158, 647-657 (2002)[PubMed]
- Hirschey, M. D., Shimazu, T., Goetzman, E. et al: SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation. Nature, 464, 121-125 (2010)[PubMed]
- Schwer, B., Bunkenborg, J., Verdin, R. O. et al: Reversible lysine acetylation controls the activity of the mitochondrial enzyme acetyl-CoA synthetase 2. Proc. Natl. Acad. Sci. USA, 103, 10224-10229 (2006)[PubMed]
- Lombard, D. B., Alt, F. W., Cheng, H. L. et al: Mammalian Sir2 homolog SIRT3 regulates global mitochondrial lysine acetylation. Mol. Cell. Biol., 27, 8807-8814 (2007)[PubMed]
- Sakakibara, I., Fujino, T., Ishii, M. et al: Fasting-induced hypothermia and reduced energy production in mice lacking acetyl-CoA synthetase 2. Cell Metab., 9, 191-202 (2009)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院農学生命科学研究科博士課程 修了,同年より米国California大学San Francisco校Gladstone Institute of Virology and Immunology博士研究員.
研究テーマ:ミトコンドリアタンパク質脱アセチル化酵素SIRT3の機能解析.
関心事:タンパク質の翻訳後修飾,とくに,Sirtuinによる脱アセチル化修飾を介した代謝調節機構あるいは寿命調節機構の解明.
Eric M. Verdin
米国California大学San Francisco校Gladstone Institute of Virology and ImmunologyにてSenior Investigator.
研究室URL:http://www.gladstone.ucsf.edu/gladstone/files/verdin/lab/Home/Home.html
© 2010 島津忠広・Eric M. Verdin Licensed under CC 表示 2.1 日本