Wntシグナル経路におけるHIPK2によるリン酸化を介したTCF3の制御
日笠 弘基
(九州大学生体防御医学研究所 ゲノム腫瘍学分野)
email:日笠弘基
DOI: 10.7875/first.author.2010.058
Regulation of TCF3 by Wnt-dependent phosphorylation during vertebrate axis specification.
Hiroki Hikasa, Jerome Ezan, Keiji Itoh, Xiaotong Li, Michael W. Klymkowsky, Sergei Y. Sokol
Developmental Cell, 4, 521-532 (2010)
標準的Wntシグナル経路において,TCFは転写共役因子であるβカテニンと複合体を形成し標的遺伝子の転写を促進するものと考えられている.しかしながら,TCFファミリーのひとつTCF3は標的遺伝子の転写を抑制することで初期胚のパターン形成および胚性幹細胞の多能性を制御しており,その制御機構は不明であった.筆者らは,アフリカツメガエルの初期胚および培養細胞の系において標準的WntシグナルがTCF3をリン酸化していること,さらに,Wnt刺激に応答してTCF3を直接にリン酸化するのはHIPK2であり,そのリン酸化が標的遺伝子への結合を弱め,結果として,背腹のパターン形成に重要な標的遺伝子の転写の促進にはたらいていることを明らかにした.また,βカテニンがHIPK2とTCF3との結合を促進しそのリン酸化に必要であることも判明し,βカテニンに転写共役因子としての機能以外の新しい役割を見い出すことができた.この研究は,WntシグナルによるTCF3のリン酸化とその発生における意義を結びつけたはじめての報告であった.
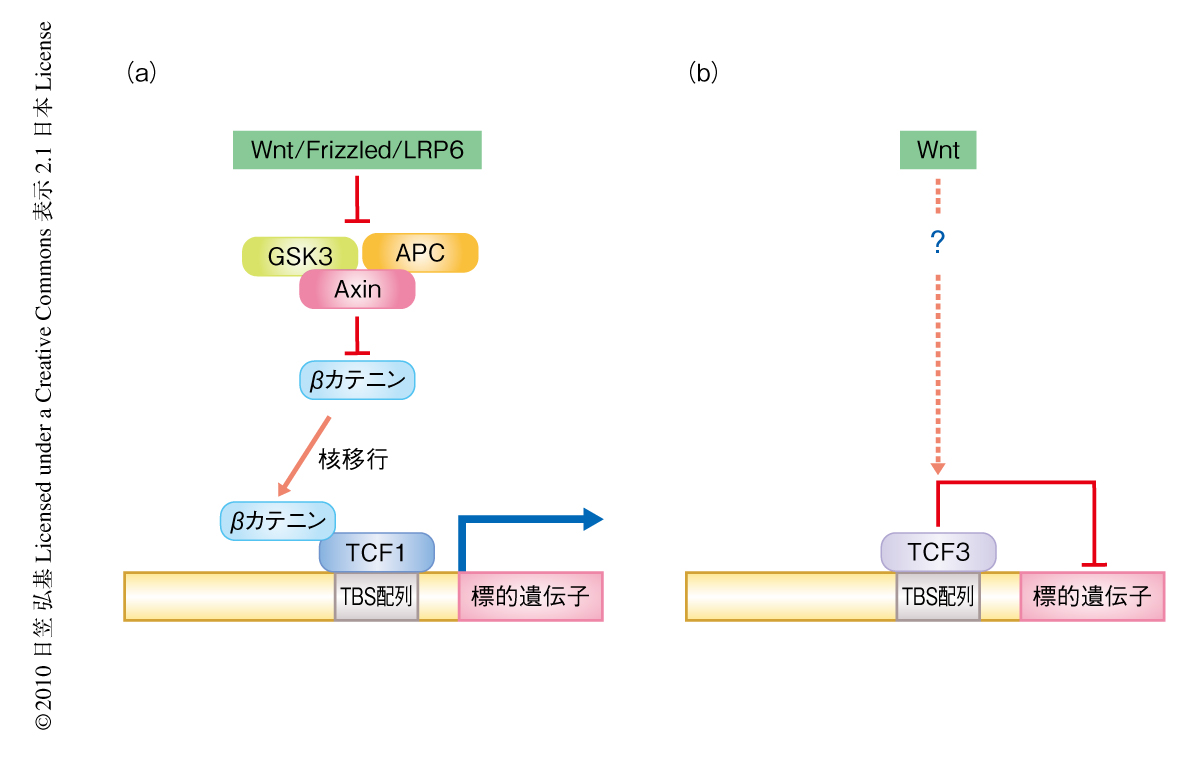
Wntシグナル経路はさまざまな細胞の増殖,分化,極性などを制御し,これまで形態形成や腫瘍形成への関与が示唆されてきた.標準的Wntシグナルの非存在下では,APC,GSK3およびAxinからなる複合体がβカテニンを細胞質でプロテオソーム分解系により分解することでシグナルを負に制御しているものと考えられている.一般的に受け入れられているシグナル活性化のモデルにおいて,Wntシグナルの存在下でWntリガンドおよびFrizzledやLRP6の受容体複合体がβカテニン分解複合体の形成を抑制することでβカテニンを安定化し,その結果,核に移行したβカテニンが転写因子TCFと結合して標的遺伝子の転写を活性化するものと考えられている1)(図1a).脊椎動物では,現在,4種類のTCFが知られており機能的に特殊化していることがわかっている.遺伝子ノックアウトや機能阻害の実験から,LEF1およびTCF1などのTCFはβカテニンとともにWntシグナルによる標的遺伝子の転写の促進に必要であるのに対し2,3),TCF3は標的遺伝子の転写を抑制することがわかっている4-6)(図1b).そのうえ,両生類の初期胚のパターン形成において標準的WntのひとつであるWnt8は腹側/後方化に必須であるのに対して7,8),逆に,TCF3は背側/前方化に必要なことが知られている4).このように,標準的WntシグナルとTCF3とは相反する生理活性および機能をもつが,TCF3の標準的Wntシグナルによる制御の有無もしくはその機構は不明であった(図1).この研究では,TCF3がWntシグナルに依存的に核に存在するキナーゼHIPK2(homeodomain-interacting protein kinase 2)によりリン酸化され,その転写抑制能が調節されていることを報告した.
筆者らは,Wnt刺激によりひき起こされるタンパク質レベルでのTCF3の変化に注目し,原腸胚の外胚葉外植体においてTCF3がWnt8刺激によってリン酸化されることを見い出した.原腸胚期にはWnt8が高レベルで発現する腹側帯域においてTCF3はリン酸化されており,優性阻害型Wnt8やWnt8モルフォリーノアンチセンスオリゴヌクレオチドによるWnt8の機能阻害によりこのリン酸化が抑制されることから,Wnt8によるシグナルがin vivoでTCF3のリン酸化をひき起こすことが明らかになった.さらに,TCF3と結合するタンパク質を検索する過程で単離されたセリン/スレオニンキナーゼHIPK2が直接にTCF3をリン酸化し,また,HIPK2がWnt8によるTCF3のリン酸化に必要なことから,Wnt8-HIPK2-TCF3リン酸化経路が原腸胚のパターン形成にかかわる可能性が示唆された.
原腸胚の腹側化に必要なVent2遺伝子はそのプロモーターにTCF結合部位を1つもちWnt8により発現誘導されることが知られている.そこで,Vent2遺伝子プロモーターを含むレポーター遺伝子,および,内在性のVent2遺伝子の発現へのWnt8,HIPK2,TCF3の作用を調べたところ,TCF結合部位を介してWnt8とHIPK2はVent2遺伝子の発現を正に制御する一方,TCF3は負に制御していることがわかった.さらに,胚前後軸の形成において,Wnt8とHIPK2はOtx2遺伝子,Xanf2遺伝子,Rx2a遺伝子などの内在性の前方化マーカー遺伝子の発現を抑制し胚を後方化するのに対し,TCF3は前方化マーカー遺伝子の発現に必要であり胚を前方化することが明らかになった.このように,Vent2遺伝子の発現調節および前後軸の形成においてTCF3はWnt8およびHIPK2とは逆の機能をもっていた.これらのことから,Wnt8およびHIPK2がリン酸化を介してTCF3の転写抑制能を阻害するという仮説をたてた.
βカテニンは標準的Wntシグナル経路において中心的な役割をはたし,原腸胚における背腹/前後のパターン形成にも密接にかかわっている9,10).そこで,βカテニンのTCF3のリン酸化への関与を調べたところ,両生類胚ではβカテニン単独ではTCF3のリン酸化をひき起こすことはできないものの,Wnt刺激によるリン酸化に必須であることがわかった.さらに,培養細胞においてβカテニンはTCF3とHIPK2との結合を強め,HIPK2の存在下にかぎってTCF3のリン酸化を促進することが観察された.これらのことは,βカテニンがこれまで考えられてきたTCFに対する転写共役因子としての役割以外にも,TCF3とHIPK2とのあいだの足場タンパク質としてリン酸化に深くかかわっていることを示唆していた.
Wnt8およびHIPK2がリン酸化を介してTCF3の転写抑制能を阻害するという仮説を検証しこのリン酸化の生理的な意義を明らかにするため,まず,Wnt刺激によるTCF3の移動度の変化を指標としてリン酸化の標的となる複数の部位,Ser147,Ser149,Thr170,Ser181,Ser184,Ser190を特定した.さらに,TCF3に特有なSer190に対するリン酸化特異的な抗体を用いWnt刺激およびHIPK2によるTCF3のリン酸化を哺乳類培養細胞でも確認できたことから,このWnt-HIPK2-TCF3経路が脊椎動物において広く保存されていることが示唆された.これら特定されたリン酸化部位のすべてをAla残基に置換した非リン酸化型TCF3は野生型TCF3に比べより強く胚を前方化し,また,両生類胚および哺乳類培養細胞の両方においてWnt刺激によるTCF依存性レポーター遺伝子の活性化をより強力に抑制した.さらに,非リン酸化型TCF3は標的遺伝子のプロモーターにより強く結合し,Wnt刺激やHIPK2により生じたリン酸化型TCF3ではプロモーターへの結合能の弱まっていることもクロマチン免疫沈降法により明らかになった.これらのことから,Wnt8/HIPK2シグナルはTCF3をリン酸化することで標的遺伝子への結合を弱め,TCF3による標的遺伝子の転写の抑制を解除することが考えられた.
両生類胚の過剰発現をはじめとする古典的な実験により,胞胚期には背側中胚葉(オーガナイザー)遺伝子を活性化し,その直後の原腸胚期には逆にVent2遺伝子などの腹側中胚葉遺伝子を活性化するといったように,標準的Wntシグナル経路が体軸のパターン形成において時期特異的に異なる役割を担っていることがわかってから20年近くがたった11).しかしながら,これら2つの発生段階においてWntシグナル経路の標的遺伝子が同じ分子機構により活性化されているのかどうかはずっと不明のままであった.この研究により,HIPK2は原腸胚期腹側においてWnt刺激によりTCF3を直接にリン酸化して標的遺伝子への結合を弱め,TCF3の転写抑制を解除することで腹側/後方化に重要な標的遺伝子の転写促進にはたらくことがわかった(図2).一方で,標準的Wntシグナル経路によりオーガナイザー遺伝子が活性化される背側中胚葉においてはTCF3のリン酸化は観察されないことから,標準的Wntシグナル経路による標的遺伝子の活性化は背側と腹側とでは異なる分子機構により制御されていることが強く示唆された.初期胚の背腹のWntシグナル経路の標的遺伝子の活性化の差を特徴づける重要なタンパク質としてHIPK2が注目されるが,Wntリガンドから核に存在するキナーゼHIPK2にいたるシグナル経路の構成タンパク質やWntシグナルによるHIPK2の活性化の機構は依然として不明であり,これらの解明は今後の重要な課題である.
略歴:2001年 東京大学大学院理学系研究科博士課程 修了,同年 米国Harvard Medical Schoolポストドクトラルフェロー,2004年 米国Mount Sinai School of Medicineリサーチインストラクターを経て,2010年より九州大学生体防御医学研究所 助教.
研究テーマ:発生などの生命現象に重要なシグナル経路の解明.
抱負:サイエンスのつぎの進歩に貢献するような研究を発表していきたい.
© 2010 日笠 弘基 Licensed under CC 表示 2.1 日本
(九州大学生体防御医学研究所 ゲノム腫瘍学分野)
email:日笠弘基
DOI: 10.7875/first.author.2010.058
Regulation of TCF3 by Wnt-dependent phosphorylation during vertebrate axis specification.
Hiroki Hikasa, Jerome Ezan, Keiji Itoh, Xiaotong Li, Michael W. Klymkowsky, Sergei Y. Sokol
Developmental Cell, 4, 521-532 (2010)
要 約
標準的Wntシグナル経路において,TCFは転写共役因子であるβカテニンと複合体を形成し標的遺伝子の転写を促進するものと考えられている.しかしながら,TCFファミリーのひとつTCF3は標的遺伝子の転写を抑制することで初期胚のパターン形成および胚性幹細胞の多能性を制御しており,その制御機構は不明であった.筆者らは,アフリカツメガエルの初期胚および培養細胞の系において標準的WntシグナルがTCF3をリン酸化していること,さらに,Wnt刺激に応答してTCF3を直接にリン酸化するのはHIPK2であり,そのリン酸化が標的遺伝子への結合を弱め,結果として,背腹のパターン形成に重要な標的遺伝子の転写の促進にはたらいていることを明らかにした.また,βカテニンがHIPK2とTCF3との結合を促進しそのリン酸化に必要であることも判明し,βカテニンに転写共役因子としての機能以外の新しい役割を見い出すことができた.この研究は,WntシグナルによるTCF3のリン酸化とその発生における意義を結びつけたはじめての報告であった.
はじめに
Wntシグナル経路はさまざまな細胞の増殖,分化,極性などを制御し,これまで形態形成や腫瘍形成への関与が示唆されてきた.標準的Wntシグナルの非存在下では,APC,GSK3およびAxinからなる複合体がβカテニンを細胞質でプロテオソーム分解系により分解することでシグナルを負に制御しているものと考えられている.一般的に受け入れられているシグナル活性化のモデルにおいて,Wntシグナルの存在下でWntリガンドおよびFrizzledやLRP6の受容体複合体がβカテニン分解複合体の形成を抑制することでβカテニンを安定化し,その結果,核に移行したβカテニンが転写因子TCFと結合して標的遺伝子の転写を活性化するものと考えられている1)(図1a).脊椎動物では,現在,4種類のTCFが知られており機能的に特殊化していることがわかっている.遺伝子ノックアウトや機能阻害の実験から,LEF1およびTCF1などのTCFはβカテニンとともにWntシグナルによる標的遺伝子の転写の促進に必要であるのに対し2,3),TCF3は標的遺伝子の転写を抑制することがわかっている4-6)(図1b).そのうえ,両生類の初期胚のパターン形成において標準的WntのひとつであるWnt8は腹側/後方化に必須であるのに対して7,8),逆に,TCF3は背側/前方化に必要なことが知られている4).このように,標準的WntシグナルとTCF3とは相反する生理活性および機能をもつが,TCF3の標準的Wntシグナルによる制御の有無もしくはその機構は不明であった(図1).この研究では,TCF3がWntシグナルに依存的に核に存在するキナーゼHIPK2(homeodomain-interacting protein kinase 2)によりリン酸化され,その転写抑制能が調節されていることを報告した.
1.TCF3はWnt8に応答しHIPK2により原腸胚の腹側帯域においてリン酸化される
筆者らは,Wnt刺激によりひき起こされるタンパク質レベルでのTCF3の変化に注目し,原腸胚の外胚葉外植体においてTCF3がWnt8刺激によってリン酸化されることを見い出した.原腸胚期にはWnt8が高レベルで発現する腹側帯域においてTCF3はリン酸化されており,優性阻害型Wnt8やWnt8モルフォリーノアンチセンスオリゴヌクレオチドによるWnt8の機能阻害によりこのリン酸化が抑制されることから,Wnt8によるシグナルがin vivoでTCF3のリン酸化をひき起こすことが明らかになった.さらに,TCF3と結合するタンパク質を検索する過程で単離されたセリン/スレオニンキナーゼHIPK2が直接にTCF3をリン酸化し,また,HIPK2がWnt8によるTCF3のリン酸化に必要なことから,Wnt8-HIPK2-TCF3リン酸化経路が原腸胚のパターン形成にかかわる可能性が示唆された.
2.胚のパターン形成においてWnt8およびHIPK2はTCF3と拮抗する
原腸胚の腹側化に必要なVent2遺伝子はそのプロモーターにTCF結合部位を1つもちWnt8により発現誘導されることが知られている.そこで,Vent2遺伝子プロモーターを含むレポーター遺伝子,および,内在性のVent2遺伝子の発現へのWnt8,HIPK2,TCF3の作用を調べたところ,TCF結合部位を介してWnt8とHIPK2はVent2遺伝子の発現を正に制御する一方,TCF3は負に制御していることがわかった.さらに,胚前後軸の形成において,Wnt8とHIPK2はOtx2遺伝子,Xanf2遺伝子,Rx2a遺伝子などの内在性の前方化マーカー遺伝子の発現を抑制し胚を後方化するのに対し,TCF3は前方化マーカー遺伝子の発現に必要であり胚を前方化することが明らかになった.このように,Vent2遺伝子の発現調節および前後軸の形成においてTCF3はWnt8およびHIPK2とは逆の機能をもっていた.これらのことから,Wnt8およびHIPK2がリン酸化を介してTCF3の転写抑制能を阻害するという仮説をたてた.
3.TCF3のリン酸化におけるβカテニンの役割
βカテニンは標準的Wntシグナル経路において中心的な役割をはたし,原腸胚における背腹/前後のパターン形成にも密接にかかわっている9,10).そこで,βカテニンのTCF3のリン酸化への関与を調べたところ,両生類胚ではβカテニン単独ではTCF3のリン酸化をひき起こすことはできないものの,Wnt刺激によるリン酸化に必須であることがわかった.さらに,培養細胞においてβカテニンはTCF3とHIPK2との結合を強め,HIPK2の存在下にかぎってTCF3のリン酸化を促進することが観察された.これらのことは,βカテニンがこれまで考えられてきたTCFに対する転写共役因子としての役割以外にも,TCF3とHIPK2とのあいだの足場タンパク質としてリン酸化に深くかかわっていることを示唆していた.
4.非リン酸化型TCF3はより強く標的遺伝子のプロモーターに結合して転写を抑制する
Wnt8およびHIPK2がリン酸化を介してTCF3の転写抑制能を阻害するという仮説を検証しこのリン酸化の生理的な意義を明らかにするため,まず,Wnt刺激によるTCF3の移動度の変化を指標としてリン酸化の標的となる複数の部位,Ser147,Ser149,Thr170,Ser181,Ser184,Ser190を特定した.さらに,TCF3に特有なSer190に対するリン酸化特異的な抗体を用いWnt刺激およびHIPK2によるTCF3のリン酸化を哺乳類培養細胞でも確認できたことから,このWnt-HIPK2-TCF3経路が脊椎動物において広く保存されていることが示唆された.これら特定されたリン酸化部位のすべてをAla残基に置換した非リン酸化型TCF3は野生型TCF3に比べより強く胚を前方化し,また,両生類胚および哺乳類培養細胞の両方においてWnt刺激によるTCF依存性レポーター遺伝子の活性化をより強力に抑制した.さらに,非リン酸化型TCF3は標的遺伝子のプロモーターにより強く結合し,Wnt刺激やHIPK2により生じたリン酸化型TCF3ではプロモーターへの結合能の弱まっていることもクロマチン免疫沈降法により明らかになった.これらのことから,Wnt8/HIPK2シグナルはTCF3をリン酸化することで標的遺伝子への結合を弱め,TCF3による標的遺伝子の転写の抑制を解除することが考えられた.
おわりに
両生類胚の過剰発現をはじめとする古典的な実験により,胞胚期には背側中胚葉(オーガナイザー)遺伝子を活性化し,その直後の原腸胚期には逆にVent2遺伝子などの腹側中胚葉遺伝子を活性化するといったように,標準的Wntシグナル経路が体軸のパターン形成において時期特異的に異なる役割を担っていることがわかってから20年近くがたった11).しかしながら,これら2つの発生段階においてWntシグナル経路の標的遺伝子が同じ分子機構により活性化されているのかどうかはずっと不明のままであった.この研究により,HIPK2は原腸胚期腹側においてWnt刺激によりTCF3を直接にリン酸化して標的遺伝子への結合を弱め,TCF3の転写抑制を解除することで腹側/後方化に重要な標的遺伝子の転写促進にはたらくことがわかった(図2).一方で,標準的Wntシグナル経路によりオーガナイザー遺伝子が活性化される背側中胚葉においてはTCF3のリン酸化は観察されないことから,標準的Wntシグナル経路による標的遺伝子の活性化は背側と腹側とでは異なる分子機構により制御されていることが強く示唆された.初期胚の背腹のWntシグナル経路の標的遺伝子の活性化の差を特徴づける重要なタンパク質としてHIPK2が注目されるが,Wntリガンドから核に存在するキナーゼHIPK2にいたるシグナル経路の構成タンパク質やWntシグナルによるHIPK2の活性化の機構は依然として不明であり,これらの解明は今後の重要な課題である.
文 献
- Clevers, H.: Wnt/β-catenin signaling in development and disease. Cell, 127, 469-480 (2006)[PubMed]
- Arce, L., Yokoyama, N. N. & Waterman, M. L.: Diversity of LEF/TCF action in development and disease. Oncogene, 25, 7492-7504 (2006)[PubMed]
- Galceran, J., Farinas, I., Depew, M. J. et al.: Wnt3a-/--like phenotype and limb deficiency in Lef-/-TCF1-/- mice. Genes Dev., 13, 709-717 (1999)[PubMed]
- Kim, C. H., Oda, T., Itoh, M. et al.: Repressor activity of Headless/Tcf3 is essential for vertebrate head formation. Nature, 407, 913-916 (2000)[PubMed]
- Houston, D. W., Kofron, M., Resnik, E. et al.: Repression of organizer genes in dorsal and ventral Xenopus cells mediated by maternal XTcf3. Development, 129, 4015-4025 (2002)[PubMed]
- Cole, M. F., Johnstone, S. E., Newman, J. J. et al.: Tcf3 is an integral component of the core regulatory circuitry of embryonic stem cells. Genes Dev., 22, 746-755 (2008)[PubMed]
- Erter, C. E., Wilm, T. P., Basler, N. et al.: Wnt8 is required in lateral mesendodermal precursor for neural posteriorization in vivo. Development, 128, 3571-3583 (2001)[PubMed]
- Lekven, A. C., Thorpe, C. J., Waxman, J. S. et al.: Zebrafish wnt8 encodes two Wnt8 proteins on a bicistronic transcript and is required for mesoderm and neurectoderm patterning. Dev. Cell, 1, 103-114 (2001)[PubMed]
- Heasman, J., Kofron, M. & Wylie, C.: β-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol., 222, 124-134 (2000)[PubMed]
- Kiecker, C. & Nierhs, C.: A morphogen gradient of Wnt/β-catenin signaling regulates anteroposterior neural patterning in Xenopus. Development, 128, 4189-4201 (2001)[PubMed]
- Harland, R. & Gerhart, J.: Formation and function of Spemann’s organizer. Annu. Rev. Cell Dev. Biol., 13, 611-667 (1997)[PubMed]
著者プロフィール
略歴:2001年 東京大学大学院理学系研究科博士課程 修了,同年 米国Harvard Medical Schoolポストドクトラルフェロー,2004年 米国Mount Sinai School of Medicineリサーチインストラクターを経て,2010年より九州大学生体防御医学研究所 助教.
研究テーマ:発生などの生命現象に重要なシグナル経路の解明.
抱負:サイエンスのつぎの進歩に貢献するような研究を発表していきたい.
© 2010 日笠 弘基 Licensed under CC 表示 2.1 日本