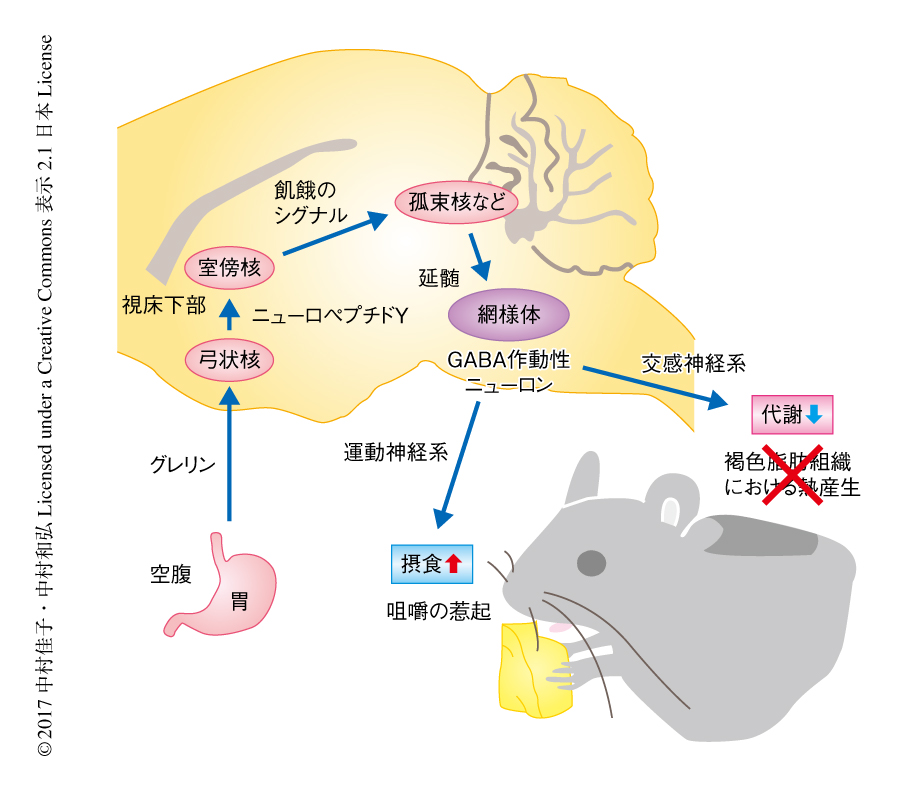
延髄の網様体のニューロンはニューロペプチドYによる熱産生の抑制および摂食の促進を指令する
中村佳子・中村和弘
(名古屋大学大学院医学系研究科 統合生理学講座)
email:中村和弘
DOI: 10.7875/first.author.2017.011
Medullary reticular neurons mediate neuropeptide Y-induced metabolic inhibition and mastication.
Yoshiko Nakamura, Yuchio Yanagawa, Shaun F. Morrison, Kazuhiro Nakamura
Cell Metabolism, 25, 322-334 (2017)
空腹のときに視床下部から放出されるニューロペプチドYは代謝を抑制するとともに摂食を促進する.これは飢餓を生き延びるための基本的な生理反応であるが,その中枢における神経機構については不明な点が多い.筆者らは,ニューロペプチドYに由来する飢餓のシグナルが延髄の網様体のGABA作動性ニューロンを活性化することを見い出した.このGABA作動性ニューロンを選択的に刺激すると褐色脂肪組織における熱産生が抑制された.一方,網様体のニューロンを不活性化するとニューロペプチドYは褐色脂肪組織における熱産生を抑制しなくなった.網様体のGABA作動性ニューロンは褐色脂肪組織を支配する交感神経系の前運動ニューロンに軸索を投射するとともに,その分枝を咀嚼の運動ニューロンにも投射していた.網様体のニューロンを刺激すると,熱産生が抑制されるとともに,咀嚼が惹起され摂食量が増加した.これらの結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルにより延髄の網様体のGABA作動性ニューロンが活性化され,エネルギーの節約および摂食の促進が同時に指令されることが示された.
恒温動物である哺乳類は生命の活動のためエネルギーを消費するが,なかでも体温を維持するための熱産生は多くのエネルギーを消費する.生体はその消費エネルギーをおぎなうために食物を摂取しエネルギーの収支バランスを維持する.とくに,空腹になると食物を得ることができる状態であれば積極的に摂食行動を起こすが,食物を得られない状態が長くつづくと熱産生を抑制してエネルギーの消費を節減し,体温を下げて飢餓を生き延びようとする.このエネルギーの収支バランスを維持するための制御系は脳にあるが,その神経機構には不明な点が多い.
これまでの研究により,空腹の際には胃からグレリンが分泌され,これが視床下部の弓状核にあるニューロペプチドYを含有するニューロンを刺激しその放出を促進することが知られている1).弓状核のニューロペプチドYを含有するニューロンは脳のいくつかの領域に投射するが,そのひとつに視床下部の室傍核がある.室傍核に微量のニューロペプチドYを注入すると摂食が促進されるとともに2),熱を産生する器官である褐色脂肪組織において代謝性の熱産生が抑制され,エネルギーの消費が節減される3).しかし,エネルギーの節約(熱産生の抑制)とエネルギーの摂取(摂食の促進)という2つの飢餓反応が,中枢におけるどのような神経機構により駆動されるのかは知られていなかった.とくに,熱産生は交感神経系により制御され摂食は運動神経系をつうじて駆動されるが,ふだんは独立して制御されるこれら2つの神経系が,飢餓を生き延びなければならないときにはどのように統合して制御されるのかは謎であった.この研究においては,視床下部から放出されるニューロペプチドYの作用により生じる飢餓反応に着目し,その反応を駆動するニューロンをラットおよびマウスを用いて探索した.
これまでの筆者らによる研究により,寒冷や発熱の刺激により生じ交感神経系により制御される褐色脂肪組織における熱産生は,延髄の縫線核に分布し小胞型グルタミン酸輸送体のひとつVGLUT3を発現する交感神経系の前運動ニューロンの活性化をつうじて駆動されることがわかっている4,5).そこで,視床下部に由来する飢餓のシグナルがこの前運動ニューロンを抑制することにより熱産生を抑制するのではないかと考え,このニューロンを直接に抑制するニューロンを探索した.抑制性の神経伝達物質であるGABAを放出するGABA作動性ニューロンに特異的にGFPを発現するマウスの延髄の縫線核に,逆行性の神経トレーサーであるコレラ毒素Bサブユニットを注入し標識されるニューロンを探索した.その結果,延髄の網様体のGABA作動性ニューロンが多く標識されたことから,これらのニューロンが延髄の縫線核へ投射することがわかった.そこで,ラットの網様体に順行性の神経トレーサーであるインゲンマメ白血球凝集素を注入したところ,GABA作動性ニューロンのマーカーであるVGATを含有し網様体に由来する軸索の終末が,延髄の縫線核のVGLUT3陽性の前運動ニューロンにシナプス様の構造を形成していた.これらの結果より,延髄の網様体のGABA作動性ニューロンが縫線核の交感神経系の前運動ニューロンを直接に抑制することにより,褐色脂肪組織における熱産生を抑制する可能性が示唆された.
麻酔したラットの延髄の網様体にGABAA受容体の拮抗薬であるビククリンを微量注入し局所のニューロンをin vivoにおいて刺激したところ,発熱刺激により惹起された褐色脂肪組織における熱産生が強く抑制された.この熱産生の抑制作用が網様体のGABA作動性ニューロンのはたらきによるものかどうか検討するため,DREADD(designer receptors exclusively activated by designer drug,デザイナー薬剤により活性化するデザイナー受容体)法を用いて6),網様体のGABA作動性ニューロンを選択的に刺激した.具体的には,網様体のGABA作動性ニューロンに特異的にhM3DqとよばれるGq共役型のデザイナー受容体を発現させ,その選択的なアゴニストであるクロザピンN-オキシドを網様体に微量注入してhM3Dqを発現したニューロンを刺激したところ,寒冷刺激により惹起された褐色脂肪組織における熱産生が消失した.これらの結果より,延髄の網様体のGABA作動性ニューロンの活性化が褐色脂肪組織における熱産生の抑制につながることが示された.
延髄の縫線核に投射する延髄の網様体のニューロンが視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルにより活性化されるかどうか,in vivoにおける単一のニューロンの活動記録により検討した.その結果,ラットの視床下部にニューロペプチドYを作用させると,褐色脂肪組織における熱産生が抑制されるとともに,延髄の縫線核に投射する網様体のニューロンにおいて発火の頻度が上昇した.ニューロペプチドYにより活性化された網様体のニューロンはすべてGABA作動性ニューロンのマーカーであるGad1 mRNAを発現していた.これらの結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルは延髄の網様体のGABA作動性ニューロンを活性化し,それにより,延髄の縫線核からの熱産生の出力を抑制する可能性が考えられた.
ニューロペプチドYによる褐色脂肪組織における熱産生の抑制が延髄の網様体のニューロンの活性化を介して生じる可能性について調べた.ニューロペプチドYを視床下部の室傍核に注入したところ,寒冷刺激による褐色脂肪組織における熱産生は抑制されたが,あらかじめ両側の延髄の網様体にGABAA受容体の作動薬で神経活動の抑制剤であるムシモールを注入しておくと,ニューロペプチドYによる褐色脂肪組織における熱産生の抑制は起こらなくなった.この結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルが褐色脂肪組織における熱産生を抑制するためには,延髄の網様体のニューロンの活性化が必要であることがわかった.
延髄の網様体のGABA作動性ニューロンは咀嚼運動のリズムの発現に関与することが知られていたため7,8),咀嚼および摂食を促進する機能をもつ可能性について調べた.網様体のGABA作動性ニューロンの投射を調べるため,GABA作動性ニューロンにおいて選択的に蛍光タンパク質Venusを発現するトランスジェニックラットを用いて,咀嚼の運動ニューロンが存在する三叉神経運動核,および,熱産生を制御する交感神経系の前運動ニューロンが存在する延髄の縫線核にそれぞれ異なる2種類の逆行性の神経トレーサーを注入し網様体を観察したところ,網様体のGABA作動性ニューロンは三叉神経運動核および延髄の縫線核の両方に投射することがわかった.
麻酔したラットの網様体にビククリンを微量注入してニューロンを刺激すると,褐色脂肪組織における熱産生が抑制されるとともに,咬筋のリズム運動をともなう咀嚼が惹起された.また,唾液の顕著な分泌を示す個体も観察された.さらに,覚醒しているラットの網様体にビククリンを微量注入してニューロンを刺激すると,摂食量および咀嚼運動が増加した.これらの結果より,延髄の網様体のGABA作動性ニューロンが熱産生および摂食を同時に制御する可能性が示された.
ここで疑問となったのは,視床下部からの飢餓のシグナルがどのような神経経路をつうじて延髄の網様体へ伝達されるかという点であった.視床下部の室傍核から延髄の網様体への直接の投射はほとんどみられないため,どこかの中継領域を経由することが考えられた.そこで,視床下部の室傍核から多数の投射をうけ,また,内臓の消化器官からも求心性の神経入力をうけることにより摂食の制御に関与する孤束核9),および,視床下部の室傍核から投射をうけメラノコルチン系による摂食の制御に関与することが示唆されている外側腕傍核10) を中継領域の候補とした.GABA作動性ニューロンにおいて選択的に蛍光タンパク質Venusを発現するトランスジェニックラットに対し,孤束核あるいは外側腕傍核に順行性の神経トレーサーを注入し,延髄の縫線核に逆行性の神経トレーサーを注入したところ,延髄の縫線核に投射する網様体のGABA作動性ニューロンに孤束核および外側腕傍核からの投射のあることが示された.外側腕傍核からよりも孤束核からのほうが投射が多く観察された.これらの結果より,視床下部の室傍核から出力される飢餓のシグナルは孤束核あるいは外側腕傍核を経由して延髄の網様体のGABA作動性ニューロンを活性化する可能性が示唆された.
以上の結果から,飢餓反応の中枢における神経機構について,以下のようなモデルが提示された(図1).空腹や飢餓により放出されるニューロペプチドYが視床下部の室傍核に作用することにより生じる飢餓のシグナルは,孤束核あるいは外側腕傍核を介して延髄の網様体へと伝達されGABA作動性ニューロンを活性化する.活性化された網様体のGABA作動性ニューロンは,延髄の縫線核の交感神経系の前運動ニューロンを抑制することにより褐色脂肪における熱産生を抑制しエネルギーの消費量は低下し,また同時に,咀嚼の運動ニューロンを制御することにより咀嚼を惹起し摂食を促進する.網様体には咀嚼運動のリズムを形成する神経回路があると考えられており7),今回,同定された抑制性のGABA作動性ニューロンが興奮性のグルタミン酸作動性ニューロンとともに交互に興奮することにより,咀嚼の運動ニューロンへ一定のリズム信号を供給する可能性が考えられる.食物がないときでも飢餓状態では咀嚼のリズム信号が運動ニューロンへと送られるが,脳の上位の領域からの抑制により咀嚼は起こらないと考えられる.しかし,食物の存在を知覚したときには,上位から咀嚼の運動ニューロンへの抑制が解除され,その際に,飢餓のシグナルの刺激をうけて網様体から供給されるリズム信号がすばやい咀嚼の開始を可能にするのかもしれない.
交感神経系と運動神経系はふだんは独立して制御されるが,この研究において,飢餓の際には延髄の網様体のニューロンがこの2つの神経系を統合的に制御することによりエネルギーの消費を節減すると同時にエネルギーの摂取を促進することが明らかにされた.この神経機構は飢餓を生き延びるために脳にそなわった基本的なしくみであると考えられる.この研究においては,ニューロペプチドYによる飢餓反応の神経機構に焦点をあてたが,メラノコルチン系を介した摂食および代謝の制御にも網様体のニューロンが関与するかどうかは不明であり,今後の検討課題である.
略歴:2003年 京都大学大学院薬学研究科博士後期課程 単位認定後退学,米国Oregon Health and Science大学 研究員,2009年 京都大学生命科学系キャリアパス形成ユニット 博士研究員を経て,2015年より名古屋大学大学院医学系研究科 助教.
研究テーマ:発熱および摂食・代謝の制御の神経機構.
抱負:Scienceを楽しむ.
中村 和弘(Kazuhiro Nakamura)
名古屋大学大学院医学系研究科 教授,科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://www.med.nagoya-u.ac.jp/physiol2/
© 2017 中村佳子・中村和弘 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 統合生理学講座)
email:中村和弘
DOI: 10.7875/first.author.2017.011
Medullary reticular neurons mediate neuropeptide Y-induced metabolic inhibition and mastication.
Yoshiko Nakamura, Yuchio Yanagawa, Shaun F. Morrison, Kazuhiro Nakamura
Cell Metabolism, 25, 322-334 (2017)
要 約
空腹のときに視床下部から放出されるニューロペプチドYは代謝を抑制するとともに摂食を促進する.これは飢餓を生き延びるための基本的な生理反応であるが,その中枢における神経機構については不明な点が多い.筆者らは,ニューロペプチドYに由来する飢餓のシグナルが延髄の網様体のGABA作動性ニューロンを活性化することを見い出した.このGABA作動性ニューロンを選択的に刺激すると褐色脂肪組織における熱産生が抑制された.一方,網様体のニューロンを不活性化するとニューロペプチドYは褐色脂肪組織における熱産生を抑制しなくなった.網様体のGABA作動性ニューロンは褐色脂肪組織を支配する交感神経系の前運動ニューロンに軸索を投射するとともに,その分枝を咀嚼の運動ニューロンにも投射していた.網様体のニューロンを刺激すると,熱産生が抑制されるとともに,咀嚼が惹起され摂食量が増加した.これらの結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルにより延髄の網様体のGABA作動性ニューロンが活性化され,エネルギーの節約および摂食の促進が同時に指令されることが示された.
はじめに
恒温動物である哺乳類は生命の活動のためエネルギーを消費するが,なかでも体温を維持するための熱産生は多くのエネルギーを消費する.生体はその消費エネルギーをおぎなうために食物を摂取しエネルギーの収支バランスを維持する.とくに,空腹になると食物を得ることができる状態であれば積極的に摂食行動を起こすが,食物を得られない状態が長くつづくと熱産生を抑制してエネルギーの消費を節減し,体温を下げて飢餓を生き延びようとする.このエネルギーの収支バランスを維持するための制御系は脳にあるが,その神経機構には不明な点が多い.
これまでの研究により,空腹の際には胃からグレリンが分泌され,これが視床下部の弓状核にあるニューロペプチドYを含有するニューロンを刺激しその放出を促進することが知られている1).弓状核のニューロペプチドYを含有するニューロンは脳のいくつかの領域に投射するが,そのひとつに視床下部の室傍核がある.室傍核に微量のニューロペプチドYを注入すると摂食が促進されるとともに2),熱を産生する器官である褐色脂肪組織において代謝性の熱産生が抑制され,エネルギーの消費が節減される3).しかし,エネルギーの節約(熱産生の抑制)とエネルギーの摂取(摂食の促進)という2つの飢餓反応が,中枢におけるどのような神経機構により駆動されるのかは知られていなかった.とくに,熱産生は交感神経系により制御され摂食は運動神経系をつうじて駆動されるが,ふだんは独立して制御されるこれら2つの神経系が,飢餓を生き延びなければならないときにはどのように統合して制御されるのかは謎であった.この研究においては,視床下部から放出されるニューロペプチドYの作用により生じる飢餓反応に着目し,その反応を駆動するニューロンをラットおよびマウスを用いて探索した.
1.延髄の網様体のGABA作動性ニューロンは褐色脂肪組織の交感神経系の前運動ニューロンを直接に抑制する
これまでの筆者らによる研究により,寒冷や発熱の刺激により生じ交感神経系により制御される褐色脂肪組織における熱産生は,延髄の縫線核に分布し小胞型グルタミン酸輸送体のひとつVGLUT3を発現する交感神経系の前運動ニューロンの活性化をつうじて駆動されることがわかっている4,5).そこで,視床下部に由来する飢餓のシグナルがこの前運動ニューロンを抑制することにより熱産生を抑制するのではないかと考え,このニューロンを直接に抑制するニューロンを探索した.抑制性の神経伝達物質であるGABAを放出するGABA作動性ニューロンに特異的にGFPを発現するマウスの延髄の縫線核に,逆行性の神経トレーサーであるコレラ毒素Bサブユニットを注入し標識されるニューロンを探索した.その結果,延髄の網様体のGABA作動性ニューロンが多く標識されたことから,これらのニューロンが延髄の縫線核へ投射することがわかった.そこで,ラットの網様体に順行性の神経トレーサーであるインゲンマメ白血球凝集素を注入したところ,GABA作動性ニューロンのマーカーであるVGATを含有し網様体に由来する軸索の終末が,延髄の縫線核のVGLUT3陽性の前運動ニューロンにシナプス様の構造を形成していた.これらの結果より,延髄の網様体のGABA作動性ニューロンが縫線核の交感神経系の前運動ニューロンを直接に抑制することにより,褐色脂肪組織における熱産生を抑制する可能性が示唆された.
2.延髄の網様体のGABA作動性ニューロンを刺激すると褐色脂肪組織における熱産生が抑制される
麻酔したラットの延髄の網様体にGABAA受容体の拮抗薬であるビククリンを微量注入し局所のニューロンをin vivoにおいて刺激したところ,発熱刺激により惹起された褐色脂肪組織における熱産生が強く抑制された.この熱産生の抑制作用が網様体のGABA作動性ニューロンのはたらきによるものかどうか検討するため,DREADD(designer receptors exclusively activated by designer drug,デザイナー薬剤により活性化するデザイナー受容体)法を用いて6),網様体のGABA作動性ニューロンを選択的に刺激した.具体的には,網様体のGABA作動性ニューロンに特異的にhM3DqとよばれるGq共役型のデザイナー受容体を発現させ,その選択的なアゴニストであるクロザピンN-オキシドを網様体に微量注入してhM3Dqを発現したニューロンを刺激したところ,寒冷刺激により惹起された褐色脂肪組織における熱産生が消失した.これらの結果より,延髄の網様体のGABA作動性ニューロンの活性化が褐色脂肪組織における熱産生の抑制につながることが示された.
3.ニューロペプチドYに由来する飢餓のシグナルは延髄の網様体のGABA作動性ニューロンの活性化を介して褐色脂肪組織における熱産生を抑制する
延髄の縫線核に投射する延髄の網様体のニューロンが視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルにより活性化されるかどうか,in vivoにおける単一のニューロンの活動記録により検討した.その結果,ラットの視床下部にニューロペプチドYを作用させると,褐色脂肪組織における熱産生が抑制されるとともに,延髄の縫線核に投射する網様体のニューロンにおいて発火の頻度が上昇した.ニューロペプチドYにより活性化された網様体のニューロンはすべてGABA作動性ニューロンのマーカーであるGad1 mRNAを発現していた.これらの結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルは延髄の網様体のGABA作動性ニューロンを活性化し,それにより,延髄の縫線核からの熱産生の出力を抑制する可能性が考えられた.
ニューロペプチドYによる褐色脂肪組織における熱産生の抑制が延髄の網様体のニューロンの活性化を介して生じる可能性について調べた.ニューロペプチドYを視床下部の室傍核に注入したところ,寒冷刺激による褐色脂肪組織における熱産生は抑制されたが,あらかじめ両側の延髄の網様体にGABAA受容体の作動薬で神経活動の抑制剤であるムシモールを注入しておくと,ニューロペプチドYによる褐色脂肪組織における熱産生の抑制は起こらなくなった.この結果より,視床下部から放出されるニューロペプチドYに由来する飢餓のシグナルが褐色脂肪組織における熱産生を抑制するためには,延髄の網様体のニューロンの活性化が必要であることがわかった.
4.延髄の網様体のGABA作動性ニューロンは摂食の促進にも機能する
延髄の網様体のGABA作動性ニューロンは咀嚼運動のリズムの発現に関与することが知られていたため7,8),咀嚼および摂食を促進する機能をもつ可能性について調べた.網様体のGABA作動性ニューロンの投射を調べるため,GABA作動性ニューロンにおいて選択的に蛍光タンパク質Venusを発現するトランスジェニックラットを用いて,咀嚼の運動ニューロンが存在する三叉神経運動核,および,熱産生を制御する交感神経系の前運動ニューロンが存在する延髄の縫線核にそれぞれ異なる2種類の逆行性の神経トレーサーを注入し網様体を観察したところ,網様体のGABA作動性ニューロンは三叉神経運動核および延髄の縫線核の両方に投射することがわかった.
麻酔したラットの網様体にビククリンを微量注入してニューロンを刺激すると,褐色脂肪組織における熱産生が抑制されるとともに,咬筋のリズム運動をともなう咀嚼が惹起された.また,唾液の顕著な分泌を示す個体も観察された.さらに,覚醒しているラットの網様体にビククリンを微量注入してニューロンを刺激すると,摂食量および咀嚼運動が増加した.これらの結果より,延髄の網様体のGABA作動性ニューロンが熱産生および摂食を同時に制御する可能性が示された.
5.視床下部から延髄の網様体へと飢餓のシグナルが伝達される経路
ここで疑問となったのは,視床下部からの飢餓のシグナルがどのような神経経路をつうじて延髄の網様体へ伝達されるかという点であった.視床下部の室傍核から延髄の網様体への直接の投射はほとんどみられないため,どこかの中継領域を経由することが考えられた.そこで,視床下部の室傍核から多数の投射をうけ,また,内臓の消化器官からも求心性の神経入力をうけることにより摂食の制御に関与する孤束核9),および,視床下部の室傍核から投射をうけメラノコルチン系による摂食の制御に関与することが示唆されている外側腕傍核10) を中継領域の候補とした.GABA作動性ニューロンにおいて選択的に蛍光タンパク質Venusを発現するトランスジェニックラットに対し,孤束核あるいは外側腕傍核に順行性の神経トレーサーを注入し,延髄の縫線核に逆行性の神経トレーサーを注入したところ,延髄の縫線核に投射する網様体のGABA作動性ニューロンに孤束核および外側腕傍核からの投射のあることが示された.外側腕傍核からよりも孤束核からのほうが投射が多く観察された.これらの結果より,視床下部の室傍核から出力される飢餓のシグナルは孤束核あるいは外側腕傍核を経由して延髄の網様体のGABA作動性ニューロンを活性化する可能性が示唆された.
6.飢餓反応の中枢における神経機構
以上の結果から,飢餓反応の中枢における神経機構について,以下のようなモデルが提示された(図1).空腹や飢餓により放出されるニューロペプチドYが視床下部の室傍核に作用することにより生じる飢餓のシグナルは,孤束核あるいは外側腕傍核を介して延髄の網様体へと伝達されGABA作動性ニューロンを活性化する.活性化された網様体のGABA作動性ニューロンは,延髄の縫線核の交感神経系の前運動ニューロンを抑制することにより褐色脂肪における熱産生を抑制しエネルギーの消費量は低下し,また同時に,咀嚼の運動ニューロンを制御することにより咀嚼を惹起し摂食を促進する.網様体には咀嚼運動のリズムを形成する神経回路があると考えられており7),今回,同定された抑制性のGABA作動性ニューロンが興奮性のグルタミン酸作動性ニューロンとともに交互に興奮することにより,咀嚼の運動ニューロンへ一定のリズム信号を供給する可能性が考えられる.食物がないときでも飢餓状態では咀嚼のリズム信号が運動ニューロンへと送られるが,脳の上位の領域からの抑制により咀嚼は起こらないと考えられる.しかし,食物の存在を知覚したときには,上位から咀嚼の運動ニューロンへの抑制が解除され,その際に,飢餓のシグナルの刺激をうけて網様体から供給されるリズム信号がすばやい咀嚼の開始を可能にするのかもしれない.
おわりに
交感神経系と運動神経系はふだんは独立して制御されるが,この研究において,飢餓の際には延髄の網様体のニューロンがこの2つの神経系を統合的に制御することによりエネルギーの消費を節減すると同時にエネルギーの摂取を促進することが明らかにされた.この神経機構は飢餓を生き延びるために脳にそなわった基本的なしくみであると考えられる.この研究においては,ニューロペプチドYによる飢餓反応の神経機構に焦点をあてたが,メラノコルチン系を介した摂食および代謝の制御にも網様体のニューロンが関与するかどうかは不明であり,今後の検討課題である.
文 献
- Kohno, D., Gao, H. Z., Muroya, S. et al.: Ghrelin directly interacts with neuropeptide-Y-containing neurons in the rat arcuate nucleus: Ca2+ signaling via protein kinase A and N-type channel-dependent mechanisms and cross-talk with leptin and orexin. Diabetes, 52, 948-956 (2003)[PubMed]
- Kalra, S. P., Dube, M. G., Sahu, A. et al.: Neuropeptide Y secretion increases in the paraventricular nucleus in association with increased appetite for food. Proc. Natl. Acad. Sci. USA, 88, 10931-10935 (1991)[PubMed]
- Egawa, M., Yoshimatsu, H. & Bray, G. A.: Neuropeptide Y suppresses sympathetic activity to interscapular brown adipose tissue in rats. Am. J. Physiol., 260, R328-R334 (1991)[PubMed]
- Nakamura, K., Matsumura, K., Hubschle, T. et al.: Identification of sympathetic premotor neurons in medullary raphe regions mediating fever and other thermoregulatory functions. J. Neurosci., 24, 5370-5380 (2004)[PubMed]
- Nakamura, K.: Central circuitries for body temperature regulation and fever. Am. J. Physiol. Regul. Integr. Comp. Physiol., 301, R1207-R1228 (2011)[PubMed]
- Roth, B. L.: DREADDs for neuroscientists. Neuron, 89, 683-694 (2016)[PubMed]
- Nakamura, Y. & Katakura, N.: Generation of masticatory rhythm in the brainstem. Neurosci. Res., 23, 1-19 (1995)[PubMed]
- Travers, J. B., Herman, K. & Travers, S. P.: Suppression of third ventricular NPY-elicited feeding following medullary reticular formation infusions of muscimol. Behav. Neurosci., 124, 225-233 (2010)[PubMed]
- Geerling, J. C., Shin, J. W., Chimenti, P. C. et al.: Paraventricular hypothalamic nucleus: axonal projections to the brainstem. J. Comp. Neurol., 518, 1460-1499 (2010)[PubMed]
- Garfield, A. S., Li, C., Madara, J. C. et al.: A neural basis for melanocortin-4 receptor-regulated appetite. Nat. Neurosci., 18, 863-871 (2015)[PubMed]
著者プロフィール
略歴:2003年 京都大学大学院薬学研究科博士後期課程 単位認定後退学,米国Oregon Health and Science大学 研究員,2009年 京都大学生命科学系キャリアパス形成ユニット 博士研究員を経て,2015年より名古屋大学大学院医学系研究科 助教.
研究テーマ:発熱および摂食・代謝の制御の神経機構.
抱負:Scienceを楽しむ.
中村 和弘(Kazuhiro Nakamura)
名古屋大学大学院医学系研究科 教授,科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://www.med.nagoya-u.ac.jp/physiol2/
© 2017 中村佳子・中村和弘 Licensed under CC 表示 2.1 日本