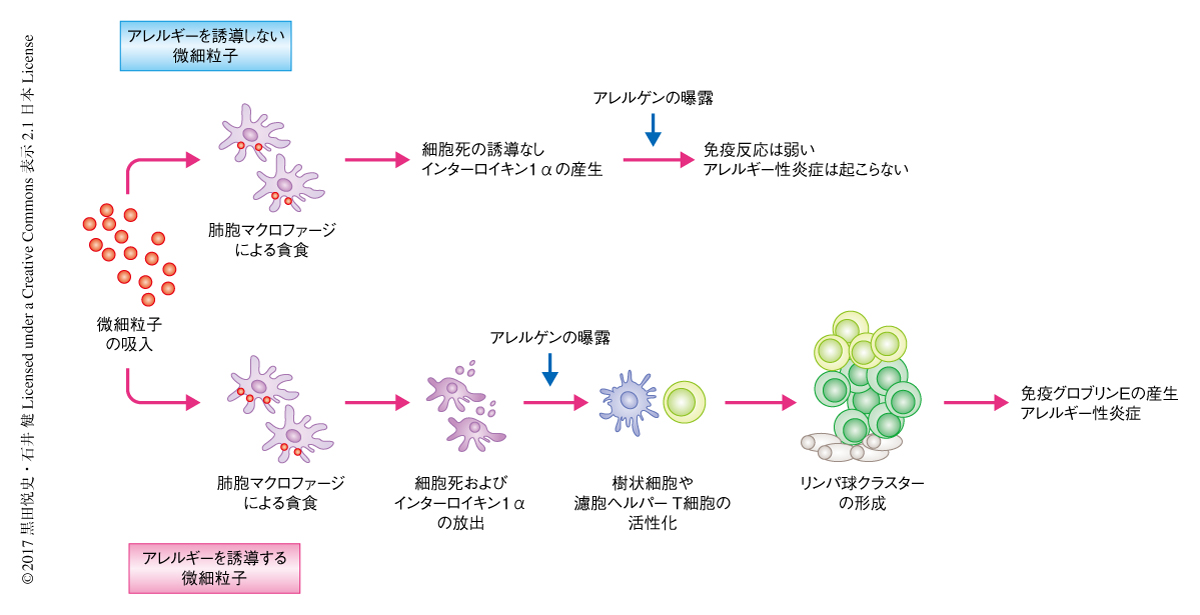
微細粒子の吸入は肺胞マクロファージの細胞死およびインターロイキン1αの放出をひき起こし肺において誘導性気管支関連リンパ組織の形成を促進する
黒田悦史・石井 健
(大阪大学免疫学フロンティア研究センター ワクチン学)
email:黒田悦史,石井 健
DOI: 10.7875/first.author.2017.007
Inhaled fine particles induce alveolar macrophage death and interleukin-1α release to promote inducible bronchus-associated lymphoid tissue formation.
Etsushi Kuroda, Koji Ozasa, Burcu Temizoz, Keiichi Ohata, Christine X. Koo, Tomohiro Kanuma, Takato Kusakabe, Shingo Kobari, Masanori Horie, Yasuo Morimoto, Saeko Nakajima, Kenji Kabashima, Steven F. Ziegler, Yoichiro Iwakura, Wataru Ise, Tomohiro Kurosaki, Takahiro Nagatake, Jun Kunisawa, Naoki Takemura, Satoshi Uematsu, Masayuki Hayashi, Taiki Aoshi, Kouji Kobiyama, Cevayir Coban, Ken J. Ishii
Immunity, 45, 1299-1310 (2016)
アレルギー性疾患の発症および増悪にはさまざまな因子が関与するが,そのひとつとして,大気中に浮遊するPM2.5や黄砂など微細粒子の関与が示唆されている.このような微細粒子は免疫反応を増強するアジュバントとしてはたらくと考えられており,とくに,免疫グロブリンEの産生をはじめとするアレルギー性炎症を誘導することが報告されている.しかしながら,微細粒子によるアレルギー性炎症の誘導あるいは増悪の分子機構は詳細には明らかにされていない.この研究においては,微細粒子の貪食により肺胞マクロファージに細胞死が誘導されインターロイキン1αが放出されること,さらに,このインターロイキン1αの放出は肺において2週間も持続することが見い出された.また,微細粒子のアジュバントとしての効果もインターロイキン1αの放出と同様に持続し,微細粒子の投与の数日のちに抗原を曝露しても抗原に特異的な免疫グロブリンEが産生された.さらに,このようなマウスの肺には誘導性気管支関連リンパ組織とよばれる異所性リンパ節が形成され,このことが免疫グロブリンEの産生およびアレルギー性炎症の誘導に関与すると考えられた.
先進国や都市部を中心にアレルギー性疾患は増加の一途をたどっており,大きな社会問題になっている.アレルギー疾患の発症および増悪にはさまざまな因子の関与が報告されているが,大気中に浮遊する微細粒子も増悪因子のひとつと考えられている.とくに,黄砂,ディーゼル粒子,PM2.5などの吸入性の微細粒子は免疫反応を増強するアジュバントとしてはたらきアレルギー性炎症を誘導および増悪する作用のあること,さらに,疫学的な解析により大気中の粒子状の汚染物質の増加と喘息患者の入院とのあいだに相関関係のあることが報告されている.
免疫学の分野においては,アルミニウム塩や結晶シリカなど多くの微細粒子が免疫グロブリンEの産生や好酸球性炎症を特徴としたTh2型の免疫反応を誘導し,アレルギー性炎症を惹起することが報告されている1).このようなアジュバントはTh2アジュバントとよばれ,多くの微細粒子がTh2アジュバント活性をもつことが報告されているが,その免疫学的な機構について詳細は明らかにされていない.
アジュバント活性をもつ物質は自然免疫を活性化することにより獲得免疫を誘導すると考えられており,アレルギー性炎症に関与するTh2型の免疫反応の誘導にも自然免疫の活性化が必須であると考えられている2).一般に,宿主のもつパターン認識受容体が病原体に由来する抗原を認識することにより自然免疫は活性化されると考えられているが,損傷をうけた細胞や死細胞に由来する因子である損傷関連分子パターン(damage-associated molecular pattern:DAMP)も同様に,パターン認識受容体やサイトカイン受容体を介して自然免疫を活性化することが知られている.さきに述べたように,微細粒子の多くがTh2アジュバント活性をもつことから,自然免疫を活性化する微細粒子に共通したなんらかの分子機構が存在すると考えられていた.最近の報告から,アルミニウム塩などの微細粒子はそれを貪食した細胞の細胞死を誘導することが示されており,微細粒子による損傷関連分子パターンを介した免疫の活性化機構の関与が示唆されている3,4).この研究においては,微細粒子によるアレルギー性炎症の誘導の機構に関して細胞死や損傷関連分子パターンの観点から解析し,微細粒子による細胞死の誘導が抗原に特異的な免疫グロブリンEの産生に重要であることを見い出した.
PM2.5やナノサイズの微細粒子は吸入により気道や肺の奥に到達し炎症反応をひき起こすことが明らかにされており,そのような微細粒子は肺胞マクロファージにより貪食され体外へ排出されると考えられている5).そこで,微細粒子の肺胞マクロファージへの影響について解析した.微細粒子としてアレルギー性炎症をひき起こすことの知られているアルムニウム塩および結晶シリカを用いて,in vitroにおいて微細粒子により肺胞マクロファージを刺激したところ,培養上清にインターロイキン1αが遊離した.そのほかの炎症性サイトカインは産生せず,また,腹腔マクロファージや顆粒球単球コロニー刺激因子により骨髄から分化させたマクロファージにおいては微細粒子によりインターロイキン1αは産生されなかった.インターロイキン1αの産生を誘導する微細粒子は肺胞マクロファージの細胞死を誘導する特性ももち,ヒドロキシアパタイトなどアレルギー性炎症を誘導しない微細粒子による刺激ではインターロイキン1αの産生も細胞死も認められなかった.これらの結果から,肺胞マクロファージからのインターロイキン1αの産生は細胞死と密に関連することが示唆された.事実,肺胞マクロファージを凍結融解した際にもインターロイキン1αが遊離した.すなわち,肺胞マクロファージは定常状態において細胞にインターロイキン1αを保持し,これは微細粒子などによる細胞死により細胞外へと放出されると考えられた.
in vivoにおける評価として,微細粒子の気管への投与による肺におけるインターロイキン1αの産生について解析した.アルミニウム塩は肺胞マクロファージからのインターロイキン1αの放出を誘導したが,アルミニウム塩の気管への投与により肺胞洗浄液からインターロイキン1αが検出された.投与の直後のみならず,投与の2週間のちにおいても肺においてインターロイキン1αは放出された.細胞死の指標であるDNAの放出も微細粒子の投与の直後から2週間にわたり検出された.このことから,in vivoにおいてもin vitroと同様に肺胞マクロファージによる微細粒子の貪食,細胞死,インターロイキン1αの産生が起こっており,この現象は少なくとも微細粒子の投与の2週間のちまでくり返されると考えられた.結晶シリカの気管への投与によっても肺においてインターロイキン1αが放出されたが,結晶シリカによる細胞死の誘導の阻害剤であるポリ-2-ビニルピリジン-N-オキシドを同時に投与することにより,肺においてDNAおよびインターロイキン1αの放出は有意に抑制された.また,マクロファージに細胞死を誘導するクロドロン酸リポソームの投与によっても肺においてインターロイキン1αが放出されたことから,in vivoにおいても肺胞マクロファージの細胞死がインターロイキン1αの放出の引き金になることが示唆された.さらに,アルミニウム塩の投与の2週間のちに肺の組織を観察したところ,インターロイキン1に依存的にリンパ球クラスターが形成されていた.
微細粒子の投与により長期間のインターロイキン1αの放出およびリンパ球クラスターの形成が認められたが,このような現象がアレルゲンの感作に関与するかどうか検討した.マウスの気管にアルミニウム塩を投与し,投与の3日後,7日後,14日後から抗原として卵白アルブミンを数回にわたり曝露した.そののち,血中の抗原に特異的な免疫グロブリンEを測定したところ,アルミニウム塩の投与の7日後あるいは14日後から抗原の曝露を開始しても抗原に特異的な免疫グロブリンEの量は増加した.結晶シリカあるいは酸化ニッケルのナノ粒子を気管に投与し7日のちに抗原を曝露した際にも,アルミニウム塩の投与と同様に,抗原に特異的な免疫グロブリンEの量は増加した.免疫グロブリンEの産生はインターロイキン1に依存的であり,インターロイキン1受容体ノックアウトマウスあるいはインターロイキン1αノックアウトマウスにおいては抗原に特異的な免疫グロブリンEの量は低下した.また,アレルギー性炎症の誘導されない微細粒子を用いて同様に実験した際には免疫グロブリンEは産生されなかった.これらの結果から,微細粒子による肺胞マクロファージの細胞死とそれにともなうインターロイキン1αの放出やリンパ球クラスターの形成は,のちの抗原の曝露による免疫グロブリンEの産生に重要であることが示唆された.さらに,微細粒子の投与の14日のちから抗原を曝露しても抗原に特異的な免疫グロブリンEの産生されたことから,微細粒子を吸入したのちにはアレルゲンに対する感受性の高い状態がつづいており,その期間にアレルゲンの曝露をうけることによりアレルギー性疾患を発症する可能性のあることが示された.
アルミニウム塩の投与により肺においてリンパ球クラスターが形成されたが,抗原の曝露により,よりサイズの大きいリンパ球クラスターが多く観察された.このリンパ球クラスターにはB細胞の成熟の場である胚中心が存在し,さらに,リンパ球クラスターの周囲には小さいながらもT細胞領域や抗体産生細胞の集団も観察された.これらの結果より,このリンパ球クラスターは異所性リンパ節である誘導性気管支関連リンパ組織であると考えられた.誘導性気管支関連リンパ組織の形成もインターロイキン1に依存性であり,インターロイキン1受容体ノックアウトマウスにおいては誘導性気管支関連リンパ組織の形成が減少していた.さらに,微細粒子の代わりにインターロイキン1αを抗原とともに気管に投与したところ,抗原に特異的な免疫グロブリンEの産生や誘導性気管支関連リンパ組織の形成が誘導されたことから,これらの反応にインターロイキン1αが重要な役割をはたすことが明らかにされた.
これまでの報告により,誘導性気管支関連リンパ組織の形成には肺にリクルートされた樹状細胞が重要な役割をはたすことが示されている6).そこで,微細粒子の投与および抗原の曝露による免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に樹状細胞が関与するかどうか検討した.アルミニウム塩を気管に投与し,7日のちに抗原として卵白アルブミンを曝露したところ,肺においてCD11c陽性CD103陽性の樹状細胞が多くリクルートされた.しかしながら,インターロイキン1受容体ノックアウトマウスにおいて樹状細胞の数は減少しており,インターロイキン1αが肺における樹状細胞の浸潤に関与すると考えられた.さらに,このマウスにおいて樹状細胞を除去したところ,抗原に特異的な免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成は有意に低下した.これらの結果から,肺胞マクロファージの細胞死により放出されるインターロイキン1αは樹状細胞を肺へリクルートすることにより免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に関与すると考えられた.
免疫グロブリンEへのクラススイッチにおいてはインターロイキン4が必須であることが知られているが,この反応にはTh2細胞に由来するインターロイキン4ではなく濾胞性ヘルパーT細胞に由来するインターロイキン4が重要であると報告されている7).そこで,免疫グロブリンEの産生における濾胞性ヘルパーT細胞の関与について調べるため,濾胞性ヘルパーT細胞の欠損したマウスを用いて同様に実験したところ,免疫グロブリンEの産生のみならず,肺における誘導性気管支関連リンパ組織の形成も減少していた.以上の結果より,樹状細胞とともに濾胞性ヘルパーT細胞の活性化が免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に重要であると考えられた.
これまでの多くの研究において,アルミニウム塩および抗原を腹腔に投与することにより抗原に特異的な免疫グロブリンEの産生を誘導しアレルギー性炎症のモデルマウスを作製していた.そこで,アルミニウム塩を肺に直接に投与する実験系と比較した.これまでに,腹腔への投与による感作においてはシグナル伝達タンパク質であるMyD88に非依存的に免疫グロブリンEが産生されることが報告されているが8,9),同様に,腹腔への投与においては免疫グロブリンEの産生にMyD88は関与しなかった.MyD88はインターロイキン1シグナルに関与する重要なシグナル伝達タンパク質であることから,腹腔への投与による免疫グロブリンEの産生においてインターロイキン1は必要とされないと考えられた.一方,アルミニウム塩および抗原の気管への投与による感作においては,MyD88に依存的に免疫グロブリンEが産生された.さらに,腹腔への投与による抗原の感作においては,気管への投与による抗原の感作と比較して,肺におけるリンパ球クラスターの形成が著しく減少した.これらの結果から,気管への投与による抗原の感作はほかの投与経路とは異なる免疫学的な機構によりアレルギー性炎症を誘導すると考えられた(図1).
最近では,ニュースなどでもPM2.5をはじめとする微細粒子の人体への影響について報道されている.とくに,大気中の微細粒子の増加が喘息患者の発作のリスクと正に相関すると報告されており,微細粒子がアレルギー性炎症の発症に密に関与することが示唆されている.また,大気中の微細粒子のみならず,多くの微細粒子が免疫系を刺激しTh2型の免疫反応を誘導すると報告されているが,その分子機構は不明であった.この研究により,微細粒子の吸入により肺胞マクロファージの細胞死が誘導され,免疫グロブリンEの産生の引き金となるインターロイキン1αが長期間にわたり放出されることが明らかにされた.これらの知見から,細胞死あるいはインターロイキン1を標的とした新しいアレルギー性炎症の予防法あるいは治療法の開発につながることが期待される.
さらに,この研究においては,微細粒子の吸入により長期間にわたりインターロイキン1αが放出される結果,アレルゲンに感作されやすい状態がつづくことが明らかにされた.この結果から,微細粒子の曝露をうけた直後だけでなく,そののち数日間はアレルゲンの曝露によりアレルギー性炎症を発症する可能性があり,注意が必要であろう.
略歴:2001年 産業医科大学大学院医学研究科 修了,同年 産業医科大学医学部 助手,2007年 カナダBritish Columbia Cancer Institute研究員,2009年 産業医科大学医学部 講師を経て,2012年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:アジュバントによる免疫の制御機構.
関心事:自然免疫やアジュバントをキーワードとして,マクロファージの活性化や細胞死による免疫の活性化機構に興味をもっている.
石井 健(Ken J. Ishii)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://www.nibiohn.go.jp/adjuvant/index.html
© 2017 黒田悦史・石井 健 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター ワクチン学)
email:黒田悦史,石井 健
DOI: 10.7875/first.author.2017.007
Inhaled fine particles induce alveolar macrophage death and interleukin-1α release to promote inducible bronchus-associated lymphoid tissue formation.
Etsushi Kuroda, Koji Ozasa, Burcu Temizoz, Keiichi Ohata, Christine X. Koo, Tomohiro Kanuma, Takato Kusakabe, Shingo Kobari, Masanori Horie, Yasuo Morimoto, Saeko Nakajima, Kenji Kabashima, Steven F. Ziegler, Yoichiro Iwakura, Wataru Ise, Tomohiro Kurosaki, Takahiro Nagatake, Jun Kunisawa, Naoki Takemura, Satoshi Uematsu, Masayuki Hayashi, Taiki Aoshi, Kouji Kobiyama, Cevayir Coban, Ken J. Ishii
Immunity, 45, 1299-1310 (2016)
要 約
アレルギー性疾患の発症および増悪にはさまざまな因子が関与するが,そのひとつとして,大気中に浮遊するPM2.5や黄砂など微細粒子の関与が示唆されている.このような微細粒子は免疫反応を増強するアジュバントとしてはたらくと考えられており,とくに,免疫グロブリンEの産生をはじめとするアレルギー性炎症を誘導することが報告されている.しかしながら,微細粒子によるアレルギー性炎症の誘導あるいは増悪の分子機構は詳細には明らかにされていない.この研究においては,微細粒子の貪食により肺胞マクロファージに細胞死が誘導されインターロイキン1αが放出されること,さらに,このインターロイキン1αの放出は肺において2週間も持続することが見い出された.また,微細粒子のアジュバントとしての効果もインターロイキン1αの放出と同様に持続し,微細粒子の投与の数日のちに抗原を曝露しても抗原に特異的な免疫グロブリンEが産生された.さらに,このようなマウスの肺には誘導性気管支関連リンパ組織とよばれる異所性リンパ節が形成され,このことが免疫グロブリンEの産生およびアレルギー性炎症の誘導に関与すると考えられた.
はじめに
先進国や都市部を中心にアレルギー性疾患は増加の一途をたどっており,大きな社会問題になっている.アレルギー疾患の発症および増悪にはさまざまな因子の関与が報告されているが,大気中に浮遊する微細粒子も増悪因子のひとつと考えられている.とくに,黄砂,ディーゼル粒子,PM2.5などの吸入性の微細粒子は免疫反応を増強するアジュバントとしてはたらきアレルギー性炎症を誘導および増悪する作用のあること,さらに,疫学的な解析により大気中の粒子状の汚染物質の増加と喘息患者の入院とのあいだに相関関係のあることが報告されている.
免疫学の分野においては,アルミニウム塩や結晶シリカなど多くの微細粒子が免疫グロブリンEの産生や好酸球性炎症を特徴としたTh2型の免疫反応を誘導し,アレルギー性炎症を惹起することが報告されている1).このようなアジュバントはTh2アジュバントとよばれ,多くの微細粒子がTh2アジュバント活性をもつことが報告されているが,その免疫学的な機構について詳細は明らかにされていない.
アジュバント活性をもつ物質は自然免疫を活性化することにより獲得免疫を誘導すると考えられており,アレルギー性炎症に関与するTh2型の免疫反応の誘導にも自然免疫の活性化が必須であると考えられている2).一般に,宿主のもつパターン認識受容体が病原体に由来する抗原を認識することにより自然免疫は活性化されると考えられているが,損傷をうけた細胞や死細胞に由来する因子である損傷関連分子パターン(damage-associated molecular pattern:DAMP)も同様に,パターン認識受容体やサイトカイン受容体を介して自然免疫を活性化することが知られている.さきに述べたように,微細粒子の多くがTh2アジュバント活性をもつことから,自然免疫を活性化する微細粒子に共通したなんらかの分子機構が存在すると考えられていた.最近の報告から,アルミニウム塩などの微細粒子はそれを貪食した細胞の細胞死を誘導することが示されており,微細粒子による損傷関連分子パターンを介した免疫の活性化機構の関与が示唆されている3,4).この研究においては,微細粒子によるアレルギー性炎症の誘導の機構に関して細胞死や損傷関連分子パターンの観点から解析し,微細粒子による細胞死の誘導が抗原に特異的な免疫グロブリンEの産生に重要であることを見い出した.
1.微細粒子は肺胞マクロファージの細胞死およびインターロイキン1αの放出を誘導する
PM2.5やナノサイズの微細粒子は吸入により気道や肺の奥に到達し炎症反応をひき起こすことが明らかにされており,そのような微細粒子は肺胞マクロファージにより貪食され体外へ排出されると考えられている5).そこで,微細粒子の肺胞マクロファージへの影響について解析した.微細粒子としてアレルギー性炎症をひき起こすことの知られているアルムニウム塩および結晶シリカを用いて,in vitroにおいて微細粒子により肺胞マクロファージを刺激したところ,培養上清にインターロイキン1αが遊離した.そのほかの炎症性サイトカインは産生せず,また,腹腔マクロファージや顆粒球単球コロニー刺激因子により骨髄から分化させたマクロファージにおいては微細粒子によりインターロイキン1αは産生されなかった.インターロイキン1αの産生を誘導する微細粒子は肺胞マクロファージの細胞死を誘導する特性ももち,ヒドロキシアパタイトなどアレルギー性炎症を誘導しない微細粒子による刺激ではインターロイキン1αの産生も細胞死も認められなかった.これらの結果から,肺胞マクロファージからのインターロイキン1αの産生は細胞死と密に関連することが示唆された.事実,肺胞マクロファージを凍結融解した際にもインターロイキン1αが遊離した.すなわち,肺胞マクロファージは定常状態において細胞にインターロイキン1αを保持し,これは微細粒子などによる細胞死により細胞外へと放出されると考えられた.
2.微細粒子の肺への投与はインターロイキン1αの産生を長期間にわたり誘導する
in vivoにおける評価として,微細粒子の気管への投与による肺におけるインターロイキン1αの産生について解析した.アルミニウム塩は肺胞マクロファージからのインターロイキン1αの放出を誘導したが,アルミニウム塩の気管への投与により肺胞洗浄液からインターロイキン1αが検出された.投与の直後のみならず,投与の2週間のちにおいても肺においてインターロイキン1αは放出された.細胞死の指標であるDNAの放出も微細粒子の投与の直後から2週間にわたり検出された.このことから,in vivoにおいてもin vitroと同様に肺胞マクロファージによる微細粒子の貪食,細胞死,インターロイキン1αの産生が起こっており,この現象は少なくとも微細粒子の投与の2週間のちまでくり返されると考えられた.結晶シリカの気管への投与によっても肺においてインターロイキン1αが放出されたが,結晶シリカによる細胞死の誘導の阻害剤であるポリ-2-ビニルピリジン-N-オキシドを同時に投与することにより,肺においてDNAおよびインターロイキン1αの放出は有意に抑制された.また,マクロファージに細胞死を誘導するクロドロン酸リポソームの投与によっても肺においてインターロイキン1αが放出されたことから,in vivoにおいても肺胞マクロファージの細胞死がインターロイキン1αの放出の引き金になることが示唆された.さらに,アルミニウム塩の投与の2週間のちに肺の組織を観察したところ,インターロイキン1に依存的にリンパ球クラスターが形成されていた.
3.微細粒子による長期間にわたるインターロイキン1αの放出およびリンパ球クラスターの形成は微細粒子のアジュバントとしての効果を持続させる
微細粒子の投与により長期間のインターロイキン1αの放出およびリンパ球クラスターの形成が認められたが,このような現象がアレルゲンの感作に関与するかどうか検討した.マウスの気管にアルミニウム塩を投与し,投与の3日後,7日後,14日後から抗原として卵白アルブミンを数回にわたり曝露した.そののち,血中の抗原に特異的な免疫グロブリンEを測定したところ,アルミニウム塩の投与の7日後あるいは14日後から抗原の曝露を開始しても抗原に特異的な免疫グロブリンEの量は増加した.結晶シリカあるいは酸化ニッケルのナノ粒子を気管に投与し7日のちに抗原を曝露した際にも,アルミニウム塩の投与と同様に,抗原に特異的な免疫グロブリンEの量は増加した.免疫グロブリンEの産生はインターロイキン1に依存的であり,インターロイキン1受容体ノックアウトマウスあるいはインターロイキン1αノックアウトマウスにおいては抗原に特異的な免疫グロブリンEの量は低下した.また,アレルギー性炎症の誘導されない微細粒子を用いて同様に実験した際には免疫グロブリンEは産生されなかった.これらの結果から,微細粒子による肺胞マクロファージの細胞死とそれにともなうインターロイキン1αの放出やリンパ球クラスターの形成は,のちの抗原の曝露による免疫グロブリンEの産生に重要であることが示唆された.さらに,微細粒子の投与の14日のちから抗原を曝露しても抗原に特異的な免疫グロブリンEの産生されたことから,微細粒子を吸入したのちにはアレルゲンに対する感受性の高い状態がつづいており,その期間にアレルゲンの曝露をうけることによりアレルギー性疾患を発症する可能性のあることが示された.
4.肺に形成される誘導性気管支関連リンパ組織は抗原に特異的な免疫グロブリンEの産生に関与する
アルミニウム塩の投与により肺においてリンパ球クラスターが形成されたが,抗原の曝露により,よりサイズの大きいリンパ球クラスターが多く観察された.このリンパ球クラスターにはB細胞の成熟の場である胚中心が存在し,さらに,リンパ球クラスターの周囲には小さいながらもT細胞領域や抗体産生細胞の集団も観察された.これらの結果より,このリンパ球クラスターは異所性リンパ節である誘導性気管支関連リンパ組織であると考えられた.誘導性気管支関連リンパ組織の形成もインターロイキン1に依存性であり,インターロイキン1受容体ノックアウトマウスにおいては誘導性気管支関連リンパ組織の形成が減少していた.さらに,微細粒子の代わりにインターロイキン1αを抗原とともに気管に投与したところ,抗原に特異的な免疫グロブリンEの産生や誘導性気管支関連リンパ組織の形成が誘導されたことから,これらの反応にインターロイキン1αが重要な役割をはたすことが明らかにされた.
これまでの報告により,誘導性気管支関連リンパ組織の形成には肺にリクルートされた樹状細胞が重要な役割をはたすことが示されている6).そこで,微細粒子の投与および抗原の曝露による免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に樹状細胞が関与するかどうか検討した.アルミニウム塩を気管に投与し,7日のちに抗原として卵白アルブミンを曝露したところ,肺においてCD11c陽性CD103陽性の樹状細胞が多くリクルートされた.しかしながら,インターロイキン1受容体ノックアウトマウスにおいて樹状細胞の数は減少しており,インターロイキン1αが肺における樹状細胞の浸潤に関与すると考えられた.さらに,このマウスにおいて樹状細胞を除去したところ,抗原に特異的な免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成は有意に低下した.これらの結果から,肺胞マクロファージの細胞死により放出されるインターロイキン1αは樹状細胞を肺へリクルートすることにより免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に関与すると考えられた.
免疫グロブリンEへのクラススイッチにおいてはインターロイキン4が必須であることが知られているが,この反応にはTh2細胞に由来するインターロイキン4ではなく濾胞性ヘルパーT細胞に由来するインターロイキン4が重要であると報告されている7).そこで,免疫グロブリンEの産生における濾胞性ヘルパーT細胞の関与について調べるため,濾胞性ヘルパーT細胞の欠損したマウスを用いて同様に実験したところ,免疫グロブリンEの産生のみならず,肺における誘導性気管支関連リンパ組織の形成も減少していた.以上の結果より,樹状細胞とともに濾胞性ヘルパーT細胞の活性化が免疫グロブリンEの産生および誘導性気管支関連リンパ組織の形成に重要であると考えられた.
5.肺への直接の感作はほかの投与経路とは異なる機構により免疫グロブリンEの産生を誘導する
これまでの多くの研究において,アルミニウム塩および抗原を腹腔に投与することにより抗原に特異的な免疫グロブリンEの産生を誘導しアレルギー性炎症のモデルマウスを作製していた.そこで,アルミニウム塩を肺に直接に投与する実験系と比較した.これまでに,腹腔への投与による感作においてはシグナル伝達タンパク質であるMyD88に非依存的に免疫グロブリンEが産生されることが報告されているが8,9),同様に,腹腔への投与においては免疫グロブリンEの産生にMyD88は関与しなかった.MyD88はインターロイキン1シグナルに関与する重要なシグナル伝達タンパク質であることから,腹腔への投与による免疫グロブリンEの産生においてインターロイキン1は必要とされないと考えられた.一方,アルミニウム塩および抗原の気管への投与による感作においては,MyD88に依存的に免疫グロブリンEが産生された.さらに,腹腔への投与による抗原の感作においては,気管への投与による抗原の感作と比較して,肺におけるリンパ球クラスターの形成が著しく減少した.これらの結果から,気管への投与による抗原の感作はほかの投与経路とは異なる免疫学的な機構によりアレルギー性炎症を誘導すると考えられた(図1).
おわりに
最近では,ニュースなどでもPM2.5をはじめとする微細粒子の人体への影響について報道されている.とくに,大気中の微細粒子の増加が喘息患者の発作のリスクと正に相関すると報告されており,微細粒子がアレルギー性炎症の発症に密に関与することが示唆されている.また,大気中の微細粒子のみならず,多くの微細粒子が免疫系を刺激しTh2型の免疫反応を誘導すると報告されているが,その分子機構は不明であった.この研究により,微細粒子の吸入により肺胞マクロファージの細胞死が誘導され,免疫グロブリンEの産生の引き金となるインターロイキン1αが長期間にわたり放出されることが明らかにされた.これらの知見から,細胞死あるいはインターロイキン1を標的とした新しいアレルギー性炎症の予防法あるいは治療法の開発につながることが期待される.
さらに,この研究においては,微細粒子の吸入により長期間にわたりインターロイキン1αが放出される結果,アレルゲンに感作されやすい状態がつづくことが明らかにされた.この結果から,微細粒子の曝露をうけた直後だけでなく,そののち数日間はアレルゲンの曝露によりアレルギー性炎症を発症する可能性があり,注意が必要であろう.
文 献
- Kuroda, E., Coban, C. & Ishii, K. J.: Particulate adjuvant and innate immunity: past achievements, present findings, and future prospects. Int. Rev. Immunol., 32, 209-220 (2013)[PubMed]
- Akira, S.: Innate immunity and adjuvants. Philos. Trans. R. Soc. Lond. B Biol. Sci., 366, 2748-2755 (2011)[PubMed]
- Marichal, T., Ohata, K., Bedoret. D. et al.: DNA released from dying host cells mediates aluminum adjuvant activity. Nat. Med., 17, 996-1002 (2011)[PubMed]
- Kool, M., Willart, M. A., van Nimwegen, M. et al.: An unexpected role for uric acid as an inducer of T helper 2 cell immunity to inhaled antigens and inflammatory mediator of allergic asthma. Immunity, 34, 527-540 (2011)[PubMed]
- Oberdorster, G., Oberdorster, E. & Oberdorster, J.: Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles. Environ. Health Perspect., 113, 823-839 (2005)[PubMed]
- GeurtsvanKessel, C. H., Willart, M. A., Bergen, I. M. et al.: Dendritic cells are crucial for maintenance of tertiary lymphoid structures in the lung of influenza virus-infected mice. J. Exp. Med., 206, 2339-2349 (2009)[PubMed]
- Harada, Y., Tanaka, S., Motomura, Y. et al.: The 3' enhancer CNS2 is a critical regulator of interleukin-4-mediated humoral immunity in follicular helper T cells. Immunity, 36, 188-200 (2012)[PubMed] [新着論文レビュー]
- Gavin, A. L., Hoebe, K., Duong, B. et al.: Adjuvant-enhanced antibody responses in the absence of Toll-like receptor signaling. Science, 314, 1936-1938 (2006)[PubMed]
- Schnare, M., Barton, G. M., Holt, A. C. et al.: Toll-like receptors control activation of adaptive immune responses. Nat. Immunol., 2, 947-950 (2001)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2001年 産業医科大学大学院医学研究科 修了,同年 産業医科大学医学部 助手,2007年 カナダBritish Columbia Cancer Institute研究員,2009年 産業医科大学医学部 講師を経て,2012年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:アジュバントによる免疫の制御機構.
関心事:自然免疫やアジュバントをキーワードとして,マクロファージの活性化や細胞死による免疫の活性化機構に興味をもっている.
石井 健(Ken J. Ishii)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://www.nibiohn.go.jp/adjuvant/index.html
© 2017 黒田悦史・石井 健 Licensed under CC 表示 2.1 日本