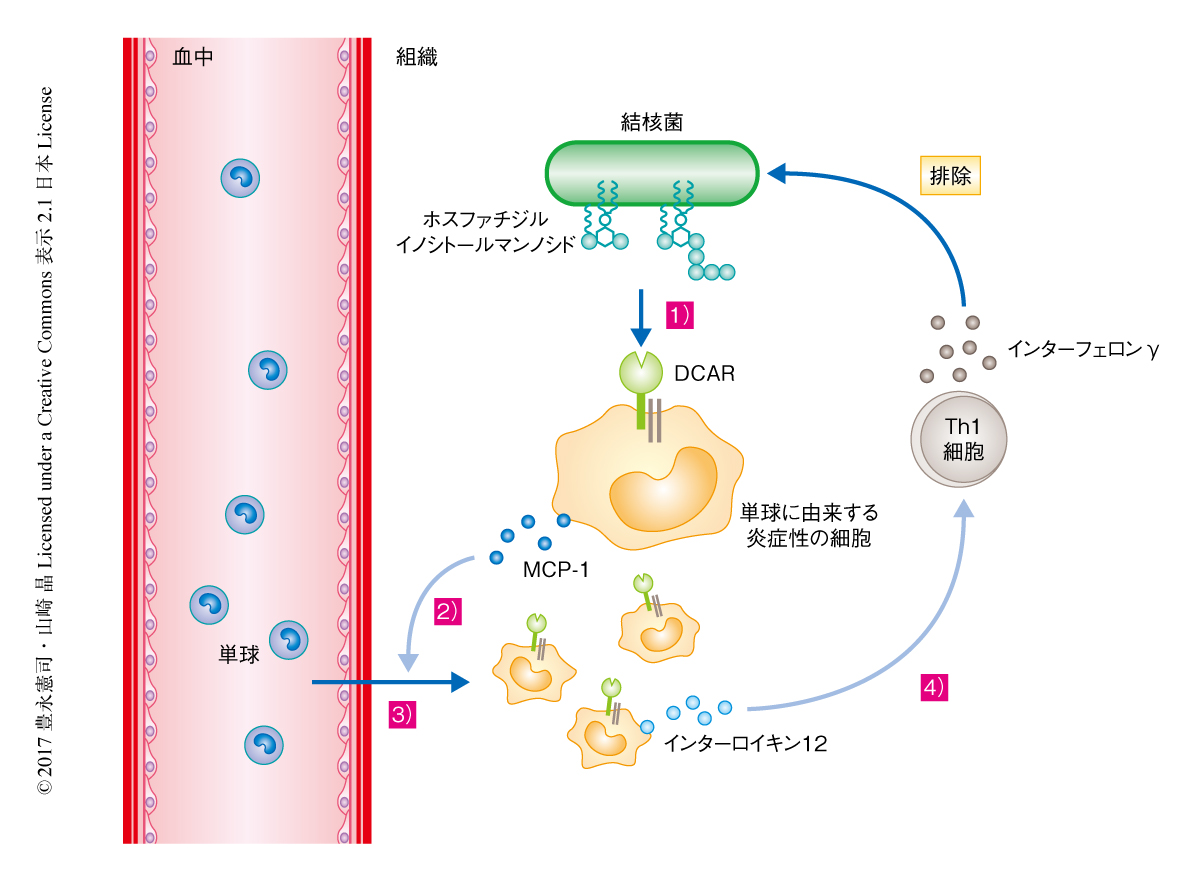
C型レクチン受容体DCARは結核菌のもつホスファチジルイノシトールマンノシドを認識して免疫応答を活性化する
豊永憲司・山崎 晶
(九州大学生体防御医学研究所 感染ネットワーク研究センター免疫制御学分野)
email:山崎 晶
DOI: 10.7875/first.author.2017.001
C-type lectin receptor DCAR recognizes mycobacterial phosphatidyl-inositol mannosides to promote a Th1 response during infection.
Kenji Toyonaga, Shota Torigoe, Yoshitomo Motomura, Takane Kamichi, Jennifer M. Hayashi, Yasu S. Morita, Naoto Noguchi, Yasushi Chuma, Hideyasu Kiyohara, Kazuhiro Matsuo, Hiroshi Tanaka, Yoshiko Nakagawa, Tetsushi Sakuma, Masaki Ohmuraya, Takashi Yamamoto, Masayuki Umemura, Goro Matsuzaki, Yasunobu Yoshikai, Ikuya Yano, Tomofumi Miyamoto, Sho Yamasaki
Immunity, 45, 1245-1257 (2016)
結核菌の細胞壁にはさまざまな脂質が含まれており,これらの脂質は病原性に寄与する因子として,古くから,構造や生理活性がさかんに研究されてきた.一方で,肝心の免疫応答を担う宿主の側の受容体についてはあまりわかっていなかったが,近年になり,パターン認識受容体のひとつであるC型レクチン受容体がこれらの脂質を認識することがわかってきた.今回,筆者らは,結核菌の新たな受容体としてC型レクチン受容体DCARを同定した.これまで,DCARの機能についてはよくわかっていなかったが,ほかのC型レクチン受容体とは異なり単球に由来する炎症性の細胞に発現が限局すること,結核菌に特有のリン脂質であるホスファチジルイノシトールマンノシドを認識することを明らかにした.DCARノックアウトマウスに結核菌を感染させたところ,結核菌の抗原に特異的なインターフェロンγの産生は減弱し臓器における菌数は上昇した.以上の結果から,DCARは結核菌のもつホスファチジルイノシトールマンノシドを認識し宿主の感染防御に寄与することが明らかにされた.
免疫受容体による感染性の病原体の認識は宿主の防御機構における最初の段階である.C型レクチン受容体は細胞外領域に糖を認識するドメインをもつ膜貫通型タンパク質で,真菌や細菌に特徴的な構造を認識することから新たなパターン認識受容体として注目されている.とくに,ITAMとよばれるシグナル伝達モチーフを介して活性化シグナルを伝達するC型レクチン受容体についてはリガンドがあいついで同定されている1,2).
結核菌の細胞壁には抗酸性や疎水性といった結核菌そのものの性質を特徴づけるさまざまな脂質が含まれる.これらの脂質は宿主に対しさまざまな生理活性を示すことから,病原性や毒性に関与する因子として構造や生理活性がさかんに研究されてきたが,肝心の免疫応答を担う宿主の側の受容体に関してはあまりわかっていなかった.近年になり,MincleおよびMCLによりトレハロースジミコール酸が,Dectin-2によりリポアラビノマンナンが認識されることが明らかにされたが,そのほかの脂質に関しては依然としてその受容体が不明なものが多い.ホスファチジルイノシトールマンノシドは結核菌をはじめとする抗酸菌の細胞壁に多く存在する糖脂質のひとつで,ホスファチジルイノシトールに付加するマンノースの数により大きく6種類に分けられ,なかでも,2個あるいは6個のマンノースが付加されたものがとくに豊富に存在すると報告されている.2個のマンノースが付加されたホスファチジルイノシトールジマンノシドの多くはアシル化修飾をうけており,さらにマンノースが付加されたホスファチジルイノシトールマンノシドや,リポマンナンやリポアラビノマンナンの前駆体としても知られている3).これまで,アシルホスファチジルイノシトールジマンノシドが炎症性サイトカインの産生を誘導するとの報告がなされていたが,その作用を担う受容体についてはあまりよくわかっていなかった.
哺乳類においてC型レクチン受容体は特定の染色体にクラスター状にコードされており,遺伝子の重複や挿入などの染色体の再構築により多様性を獲得してきたと考えられている4).実際に,筆者らがこれまでに結核菌の受容体として同定してきたMincle,MCL,Dectin-2も,マウスの第6染色体に隣接して存在する.そこで,同じ領域にコードされるリガンドが不明のC型レクチン受容体であるDCARに着目し,このDCARはMincle,MCL,Dectin-2と同様にFc受容体γ鎖と会合しうるという報告とあわせて5),DCARが結核菌を認識する可能性について考えた.
DCARが結核菌を認識するかどうかを明らかにするため,DCARによるリガンドの認識を蛍光によりモニターすることが可能なレポーター細胞を樹立した.DCARはMincle,MCL,Dectin-2と同様にFc受容体γ鎖と会合して活性化シグナルを伝達しうることが報告されていたため5),DCARとFc受容体γ鎖とを共発現させたレポーター細胞を樹立し,結核菌と共培養した.ヒト型の結核菌およびワクチン株であるウシ型の結核菌の弱毒株Mycobacterium bovis BCGいずれとの共培養においてもレポーター細胞に活性が認められたことから,DCARは結核菌を認識することが明らかにされた.また,いずれの結核菌にもリガンドの活性が認められたことから,結核菌に共通して存在する成分がDCARのリガンドである可能性も示唆された.
結核菌に含まれるDCARのリガンドについて明らかにするため,菌体から有機溶媒を用いて脂質を抽出し,脱脂質した菌体と抽出された脂質のどちらにリガンドの活性が移行するかを追跡した.その結果,脱脂質した菌体にはリガンドの活性は認められなかったが,抽出された脂質には強い活性が認められた.このことから,DCARは結核菌のもつなんらかの脂質を認識する可能性が示唆された.この脂質の抽出物を薄層クロマトグラフィーにより分離しリガンドの活性を示す脂質を絞り込んだところ,4つのスポットに活性が認められた.この脂質の抽出物にはMincleのリガンドであるトレハロースジミコール酸も含まれていたが,Mincleのレポーター細胞をこれら4つのスポットにより刺激しても活性は認められなかったことから,トレハロースジミコール酸はDCARのリガンドではないことも強く示唆された.これらの4つのスポットに含まれる脂質の化学的な性状について調べたところ,すべてにリン酸基が含まれること,活性のとくに強かった2つのスポットには糖が含まれることが明らかにされた.以上の結果から,DCARのリガンドは結核菌に含まれる糖を含有するリン脂質である可能性が示唆された.
活性を示した4つのスポットはヒト型の結核菌だけでなくワクチン株であるM. bovis BCGの脂質の抽出物にも認められたことから,M. bovis BCGから脂質の抽出物を大量に調製しDCARのリガンドの単離を試みた.脂質の抽出物をシリカゲルカラムにくわえてステップワイズ溶出法により脂質を分離し,溶出された脂質を薄層クロマトグラフィー法によりモニターした.レポーター細胞を用いて得られたすべての画分のリガンドの活性について検討し,活性を示した画分に含まれる脂質を質量分析法およびNMR法により解析した.これら構造解析の結果と文献3) における値から,DCARのリガンドは溶出の順に,カルジオリピン,ジアシルホスファチジルイノシトールジマンノシド,ホスファチジルイノシトール,モノアシルホスファチジルイノシトールジマンノシドであることが明らかにされた.これらの脂質には共通してリン酸が含まれること,リガンドの活性の強かったモノアシルホスファチジルイノシトールジマンノシドおよびジアシルホスファチジルイノシトールジマンノシドにはマンノースが含まれることも,これまでの解析の結果と合致した.
化学合成されたモノアシルホスファチジルジイノシトールマンノシドを入手してリガンドの活性をレポーター細胞において検討したところ,強い活性が認められたことから,DCARのリガンドはホスファチジルイノシトールマンノシドであることが明らかにされた.そこで,DCARの細胞外領域とヒトの免疫グロブリンを結合させた可溶性のタンパク質を作製し,ELISA法によりそのリガンドとの結合について解析したところ,DCARはホスファチジルイノシトールマンノシドと直接に結合することも明らかにされた.この結合はEDTAやEGTAなどのキレート剤の存在のもとにおいては消失したことから,DCARとホスファチジルイノシトールマンノシドとの結合にはCa2+が必要である可能性も示唆された.さらに,ホスファチジルイノシトールマンノシドの合成経路の酵素の遺伝子を欠損した結核菌株の脂質の抽出物を用いた解析から,ホスファチジルイノシトールマンノシドのリガンドの活性の強さは,2個のマンノースが付加されたジマンノシド,4個のマンノースが付加されたテトラマンノシド,6個のマンノースが付加されたヘキサマンノシド,の順であることも明らかにされた.
DCARが生体においてどのような細胞に発現しているかフローサイトメトリー法を用いて解析した.DCARノックアウトマウスに対しDCARを安定に発現する細胞株を免疫し,DCARを特異的に認識するモノクローナル抗体を樹立した.この抗体を用いて細胞の表面におけるDCARの発現を解析したところ,腹腔内の一部の細胞の集団にDCARが発現していることが見い出された.この細胞の集団は腹腔常在性のマクロファージのなかでも,近年,SPM(small peritoneal macrophage)とよばれている集団であり,MHCクラスII分子を高発現すること,血中を循環する単球に由来することなどが報告されている6,7).さらに,腹腔だけでなく,肺や脾臓に存在する単球に由来する炎症性の細胞にもDCARは選択的に発現していた.この細胞の表面におけるDCARの発現は,DCARと会合して活性化シグナルを伝達するFc受容体γ鎖を欠損したマウスにおいては消失したことから,細胞の表面における内在性のDCARの発現にはFc受容体γ鎖が必須であることも明らかにされた.
ホスファチジルイノシトールマンノシドによりひき起こされる自然免疫応答について解析するため,SPMを含む腹腔内の細胞を精製したアシルホスファチジルイノシトールジマンノシドにより刺激した.野生型のマウスに由来する細胞はアシルホスファチジルイノシトールジマンノシドによる刺激によりMCP-1やMIP-2などのケモカインを産生したが,DCARノックアウトマウスに由来する細胞においてはこれらの産生は部分的に抑制された.この抑制はFc受容体γ鎖ノックアウトマウスに由来する細胞においても同様に認められたことから,アシルホスファチジルイノシトールジマンノシドがDCARとFc受容体γ鎖との複合体を介してケモカインの産生を誘導する可能性が示唆された.さらに,アシルホスファチジルイノシトールジマンノシドを腹腔に投与したところ,野生型のマウスにおいてはin vitroにおける結果と同様に腹腔においてMCP-1およびMIP-2のレベルが上昇したが,DCARノックアウトマウスにおいてこれらの上昇は抑制された.このことから,アシルホスファチジルイノシトールジマンノシドがin vivoにおいてDCARを介して炎症応答をひき起こす可能性が考えられた.
実際の結核菌の感染におけるDCARの役割を解析するため感染実験を行った..結核菌に感染すると感染の局所に炎症性の単球の浸潤が認められ,これは感染に対する初期の免疫応答のひとつと考えられている8,9).ワクチン株であるM. bovis BCGを腹腔に感染させたところ,DCARノックアウトマウスにおいては野生型のマウスにおいてみられた炎症性の単球の腹腔への浸潤が減少の傾向にあった.浸潤する炎症性の単球はMCP-1の受容体であるCCR2を発現し感染の局所に集積すると考えられているが,DCARノックアウトマウスにおいては腹腔におけるMCP-1の産生も減少した.また,結核菌に対する感染防御にはCD4陽性T細胞からのインターフェロンγの産生を主体とするTh1応答が重要であることが知られている10).感染から2週間のちの野生型のマウスの腹腔においてインターフェロンγおよびインターロイキン12のレベルが上昇したが,DCARノックアウトマウスにおいてこれらの産生は減弱しており,腹腔における菌数は上昇の傾向にあった.主要な感染経路である経気道からM. bovis BCGを感染させ,感染から2週間のちに縦隔リンパ節を採取し結核菌に特有な抗原により再刺激したところ,DCARノックアウトマウスにおいてインターフェロンγの産生が減弱しており肺における菌数も上昇の傾向にあった.これらの結果から,結核菌の感染に対する宿主の感染防御にDCARが関与することが示唆された.
この研究により,DCARが結核菌のもつホスファチジルイノシトールマンノシドを認識し免疫応答を活性化することが明らかにされた(図1).DCARはマウスの第6染色体にコードされるMincle,MCL,Dectin-2につぐ結核菌の受容体であることが明らかにされた.これらのC型レクチン受容体はFc受容体γ鎖と会合して活性化シグナルを伝達するが,それぞれ異なるリガンドを認識するだけでなく発現する細胞も異なりユニークな応答を惹起する.生体はこれら複数の結核菌の受容体を獲得することにより結核菌に対抗してきたのかもしれない.これまでのところ,ヒトのDCARのオーソログは同定されていないが,筆者らは,ヒトの末梢血の単球に由来する樹状細胞をホスファチジルイノシトールマンノシドにより刺激するとマウスの細胞と同様に活性化することを見い出しており,現在,この作用を担う分子を探索している.ホスファチジルイノシトールマンノシドは獲得免疫応答を増強する免疫賦活剤としても注目されており,さまざまな類似体が合成されその活性が研究されている.ホスファチジルイノシトールマンノシドの受容体の同定は,結核のみならずさまざまな感染症に対する効果的なワクチンの開発という観点からも有用な知見であると考えられる.
略歴:2014年 九州大学大学院医学系学府博士課程 修了,同年 九州大学生体防御医学研究所 研究員を経て,2016年より鹿児島大学大学院医歯学総合研究科 研究員.
研究テーマ:ITAM共役型受容体による病原体の認識とその意義.
関心事:抗酸菌のもつ脂質が宿主の免疫応答におよぼす影響.
山崎 晶(Sho Yamasaki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/molimm/
© 2017 豊永憲司・山崎 晶 Licensed under CC 表示 2.1 日本
(九州大学生体防御医学研究所 感染ネットワーク研究センター免疫制御学分野)
email:山崎 晶
DOI: 10.7875/first.author.2017.001
C-type lectin receptor DCAR recognizes mycobacterial phosphatidyl-inositol mannosides to promote a Th1 response during infection.
Kenji Toyonaga, Shota Torigoe, Yoshitomo Motomura, Takane Kamichi, Jennifer M. Hayashi, Yasu S. Morita, Naoto Noguchi, Yasushi Chuma, Hideyasu Kiyohara, Kazuhiro Matsuo, Hiroshi Tanaka, Yoshiko Nakagawa, Tetsushi Sakuma, Masaki Ohmuraya, Takashi Yamamoto, Masayuki Umemura, Goro Matsuzaki, Yasunobu Yoshikai, Ikuya Yano, Tomofumi Miyamoto, Sho Yamasaki
Immunity, 45, 1245-1257 (2016)
要 約
結核菌の細胞壁にはさまざまな脂質が含まれており,これらの脂質は病原性に寄与する因子として,古くから,構造や生理活性がさかんに研究されてきた.一方で,肝心の免疫応答を担う宿主の側の受容体についてはあまりわかっていなかったが,近年になり,パターン認識受容体のひとつであるC型レクチン受容体がこれらの脂質を認識することがわかってきた.今回,筆者らは,結核菌の新たな受容体としてC型レクチン受容体DCARを同定した.これまで,DCARの機能についてはよくわかっていなかったが,ほかのC型レクチン受容体とは異なり単球に由来する炎症性の細胞に発現が限局すること,結核菌に特有のリン脂質であるホスファチジルイノシトールマンノシドを認識することを明らかにした.DCARノックアウトマウスに結核菌を感染させたところ,結核菌の抗原に特異的なインターフェロンγの産生は減弱し臓器における菌数は上昇した.以上の結果から,DCARは結核菌のもつホスファチジルイノシトールマンノシドを認識し宿主の感染防御に寄与することが明らかにされた.
はじめに
免疫受容体による感染性の病原体の認識は宿主の防御機構における最初の段階である.C型レクチン受容体は細胞外領域に糖を認識するドメインをもつ膜貫通型タンパク質で,真菌や細菌に特徴的な構造を認識することから新たなパターン認識受容体として注目されている.とくに,ITAMとよばれるシグナル伝達モチーフを介して活性化シグナルを伝達するC型レクチン受容体についてはリガンドがあいついで同定されている1,2).
結核菌の細胞壁には抗酸性や疎水性といった結核菌そのものの性質を特徴づけるさまざまな脂質が含まれる.これらの脂質は宿主に対しさまざまな生理活性を示すことから,病原性や毒性に関与する因子として構造や生理活性がさかんに研究されてきたが,肝心の免疫応答を担う宿主の側の受容体に関してはあまりわかっていなかった.近年になり,MincleおよびMCLによりトレハロースジミコール酸が,Dectin-2によりリポアラビノマンナンが認識されることが明らかにされたが,そのほかの脂質に関しては依然としてその受容体が不明なものが多い.ホスファチジルイノシトールマンノシドは結核菌をはじめとする抗酸菌の細胞壁に多く存在する糖脂質のひとつで,ホスファチジルイノシトールに付加するマンノースの数により大きく6種類に分けられ,なかでも,2個あるいは6個のマンノースが付加されたものがとくに豊富に存在すると報告されている.2個のマンノースが付加されたホスファチジルイノシトールジマンノシドの多くはアシル化修飾をうけており,さらにマンノースが付加されたホスファチジルイノシトールマンノシドや,リポマンナンやリポアラビノマンナンの前駆体としても知られている3).これまで,アシルホスファチジルイノシトールジマンノシドが炎症性サイトカインの産生を誘導するとの報告がなされていたが,その作用を担う受容体についてはあまりよくわかっていなかった.
哺乳類においてC型レクチン受容体は特定の染色体にクラスター状にコードされており,遺伝子の重複や挿入などの染色体の再構築により多様性を獲得してきたと考えられている4).実際に,筆者らがこれまでに結核菌の受容体として同定してきたMincle,MCL,Dectin-2も,マウスの第6染色体に隣接して存在する.そこで,同じ領域にコードされるリガンドが不明のC型レクチン受容体であるDCARに着目し,このDCARはMincle,MCL,Dectin-2と同様にFc受容体γ鎖と会合しうるという報告とあわせて5),DCARが結核菌を認識する可能性について考えた.
1.DCARは結核菌のもつ脂質を認識する
DCARが結核菌を認識するかどうかを明らかにするため,DCARによるリガンドの認識を蛍光によりモニターすることが可能なレポーター細胞を樹立した.DCARはMincle,MCL,Dectin-2と同様にFc受容体γ鎖と会合して活性化シグナルを伝達しうることが報告されていたため5),DCARとFc受容体γ鎖とを共発現させたレポーター細胞を樹立し,結核菌と共培養した.ヒト型の結核菌およびワクチン株であるウシ型の結核菌の弱毒株Mycobacterium bovis BCGいずれとの共培養においてもレポーター細胞に活性が認められたことから,DCARは結核菌を認識することが明らかにされた.また,いずれの結核菌にもリガンドの活性が認められたことから,結核菌に共通して存在する成分がDCARのリガンドである可能性も示唆された.
結核菌に含まれるDCARのリガンドについて明らかにするため,菌体から有機溶媒を用いて脂質を抽出し,脱脂質した菌体と抽出された脂質のどちらにリガンドの活性が移行するかを追跡した.その結果,脱脂質した菌体にはリガンドの活性は認められなかったが,抽出された脂質には強い活性が認められた.このことから,DCARは結核菌のもつなんらかの脂質を認識する可能性が示唆された.この脂質の抽出物を薄層クロマトグラフィーにより分離しリガンドの活性を示す脂質を絞り込んだところ,4つのスポットに活性が認められた.この脂質の抽出物にはMincleのリガンドであるトレハロースジミコール酸も含まれていたが,Mincleのレポーター細胞をこれら4つのスポットにより刺激しても活性は認められなかったことから,トレハロースジミコール酸はDCARのリガンドではないことも強く示唆された.これらの4つのスポットに含まれる脂質の化学的な性状について調べたところ,すべてにリン酸基が含まれること,活性のとくに強かった2つのスポットには糖が含まれることが明らかにされた.以上の結果から,DCARのリガンドは結核菌に含まれる糖を含有するリン脂質である可能性が示唆された.
2.DCARは結核菌のもつホスファチジルイノシトールマンノシドと直接に結合する
活性を示した4つのスポットはヒト型の結核菌だけでなくワクチン株であるM. bovis BCGの脂質の抽出物にも認められたことから,M. bovis BCGから脂質の抽出物を大量に調製しDCARのリガンドの単離を試みた.脂質の抽出物をシリカゲルカラムにくわえてステップワイズ溶出法により脂質を分離し,溶出された脂質を薄層クロマトグラフィー法によりモニターした.レポーター細胞を用いて得られたすべての画分のリガンドの活性について検討し,活性を示した画分に含まれる脂質を質量分析法およびNMR法により解析した.これら構造解析の結果と文献3) における値から,DCARのリガンドは溶出の順に,カルジオリピン,ジアシルホスファチジルイノシトールジマンノシド,ホスファチジルイノシトール,モノアシルホスファチジルイノシトールジマンノシドであることが明らかにされた.これらの脂質には共通してリン酸が含まれること,リガンドの活性の強かったモノアシルホスファチジルイノシトールジマンノシドおよびジアシルホスファチジルイノシトールジマンノシドにはマンノースが含まれることも,これまでの解析の結果と合致した.
化学合成されたモノアシルホスファチジルジイノシトールマンノシドを入手してリガンドの活性をレポーター細胞において検討したところ,強い活性が認められたことから,DCARのリガンドはホスファチジルイノシトールマンノシドであることが明らかにされた.そこで,DCARの細胞外領域とヒトの免疫グロブリンを結合させた可溶性のタンパク質を作製し,ELISA法によりそのリガンドとの結合について解析したところ,DCARはホスファチジルイノシトールマンノシドと直接に結合することも明らかにされた.この結合はEDTAやEGTAなどのキレート剤の存在のもとにおいては消失したことから,DCARとホスファチジルイノシトールマンノシドとの結合にはCa2+が必要である可能性も示唆された.さらに,ホスファチジルイノシトールマンノシドの合成経路の酵素の遺伝子を欠損した結核菌株の脂質の抽出物を用いた解析から,ホスファチジルイノシトールマンノシドのリガンドの活性の強さは,2個のマンノースが付加されたジマンノシド,4個のマンノースが付加されたテトラマンノシド,6個のマンノースが付加されたヘキサマンノシド,の順であることも明らかにされた.
3.DCARは単球に由来する炎症性の細胞に発現している
DCARが生体においてどのような細胞に発現しているかフローサイトメトリー法を用いて解析した.DCARノックアウトマウスに対しDCARを安定に発現する細胞株を免疫し,DCARを特異的に認識するモノクローナル抗体を樹立した.この抗体を用いて細胞の表面におけるDCARの発現を解析したところ,腹腔内の一部の細胞の集団にDCARが発現していることが見い出された.この細胞の集団は腹腔常在性のマクロファージのなかでも,近年,SPM(small peritoneal macrophage)とよばれている集団であり,MHCクラスII分子を高発現すること,血中を循環する単球に由来することなどが報告されている6,7).さらに,腹腔だけでなく,肺や脾臓に存在する単球に由来する炎症性の細胞にもDCARは選択的に発現していた.この細胞の表面におけるDCARの発現は,DCARと会合して活性化シグナルを伝達するFc受容体γ鎖を欠損したマウスにおいては消失したことから,細胞の表面における内在性のDCARの発現にはFc受容体γ鎖が必須であることも明らかにされた.
4.ホスファチジルイノシトールマンノシドはDCARを介して免疫応答を活性化する
ホスファチジルイノシトールマンノシドによりひき起こされる自然免疫応答について解析するため,SPMを含む腹腔内の細胞を精製したアシルホスファチジルイノシトールジマンノシドにより刺激した.野生型のマウスに由来する細胞はアシルホスファチジルイノシトールジマンノシドによる刺激によりMCP-1やMIP-2などのケモカインを産生したが,DCARノックアウトマウスに由来する細胞においてはこれらの産生は部分的に抑制された.この抑制はFc受容体γ鎖ノックアウトマウスに由来する細胞においても同様に認められたことから,アシルホスファチジルイノシトールジマンノシドがDCARとFc受容体γ鎖との複合体を介してケモカインの産生を誘導する可能性が示唆された.さらに,アシルホスファチジルイノシトールジマンノシドを腹腔に投与したところ,野生型のマウスにおいてはin vitroにおける結果と同様に腹腔においてMCP-1およびMIP-2のレベルが上昇したが,DCARノックアウトマウスにおいてこれらの上昇は抑制された.このことから,アシルホスファチジルイノシトールジマンノシドがin vivoにおいてDCARを介して炎症応答をひき起こす可能性が考えられた.
5.結核菌の感染においてDCARは宿主の防御応答に寄与する
実際の結核菌の感染におけるDCARの役割を解析するため感染実験を行った..結核菌に感染すると感染の局所に炎症性の単球の浸潤が認められ,これは感染に対する初期の免疫応答のひとつと考えられている8,9).ワクチン株であるM. bovis BCGを腹腔に感染させたところ,DCARノックアウトマウスにおいては野生型のマウスにおいてみられた炎症性の単球の腹腔への浸潤が減少の傾向にあった.浸潤する炎症性の単球はMCP-1の受容体であるCCR2を発現し感染の局所に集積すると考えられているが,DCARノックアウトマウスにおいては腹腔におけるMCP-1の産生も減少した.また,結核菌に対する感染防御にはCD4陽性T細胞からのインターフェロンγの産生を主体とするTh1応答が重要であることが知られている10).感染から2週間のちの野生型のマウスの腹腔においてインターフェロンγおよびインターロイキン12のレベルが上昇したが,DCARノックアウトマウスにおいてこれらの産生は減弱しており,腹腔における菌数は上昇の傾向にあった.主要な感染経路である経気道からM. bovis BCGを感染させ,感染から2週間のちに縦隔リンパ節を採取し結核菌に特有な抗原により再刺激したところ,DCARノックアウトマウスにおいてインターフェロンγの産生が減弱しており肺における菌数も上昇の傾向にあった.これらの結果から,結核菌の感染に対する宿主の感染防御にDCARが関与することが示唆された.
おわりに
この研究により,DCARが結核菌のもつホスファチジルイノシトールマンノシドを認識し免疫応答を活性化することが明らかにされた(図1).DCARはマウスの第6染色体にコードされるMincle,MCL,Dectin-2につぐ結核菌の受容体であることが明らかにされた.これらのC型レクチン受容体はFc受容体γ鎖と会合して活性化シグナルを伝達するが,それぞれ異なるリガンドを認識するだけでなく発現する細胞も異なりユニークな応答を惹起する.生体はこれら複数の結核菌の受容体を獲得することにより結核菌に対抗してきたのかもしれない.これまでのところ,ヒトのDCARのオーソログは同定されていないが,筆者らは,ヒトの末梢血の単球に由来する樹状細胞をホスファチジルイノシトールマンノシドにより刺激するとマウスの細胞と同様に活性化することを見い出しており,現在,この作用を担う分子を探索している.ホスファチジルイノシトールマンノシドは獲得免疫応答を増強する免疫賦活剤としても注目されており,さまざまな類似体が合成されその活性が研究されている.ホスファチジルイノシトールマンノシドの受容体の同定は,結核のみならずさまざまな感染症に対する効果的なワクチンの開発という観点からも有用な知見であると考えられる.
文 献
- Sancho, D. & Reis e Sousa, C.: Signaling by myeloid C-type lectin receptors in immunity and homeostasis. Annu. Rev. Immunol., 30, 491-529 (2012)[PubMed]
- Ishikawa, E., Mori, D. & Yamasaki, S.: Recognition of mycobacterial lipids by immune receptors. Trends Immunol., 38, 66-76 (2017)[PubMed]
- Gilleron, M., Ronet, C., Mempel, M. et al.: Acylation state of the phosphatidylinositol mannosides from Mycobacterium bovis bacillus Calmette Guerin and ability to induce granuloma and recruit natural killer T cells. J. Biol. Chem., 276, 34896-34904 (2001)[PubMed]
- Flornes, L. M., Bryceson, Y. T., Spurkland, A. et al.: Identification of lectin-like receptors expressed by antigen presenting cells and neutrophils and their mapping to a novel gene complex. Immunogenetics, 56, 506-517 (2004)[PubMed]
- Kanazawa, N., Tashiro, K., Inaba, K. et al.: Dendritic cell immunoactivating receptor, a novel C-type lectin immunoreceptor, acts as an activating receptor through association with Fc receptor γ chain. J. Biol. Chem., 278, 32645-32652 (2003)[PubMed]
- Ghosn, E. E., Cassado, A. A., Govoni, G. R. et al.: Two physically, functionally, and developmentally distinct peritoneal macrophage subsets. Proc. Natl. Acad. Sci. USA, 107, 2568-2573 (2010)[PubMed]
- Cain, D. W., O'Koren, E. G., Kan, M. J. et al.: Identification of a tissue-specific, C/EBPβ-dependent pathway of differentiation for murine peritoneal macrophages. J. Immunol., 191, 4665-4675 (2013)[PubMed]
- Peters, W., Scott, H. M., Chambers, H. F. et al.: Chemokine receptor 2 serves an early and essential role in resistance to Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. USA, 98, 7958-7963 (2001)[PubMed]
- Gonzalez-Juarrero, M., Shim, T. S., Kipnis, A. et al.: Dynamics of macrophage cell populations during murine pulmonary tuberculosis. J. Immunol., 171, 3128-3135 (2003)[PubMed]
- Cooper, A. M.: Cell-mediated immune responses in tuberculosis. Annu. Rev. Immunol., 27, 393-422 (2009)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 九州大学大学院医学系学府博士課程 修了,同年 九州大学生体防御医学研究所 研究員を経て,2016年より鹿児島大学大学院医歯学総合研究科 研究員.
研究テーマ:ITAM共役型受容体による病原体の認識とその意義.
関心事:抗酸菌のもつ脂質が宿主の免疫応答におよぼす影響.
山崎 晶(Sho Yamasaki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/molimm/
© 2017 豊永憲司・山崎 晶 Licensed under CC 表示 2.1 日本