概日時計はRNA編集酵素ADAR2を介してRNA編集のリズムを生み出しRNAのリズムの出力を制御する
寺嶋秀騎・吉種 光・深田吉孝
(東京大学大学院理学系研究科生物科学専攻 光計測生命学講座神経機能生化学研究室)
email:寺嶋秀騎,吉種 光,深田吉孝
DOI: 10.7875/first.author.2016.133
ADARB1 catalyzes circadian A-to-I editing and regulates RNA rhythm.
Hideki Terajima, Hikari Yoshitane, Haruka Ozaki, Yutaka Suzuki, Shigeki Shimba, Shinya Kuroda, Wataru Iwasaki, Yoshitaka Fukada
Nature Genetics, 49, 146-151 (2017)
多くの生物は概日時計とよばれる内因性の自律振動体を備えており,これが睡眠と覚醒のサイクルに代表される約24時間の周期の概日リズムを生み出す.哺乳類の概日時計においては,転写因子であるCLOCKとBMAL1のヘテロ二量体が多くの遺伝子の転写を特定の時刻に活性化して概日リズムの出力の基盤を担う.筆者らは,RNA編集酵素であるADAR2の発現がCLOCKの制御をうけてリズムを示し,多くのRNAにおいてRNA編集のリズムを生み出すことを明らかにした.さらに,ADAR2ノックアウトマウスの多くの遺伝子において発現のリズムが消失あるいは減弱しており,ADAR2が多様な遺伝子において発現のリズムを生み出す鍵分子であることが明らかにされた.一方,ADAR2ノックアウトマウスにおいては時計タンパク質CRY2が異常に蓄積し,その結果として輪回し行動のリズムおよび遺伝子発現のリズムの周期が短くなった.以上の結果から,ADAR2は概日時計の周期の決定および概日リズムの出力において重要な役割をはたすことが明らかにされた.
睡眠と覚醒のサイクルやホルモンや代謝のリズムなど,広範な生命現象が約24時間の周期で変動することが知られている.この概日リズムは生物に内在する概日時計とよばれる自律振動体により生み出される.哺乳類における概日時計の分子機構は,転写因子であるCLOCKとBMAL1のヘテロ二量体が生み出す多彩な遺伝子の転写のリズムを基盤とする.そのなかにはPERやCRYといった抑制性の転写因子が含まれており,これらがCLOCK-BMAL1ヘテロ二量体と結合してその転写の促進活性を抑制する1).筆者らはこれまで,このフィードバックループの全体像を明らかにするため,マウスの肝臓におけるChIP-Seq解析によりCLOCKの標的となる遺伝子をゲノムワイドに同定し,同時に,RNA-Seq解析により概日リズムを示すRNAを網羅的にリストアップしてきた2).このようなCLOCK-BMAL1ヘテロ二量体を起点とするフィードバックループにより生み出される転写のリズムは,これまで,概日リズムの出力の根幹であると考えられてきた.しかし,次世代シークエンサーを用いた最近の研究により,概日時計の生み出すRNAのリズムの7~8割において転写そのものに明確なリズムが検出されず,RNAのリズムの大部分は転写後制御により駆動されると報告された3,4).このような状況から,転写後制御のリズムに注目があつまったが,その実体は不明であった.
これまでに得られたCLOCKに対するChIP-Seq解析のデータおよびRNA-Seq解析のデータから,リズムの出力に重要な役割をはたしうる転写後制御の手がかりを探したところ,A-to-I RNA編集酵素であるADAR2(別名ADARB1)をコードする遺伝子の領域へのCLOCKの結合が概日リズムを示すことが見い出された.ADAR2は2本鎖RNAを認識して結合し,RNAのアデノシン(A)をイノシン(I)へと変換しA-to-I RNA編集する.イノシンは遺伝情報としてはグアノシンと読み替えられるため,コード領域におけるA-to-I RNA編集はコードされるタンパク質のアミノ酸残基の変化をひき起こし,イントロン領域においては選択的スプライシングを制御する.また,ADAR2はmiRNA前駆体と結合することによりその発現量を制御する.
レポーターアッセイにより,Adar2遺伝子の第1イントロンに存在する時計遺伝子のシス配列であるEボックスにCLOCK-BMAL1ヘテロ二量体が結合し転写が活性化されることが示された.さらに,マウスの肝臓においてAdar2遺伝子の発現はリズムを示し,時計遺伝子であるBmal1遺伝子を欠損したマウスにおいてAdar2遺伝子の発現のリズムは消失した.これらの結果から,A-to-I RNA編集の効率が概日リズムを示す可能性が推測された.
複数のA-to-I RNA編集部位におけるRNA編集の効率をSanger法による塩基配列の決定により調べた.その結果,多くのA-to-I RNA編集部位においてRNA編集の効率に概日リズムが検出され,ADAR2ノックアウトマウスにおいてそれらのRNA編集のリズムは完全に消失した.このRNA編集のリズムをより直接的に証明するため,1日のさまざまな時刻に採取したマウスの肝臓から調製した核画分の抽出液に,in vitroにおいて合成した既知のA-to-I編集部位を含むRNA断片を基質としてくわえ,一定の時間ののちA-to-I RNA編集をうけたRNAを定量した.その結果,RNA編集活性に概日リズムが検出された.一方,ADAR2ノックアウトマウスの肝臓から調製した核画分の抽出物に同じ基質をくわえてもRNA編集はまったく検出されなかったことから,ADAR2によるRNA編集活性が概日リズムを示すことが確かめられた.
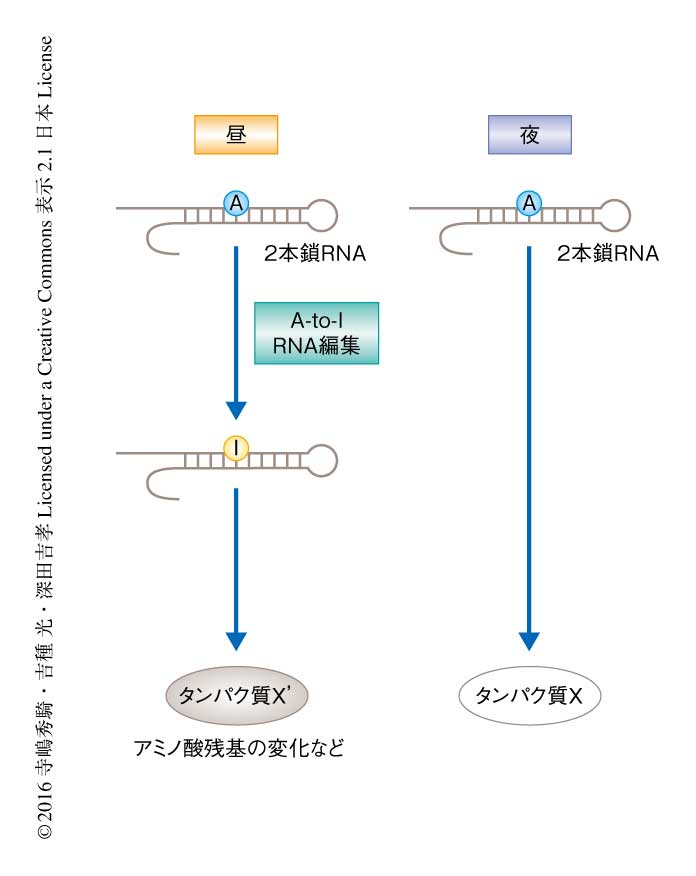
A-to-I RNA編集の効率のリズムを示すRNA編集部位を網羅的に同定するため,ADAR2ノックアウトマウスおよび対照となるマウスの肝臓から1日のさまざまな時刻にRNAを抽出した.RNA-Seq解析の結果,同定されたすべてのA-to-I RNA編集部位の34%に相当する132箇所においてRNA編集の効率に概日リズムが検出された.これらのA-to-I RNA編集部位の多くはADAR2ノックアウトマウスにおいてリズムが消失していたことから,RNA編集のリズムの大部分はADAR2に依存すると考えられた.さらに,リズムを示すA-to-I RNA編集部位のほぼすべてにおいて,RNA編集の効率は昼の時間帯に最大になった.以上の結果より,CLOCK-BMAL1ヘテロ二量体によるADAR2の発現のリズムがA-to-I RNA編集の概日リズムを生み出すことが示された(図1).
A-to-I RNA編集はRNAの発現量にも影響することが知られていた.そこで,RNA-Seq解析のデータを詳細に解析したところ,ADAR2ノックアウトマウスにおいては359種のRNAについて発現量のリズムが消失あるいは減弱していた.これらRNAのいくつかにおいては,その半減期がAdar2遺伝子の欠損により変化していた.この結果から,RNAの安定性の変化がADAR2に依存的なRNAの量の概日リズムに寄与する可能性が示唆された.
RNA-Seq解析のデータをもとにしたパスウェイ解析の結果,ADAR2ノックアウトマウスにおいて脂肪酸の分解にかかわる酵素の発現のリズムが消失していた.そこで,ADAR2ノックアウトマウスにおいて血中の遊離脂肪酸を測定したところ,対照となるマウスにおいてみられた遊離脂肪酸の概日リズムは,ADAR2ノックアウトマウスにおいては検出されなかった.さらに,ADAR2ノックアウトマウスに高脂肪食を投与したところ,対照となるマウスより顕著に体重が増加したことから,Adar2遺伝子の欠損は脂肪酸の代謝のリズムに異常をひき起こすことが示唆された.これらの結果から,多くの遺伝子において発現のリズムを生み出す転写後制御の一端をADAR2によるRNA編集が担い,ADAR2は脂肪酸の代謝のリズムに重要な役割をはたすことが明らかにされた.
ADAR2ノックアウトマウスの肝臓において時計遺伝子の発現量を解析したところ,対照となるマウスの肝臓とよく似た変動プロファイルを示した.しかし,RNA-Seq解析のデータを注意深く解析したところ,ADAR2ノックアウトマウスにおいては概日リズムを示すRNAの発現のリズムの周期は対照となるマウスよりも短いことが見い出された.この結果から,ADAR2が概日時計の周期の決定においても重要な役割をはたすことが示唆された.実際に,ADAR2ノックアウトマウスにおいて輪回し行動のリズムを測定したところ,その周期は対照となるマウスより有意に短かった.その原因を探るためADAR2ノックアウトマウスにおいて時計タンパク質の発現プロファイルを調べたところ,CRY2が異常に蓄積していた.CRY2ノックアウトマウスにおいてADAR2の有無が輪回し行動のリズムにおよぼす影響を調べたところ,Adar2遺伝子の欠損による行動のリズムの周期の短縮は観察されなくなった.このことから,ADAR2ノックアウトマウスにおける周期の短縮の原因はCRY2の異常な蓄積によると結論された.CRY2ノックアウトマウスは長周期性の輪回し行動リズムを示すという知見も5),これらの結果を支持した.
ADAR2の欠損がCRY2の異常な蓄積をひき起こすしくみについて考察した.miRNAの合成に必須のタンパク質であるDICERを欠損したマウスの解析においてCRY2の発現にmiRNAによる制御が関与することが報告されている6).また,ADAR2がmiRNAの前駆体となる2本鎖RNAと結合しその発現量を制御することもよく知られている7,8).そこで,Cry2遺伝子を標的としうるmiRNAの候補をリストアップし,そのなかからA-to-I RNA編集をうけると報告されていたlet-7 miRNAに着目した.ADAR2をノックダウンした細胞におけるCry2遺伝子の3'側非翻訳領域を用いたレポーターアッセイにより,let-7の標的配列に依存的なレポーターの発現量の上昇がみられた.つまり,ADAR2はlet-7を含むmiRNAの発現の制御を介してCRY2の翻訳を抑制することにより,概日時計の周期の制御に関与することが明らかにされた.
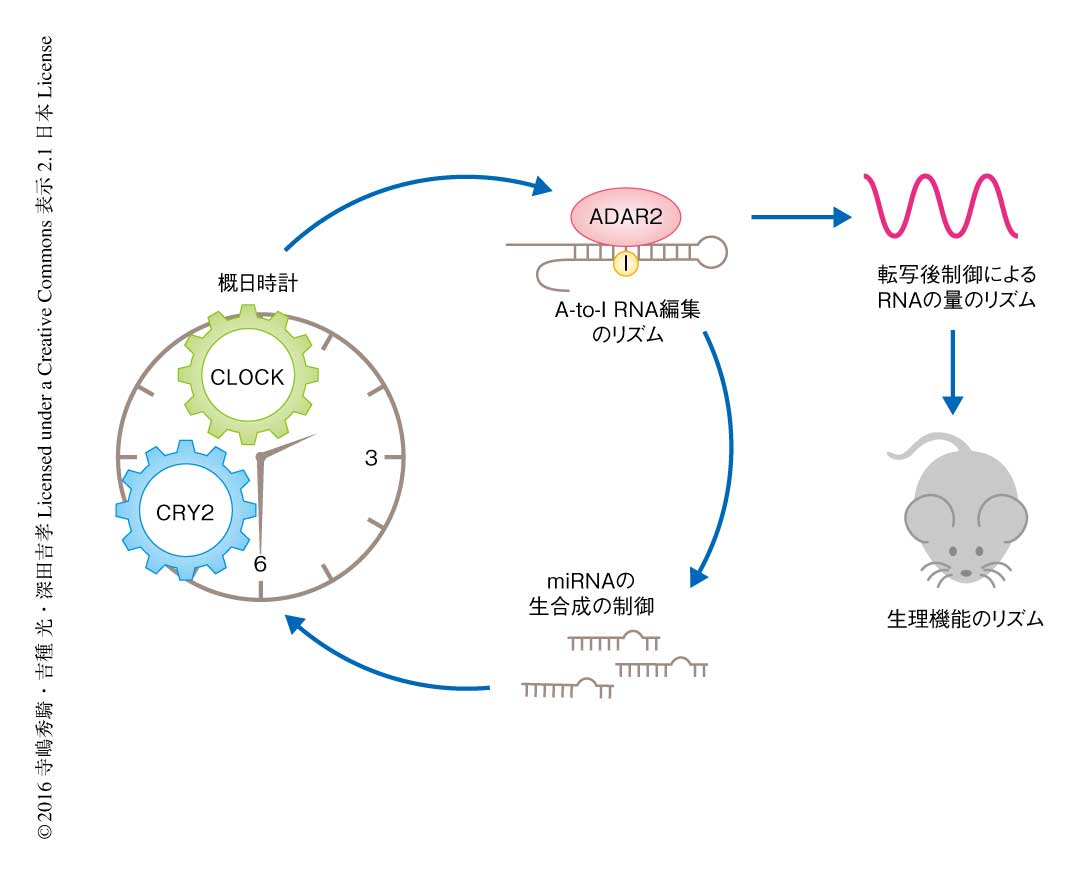
以上の結果より,ADAR2は概日時計の制御をうけてA-to-I RNA編集のリズムを制御し,概日時計の出力として多数の遺伝子において発現のリズムを生み出すのみならず,概日時計の周期の決定にも重要な役割をはたすことが明らかにされた(図2).
研究の当初,CLOCKに対するChIP-Seq解析のデータのなかにAdar2遺伝子を発見したものの,RNA編集の概日リズムについてはあまり期待していなかった.なぜなら,A-to-I RNA編集に逆反応は知られておらず,RNA編集の効率においてリズムが形成されるには修飾をうけたmRNA自体がすばやく分解されることが必要と推定されたからである.しかし,のちのRNA-Seq解析により,多くの遺伝子においてADAR2に依存的なRNA編集の効率のリズムが検出され,非常に興奮した.今後,RNA編集の効率の変化について議論する際には概日時計の影響も考慮に入れる必要があることがわかったため,この研究は,RNA修飾の研究においても大きなインパクトをもつと思われる.また,この研究のように,概日時計の研究領域とほかのさまざまな研究領域との異分野融合が,概日リズムを示す生命現象の新たな発見につながるのではないかと考えている.
夜更かしやシフトワークなどがひき起こす概日時計の乱れは,がん,睡眠障害,肥満などを誘発することがよく知られており,リズムの出力の詳細な機構の理解は多くの疾患の克服に貢献しうる.また,肝細胞がんにおいてADAR2の発現の異常およびRNA編集の効率の異常が報告されていることなどからも,概日時計とA-to-I RNA編集の相互の連関を示したこの研究の成果は,疾病の治療の糸口ともなりうると期待している.
略歴:2015年 東京大学大学院理学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:概日時計と転写後制御との機能的な連関.
抱負:分子機構から表現型まで,きれいにつながるような研究がしたい.
吉種 光(Hikari Yoshitane)
東京大学大学院理学系研究科 助教.
深田 吉孝(Yoshitaka Fukada)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biochem.s.u-tokyo.ac.jp/fukada-lab/
© 2016 寺嶋秀騎・吉種 光・深田吉孝 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科生物科学専攻 光計測生命学講座神経機能生化学研究室)
email:寺嶋秀騎,吉種 光,深田吉孝
DOI: 10.7875/first.author.2016.133
ADARB1 catalyzes circadian A-to-I editing and regulates RNA rhythm.
Hideki Terajima, Hikari Yoshitane, Haruka Ozaki, Yutaka Suzuki, Shigeki Shimba, Shinya Kuroda, Wataru Iwasaki, Yoshitaka Fukada
Nature Genetics, 49, 146-151 (2017)
要 約
多くの生物は概日時計とよばれる内因性の自律振動体を備えており,これが睡眠と覚醒のサイクルに代表される約24時間の周期の概日リズムを生み出す.哺乳類の概日時計においては,転写因子であるCLOCKとBMAL1のヘテロ二量体が多くの遺伝子の転写を特定の時刻に活性化して概日リズムの出力の基盤を担う.筆者らは,RNA編集酵素であるADAR2の発現がCLOCKの制御をうけてリズムを示し,多くのRNAにおいてRNA編集のリズムを生み出すことを明らかにした.さらに,ADAR2ノックアウトマウスの多くの遺伝子において発現のリズムが消失あるいは減弱しており,ADAR2が多様な遺伝子において発現のリズムを生み出す鍵分子であることが明らかにされた.一方,ADAR2ノックアウトマウスにおいては時計タンパク質CRY2が異常に蓄積し,その結果として輪回し行動のリズムおよび遺伝子発現のリズムの周期が短くなった.以上の結果から,ADAR2は概日時計の周期の決定および概日リズムの出力において重要な役割をはたすことが明らかにされた.
はじめに
睡眠と覚醒のサイクルやホルモンや代謝のリズムなど,広範な生命現象が約24時間の周期で変動することが知られている.この概日リズムは生物に内在する概日時計とよばれる自律振動体により生み出される.哺乳類における概日時計の分子機構は,転写因子であるCLOCKとBMAL1のヘテロ二量体が生み出す多彩な遺伝子の転写のリズムを基盤とする.そのなかにはPERやCRYといった抑制性の転写因子が含まれており,これらがCLOCK-BMAL1ヘテロ二量体と結合してその転写の促進活性を抑制する1).筆者らはこれまで,このフィードバックループの全体像を明らかにするため,マウスの肝臓におけるChIP-Seq解析によりCLOCKの標的となる遺伝子をゲノムワイドに同定し,同時に,RNA-Seq解析により概日リズムを示すRNAを網羅的にリストアップしてきた2).このようなCLOCK-BMAL1ヘテロ二量体を起点とするフィードバックループにより生み出される転写のリズムは,これまで,概日リズムの出力の根幹であると考えられてきた.しかし,次世代シークエンサーを用いた最近の研究により,概日時計の生み出すRNAのリズムの7~8割において転写そのものに明確なリズムが検出されず,RNAのリズムの大部分は転写後制御により駆動されると報告された3,4).このような状況から,転写後制御のリズムに注目があつまったが,その実体は不明であった.
1.CLOCK-BMAL1ヘテロ二量体によるADAR2の発現のリズムに対する制御
これまでに得られたCLOCKに対するChIP-Seq解析のデータおよびRNA-Seq解析のデータから,リズムの出力に重要な役割をはたしうる転写後制御の手がかりを探したところ,A-to-I RNA編集酵素であるADAR2(別名ADARB1)をコードする遺伝子の領域へのCLOCKの結合が概日リズムを示すことが見い出された.ADAR2は2本鎖RNAを認識して結合し,RNAのアデノシン(A)をイノシン(I)へと変換しA-to-I RNA編集する.イノシンは遺伝情報としてはグアノシンと読み替えられるため,コード領域におけるA-to-I RNA編集はコードされるタンパク質のアミノ酸残基の変化をひき起こし,イントロン領域においては選択的スプライシングを制御する.また,ADAR2はmiRNA前駆体と結合することによりその発現量を制御する.
レポーターアッセイにより,Adar2遺伝子の第1イントロンに存在する時計遺伝子のシス配列であるEボックスにCLOCK-BMAL1ヘテロ二量体が結合し転写が活性化されることが示された.さらに,マウスの肝臓においてAdar2遺伝子の発現はリズムを示し,時計遺伝子であるBmal1遺伝子を欠損したマウスにおいてAdar2遺伝子の発現のリズムは消失した.これらの結果から,A-to-I RNA編集の効率が概日リズムを示す可能性が推測された.
2.A-to-I RNA編集の効率のリズムを示すRNA編集部位の網羅的な同定
複数のA-to-I RNA編集部位におけるRNA編集の効率をSanger法による塩基配列の決定により調べた.その結果,多くのA-to-I RNA編集部位においてRNA編集の効率に概日リズムが検出され,ADAR2ノックアウトマウスにおいてそれらのRNA編集のリズムは完全に消失した.このRNA編集のリズムをより直接的に証明するため,1日のさまざまな時刻に採取したマウスの肝臓から調製した核画分の抽出液に,in vitroにおいて合成した既知のA-to-I編集部位を含むRNA断片を基質としてくわえ,一定の時間ののちA-to-I RNA編集をうけたRNAを定量した.その結果,RNA編集活性に概日リズムが検出された.一方,ADAR2ノックアウトマウスの肝臓から調製した核画分の抽出物に同じ基質をくわえてもRNA編集はまったく検出されなかったことから,ADAR2によるRNA編集活性が概日リズムを示すことが確かめられた.
A-to-I RNA編集の効率のリズムを示すRNA編集部位を網羅的に同定するため,ADAR2ノックアウトマウスおよび対照となるマウスの肝臓から1日のさまざまな時刻にRNAを抽出した.RNA-Seq解析の結果,同定されたすべてのA-to-I RNA編集部位の34%に相当する132箇所においてRNA編集の効率に概日リズムが検出された.これらのA-to-I RNA編集部位の多くはADAR2ノックアウトマウスにおいてリズムが消失していたことから,RNA編集のリズムの大部分はADAR2に依存すると考えられた.さらに,リズムを示すA-to-I RNA編集部位のほぼすべてにおいて,RNA編集の効率は昼の時間帯に最大になった.以上の結果より,CLOCK-BMAL1ヘテロ二量体によるADAR2の発現のリズムがA-to-I RNA編集の概日リズムを生み出すことが示された(図1).
3.ADAR2に依存的な概日リズムの出力
A-to-I RNA編集はRNAの発現量にも影響することが知られていた.そこで,RNA-Seq解析のデータを詳細に解析したところ,ADAR2ノックアウトマウスにおいては359種のRNAについて発現量のリズムが消失あるいは減弱していた.これらRNAのいくつかにおいては,その半減期がAdar2遺伝子の欠損により変化していた.この結果から,RNAの安定性の変化がADAR2に依存的なRNAの量の概日リズムに寄与する可能性が示唆された.
RNA-Seq解析のデータをもとにしたパスウェイ解析の結果,ADAR2ノックアウトマウスにおいて脂肪酸の分解にかかわる酵素の発現のリズムが消失していた.そこで,ADAR2ノックアウトマウスにおいて血中の遊離脂肪酸を測定したところ,対照となるマウスにおいてみられた遊離脂肪酸の概日リズムは,ADAR2ノックアウトマウスにおいては検出されなかった.さらに,ADAR2ノックアウトマウスに高脂肪食を投与したところ,対照となるマウスより顕著に体重が増加したことから,Adar2遺伝子の欠損は脂肪酸の代謝のリズムに異常をひき起こすことが示唆された.これらの結果から,多くの遺伝子において発現のリズムを生み出す転写後制御の一端をADAR2によるRNA編集が担い,ADAR2は脂肪酸の代謝のリズムに重要な役割をはたすことが明らかにされた.
4.概日時計の周期の決定におけるADAR2の役割
ADAR2ノックアウトマウスの肝臓において時計遺伝子の発現量を解析したところ,対照となるマウスの肝臓とよく似た変動プロファイルを示した.しかし,RNA-Seq解析のデータを注意深く解析したところ,ADAR2ノックアウトマウスにおいては概日リズムを示すRNAの発現のリズムの周期は対照となるマウスよりも短いことが見い出された.この結果から,ADAR2が概日時計の周期の決定においても重要な役割をはたすことが示唆された.実際に,ADAR2ノックアウトマウスにおいて輪回し行動のリズムを測定したところ,その周期は対照となるマウスより有意に短かった.その原因を探るためADAR2ノックアウトマウスにおいて時計タンパク質の発現プロファイルを調べたところ,CRY2が異常に蓄積していた.CRY2ノックアウトマウスにおいてADAR2の有無が輪回し行動のリズムにおよぼす影響を調べたところ,Adar2遺伝子の欠損による行動のリズムの周期の短縮は観察されなくなった.このことから,ADAR2ノックアウトマウスにおける周期の短縮の原因はCRY2の異常な蓄積によると結論された.CRY2ノックアウトマウスは長周期性の輪回し行動リズムを示すという知見も5),これらの結果を支持した.
ADAR2の欠損がCRY2の異常な蓄積をひき起こすしくみについて考察した.miRNAの合成に必須のタンパク質であるDICERを欠損したマウスの解析においてCRY2の発現にmiRNAによる制御が関与することが報告されている6).また,ADAR2がmiRNAの前駆体となる2本鎖RNAと結合しその発現量を制御することもよく知られている7,8).そこで,Cry2遺伝子を標的としうるmiRNAの候補をリストアップし,そのなかからA-to-I RNA編集をうけると報告されていたlet-7 miRNAに着目した.ADAR2をノックダウンした細胞におけるCry2遺伝子の3'側非翻訳領域を用いたレポーターアッセイにより,let-7の標的配列に依存的なレポーターの発現量の上昇がみられた.つまり,ADAR2はlet-7を含むmiRNAの発現の制御を介してCRY2の翻訳を抑制することにより,概日時計の周期の制御に関与することが明らかにされた.
以上の結果より,ADAR2は概日時計の制御をうけてA-to-I RNA編集のリズムを制御し,概日時計の出力として多数の遺伝子において発現のリズムを生み出すのみならず,概日時計の周期の決定にも重要な役割をはたすことが明らかにされた(図2).
おわりに
研究の当初,CLOCKに対するChIP-Seq解析のデータのなかにAdar2遺伝子を発見したものの,RNA編集の概日リズムについてはあまり期待していなかった.なぜなら,A-to-I RNA編集に逆反応は知られておらず,RNA編集の効率においてリズムが形成されるには修飾をうけたmRNA自体がすばやく分解されることが必要と推定されたからである.しかし,のちのRNA-Seq解析により,多くの遺伝子においてADAR2に依存的なRNA編集の効率のリズムが検出され,非常に興奮した.今後,RNA編集の効率の変化について議論する際には概日時計の影響も考慮に入れる必要があることがわかったため,この研究は,RNA修飾の研究においても大きなインパクトをもつと思われる.また,この研究のように,概日時計の研究領域とほかのさまざまな研究領域との異分野融合が,概日リズムを示す生命現象の新たな発見につながるのではないかと考えている.
夜更かしやシフトワークなどがひき起こす概日時計の乱れは,がん,睡眠障害,肥満などを誘発することがよく知られており,リズムの出力の詳細な機構の理解は多くの疾患の克服に貢献しうる.また,肝細胞がんにおいてADAR2の発現の異常およびRNA編集の効率の異常が報告されていることなどからも,概日時計とA-to-I RNA編集の相互の連関を示したこの研究の成果は,疾病の治療の糸口ともなりうると期待している.
文 献
- Dunlap, J. C.: Molecular bases for circadian clocks. Cell, 96, 271-290 (1999)[PubMed]
- Yoshitane, H., Ozaki, H., Terajima, H. et al.: CLOCK-controlled polyphonic regulation of circadian rhythms through canonical and noncanonical E-boxes. Mol. Cell. Biol., 34, 1776-1787 (2014)[PubMed]
- Koike, N., Yoo, S. -H., Huang, H. -C. et al.: Transcriptional architecture and chromatin landscape of the core circadian clock in mammals. Science, 338, 349-354 (2012)[PubMed]
- Menet, J. S., Rodriguez, J., Abruzzi, K. C. et al.: Nascent-Seq reveals novel features of mouse circadian transcriptional regulation. ELife, 1, e00011 (2012)[PubMed]
- Thresher, R. J., Vitaterna, M. H., Miyamoto, Y. et al.: Role of mouse cryptochrome blue-light photoreceptor in circadian photoresponses. Science, 282, 1490-1494 (1998)[PubMed]
- Du, N. -H., Arpat, A. B., De Matos, M. et al.: MicroRNAs shape circadian hepatic gene expression on a transcriptome-wide scale. ELife, 3, e02510 (2014)[PubMed]
- Nishikura, K.: Editor meets silencer: crosstalk between RNA editing and RNA interference. Nat. Rev. Mol. Cell Biol., 7, 919-931 (2006)[PubMed]
- Vesely, C., Tauber, S., Sedlazeck, F. J. et al.: Adenosine deaminases that act on RNA induce reproducible changes in abundance and sequence of embryonic miRNAs. Genome Res., 22, 1468-1476 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 東京大学大学院理学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:概日時計と転写後制御との機能的な連関.
抱負:分子機構から表現型まで,きれいにつながるような研究がしたい.
吉種 光(Hikari Yoshitane)
東京大学大学院理学系研究科 助教.
深田 吉孝(Yoshitaka Fukada)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biochem.s.u-tokyo.ac.jp/fukada-lab/
© 2016 寺嶋秀騎・吉種 光・深田吉孝 Licensed under CC 表示 2.1 日本