肝臓におけるトランスクリプトームの解析およびリゾホスファチジン酸経路の阻害による肝がんの発生の予防
中川茂樹・星田有人
(米国Icahn School of Medicine at Mount Sinai,Division of Liver Diseases)
email:星田有人
DOI: 10.7875/first.author.2016.131
Molecular liver cancer prevention in cirrhosis by organ transcriptome analysis and lysophosphatidic acid pathway inhibition.
Shigeki Nakagawa, Lan Wei, Won Min Song, Takaaki Higashi, Sarani Ghoshal, Rosa S. Kim, C. Billie Bian, Suguru Yamada, Xiaochen Sun, Anu Venkatesh, Nicolas Goossens, Gretchen Bain, Gregory Y. Lauwers, Anna P. Koh, Mohamed El-Abtah, Noor B. Ahmad, Hiroki Hoshida, Derek J. Erstad, Ganesh Gunasekaran, Youngmin Lee, Ming-Lung Yu, Wan-Long Chuang, Chia-Yen Dai, Masahiro Kobayashi, Hiromitsu Kumada, Toru Beppu, Hideo Baba, Milind Mahajan, Venugopalan D. Nair, Michael Lanuti, Augusto Villanueva, Angelo Sangiovanni, Massimo Iavarone, Massimo Colombo, Josep M. Llovet, Aravind Subramanian, Andrew M. Tager, Scott L. Friedman, Thomas F. Baumert, Myron E. Schwarz, Raymond T. Chung, Kenneth K. Tanabe, Bin Zhang, Bryan C. Fuchs, Yujin Hoshida
Cancer Cell, 30, 879-890 (2016)
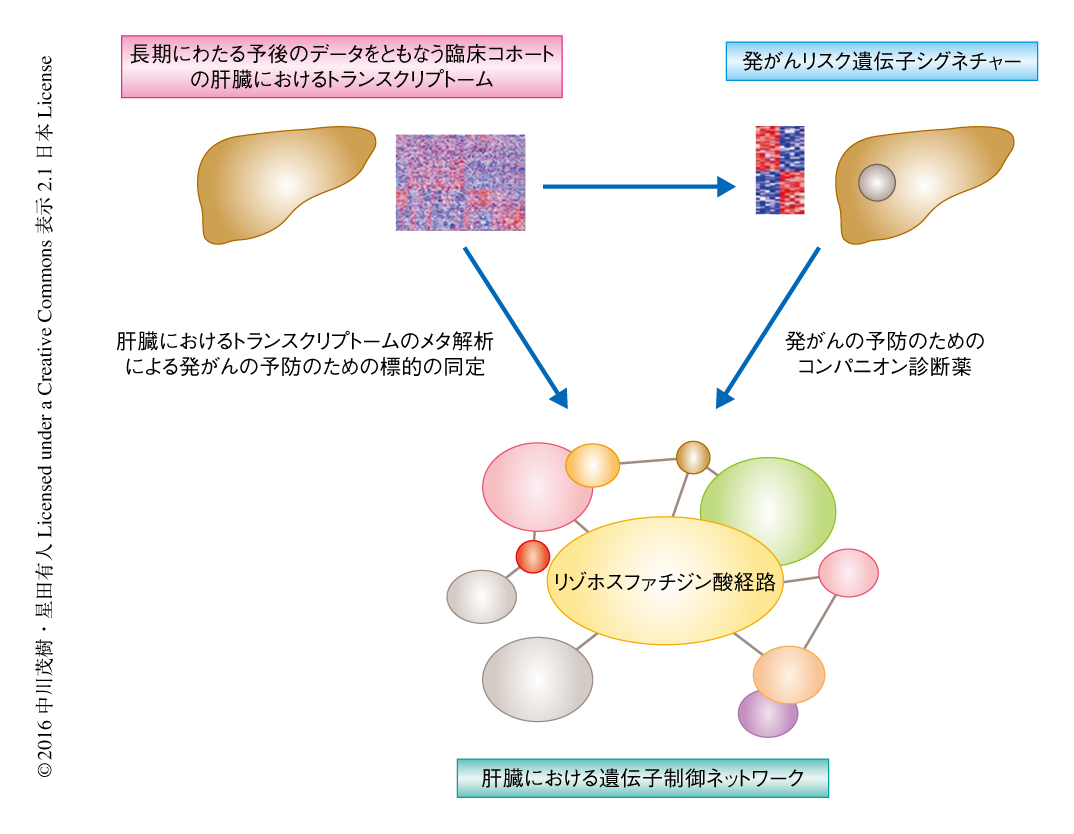
肝硬変は肝がんの発生の母地になることが知られているが,肝がんの発生リスクの予測およびその予防はいまだ困難である.この研究において,筆者らは,B型肝炎,C型肝炎,アルコール性肝炎,脂肪肝による肝がんの予測に用いることのできる肝がんリスク遺伝子シグネチャーを確立した.また,500例以上の肝硬変の症例における遺伝子発現プロファイルをメタ解析することにより,肝がんのリスクに関与する遺伝子制御ネットワークおよび肝がんの予防において新たな標的になるリゾホスファチジン酸経路が同定された.薬剤によるリゾホスファチジン酸経路の阻害は動物モデルにおいて肝がんの発生を減少させ肝がんリスク遺伝子シグネチャーを改善させた.肝がんリスク遺伝子シグネチャーの改善はヒトの線維化をともなう肝臓の組織の体外培養においても確認された.これらの結果から,臨床から得られた組織の遺伝子発現プロファイルからのリバースエンジニアリングにより個別化された発がんの予防が可能であることが示された.
脳血管の障害による死は予防により劇的に改善されたが,がんの予防はいまだ困難である.動物モデルにおいて同定された発がんの機序のヒトにおける検証は,ほとんどのケースにおいて現実的には不可能である1).筆者らは,これらの問題を解決するため,長期にわたる肝がんのリスクに確実に関与する遺伝子を同定し,これを動物モデルにおいて検証するリバースエンジニアリングによりがんの予防のための標的を発見する手法を確立した.肝硬変は慢性炎症および線維化をともなう肝臓の疾患の最終段階であり,肝がんの発生の強力な母地であって,年発がん率は8%に及ぶ.肝がん結節を完全に切除しても遺残する肝臓に残る肝硬変のため,手術後の再発率は5年で70%にも及ぶ.結果として,5年生存率はいまだ15%にみたない.これらの知見から,肝硬変の組織は発がんの予防のための生体マーカーや治療の標的を発見するための情報源になることが示唆される1).しかし,B型肝炎,C型肝炎,アルコール性肝炎,脂肪肝といった病因の違いが広く適応の可能な肝がんリスクマーカーの同定を困難にしている.
筆者らは,リバースエンジニアリング法の最初のステップとして,186遺伝子からなる肝がんリスク遺伝子シグネチャーを同定し,アジア,ヨーロッパ,米国の複数の患者コホートにおいて検証した2-4).この肝がんリスク遺伝子シグネチャーは米国Food and Drug Administrationにより認可されたEGF受容体の低分子阻害剤であるerlotinibの動物モデルにおける肝がんの予防効果のモニタリングにおいて使用された5).この研究をもとに臨床試験が開始されたが,肝がんリスク遺伝子シグネチャーはおもにC型肝炎の症例においてのみ検証されており,erlotinibのもつ毒性はがん予防薬として適切でない可能性がある.この研究においては,肝がんリスク遺伝子シグネチャーをC型肝炎のほかの病因においても検証した.
肝がんリスク遺伝子シグネチャーがより臨床に適用しやすくなるように,遺伝子の数を32に減らしたうえで診断検査プラットフォームに実装し,263例のB型肝炎,C型肝炎,アルコール性肝炎,脂肪肝による肝がんの治癒切除症例の新たな独立コホートにおいて検証した(図1).肝がんリスク遺伝子シグネチャーにより57例(22%),148例(56%),58例(22%)がそれぞれ高リスク群,中リスク群,低リスク群に分類され,新規の再発および全死亡と有意に相関した.遺伝子シグネチャーの予後との相関はおのおのの病因および病期においても有意であった.最近の疫学研究により示されているように,このコホートの脂肪肝の症例においても肝硬変の頻度は低かったが,ほかの病因,とくにB型肝炎に比べ,肝がんリスク遺伝子シグネチャーはより高リスクのパターンを示した.
新たな抗C型肝炎ウイルス薬によりウイルスの除去率は高くなったが,発がんのリスクはそののち10年以上もつづくことが疫学研究により示されている1).この肝がんの治癒切除コホートにおける67例のC型肝炎の症例のうち4例はC型肝炎ウイルスを除去したのちの発がんであったが,肝がんリスク遺伝子シグネチャーはいずれも低リスクのパターンを示した.34例の発がんしていないC型肝炎の症例についてC型肝炎ウイルスの除去の前後の肝臓の生検組織において肝がんリスク遺伝子シグネチャーを検証したところ,より改善度の高い症例において発がんは認められなかったが,改善度の低い症例においてはC型肝炎ウイルスが除去されたのちにも肝がんが発生していた.これらの結果から,肝がんリスク遺伝子シグネチャーによりC型肝炎ウイルスを除去したのちの発がんの予測が可能であることが示唆された.
病因によらない肝がんの予防のための標的を探索した.523例の肝臓における遺伝子発現プロファイルのメタ解析により,31の遺伝子制御モジュールが同定され,おのおののモジュールにおける既知の肝炎症,線維化,発がんに関与する分子経路の関与が確認された.おのおのの遺伝子制御モジュールの活性化あるいは非活性化のパターンにより,臨床コホートにおいて肝臓における分子経路の異常をさまざまな動物実験モデルと比較することができた.肝硬変による肝がんの発生のモデルである低用量のジメチルニトロソアミンを頻回投与したラットは,ほかのいくつかのモデルとともに,臨床コホートに類似した遺伝子制御モジュールの活性化のパターンを示した.
臨床コホートにおいて肝臓における遺伝子制御ネットワークの中心に位置する第8モジュールは長期の発がんのリスクに関与する唯一のモジュールであり,そのなかにはすでに肝がんの発生への関与の知られている複数の遺伝子が含まれた.このモジュールを制御する遺伝子を同定するため,米国NIHのLibrary of Integrated Cellular Signaturesプロジェクトにおいて得られた5272遺伝子のノックダウンシグネチャーと統合して解析したところ,AKT1遺伝子,SLC35A1遺伝子,DDX42遺伝子,LPAR1遺伝子,ILK遺伝子が上位の遺伝子として同定された.現在,Akt-mTOR経路の阻害剤であるeverolimusやsirolimusは肝臓を移植したのちの肝がんの再発の予防薬の候補として臨床試験されている.そのほか,LPAR1遺伝子は唯一,臨床開発されている薬剤により阻害が可能であった.LPAR1遺伝子のコードするリゾホスファチジン酸受容体はGタンパク質共役受容体のファミリーのひとつであり,LPAR1遺伝子は複数の臓器において線維化に関与することが知られており,肝星細胞において結合組織増殖因子などの発現を誘導する.肝臓においては,オートタキシンがリゾホスファチジルコリンをリゾホスファチジン酸受容体のリガンドとなるリゾホスファチジン酸に変換する.肝がんもしくは高度に肝線維化したC型肝炎の症例において血清中のオートタキシンの濃度の高いことが知られている.リゾホスファチジン酸経路の下流として,RhoA経路,Ras-MAPK-ERK-MEK経路,Akt-PI3K経路,ホスホリパーゼC経路が知られている6).この臨床コホートにおいて,RhoA経路の標的であるNCAPH遺伝子,K-Ras経路の標的であるPRKG2遺伝子,H-Ras経路の標的であるSERPINB2遺伝子,MEK経路の標的であるGPX2遺伝子の発現が,肝がんリスク遺伝子シグネチャーの発現パターンと相関して増加していた.同様に,米国NIHのLibrary of Integrated Cellular Signaturesプロジェクトにより得られた低分子化合物のデータの探索において,Rhoキナーゼ経路,Akt-mTOR-PI3K経路,MAPK-ERK-MEK経路の阻害剤が同定され,リゾホスファチジン酸経路の関与およびリゾホスファチジン酸経路は肝がんの発生の予防のための標的として可能性のあることが強く示唆された.
選択的なオートタキシンの阻害剤AM063およびLPAR1の阻害剤AM095によりリゾホスファチジン酸経路の阻害を試みた.また,Rho経路の関与について評価するため,ROCKの阻害剤であるFasudilおよびY-27632を用いた.肝臓の線維化が促進されている肝星細胞株において,これらの薬剤はRhoAの標的タンパク質であるミオシン制御軽鎖のリゾホスファチジン酸によるリン酸化を阻害したことから,RhoA経路がリゾホスファチジン酸経路の下流であることが示された.ERKのリン酸化の阻害はリゾホスファチジン酸経路の阻害剤においてのみ認められた.Akt経路の阻害は認められず,肝星細胞においてAkt経路はリゾホスファチジン酸経路の下流ではないことが示された.以上の結果から,リゾホスファチジン酸経路は肝臓においてAkt経路とは独立した,肝がんの発生の予防のための標的であることが示唆された.TGFβは肝臓の線維化を促進する主要なタンパク質であり,結合組織増殖因子の上流にあることが知られている.TGFβの中和抗体はリゾホスファチジン酸経路の下流の経路には影響をおよぼさなかった.結合組織増殖因子をコードするCTGF遺伝子のリゾホスファチジン酸経路の活性化による発現の増強は,LPAR1阻害剤およびROCK阻害剤により阻害されたがTGFβの中和抗体には影響されず,リゾホスファチジン酸経路とTGFβ経路は独立した経路であると考えられた.shRNAによるLPAR1あるいはRhoAのノックダウンは,同様にリゾホスファチジン酸経路に依存的なCTGF遺伝子の発現を抑制した.
肝硬変に依存性の肝がんの発生のモデルである低用量のジメチルニトロソアミンを頻回投与したラットにおいて,血清中のオートタキシンの濃度および肝臓におけるLpar1遺伝子の発現は肝臓の線維化の進展とともに徐々に上昇した.Ctgf遺伝子およびLpar1遺伝子の発現はおもに肝星細胞において,Atx遺伝子の発現はおもに肝細胞において認められ,これらの細胞のあいだのクロストークの存在が示唆された.10週間のオートタキシン阻害剤およびLPAR1阻害剤による治療は,肝臓におけるCtgf遺伝子の発現および肝星細胞に発現する細胞外マトリックスをコードするCol1a1遺伝子およびActa2遺伝子の発現を抑制した.肝臓の線維化は改善し,肝がん結節の数も有意に減少した.RNA-Seq法による肝臓におけるトランスクリプトームの解析により,肝がんリスク遺伝子シグネチャーおよび肝臓における遺伝子制御ネットワークの中心に位置する第8モジュールを含む肝臓における遺伝子制御ネットワークの異常の改善が確認された.肝星細胞における結果と同様に,RhoA経路およびERK経路の抑制,また,Akt経路およびTGFβ経路の無関与が確認された.血清中のビリルビンの濃度の上昇など肝臓への毒性を示唆する所見は認められなかった.
ヒトの肝臓の組織においてリゾホスファチジン酸経路の阻害による肝がんリスク遺伝子シグネチャーの改善を検証した.13例の肝疾患をともなう肝臓の組織(男性7例,女性6例.B型肝炎5例,C型肝炎3例,脂肪肝炎1例,病因不明4例)をLPAR1阻害剤とともに48時間にわたり体外培養し,肝がんリスク遺伝子シグネチャーの変化を測定した.培養まえの肝がんリスク遺伝子シグネチャーの高リスクのパターンおよびより軽度な肝臓の線維化は,より強い肝がんリスク遺伝子シグネチャーの改善と相関した.おのおのの遺伝子のレベルにおいては,増殖因子,細胞外マトリックス,細胞接着および線維化を促進するサイトカイン,酸化ストレス,血漿タンパク質の遺伝子について発現の抑制が認められた.同時に,肝星細胞シグネチャー7) の改善も認められた.これらの結果から,遺伝子シグネチャーあるいは血中においてその代理となるバイオマーカーは,肝がんの発生の予防におけるコンパニオン診断薬として有用であると考えられた.事実,肝がんの発生の予防についての臨床試験に必要な症例数の計算により,肝がんの発がんリスクバイオマーカーの使用により,100~200例の症例数および1~2年の観察期間で十分であることが明らかにされた.
がんの予防はいまだ困難である1).通常,ヒトにおける発がんの過程すべてを動物モデルにおいて再現し薬効を評価するのは不可能である.また,従来,がん予防薬の臨床試験には膨大な症例数と長期の観察期間が必要であった.発がんリスクバイオマーカーにより高リスクの症例を事前に選びだすことが可能になれば,必要となる症例数の低減や観察期間の短縮により臨床試験がより容易になることが期待される.筆者らの開発した病因によらない肝がんリスク遺伝子シグネチャーは,肝がんの発生の予防についての臨床試験において幅広く利用できると考えられる.
この研究において明らかにされた肝臓における遺伝子制御ネットワークは,臨床的に関連があり標的となる分子の評価に適した実験モデルの迅速な同定に有用であると考えられる.リゾホスファチジン酸経路は肝臓における遺伝子ネットワークの中心に位置し,肝がんの発生の予防の標的のひとつとして同定され,薬剤による阻害が可能であった.TGFβ経路の阻害による毒性の懸念のない発がんの予防が可能になると期待される.
今回,筆者らが用いた,長期のにわたる予後のデータをともなう臨床から得られた臓器におけるトランスクリプトームの解析による,発がんの予防のための標的と発がんリスクバイオマーカーの同時探索は,慢性炎症や線維化を発がんの母地とするほかの臓器のがんにも応用でき,リバースエンジニアリングによる個別化された発がんの予防という新たなパラダイムを生み出すものと期待される.
略歴:2014年 熊本大学大学院医学教育部博士課程 修了,同年 米国Icahn School of Medicine at Mount Sinai研究員を経て,2016年より熊本大学大学院生命科学研究部 特任助教.
研究テーマ:肝胆膵領域の悪性腫瘍の分子病態の解明および治療法の開発.
星田 有人(Yujin Hoshida)
米国Icahn School of Medicine at Mount Sinai准教授
研究室URL:http://www.hoshida-lab.org/
© 2016 中川茂樹・星田有人 Licensed under CC 表示 2.1 日本
(米国Icahn School of Medicine at Mount Sinai,Division of Liver Diseases)
email:星田有人
DOI: 10.7875/first.author.2016.131
Molecular liver cancer prevention in cirrhosis by organ transcriptome analysis and lysophosphatidic acid pathway inhibition.
Shigeki Nakagawa, Lan Wei, Won Min Song, Takaaki Higashi, Sarani Ghoshal, Rosa S. Kim, C. Billie Bian, Suguru Yamada, Xiaochen Sun, Anu Venkatesh, Nicolas Goossens, Gretchen Bain, Gregory Y. Lauwers, Anna P. Koh, Mohamed El-Abtah, Noor B. Ahmad, Hiroki Hoshida, Derek J. Erstad, Ganesh Gunasekaran, Youngmin Lee, Ming-Lung Yu, Wan-Long Chuang, Chia-Yen Dai, Masahiro Kobayashi, Hiromitsu Kumada, Toru Beppu, Hideo Baba, Milind Mahajan, Venugopalan D. Nair, Michael Lanuti, Augusto Villanueva, Angelo Sangiovanni, Massimo Iavarone, Massimo Colombo, Josep M. Llovet, Aravind Subramanian, Andrew M. Tager, Scott L. Friedman, Thomas F. Baumert, Myron E. Schwarz, Raymond T. Chung, Kenneth K. Tanabe, Bin Zhang, Bryan C. Fuchs, Yujin Hoshida
Cancer Cell, 30, 879-890 (2016)
要 約
肝硬変は肝がんの発生の母地になることが知られているが,肝がんの発生リスクの予測およびその予防はいまだ困難である.この研究において,筆者らは,B型肝炎,C型肝炎,アルコール性肝炎,脂肪肝による肝がんの予測に用いることのできる肝がんリスク遺伝子シグネチャーを確立した.また,500例以上の肝硬変の症例における遺伝子発現プロファイルをメタ解析することにより,肝がんのリスクに関与する遺伝子制御ネットワークおよび肝がんの予防において新たな標的になるリゾホスファチジン酸経路が同定された.薬剤によるリゾホスファチジン酸経路の阻害は動物モデルにおいて肝がんの発生を減少させ肝がんリスク遺伝子シグネチャーを改善させた.肝がんリスク遺伝子シグネチャーの改善はヒトの線維化をともなう肝臓の組織の体外培養においても確認された.これらの結果から,臨床から得られた組織の遺伝子発現プロファイルからのリバースエンジニアリングにより個別化された発がんの予防が可能であることが示された.
はじめに
脳血管の障害による死は予防により劇的に改善されたが,がんの予防はいまだ困難である.動物モデルにおいて同定された発がんの機序のヒトにおける検証は,ほとんどのケースにおいて現実的には不可能である1).筆者らは,これらの問題を解決するため,長期にわたる肝がんのリスクに確実に関与する遺伝子を同定し,これを動物モデルにおいて検証するリバースエンジニアリングによりがんの予防のための標的を発見する手法を確立した.肝硬変は慢性炎症および線維化をともなう肝臓の疾患の最終段階であり,肝がんの発生の強力な母地であって,年発がん率は8%に及ぶ.肝がん結節を完全に切除しても遺残する肝臓に残る肝硬変のため,手術後の再発率は5年で70%にも及ぶ.結果として,5年生存率はいまだ15%にみたない.これらの知見から,肝硬変の組織は発がんの予防のための生体マーカーや治療の標的を発見するための情報源になることが示唆される1).しかし,B型肝炎,C型肝炎,アルコール性肝炎,脂肪肝といった病因の違いが広く適応の可能な肝がんリスクマーカーの同定を困難にしている.
筆者らは,リバースエンジニアリング法の最初のステップとして,186遺伝子からなる肝がんリスク遺伝子シグネチャーを同定し,アジア,ヨーロッパ,米国の複数の患者コホートにおいて検証した2-4).この肝がんリスク遺伝子シグネチャーは米国Food and Drug Administrationにより認可されたEGF受容体の低分子阻害剤であるerlotinibの動物モデルにおける肝がんの予防効果のモニタリングにおいて使用された5).この研究をもとに臨床試験が開始されたが,肝がんリスク遺伝子シグネチャーはおもにC型肝炎の症例においてのみ検証されており,erlotinibのもつ毒性はがん予防薬として適切でない可能性がある.この研究においては,肝がんリスク遺伝子シグネチャーをC型肝炎のほかの病因においても検証した.
1.病因によらない肝がんリスク遺伝子シグネチャーの確立
肝がんリスク遺伝子シグネチャーがより臨床に適用しやすくなるように,遺伝子の数を32に減らしたうえで診断検査プラットフォームに実装し,263例のB型肝炎,C型肝炎,アルコール性肝炎,脂肪肝による肝がんの治癒切除症例の新たな独立コホートにおいて検証した(図1).肝がんリスク遺伝子シグネチャーにより57例(22%),148例(56%),58例(22%)がそれぞれ高リスク群,中リスク群,低リスク群に分類され,新規の再発および全死亡と有意に相関した.遺伝子シグネチャーの予後との相関はおのおのの病因および病期においても有意であった.最近の疫学研究により示されているように,このコホートの脂肪肝の症例においても肝硬変の頻度は低かったが,ほかの病因,とくにB型肝炎に比べ,肝がんリスク遺伝子シグネチャーはより高リスクのパターンを示した.
2.C型肝炎ウイルスを除去したのちの肝がんの発生の予測
新たな抗C型肝炎ウイルス薬によりウイルスの除去率は高くなったが,発がんのリスクはそののち10年以上もつづくことが疫学研究により示されている1).この肝がんの治癒切除コホートにおける67例のC型肝炎の症例のうち4例はC型肝炎ウイルスを除去したのちの発がんであったが,肝がんリスク遺伝子シグネチャーはいずれも低リスクのパターンを示した.34例の発がんしていないC型肝炎の症例についてC型肝炎ウイルスの除去の前後の肝臓の生検組織において肝がんリスク遺伝子シグネチャーを検証したところ,より改善度の高い症例において発がんは認められなかったが,改善度の低い症例においてはC型肝炎ウイルスが除去されたのちにも肝がんが発生していた.これらの結果から,肝がんリスク遺伝子シグネチャーによりC型肝炎ウイルスを除去したのちの発がんの予測が可能であることが示唆された.
3.ヒトの線維化した肝組織における遺伝子制御ネットワークの同定
病因によらない肝がんの予防のための標的を探索した.523例の肝臓における遺伝子発現プロファイルのメタ解析により,31の遺伝子制御モジュールが同定され,おのおののモジュールにおける既知の肝炎症,線維化,発がんに関与する分子経路の関与が確認された.おのおのの遺伝子制御モジュールの活性化あるいは非活性化のパターンにより,臨床コホートにおいて肝臓における分子経路の異常をさまざまな動物実験モデルと比較することができた.肝硬変による肝がんの発生のモデルである低用量のジメチルニトロソアミンを頻回投与したラットは,ほかのいくつかのモデルとともに,臨床コホートに類似した遺伝子制御モジュールの活性化のパターンを示した.
4.機能的な肝がんの発生の標的としてのリゾホスファチジン酸経路の同定
臨床コホートにおいて肝臓における遺伝子制御ネットワークの中心に位置する第8モジュールは長期の発がんのリスクに関与する唯一のモジュールであり,そのなかにはすでに肝がんの発生への関与の知られている複数の遺伝子が含まれた.このモジュールを制御する遺伝子を同定するため,米国NIHのLibrary of Integrated Cellular Signaturesプロジェクトにおいて得られた5272遺伝子のノックダウンシグネチャーと統合して解析したところ,AKT1遺伝子,SLC35A1遺伝子,DDX42遺伝子,LPAR1遺伝子,ILK遺伝子が上位の遺伝子として同定された.現在,Akt-mTOR経路の阻害剤であるeverolimusやsirolimusは肝臓を移植したのちの肝がんの再発の予防薬の候補として臨床試験されている.そのほか,LPAR1遺伝子は唯一,臨床開発されている薬剤により阻害が可能であった.LPAR1遺伝子のコードするリゾホスファチジン酸受容体はGタンパク質共役受容体のファミリーのひとつであり,LPAR1遺伝子は複数の臓器において線維化に関与することが知られており,肝星細胞において結合組織増殖因子などの発現を誘導する.肝臓においては,オートタキシンがリゾホスファチジルコリンをリゾホスファチジン酸受容体のリガンドとなるリゾホスファチジン酸に変換する.肝がんもしくは高度に肝線維化したC型肝炎の症例において血清中のオートタキシンの濃度の高いことが知られている.リゾホスファチジン酸経路の下流として,RhoA経路,Ras-MAPK-ERK-MEK経路,Akt-PI3K経路,ホスホリパーゼC経路が知られている6).この臨床コホートにおいて,RhoA経路の標的であるNCAPH遺伝子,K-Ras経路の標的であるPRKG2遺伝子,H-Ras経路の標的であるSERPINB2遺伝子,MEK経路の標的であるGPX2遺伝子の発現が,肝がんリスク遺伝子シグネチャーの発現パターンと相関して増加していた.同様に,米国NIHのLibrary of Integrated Cellular Signaturesプロジェクトにより得られた低分子化合物のデータの探索において,Rhoキナーゼ経路,Akt-mTOR-PI3K経路,MAPK-ERK-MEK経路の阻害剤が同定され,リゾホスファチジン酸経路の関与およびリゾホスファチジン酸経路は肝がんの発生の予防のための標的として可能性のあることが強く示唆された.
5.リゾホスファチジン酸経路の阻害薬による肝がんの発生の予防および肝がんリスク遺伝子シグネチャーの改善
選択的なオートタキシンの阻害剤AM063およびLPAR1の阻害剤AM095によりリゾホスファチジン酸経路の阻害を試みた.また,Rho経路の関与について評価するため,ROCKの阻害剤であるFasudilおよびY-27632を用いた.肝臓の線維化が促進されている肝星細胞株において,これらの薬剤はRhoAの標的タンパク質であるミオシン制御軽鎖のリゾホスファチジン酸によるリン酸化を阻害したことから,RhoA経路がリゾホスファチジン酸経路の下流であることが示された.ERKのリン酸化の阻害はリゾホスファチジン酸経路の阻害剤においてのみ認められた.Akt経路の阻害は認められず,肝星細胞においてAkt経路はリゾホスファチジン酸経路の下流ではないことが示された.以上の結果から,リゾホスファチジン酸経路は肝臓においてAkt経路とは独立した,肝がんの発生の予防のための標的であることが示唆された.TGFβは肝臓の線維化を促進する主要なタンパク質であり,結合組織増殖因子の上流にあることが知られている.TGFβの中和抗体はリゾホスファチジン酸経路の下流の経路には影響をおよぼさなかった.結合組織増殖因子をコードするCTGF遺伝子のリゾホスファチジン酸経路の活性化による発現の増強は,LPAR1阻害剤およびROCK阻害剤により阻害されたがTGFβの中和抗体には影響されず,リゾホスファチジン酸経路とTGFβ経路は独立した経路であると考えられた.shRNAによるLPAR1あるいはRhoAのノックダウンは,同様にリゾホスファチジン酸経路に依存的なCTGF遺伝子の発現を抑制した.
肝硬変に依存性の肝がんの発生のモデルである低用量のジメチルニトロソアミンを頻回投与したラットにおいて,血清中のオートタキシンの濃度および肝臓におけるLpar1遺伝子の発現は肝臓の線維化の進展とともに徐々に上昇した.Ctgf遺伝子およびLpar1遺伝子の発現はおもに肝星細胞において,Atx遺伝子の発現はおもに肝細胞において認められ,これらの細胞のあいだのクロストークの存在が示唆された.10週間のオートタキシン阻害剤およびLPAR1阻害剤による治療は,肝臓におけるCtgf遺伝子の発現および肝星細胞に発現する細胞外マトリックスをコードするCol1a1遺伝子およびActa2遺伝子の発現を抑制した.肝臓の線維化は改善し,肝がん結節の数も有意に減少した.RNA-Seq法による肝臓におけるトランスクリプトームの解析により,肝がんリスク遺伝子シグネチャーおよび肝臓における遺伝子制御ネットワークの中心に位置する第8モジュールを含む肝臓における遺伝子制御ネットワークの異常の改善が確認された.肝星細胞における結果と同様に,RhoA経路およびERK経路の抑制,また,Akt経路およびTGFβ経路の無関与が確認された.血清中のビリルビンの濃度の上昇など肝臓への毒性を示唆する所見は認められなかった.
6.ヒトの線維化した肝臓の組織の体外培養における肝がんリスク遺伝子シグネチャーの改善
ヒトの肝臓の組織においてリゾホスファチジン酸経路の阻害による肝がんリスク遺伝子シグネチャーの改善を検証した.13例の肝疾患をともなう肝臓の組織(男性7例,女性6例.B型肝炎5例,C型肝炎3例,脂肪肝炎1例,病因不明4例)をLPAR1阻害剤とともに48時間にわたり体外培養し,肝がんリスク遺伝子シグネチャーの変化を測定した.培養まえの肝がんリスク遺伝子シグネチャーの高リスクのパターンおよびより軽度な肝臓の線維化は,より強い肝がんリスク遺伝子シグネチャーの改善と相関した.おのおのの遺伝子のレベルにおいては,増殖因子,細胞外マトリックス,細胞接着および線維化を促進するサイトカイン,酸化ストレス,血漿タンパク質の遺伝子について発現の抑制が認められた.同時に,肝星細胞シグネチャー7) の改善も認められた.これらの結果から,遺伝子シグネチャーあるいは血中においてその代理となるバイオマーカーは,肝がんの発生の予防におけるコンパニオン診断薬として有用であると考えられた.事実,肝がんの発生の予防についての臨床試験に必要な症例数の計算により,肝がんの発がんリスクバイオマーカーの使用により,100~200例の症例数および1~2年の観察期間で十分であることが明らかにされた.
おわりに
がんの予防はいまだ困難である1).通常,ヒトにおける発がんの過程すべてを動物モデルにおいて再現し薬効を評価するのは不可能である.また,従来,がん予防薬の臨床試験には膨大な症例数と長期の観察期間が必要であった.発がんリスクバイオマーカーにより高リスクの症例を事前に選びだすことが可能になれば,必要となる症例数の低減や観察期間の短縮により臨床試験がより容易になることが期待される.筆者らの開発した病因によらない肝がんリスク遺伝子シグネチャーは,肝がんの発生の予防についての臨床試験において幅広く利用できると考えられる.
この研究において明らかにされた肝臓における遺伝子制御ネットワークは,臨床的に関連があり標的となる分子の評価に適した実験モデルの迅速な同定に有用であると考えられる.リゾホスファチジン酸経路は肝臓における遺伝子ネットワークの中心に位置し,肝がんの発生の予防の標的のひとつとして同定され,薬剤による阻害が可能であった.TGFβ経路の阻害による毒性の懸念のない発がんの予防が可能になると期待される.
今回,筆者らが用いた,長期のにわたる予後のデータをともなう臨床から得られた臓器におけるトランスクリプトームの解析による,発がんの予防のための標的と発がんリスクバイオマーカーの同時探索は,慢性炎症や線維化を発がんの母地とするほかの臓器のがんにも応用でき,リバースエンジニアリングによる個別化された発がんの予防という新たなパラダイムを生み出すものと期待される.
文 献
- Hoshida, Y., Fuchs, B. C., Bardeesy, N. et al.: Pathogenesis and prevention of hepatitis C virus-induced hepatocellular carcinoma. J. Hepatol., 61, S79-S90 (2014)[PubMed]
- Hoshida, Y., Villanueva, A., Sangiovanni, A. et al.: Prognostic gene expression signature for patients with hepatitis C-related early-stage cirrhosis. Gastroenterology, 144, 1024-1030 (2013)[PubMed]
- Hoshida, Y., Villanueva, A., Kobayashi, M. et al.: Gene expression in fixed tissues and outcome in hepatocellular carcinoma. N. Engl. J. Med., 359, 1995-2004 (2008)[PubMed]
- King, L. Y., Canasto-Chibuque, C., Johnson, K. B et al.: A genomic and clinical prognostic index for hepatitis C-related early-stage cirrhosis that predicts clinical deterioration. Gut, 64, 1296-1302 (2015)[PubMed]
- Fuchs, B. C., Hoshida, Y., Fujii, T. et al.: Epidermal growth factor receptor inhibition attenuates liver fibrosis and development of hepatocellular carcinoma. Hepatology, 59, 1577-1590 (2014)[PubMed]
- Kihara, Y., Mizuno, H. & Chun, J.: Lysophospholipid receptors in drug discovery. Exp. Cell Res., 333, 171-177 (2015)[PubMed]
- Zhang, D. Y., Goossens, N., Guo, J. et al.: A hepatic stellate cell gene expression signature associated with outcomes in hepatitis C cirrhosis and hepatocellular carcinoma after curative resection. Gut, 65, 1754-1764 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 熊本大学大学院医学教育部博士課程 修了,同年 米国Icahn School of Medicine at Mount Sinai研究員を経て,2016年より熊本大学大学院生命科学研究部 特任助教.
研究テーマ:肝胆膵領域の悪性腫瘍の分子病態の解明および治療法の開発.
星田 有人(Yujin Hoshida)
米国Icahn School of Medicine at Mount Sinai准教授
研究室URL:http://www.hoshida-lab.org/
© 2016 中川茂樹・星田有人 Licensed under CC 表示 2.1 日本