Aireによる自己免疫の新たな制御機構
藤門 範行
(米国Harvard Medical School,Department of Microbiology and Immunobiology,Division of Immunology)
email:藤門範行
DOI: 10.7875/first.author.2016.129
Aire inhibits the generation of a perinatal population of interleukin-17A-producing γδ T cells to promote immunologic tolerance.
Noriyuki Fujikado, Alexander O. Mann, Kushagra Bansal, Kimberly R. Romito, Elise M. N. Ferre, Sergio D. Rosenzweig, Michail S. Lionakis, Christophe Benoist, Diane Mathis
Immunity, 45, 999-1012 (2016)
Aireによる自己免疫のおもな制御機構は,胸腺における自己抗原遺伝子の転写の活性化,および,それにともなうエフェクターT細胞の負の選択および制御性T細胞の正の選択である.筆者らは,組織の傷害や炎症反応の際に初期に応答することが知られているインターロイキン17産生性γδT細胞が,Aireノックアウトマウスの新生仔の胸腺および成体の末梢の組織において増加していることを発見し,新生仔期の胸腺髄質上皮細胞におけるAireに依存性のインターロイキン7の発現の制御により胸腺におけるインターロイキン17産生性γδT細胞が増加することが明らかにされた.γδT細胞を欠損するAireノックアウトマウスにおいては,Aireの欠損による疾患において典型的な標的となる網膜への炎症性細胞の浸潤が抑制されていること,Aireノックアウトマウスにおいて自己免疫が発症するまえに網膜においてインターロイキン17産生性γδT細胞が増加していたことから,自己免疫疾患の標的となる臓器の特異性の一部はγδT細胞に起因することが示唆された.さらに,Aireを欠損したヒトの患者においても相同の細胞と考えられるインターロイキン17産生性γδT細胞が増加していた.これらの結果から,Aireによる自己免疫の制御機構は自己抗原に特異的なT細胞の選択から自然リンパ球の分化の制御にまでひろがり,単一の転写因子による免疫学的な寛容の制御がより多面的な機能をもつことが明らかにされた.
関節リウマチや全身性エリテマトーデスなどの自己免疫疾患は自己に対する免疫寛容の破綻により生じる.遺伝的な要因と環境的な要因とが複雑に関与するため発症機構の解明は十分ではなく,いまだ根治療法は確立されていない.このような自己免疫疾患において,家系分析などにより単一の遺伝子の変異により発症することが明らかにされている2種類の疾患があり,自己に対する免疫寛容の破綻の研究において有用なモデルになっている.そのひとつはIPEXとよばれる疾患で,制御性T細胞の分化のマスターレギュレーターであるFoxp3遺伝子の変異が原因である.もうひとつはAPECEDとよばれる疾患で,Aire遺伝子の変異が原因である.
自己に対する免疫寛容の成立には,胸腺における自己反応性のT細胞の負の選択および制御性T細胞による末梢の組織における免疫の抑制が必要であるが,Aireはこの両者の機構に関与する1).以前に,筆者らは,新生仔期におけるAireの発現が自己免疫の制御に必要十分であり,生後まもなく分化するAireに依存性の制御性T細胞が自己に対する免疫寛容の成立および維持に重要な役割をはたすことを報告した2,3)(文献3) は新着論文レビュー でも掲載).
これまで,自然リンパ球の分化に対するAireの影響については,ナチュラルキラーT細胞およびγδT細胞はAireに非依存的に分化することが報告されている4).しかしながら,特定のγδT細胞のサブセットが新生仔の胸腺において分化すること,さらに,近年の研究により,胸腺に発現する特定のタンパク質がγδT細胞のサブセットの選択やサイトカインの産生に関与することなどが明らかにされたことから,AireノックアウトマウスにおいてγδT細胞の表現型につき再検討した.
AireノックアウトマウスのγδT細胞は,ほかの研究グループからの報告4) と同様に,野生型のマウスのγδT細胞と大きな差は認められなかった.しかしながら,γδT細胞をエフェクターのサブセットに分離して解析したところ,Aireの欠損の影響がみられた.Aireノックアウトマウスの胸腺においては,新生仔期をピークとしてインターロイキン17産生性のγδT細胞が増加し,この傾向は成体まで維持された.一方,ほかの研究グループからの報告5) と同様に,新生仔の胸腺においてインターフェロンγ産生性のγδT細胞はほとんど検出されなかった.また,Aireノックアウトマウスにおいては,脾臓,リンパ節,真皮,小腸粘膜固有層など末梢の組織においてもインターロイキン17産生性のγδT細胞の増加が認められた.これらの細胞はインターロイキン23受容体を発現し,CD24陰性およびCD27陰性というインターロイキン17産生性のγδT細胞の典型的な表現型を示した.
Aireノックアウトマウスにおいて増加するインターロイキン17産生性のγδT細胞が特定のγδT細胞のサブセットに限局するのかどうか確認するため,抗T細胞受容体γ鎖抗体を利用してフローサイトメトリーにより解析した.その結果,Vγ1,Vγ4,Vγ5を発現するγδT細胞のサブセットに顕著な影響はなく,新生仔の胸腺に由来するVγ6陽性Vδ1陽性のサブセットがAireノックアウトマウスにおいて増加していた.これらVγ6陽性Vδ1陽性のサブセットのT細胞受容体γ鎖およびT細胞受容体δ鎖の単一の細胞におけるシークエンス解析の結果,野生型マウスおよびAireノックアウトマウスともにVγ6のCDR3領域は解析したすべての細胞において完全に一致し,Vδ1についても大部分は共通していたが,Vδ1の多様性がAireノックアウトマウスにおいて上昇していた.同様の表現型は肺や網膜といった末梢の組織に分布するγδT細胞のサブセットでも認められ,インターロイキン17産生性のγδT細胞に対するAireの影響は新生仔の胸腺に由来するVγ6陽性Vδ1陽性のサブセットに限局することが示唆された.
Aireによるインターロイキン17産生性のγδT細胞の分化の制御としては,新生仔の胸腺における増殖因子の発現の上昇,あるいは,γδT細胞の選択にかかわるリガンドの発現の低下,の2つの可能性が考えられた.増殖因子の発現の上昇の可能性について検討するため,リンパ球の分化,生存,維持にとくに重要な共通γ鎖ファミリーのサイトカインに注目した.これまでに,インターロイキン7がインターロイキン17産生性のγδT細胞のサブセットの増殖に,インターロイキン15がインターフェロンγ産生性のγδT細胞のサブセットの増殖に重要という結果が報告されている6).胸腺髄質上皮細胞のマイクロアレイのデータから共通γ鎖ファミリーサイトカインの遺伝子発現プロファイルを抽出し,野生型のマウスとAireノックアウトマウス,および,成体のマウスと周産期のマウスについて比較した.その結果,インターロイキン7がAireノックアウトマウスの新生仔の胸腺においてとくに強く発現し,インターロイキン15については逆の発現パターンを示した.生後0日の野生型マウスにインターロイキン7を投与し,3日のちに胸腺の細胞を解析した結果,Vγ6陽性のインターロイキン17産生性のγδT細胞が有意に増加していた.また,生後0日のAireノックアウトマウスに抗インターロイキン7受容体抗体を投与し,3日のちに胸腺の細胞を解析した結果,Vγ6陽性のインターロイキン17産生性のγδT細胞が有意に減少していた.これらの結果から,Aireノックアウトマウスの新生仔の胸腺においては,胸腺髄質上皮細胞におけるインターロイキン7の発現が亢進し,インターロイキン17産生性のγδT細胞の増加に寄与することが明らかにされた.
γδT細胞の選択にかかわるリガンドの発現の低下の可能性について検討するため,既知のγδT細胞のリガンドについて検討したが,Aireに依存した効果の証拠は得られなかった.しかしながら,未同定の内在性のリガンドがインターロイキン17産生性のγδT細胞の分化の制御にかかわる可能性は否定できなかった.
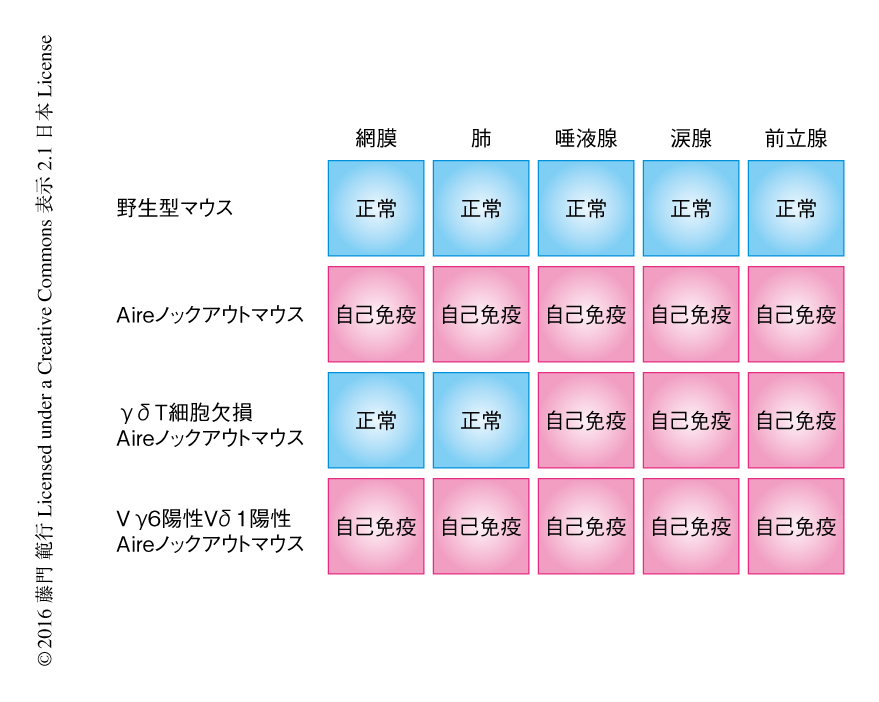
Aireの欠損による疾患におけるγδT細胞の役割について解析するため,AireノックアウトマウスとT細胞受容体δ鎖ノックアウトマウスとをかけあわせAireとT細胞受容体δ鎖のダブルノックアウトマウスを作製した.その結果,このダブルノックアウトマウスにおいてはAireノックアウトマウスに特徴的な網膜の変性や肺への炎症性細胞の浸潤といった自己免疫疾患の症状が顕著に抑制されたが,唾液腺,涙腺,前立腺といったAireの欠損による疾患において典型的な標的となる内分泌組織への影響はまったく認められなかった.AireノックアウトマウスとVγ6Vδ1トランスジェニックマウスをかけあわせ,ほぼすべてのγδT細胞がインターロイキン17を産生するようにした結果,12週齢のマウスにおいて網膜や肺に顕著な自己免疫疾患の症状がみられたが,唾液腺,涙腺,前立腺における増悪の傾向はとくに認められなかった.これらの結果から,γδT細胞がAireの欠損による疾患の発症に関与することが明らかにされたが,標的となる臓器のすべてが対象になるわけではなく,Vγ6陽性Vδ1陽性γδT細胞が分布する組織に限局された(図1).
自己免疫疾患におけるインターロイキン17産生性のγδT細胞の役割についての一般的なモデルは,炎症反応の早期にはたらき,局所への好中球の遊走やミエロイド系細胞およびリンパ球系細胞の運命の決定に関与するというものである7).もし,このシナリオが正しければ,Aireノックアウトマウスの自己免疫疾患において標的となる臓器には早期からすでにインターロイキン17産生性のγδT細胞が分布することが予想された.そこで,Aireノックアウトマウスの自己免疫疾患において標的となる代表的な臓器であり,γδT細胞に依存性に自己免疫疾患の症状を示す網膜に注目した.インターロイキン23受容体-GFPレポーターマウスの眼球からぶどう膜および網膜を単離し,組織に存在するVγ6陽性Vδ1陽性のインターロイキン17産生性のγδT細胞のほとんどがGFPを発現することを確認した.このレポーターマウスとAireノックアウトマウスとをかけあわせ,自己免疫疾患の症状を示すまえの7週齢のマウスのぶどう膜および網膜を解析した結果,GFP陽性のインターロイキン17産生性のγδT細胞が平均して野生型マウスの約6倍も蓄積した.さらに,より早期の4週齢のマウスにおいてもGFP陽性細胞の増加の傾向が認められた.同様の結果は肺の組織においても観察されたが,唾液腺や涙腺においては認められなかった.
組織に浸潤したインターロイキン17産生性のγδT細胞の表現型をRNA-seq法により解析した.網膜の組織からは必要な数の細胞を回収することができなかったため,肺に由来するインターロイキン17産生性のγδT細胞を用いた.野生型のマウスおよびAireノックアウトマウスに由来するインターロイキン17産生性のγδT細胞のトランスクリプトームは全体的には非常に類似していた.しかしながら,Vγ6陽性細胞の成熟度にかかわるトランスクリプトームのパターンを解析したところ,Aireノックアウトマウスに由来するインターロイキン17産生性のγδT細胞は野生型のマウスと比較してより成熟しており,サイトカイン受容体の遺伝子の発現が亢進していた.
ヒトにおけるインターロイキン17産生性のγδT細胞に対するAireの影響について解析するため,健常なヒトおよびAPECEDの患者のインターロイキン17陽性Vγ9陽性Vδ2陽性T細胞を比較した.このγδT細胞のサブセットは新生児期に発生し,インターロイキン17を産生することが報告されている8,9).解析の結果,APECEDの患者における血中のγδT細胞の数は健常なヒトと同様であった.しかしながら,インターロイキン17陽性Vγ9陽性Vδ2陽性T細胞はAPECEDの患者において健常人の6~7倍も多く存在した.一方,インターロイキン17陽性CD4陽性T細胞はAPECEDの患者において減少していた.したがって,Aireの欠損によるγδT細胞のサブセットへの影響は,マウスおよびヒトにおいて同様に認められた.
今回の研究により,Aireノックアウトマウスにおいては新生仔の胸腺に由来するVγ6陽性Vδ1陽性のインターロイキン17産生性のγδT細胞が,少なくともその一部はインターロイキン7に依存性に増加し,自己免疫疾患の発症にさきだち末梢の組織に移行してAireの欠損による疾患において病態の形成に関与することが示唆された.また,ヒトのAPECEDの患者においても機能的に相同なVγ9陽性Vδ2陽性インターロイキン17産生性のγδT細胞が末梢血において増加しており,AireがマウスおよびヒトにおいてγδT細胞の分化に影響をおよぼすことが明らかにされた.しかしながら,今回の発見にはさらなる議論の余地がある.すでに筆者らが報告しているとおり,新生仔期においてAireは制御性T細胞の選択に必須であるが3),制御性T細胞とインターロイキン17産生性のγδT細胞との関連についてはさらなる検討が必要である.また,インターロイキン7の役割については,インターロイキン17産生性のγδT細胞の増殖に関する過去の報告と一致するものの6),インターロイキン7の主要な産生細胞が胸腺皮質上皮細胞であることからさらなる議論が必要であると考えている.胸腺皮質上皮細胞を欠失する変異マウスにおいてもVγ6陽性のインターロイキン17産生性のγδT細胞が増加することが明らかにされており10),インターロイキン17産生性のγδT細胞のサブセットの分化には新生仔の胸腺の微小環境における厳密な制御が必須であると考えられる.さらに,APECEDの患者およびAireノックアウトマウスにおいてはインターロイキン17ファミリーサイトカインに対する自己抗体が存在し,インターロイキン17に対する自己免疫反応がAPECEDの患者におけるカンジダの感染の原因となることが示唆されている11,12).しかしながら,Aireによるインターロイキン17産生性のγδT細胞の分化の制御と自己抗体の産生との関連については不明である.
今回の研究により,Aireによる自己に対する免疫寛容の新たな制御機構として自己免疫をひき起こすγδT細胞のサブセットの分化の制御が明らかにされた.単一のタンパク質による自己に対する免疫寛容の多面的な機構は驚くべきことであり,Aireによる転写制御の分子機構など今後の研究の進展が期待される.
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,東京大学医科学研究所 助教,2010年 米国Harvard Medical SchoolにてResearch Fellowを経て,2015年より日本イーライリリーResearch Scientist.
研究テーマ:自己免疫疾患の病因.
関心事:免疫学的および哲学的な“寛容”の意味.免疫学の創薬への応用.
© 2016 藤門 範行 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Microbiology and Immunobiology,Division of Immunology)
email:藤門範行
DOI: 10.7875/first.author.2016.129
Aire inhibits the generation of a perinatal population of interleukin-17A-producing γδ T cells to promote immunologic tolerance.
Noriyuki Fujikado, Alexander O. Mann, Kushagra Bansal, Kimberly R. Romito, Elise M. N. Ferre, Sergio D. Rosenzweig, Michail S. Lionakis, Christophe Benoist, Diane Mathis
Immunity, 45, 999-1012 (2016)
要 約
Aireによる自己免疫のおもな制御機構は,胸腺における自己抗原遺伝子の転写の活性化,および,それにともなうエフェクターT細胞の負の選択および制御性T細胞の正の選択である.筆者らは,組織の傷害や炎症反応の際に初期に応答することが知られているインターロイキン17産生性γδT細胞が,Aireノックアウトマウスの新生仔の胸腺および成体の末梢の組織において増加していることを発見し,新生仔期の胸腺髄質上皮細胞におけるAireに依存性のインターロイキン7の発現の制御により胸腺におけるインターロイキン17産生性γδT細胞が増加することが明らかにされた.γδT細胞を欠損するAireノックアウトマウスにおいては,Aireの欠損による疾患において典型的な標的となる網膜への炎症性細胞の浸潤が抑制されていること,Aireノックアウトマウスにおいて自己免疫が発症するまえに網膜においてインターロイキン17産生性γδT細胞が増加していたことから,自己免疫疾患の標的となる臓器の特異性の一部はγδT細胞に起因することが示唆された.さらに,Aireを欠損したヒトの患者においても相同の細胞と考えられるインターロイキン17産生性γδT細胞が増加していた.これらの結果から,Aireによる自己免疫の制御機構は自己抗原に特異的なT細胞の選択から自然リンパ球の分化の制御にまでひろがり,単一の転写因子による免疫学的な寛容の制御がより多面的な機能をもつことが明らかにされた.
はじめに
関節リウマチや全身性エリテマトーデスなどの自己免疫疾患は自己に対する免疫寛容の破綻により生じる.遺伝的な要因と環境的な要因とが複雑に関与するため発症機構の解明は十分ではなく,いまだ根治療法は確立されていない.このような自己免疫疾患において,家系分析などにより単一の遺伝子の変異により発症することが明らかにされている2種類の疾患があり,自己に対する免疫寛容の破綻の研究において有用なモデルになっている.そのひとつはIPEXとよばれる疾患で,制御性T細胞の分化のマスターレギュレーターであるFoxp3遺伝子の変異が原因である.もうひとつはAPECEDとよばれる疾患で,Aire遺伝子の変異が原因である.
自己に対する免疫寛容の成立には,胸腺における自己反応性のT細胞の負の選択および制御性T細胞による末梢の組織における免疫の抑制が必要であるが,Aireはこの両者の機構に関与する1).以前に,筆者らは,新生仔期におけるAireの発現が自己免疫の制御に必要十分であり,生後まもなく分化するAireに依存性の制御性T細胞が自己に対する免疫寛容の成立および維持に重要な役割をはたすことを報告した2,3)(文献3) は新着論文レビュー でも掲載).
1.Aireノックアウトマウスの胸腺および末梢の組織においてインターロイキン17産生性γδ17細胞が増加している
これまで,自然リンパ球の分化に対するAireの影響については,ナチュラルキラーT細胞およびγδT細胞はAireに非依存的に分化することが報告されている4).しかしながら,特定のγδT細胞のサブセットが新生仔の胸腺において分化すること,さらに,近年の研究により,胸腺に発現する特定のタンパク質がγδT細胞のサブセットの選択やサイトカインの産生に関与することなどが明らかにされたことから,AireノックアウトマウスにおいてγδT細胞の表現型につき再検討した.
AireノックアウトマウスのγδT細胞は,ほかの研究グループからの報告4) と同様に,野生型のマウスのγδT細胞と大きな差は認められなかった.しかしながら,γδT細胞をエフェクターのサブセットに分離して解析したところ,Aireの欠損の影響がみられた.Aireノックアウトマウスの胸腺においては,新生仔期をピークとしてインターロイキン17産生性のγδT細胞が増加し,この傾向は成体まで維持された.一方,ほかの研究グループからの報告5) と同様に,新生仔の胸腺においてインターフェロンγ産生性のγδT細胞はほとんど検出されなかった.また,Aireノックアウトマウスにおいては,脾臓,リンパ節,真皮,小腸粘膜固有層など末梢の組織においてもインターロイキン17産生性のγδT細胞の増加が認められた.これらの細胞はインターロイキン23受容体を発現し,CD24陰性およびCD27陰性というインターロイキン17産生性のγδT細胞の典型的な表現型を示した.
2.Aireノックアウトマウスにおいて増加するインターロイキン17産生性のγδT細胞は新生仔の胸腺に由来するVγ6陽性Vδ1陽性のサブセットである
Aireノックアウトマウスにおいて増加するインターロイキン17産生性のγδT細胞が特定のγδT細胞のサブセットに限局するのかどうか確認するため,抗T細胞受容体γ鎖抗体を利用してフローサイトメトリーにより解析した.その結果,Vγ1,Vγ4,Vγ5を発現するγδT細胞のサブセットに顕著な影響はなく,新生仔の胸腺に由来するVγ6陽性Vδ1陽性のサブセットがAireノックアウトマウスにおいて増加していた.これらVγ6陽性Vδ1陽性のサブセットのT細胞受容体γ鎖およびT細胞受容体δ鎖の単一の細胞におけるシークエンス解析の結果,野生型マウスおよびAireノックアウトマウスともにVγ6のCDR3領域は解析したすべての細胞において完全に一致し,Vδ1についても大部分は共通していたが,Vδ1の多様性がAireノックアウトマウスにおいて上昇していた.同様の表現型は肺や網膜といった末梢の組織に分布するγδT細胞のサブセットでも認められ,インターロイキン17産生性のγδT細胞に対するAireの影響は新生仔の胸腺に由来するVγ6陽性Vδ1陽性のサブセットに限局することが示唆された.
3.Aireノックアウトマウスの新生仔の胸腺においてインターロイキン7の発現が亢進しγδT細胞からのインターロイキン17の産生が促進される
Aireによるインターロイキン17産生性のγδT細胞の分化の制御としては,新生仔の胸腺における増殖因子の発現の上昇,あるいは,γδT細胞の選択にかかわるリガンドの発現の低下,の2つの可能性が考えられた.増殖因子の発現の上昇の可能性について検討するため,リンパ球の分化,生存,維持にとくに重要な共通γ鎖ファミリーのサイトカインに注目した.これまでに,インターロイキン7がインターロイキン17産生性のγδT細胞のサブセットの増殖に,インターロイキン15がインターフェロンγ産生性のγδT細胞のサブセットの増殖に重要という結果が報告されている6).胸腺髄質上皮細胞のマイクロアレイのデータから共通γ鎖ファミリーサイトカインの遺伝子発現プロファイルを抽出し,野生型のマウスとAireノックアウトマウス,および,成体のマウスと周産期のマウスについて比較した.その結果,インターロイキン7がAireノックアウトマウスの新生仔の胸腺においてとくに強く発現し,インターロイキン15については逆の発現パターンを示した.生後0日の野生型マウスにインターロイキン7を投与し,3日のちに胸腺の細胞を解析した結果,Vγ6陽性のインターロイキン17産生性のγδT細胞が有意に増加していた.また,生後0日のAireノックアウトマウスに抗インターロイキン7受容体抗体を投与し,3日のちに胸腺の細胞を解析した結果,Vγ6陽性のインターロイキン17産生性のγδT細胞が有意に減少していた.これらの結果から,Aireノックアウトマウスの新生仔の胸腺においては,胸腺髄質上皮細胞におけるインターロイキン7の発現が亢進し,インターロイキン17産生性のγδT細胞の増加に寄与することが明らかにされた.
γδT細胞の選択にかかわるリガンドの発現の低下の可能性について検討するため,既知のγδT細胞のリガンドについて検討したが,Aireに依存した効果の証拠は得られなかった.しかしながら,未同定の内在性のリガンドがインターロイキン17産生性のγδT細胞の分化の制御にかかわる可能性は否定できなかった.
4.γδT細胞はAireノックアウトマウスに特徴的な自己免疫疾患を制御する
Aireの欠損による疾患におけるγδT細胞の役割について解析するため,AireノックアウトマウスとT細胞受容体δ鎖ノックアウトマウスとをかけあわせAireとT細胞受容体δ鎖のダブルノックアウトマウスを作製した.その結果,このダブルノックアウトマウスにおいてはAireノックアウトマウスに特徴的な網膜の変性や肺への炎症性細胞の浸潤といった自己免疫疾患の症状が顕著に抑制されたが,唾液腺,涙腺,前立腺といったAireの欠損による疾患において典型的な標的となる内分泌組織への影響はまったく認められなかった.AireノックアウトマウスとVγ6Vδ1トランスジェニックマウスをかけあわせ,ほぼすべてのγδT細胞がインターロイキン17を産生するようにした結果,12週齢のマウスにおいて網膜や肺に顕著な自己免疫疾患の症状がみられたが,唾液腺,涙腺,前立腺における増悪の傾向はとくに認められなかった.これらの結果から,γδT細胞がAireの欠損による疾患の発症に関与することが明らかにされたが,標的となる臓器のすべてが対象になるわけではなく,Vγ6陽性Vδ1陽性γδT細胞が分布する組織に限局された(図1).
5.インターロイキン17産生性のγδT細胞は自己免疫疾患の発症の早期に標的となる臓器に集積する
自己免疫疾患におけるインターロイキン17産生性のγδT細胞の役割についての一般的なモデルは,炎症反応の早期にはたらき,局所への好中球の遊走やミエロイド系細胞およびリンパ球系細胞の運命の決定に関与するというものである7).もし,このシナリオが正しければ,Aireノックアウトマウスの自己免疫疾患において標的となる臓器には早期からすでにインターロイキン17産生性のγδT細胞が分布することが予想された.そこで,Aireノックアウトマウスの自己免疫疾患において標的となる代表的な臓器であり,γδT細胞に依存性に自己免疫疾患の症状を示す網膜に注目した.インターロイキン23受容体-GFPレポーターマウスの眼球からぶどう膜および網膜を単離し,組織に存在するVγ6陽性Vδ1陽性のインターロイキン17産生性のγδT細胞のほとんどがGFPを発現することを確認した.このレポーターマウスとAireノックアウトマウスとをかけあわせ,自己免疫疾患の症状を示すまえの7週齢のマウスのぶどう膜および網膜を解析した結果,GFP陽性のインターロイキン17産生性のγδT細胞が平均して野生型マウスの約6倍も蓄積した.さらに,より早期の4週齢のマウスにおいてもGFP陽性細胞の増加の傾向が認められた.同様の結果は肺の組織においても観察されたが,唾液腺や涙腺においては認められなかった.
組織に浸潤したインターロイキン17産生性のγδT細胞の表現型をRNA-seq法により解析した.網膜の組織からは必要な数の細胞を回収することができなかったため,肺に由来するインターロイキン17産生性のγδT細胞を用いた.野生型のマウスおよびAireノックアウトマウスに由来するインターロイキン17産生性のγδT細胞のトランスクリプトームは全体的には非常に類似していた.しかしながら,Vγ6陽性細胞の成熟度にかかわるトランスクリプトームのパターンを解析したところ,Aireノックアウトマウスに由来するインターロイキン17産生性のγδT細胞は野生型のマウスと比較してより成熟しており,サイトカイン受容体の遺伝子の発現が亢進していた.
6.APECEDの患者においてはインターロイキン17を産生するVγ9陽性Vδ2陽性T細胞が増加している
ヒトにおけるインターロイキン17産生性のγδT細胞に対するAireの影響について解析するため,健常なヒトおよびAPECEDの患者のインターロイキン17陽性Vγ9陽性Vδ2陽性T細胞を比較した.このγδT細胞のサブセットは新生児期に発生し,インターロイキン17を産生することが報告されている8,9).解析の結果,APECEDの患者における血中のγδT細胞の数は健常なヒトと同様であった.しかしながら,インターロイキン17陽性Vγ9陽性Vδ2陽性T細胞はAPECEDの患者において健常人の6~7倍も多く存在した.一方,インターロイキン17陽性CD4陽性T細胞はAPECEDの患者において減少していた.したがって,Aireの欠損によるγδT細胞のサブセットへの影響は,マウスおよびヒトにおいて同様に認められた.
おわりに
今回の研究により,Aireノックアウトマウスにおいては新生仔の胸腺に由来するVγ6陽性Vδ1陽性のインターロイキン17産生性のγδT細胞が,少なくともその一部はインターロイキン7に依存性に増加し,自己免疫疾患の発症にさきだち末梢の組織に移行してAireの欠損による疾患において病態の形成に関与することが示唆された.また,ヒトのAPECEDの患者においても機能的に相同なVγ9陽性Vδ2陽性インターロイキン17産生性のγδT細胞が末梢血において増加しており,AireがマウスおよびヒトにおいてγδT細胞の分化に影響をおよぼすことが明らかにされた.しかしながら,今回の発見にはさらなる議論の余地がある.すでに筆者らが報告しているとおり,新生仔期においてAireは制御性T細胞の選択に必須であるが3),制御性T細胞とインターロイキン17産生性のγδT細胞との関連についてはさらなる検討が必要である.また,インターロイキン7の役割については,インターロイキン17産生性のγδT細胞の増殖に関する過去の報告と一致するものの6),インターロイキン7の主要な産生細胞が胸腺皮質上皮細胞であることからさらなる議論が必要であると考えている.胸腺皮質上皮細胞を欠失する変異マウスにおいてもVγ6陽性のインターロイキン17産生性のγδT細胞が増加することが明らかにされており10),インターロイキン17産生性のγδT細胞のサブセットの分化には新生仔の胸腺の微小環境における厳密な制御が必須であると考えられる.さらに,APECEDの患者およびAireノックアウトマウスにおいてはインターロイキン17ファミリーサイトカインに対する自己抗体が存在し,インターロイキン17に対する自己免疫反応がAPECEDの患者におけるカンジダの感染の原因となることが示唆されている11,12).しかしながら,Aireによるインターロイキン17産生性のγδT細胞の分化の制御と自己抗体の産生との関連については不明である.
今回の研究により,Aireによる自己に対する免疫寛容の新たな制御機構として自己免疫をひき起こすγδT細胞のサブセットの分化の制御が明らかにされた.単一のタンパク質による自己に対する免疫寛容の多面的な機構は驚くべきことであり,Aireによる転写制御の分子機構など今後の研究の進展が期待される.
文 献
- Mathis, D. & Benoist C.: Aire. Annu. Rev. Immunol., 27, 287-312 (2009)[PubMed]
- Guerau-de-Arellano, M., Martinic, M., Benoist, C. et al.: Neonatal tolerance revisited: a perinatal window for Aire control of autoimmunity. J. Exp. Med., 206, 1245-1252 (2009)[PubMed]
- Yang, S., Fujikado, N., Kolodin, D. et al.: Regulatory T cells generated early in life play a distinct role in maintaining self-tolerance. Science, 348, 589-594 (2015)[PubMed] [新着論文レビュー]
- Tuovinen, H., Pontynen, N., Gylling, M. et al.: γδ T cells develop independently of Aire. Cell. Immunol., 257, 5-12 (2009)[PubMed]
- Do, J. S., Fink, P. J., Li, L. et al.: Cutting edge: spontaneous development of IL-17-producing γδ T cells in the thymus occurs via a TGF-β1-dependent mechanism. J. Immunol., 184, 1675-1679 (2010)[PubMed]
- Michel, M. L., Pang, D. J., Haque, S. F. et al.: Interleukin 7 (IL-7) selectively promotes mouse and human IL-17-producing γδ cells. Proc. Natl. Acad. Sci. USA, 109, 17549-17554 (2012)[PubMed]
- Cua, D.J. & Tato, C. M.: Innate IL-17-producing cells: the sentinels of the immune system. Nat. Rev. Immunol., 10, 479-489 (2010)[PubMed]
- Caccamo, N., La Mendola, C., Orlando, V. et al.: Differentiation, phenotype, and function of interleukin-17-producing human Vγ9Vδ2 T cells. Blood, 118, 129-138 (2011)[PubMed]
- Dimova, T., Brouwer, M., Gosselin, F. et al.: Effector Vγ9Vδ2 T cells dominate the human fetal γδ T-cell repertoire. Proc. Natl. Acad. Sci. USA, 112, E556-E565 (2015)[PubMed]
- Nitta, T., Muro, R., Shimizu, Y. et al.: The thymic cortical epithelium determines the TCR repertoire of IL-17-producing γδT cells. EMBO Rep., 16, 638-653 (2015)[PubMed]
- Kisand, K., Boe Wolff, A. S., Podkrajsek, K. T. et al.: Chronic mucocutaneous candidiasis in APECED or thymoma patients correlates with autoimmunity to Th17-associated cytokines. J. Exp. Med., 207, 299-308 (2010)[PubMed]
- Puel, A., Doffinger, R., Natividad, A. et al.: Autoantibodies against IL-17A, IL-17F, and IL-22 in patientswith chronic mucocutaneous candidiasis and autoimmune polyendocrine syndrome type I. J. Exp. Med., 207, 291-297 (2010)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,東京大学医科学研究所 助教,2010年 米国Harvard Medical SchoolにてResearch Fellowを経て,2015年より日本イーライリリーResearch Scientist.
研究テーマ:自己免疫疾患の病因.
関心事:免疫学的および哲学的な“寛容”の意味.免疫学の創薬への応用.
© 2016 藤門 範行 Licensed under CC 表示 2.1 日本