CRISPR-Cas9系を利用したHITI法による生体におけるゲノム編集
鈴木啓一郎・Juan Carlos Izpisua Belmonte
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:鈴木啓一郎
DOI: 10.7875/first.author.2016.128
In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration.
Keiichiro Suzuki, Yuji Tsunekawa, Reyna Hernandez-Benitez, Jun Wu, Jie Zhu, Euiseok J. Kim, Fumiyuki Hatanaka, Mako Yamamoto, Toshikazu Araoka, Zhe Li, Masakazu Kurita, Tomoaki Hishida, Mo Li, Emi Aizawa, Shicheng Guo, Song Chen, April Goebl, Rupa Devi Soligalla, Jing Qu, Tingshuai Jiang, Xin Fu, Maryam Jafari, Concepcion Rodriguez Esteban, W. Travis Berggren, Jeronimo Lajara, Estrella Nuñez-Delicado, Pedro Guillen, Josep M. Campistol, Fumio Matsuzaki, Guang-Hui Liu, Pierre Magistretti, Kun Zhang, Edward M. Callaway, Kang Zhang, Juan Carlos Izpisua Belmonte
Nature, 540, 144-149 (2016)
部位特異的なヌクレアーゼを利用したゲノム編集の技術は生命科学の研究に革命をもたらし,臨床への応用の可能性もひめている.しかしながら,細胞分裂の高い活性が必要な従来の方法では,分裂をしていない細胞がほとんどをしめる生体において,ゲノムのねらった部位に直接に遺伝子を挿入することは非常に困難であった.この研究においては,CRISPR-Cas9系を利用した,さまざまな細胞種に適用の可能なゲノム編集の技術を開発し,HITI法と名づけた.HITI法を用いることにより,従来の方法では不可能であった非分裂細胞における遺伝子のノックインに成功し,また,生きたままのマウスの脳や筋肉を含むさまざまな組織や器官においても遺伝子のノックインが可能になった.さらに,網膜の視細胞の変性により進行性の視覚の障害をきたす遺伝性疾患である網膜色素変性症のラットモデルにおいて,HITI法による遺伝子のノックインにより視覚の機能が改善された.以上の結果から,HITI法は基礎的な研究のみならず,難治性の遺伝病に対する新規の遺伝子治療にも応用できる可能性が示された.
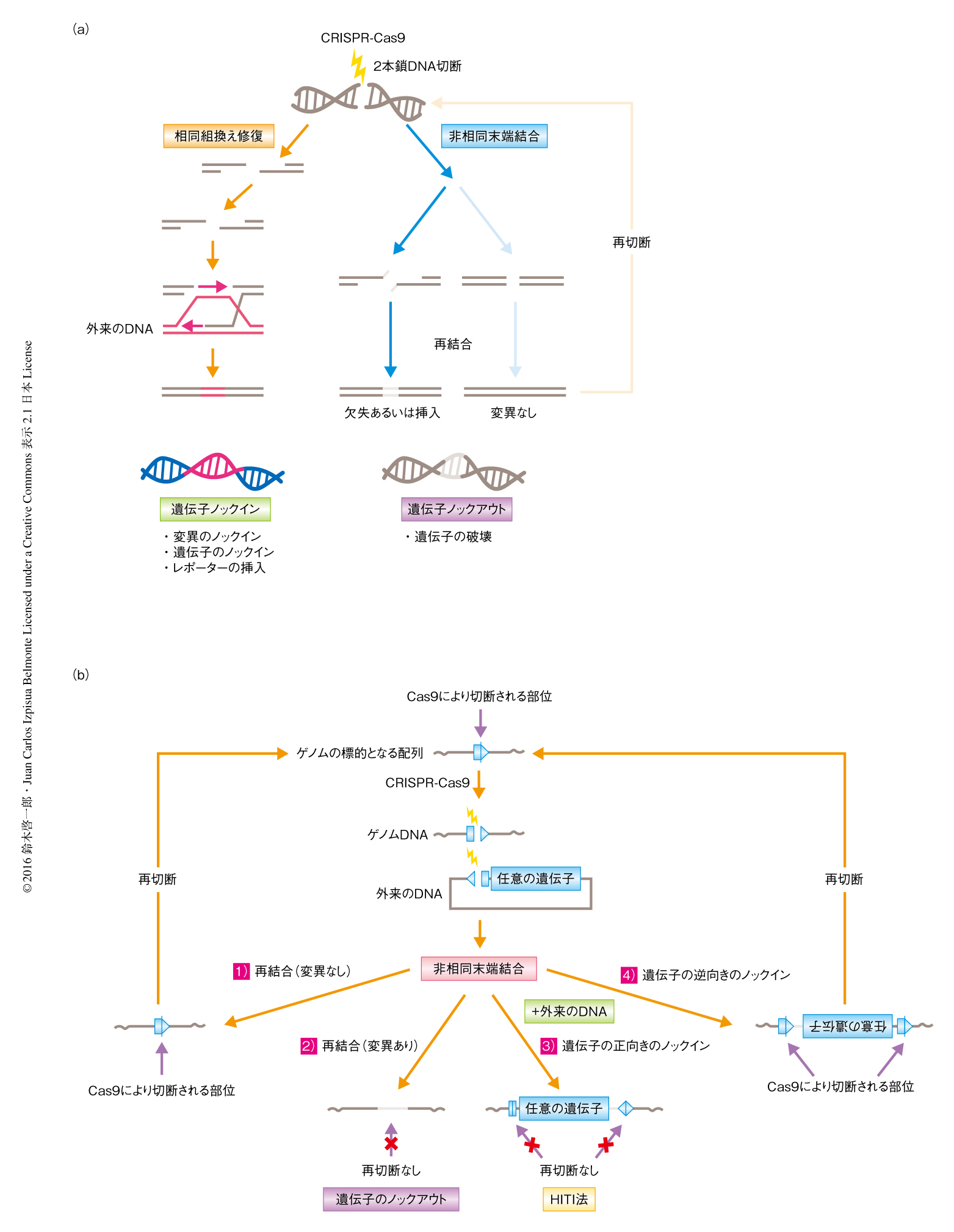
近年,CRISPR-Cas9系に代表される部位特異的なヌクレアーゼの登場により,ゲノムのねらった部位において遺伝子を操作する“ゲノム編集”の技術が急速に進歩し,多種多様な細胞あるいは生物種のゲノムを選択的に改変することが可能になった1,2).この基本的な原理としては,細胞がもともともつゲノムDNAの2本鎖切断を修復する2本鎖DNA切断修復機構を利用する.2本鎖DNA切断修復機構にはおもに,相同な配列を鋳型として組換えを起こす相同組換え(homologous recombination)と,相同な配列に依存せず切断された末端を直接に結合する非相同末端結合(non-homologous end joining)の2つの機構がある.この2つの2本鎖DNA切断修復機構をうまく利用することにより,ゲノムのねらった部位において遺伝子を操作するゲノム編集が可能になる(図1a).具体的には,切断されたDNAの末端を直接につなぎあわせる際に数塩基の欠失や挿入などのエラーの起こりやすい非相同末端結合を利用することにより標的となる遺伝子を破壊する遺伝子ノックアウトが可能になる.一方で,相同な配列をもつ外来のDNAを導入しておくと相同組換え修復によりあやまってゲノムに取り込まれるが,これを利用して標的となる塩基配列を自由自在に改変する遺伝子ノックインが可能になる.これらの遺伝子の改変を効率よく起こすため,ゲノムのねらった部位を特異的に切断し2本鎖DNA切断修復機構を人為的にひき起こす,CRISPR-Cas9系といった部位特異的なヌクレアーゼが開発されてきた.
既存の遺伝子ノックインの手法は細胞分裂のさかんな細胞においてはたらく相同組換え修復を利用したものであるため,培養細胞においては有効なツールとして幅広く用いられてきた.しかしながら,相同組換え修復は細胞周期に依存しているため,この手法は細胞分裂のさかんな細胞にしか用いることができないという欠点があった3).このため,多くの細胞が分裂を停止した非分裂細胞からなる生体においては,これまで,有効な遺伝子ノックインの手法は報告されていない4).
この研究においては,CRISPR-Cas9系を用いて非分裂細胞においても活性をもつ非相同末端結合を利用することにより,非分裂細胞においても遺伝子のノックインができるのではないかと考えた.
これまで,分裂細胞において非相同末端結合を利用した遺伝子ノックインの手法の報告は数例あったが,詳細には解析されておらず応用の可能な細胞種も検討されていなかった5,6).また,非相同末端結合を利用した遺伝子ノックインの手法については,目的の遺伝子があやまった向きで挿入されるという問題点があった.そこで,導入する遺伝子ベクターの配列をくふうし,逆方向の挿入を抑制して遺伝子を目的の向きで安定的に挿入できるよう設計した(図1b).この方法は,相同な配列を必要としない標的となる部位に特異的な遺伝子ノックインの手法であることから,HITI(homology-independent targeted integration)法と名づけた.
細胞分裂をする培養細胞を用いて,HITI法と相同な配列を利用した既存の遺伝子ノックインの手法とを比較した.具体的には,IRESmCherryをもつさまざまなベクターを作製し,IRESmCherryがノックインされてmCherry陽性となった細胞の割合をフローサイトメトリー法により同定し,おのおのの手法について標的となる部位へのノックインの効率を比較した.その結果,HITI法は従来の方法と比べて約10倍も高い効率で遺伝子をノックインすることが可能であった.また,HITI法により標的となる部位に挿入された約90%の外来のDNAは,末端が変異することがなくゲノムに組み込まれていた.このことから,HITI法においては,外来のDNAはおもに変異をともなわない非相同末端結合によりゲノムに組み込まれることが示唆された.
相同組換え修復の活性を必要としないことと,高いノックインの効率を示すことを活かして,従来の相同組換え修復を利用した手法では不可能であった非分裂細胞であるマウスのニューロンへの遺伝子のノックインを試みた.マウスの胎仔の脳に由来するニューロンを培養し,ニューロンに特異的に発現するTubb3遺伝子の下流にGFP遺伝子をノックインした.さまざまな遺伝子ノックインの手法を比較したところ,HITI法を用いたときのみ,遺伝子が導入された細胞あたり最大で60%という高い効率で目的の部位にGFP遺伝子が挿入された.これまで,非分裂細胞において遺伝子をノックインしたという報告はなく,HITI法によりそれが可能になった.
生きたままの生体においてHITI法が有効かどうか検討した.マウスにおいて子宮の胎生15.5日の胎仔の脳に子宮内エレクトロポレーション法により外来のDNAを導入し,Tubb3遺伝子の下流にGFP遺伝子をノックインした.マウスの脳を生後21日において解析したところ,遺伝子が導入された細胞あたり最大で20%という効率でGFP遺伝子がノックインされた.胎生15.5日の脳はまださかんに細胞分裂している時期であるため,生体の非分裂細胞において遺伝子がノックインされたのかどうかはわからない.このため,タモキシフェンにより発現が誘導されるCas9を用い,脳において細胞分裂がすでに停止しているとされる生後10日および生後11日においてCas9を発現させたところ,従来の相同組換え修復を利用した手法により遺伝子のノックインは起こらなかったが,HITI法を用いることにより遺伝子のノックインに成功した.このことから,生きたままの生体においても非分裂細胞にて標的となる部位に遺伝子をノックインできる可能性が示唆された.
生体における遺伝子の導入にすぐれたアデノ随伴ウイルスベクターを用いて,HITI法の系を細胞に導入するベクターを作製した.このベクターを生きたままのマウスへ注射することにより,生体における部位特異的な遺伝子のノックインを試みた.成体のマウスの脳にこのベクターを感染させたところ,細胞あたり3.5%の効率でTubb3遺伝子の下流にGFP遺伝子がノックインされた.また,骨格筋においても同様に局所的な遺伝子のノックインに成功した.
HITI法の遺伝性疾患に対する有効性を示すため,網膜色素変性症のラットモデルへの応用を試みた.網膜色素変性症は網膜の視細胞が変性していく進行性の難病であり,まだ有効な治療法が確立されていない.
網膜色素変性症のモデルラットは,ヒトにおいても原因遺伝子のひとつとして知られているMertk遺伝子のイントロン1とエキソン2の一部が両方の対立遺伝子において欠損している7).エキソン2を欠損した領域の直前に挿入するHITI法の系をもつアデノ随伴ウイルスベクターを作製した.これを生後3週齢の網膜色素変性症モデルラットの網膜下のすきまに直接に投与し4~5週間のちに解析した結果,標的となる部位における遺伝子のノックインがPCR法により確認され,Mertk遺伝子の発現量はmRNAのレベルで正常なラットの4.5%にまで改善した.また,免疫染色法によってもMertk遺伝子の発現が確認され,モデルラットにみられるONL層の厚みの減少も緩和された.さらに,外部からの光の刺激に対する反応を調べた結果,視覚の障害の部分的な回復がみられた.これらの結果は,同様に並行して行った従来の相同組換え修復を利用した遺伝子ノックインの手法を用いた場合より有意に効果の高いことが確認され,HITI法が難治性の遺伝病に対する新しい遺伝子治療に応用できる可能性が示された.
全身性の遺伝子ノックインが可能かどうか調べるため,Rosa26遺伝子座にCAGプロモーターが挿入されたAi14マウス8) を用いた.生後1日のマウスに静脈への注射によりHITI法の系をもつアデノ随伴ウイルスベクターを投与し,GFP遺伝子がCAGプロモーターの下流にノックインすることによるGFPの発現をさまざまな臓器において観察した.2週間のちに解析したところ,多くの臓器において遺伝子のノックインがみられ,とくにアデノ随伴ウイルスセロタイプ9をベクターとして用いた場合には,感染の効率の高い心臓(3.4%),肝臓(4.2%),筋肉(10%)において高い効率で遺伝子ノックインに成功した.また,従来の相同組換え修復を利用した手法よりもノックインの効率が有意に高かった.次世代シークエンサーを用いて標的となる部位の変異率を決定したところ,ノックインの効率と同じ程度であった.筋肉および心臓から単離したGFP陽性細胞について標的となる部位の塩基配列を1細胞のレベルで解析したところ,標的となる部位に90~95%という高い効率でGFP遺伝子がノックインされており,HITI法による遺伝子のノックインは正確であることが明らかにされた.さらに,30~50%ものGFP陽性細胞において両方の対立遺伝子において遺伝子がノックインされていた.肝臓からゲノムDNAを抽出し標的となる部位のほかの部位へのノックインについて調べたところ,オフターゲット部位の変異が少ないことも示された.
この研究において,非分裂細胞における遺伝子のノックインに成功し,生きたままのマウスおよびラットのさまざまな臓器などにおいて局所的あるいは全身性でゲノムの任意の部位に遺伝子をノックインすることが可能になった.このHITI法を遺伝子のノックインによる遺伝子改変動物の作製の例のない霊長類の脳に応用することにより,複雑な思考力をつかさどる脳機能の解明,脳の一部が関与する疾患の機構の解明につながることが期待される.
現時点では,HITI法は生体の一部の臓器において約3~10%の細胞のゲノムを改変できる.今後,HITI法の分子機構を解明することによりさらなる改良をくわえ,ノックインの効率の上昇をめざしている.そのうえで,十分に安全性を検討したのちには,成人の神経,筋肉,網膜など終末分化細胞に異常をもつさまざまな難治性の遺伝病に対し,その原因となる異常な遺伝子を病変の部位において直接に修復する遺伝子治療へと応用できる可能性があると考えている.
略歴:2005年 埼玉大学大学院理工学研究科 修了,2006年 埼玉医科大学 特任研究員,2009年 同 助教を経て,2010年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:ゲノム編集技術を用いたヒトの遺伝性疾患の分子機構の解明,および,新規のゲノム編集技術の開発.
Juan Carlos Izpisua Belmonte
米国Salk Institute for Biological StudiesにてProfessor.
研究室URL:http://www.salk.edu/labs/belmonte/
© 2016 鈴木啓一郎・Juan Carlos Izpisua Belmonte Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:鈴木啓一郎
DOI: 10.7875/first.author.2016.128
In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration.
Keiichiro Suzuki, Yuji Tsunekawa, Reyna Hernandez-Benitez, Jun Wu, Jie Zhu, Euiseok J. Kim, Fumiyuki Hatanaka, Mako Yamamoto, Toshikazu Araoka, Zhe Li, Masakazu Kurita, Tomoaki Hishida, Mo Li, Emi Aizawa, Shicheng Guo, Song Chen, April Goebl, Rupa Devi Soligalla, Jing Qu, Tingshuai Jiang, Xin Fu, Maryam Jafari, Concepcion Rodriguez Esteban, W. Travis Berggren, Jeronimo Lajara, Estrella Nuñez-Delicado, Pedro Guillen, Josep M. Campistol, Fumio Matsuzaki, Guang-Hui Liu, Pierre Magistretti, Kun Zhang, Edward M. Callaway, Kang Zhang, Juan Carlos Izpisua Belmonte
Nature, 540, 144-149 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
部位特異的なヌクレアーゼを利用したゲノム編集の技術は生命科学の研究に革命をもたらし,臨床への応用の可能性もひめている.しかしながら,細胞分裂の高い活性が必要な従来の方法では,分裂をしていない細胞がほとんどをしめる生体において,ゲノムのねらった部位に直接に遺伝子を挿入することは非常に困難であった.この研究においては,CRISPR-Cas9系を利用した,さまざまな細胞種に適用の可能なゲノム編集の技術を開発し,HITI法と名づけた.HITI法を用いることにより,従来の方法では不可能であった非分裂細胞における遺伝子のノックインに成功し,また,生きたままのマウスの脳や筋肉を含むさまざまな組織や器官においても遺伝子のノックインが可能になった.さらに,網膜の視細胞の変性により進行性の視覚の障害をきたす遺伝性疾患である網膜色素変性症のラットモデルにおいて,HITI法による遺伝子のノックインにより視覚の機能が改善された.以上の結果から,HITI法は基礎的な研究のみならず,難治性の遺伝病に対する新規の遺伝子治療にも応用できる可能性が示された.
はじめに
近年,CRISPR-Cas9系に代表される部位特異的なヌクレアーゼの登場により,ゲノムのねらった部位において遺伝子を操作する“ゲノム編集”の技術が急速に進歩し,多種多様な細胞あるいは生物種のゲノムを選択的に改変することが可能になった1,2).この基本的な原理としては,細胞がもともともつゲノムDNAの2本鎖切断を修復する2本鎖DNA切断修復機構を利用する.2本鎖DNA切断修復機構にはおもに,相同な配列を鋳型として組換えを起こす相同組換え(homologous recombination)と,相同な配列に依存せず切断された末端を直接に結合する非相同末端結合(non-homologous end joining)の2つの機構がある.この2つの2本鎖DNA切断修復機構をうまく利用することにより,ゲノムのねらった部位において遺伝子を操作するゲノム編集が可能になる(図1a).具体的には,切断されたDNAの末端を直接につなぎあわせる際に数塩基の欠失や挿入などのエラーの起こりやすい非相同末端結合を利用することにより標的となる遺伝子を破壊する遺伝子ノックアウトが可能になる.一方で,相同な配列をもつ外来のDNAを導入しておくと相同組換え修復によりあやまってゲノムに取り込まれるが,これを利用して標的となる塩基配列を自由自在に改変する遺伝子ノックインが可能になる.これらの遺伝子の改変を効率よく起こすため,ゲノムのねらった部位を特異的に切断し2本鎖DNA切断修復機構を人為的にひき起こす,CRISPR-Cas9系といった部位特異的なヌクレアーゼが開発されてきた.
既存の遺伝子ノックインの手法は細胞分裂のさかんな細胞においてはたらく相同組換え修復を利用したものであるため,培養細胞においては有効なツールとして幅広く用いられてきた.しかしながら,相同組換え修復は細胞周期に依存しているため,この手法は細胞分裂のさかんな細胞にしか用いることができないという欠点があった3).このため,多くの細胞が分裂を停止した非分裂細胞からなる生体においては,これまで,有効な遺伝子ノックインの手法は報告されていない4).
この研究においては,CRISPR-Cas9系を用いて非分裂細胞においても活性をもつ非相同末端結合を利用することにより,非分裂細胞においても遺伝子のノックインができるのではないかと考えた.
1.分裂細胞を用いたHITI法の開発
これまで,分裂細胞において非相同末端結合を利用した遺伝子ノックインの手法の報告は数例あったが,詳細には解析されておらず応用の可能な細胞種も検討されていなかった5,6).また,非相同末端結合を利用した遺伝子ノックインの手法については,目的の遺伝子があやまった向きで挿入されるという問題点があった.そこで,導入する遺伝子ベクターの配列をくふうし,逆方向の挿入を抑制して遺伝子を目的の向きで安定的に挿入できるよう設計した(図1b).この方法は,相同な配列を必要としない標的となる部位に特異的な遺伝子ノックインの手法であることから,HITI(homology-independent targeted integration)法と名づけた.
細胞分裂をする培養細胞を用いて,HITI法と相同な配列を利用した既存の遺伝子ノックインの手法とを比較した.具体的には,IRESmCherryをもつさまざまなベクターを作製し,IRESmCherryがノックインされてmCherry陽性となった細胞の割合をフローサイトメトリー法により同定し,おのおのの手法について標的となる部位へのノックインの効率を比較した.その結果,HITI法は従来の方法と比べて約10倍も高い効率で遺伝子をノックインすることが可能であった.また,HITI法により標的となる部位に挿入された約90%の外来のDNAは,末端が変異することがなくゲノムに組み込まれていた.このことから,HITI法においては,外来のDNAはおもに変異をともなわない非相同末端結合によりゲノムに組み込まれることが示唆された.
2.非分裂細胞における遺伝子のノックイン
相同組換え修復の活性を必要としないことと,高いノックインの効率を示すことを活かして,従来の相同組換え修復を利用した手法では不可能であった非分裂細胞であるマウスのニューロンへの遺伝子のノックインを試みた.マウスの胎仔の脳に由来するニューロンを培養し,ニューロンに特異的に発現するTubb3遺伝子の下流にGFP遺伝子をノックインした.さまざまな遺伝子ノックインの手法を比較したところ,HITI法を用いたときのみ,遺伝子が導入された細胞あたり最大で60%という高い効率で目的の部位にGFP遺伝子が挿入された.これまで,非分裂細胞において遺伝子をノックインしたという報告はなく,HITI法によりそれが可能になった.
3.子宮内エレクトロポレーション法による生体におけるゲノム編集
生きたままの生体においてHITI法が有効かどうか検討した.マウスにおいて子宮の胎生15.5日の胎仔の脳に子宮内エレクトロポレーション法により外来のDNAを導入し,Tubb3遺伝子の下流にGFP遺伝子をノックインした.マウスの脳を生後21日において解析したところ,遺伝子が導入された細胞あたり最大で20%という効率でGFP遺伝子がノックインされた.胎生15.5日の脳はまださかんに細胞分裂している時期であるため,生体の非分裂細胞において遺伝子がノックインされたのかどうかはわからない.このため,タモキシフェンにより発現が誘導されるCas9を用い,脳において細胞分裂がすでに停止しているとされる生後10日および生後11日においてCas9を発現させたところ,従来の相同組換え修復を利用した手法により遺伝子のノックインは起こらなかったが,HITI法を用いることにより遺伝子のノックインに成功した.このことから,生きたままの生体においても非分裂細胞にて標的となる部位に遺伝子をノックインできる可能性が示唆された.
4.アデノ随伴ウイルスベクターを用いた生体における局所的なゲノム編集
生体における遺伝子の導入にすぐれたアデノ随伴ウイルスベクターを用いて,HITI法の系を細胞に導入するベクターを作製した.このベクターを生きたままのマウスへ注射することにより,生体における部位特異的な遺伝子のノックインを試みた.成体のマウスの脳にこのベクターを感染させたところ,細胞あたり3.5%の効率でTubb3遺伝子の下流にGFP遺伝子がノックインされた.また,骨格筋においても同様に局所的な遺伝子のノックインに成功した.
5.網膜色素変性症モデルラットの遺伝子治療
HITI法の遺伝性疾患に対する有効性を示すため,網膜色素変性症のラットモデルへの応用を試みた.網膜色素変性症は網膜の視細胞が変性していく進行性の難病であり,まだ有効な治療法が確立されていない.
網膜色素変性症のモデルラットは,ヒトにおいても原因遺伝子のひとつとして知られているMertk遺伝子のイントロン1とエキソン2の一部が両方の対立遺伝子において欠損している7).エキソン2を欠損した領域の直前に挿入するHITI法の系をもつアデノ随伴ウイルスベクターを作製した.これを生後3週齢の網膜色素変性症モデルラットの網膜下のすきまに直接に投与し4~5週間のちに解析した結果,標的となる部位における遺伝子のノックインがPCR法により確認され,Mertk遺伝子の発現量はmRNAのレベルで正常なラットの4.5%にまで改善した.また,免疫染色法によってもMertk遺伝子の発現が確認され,モデルラットにみられるONL層の厚みの減少も緩和された.さらに,外部からの光の刺激に対する反応を調べた結果,視覚の障害の部分的な回復がみられた.これらの結果は,同様に並行して行った従来の相同組換え修復を利用した遺伝子ノックインの手法を用いた場合より有意に効果の高いことが確認され,HITI法が難治性の遺伝病に対する新しい遺伝子治療に応用できる可能性が示された.
6.アデノ随伴ウイルスベクターを用いた生体における全身性のゲノム編集
全身性の遺伝子ノックインが可能かどうか調べるため,Rosa26遺伝子座にCAGプロモーターが挿入されたAi14マウス8) を用いた.生後1日のマウスに静脈への注射によりHITI法の系をもつアデノ随伴ウイルスベクターを投与し,GFP遺伝子がCAGプロモーターの下流にノックインすることによるGFPの発現をさまざまな臓器において観察した.2週間のちに解析したところ,多くの臓器において遺伝子のノックインがみられ,とくにアデノ随伴ウイルスセロタイプ9をベクターとして用いた場合には,感染の効率の高い心臓(3.4%),肝臓(4.2%),筋肉(10%)において高い効率で遺伝子ノックインに成功した.また,従来の相同組換え修復を利用した手法よりもノックインの効率が有意に高かった.次世代シークエンサーを用いて標的となる部位の変異率を決定したところ,ノックインの効率と同じ程度であった.筋肉および心臓から単離したGFP陽性細胞について標的となる部位の塩基配列を1細胞のレベルで解析したところ,標的となる部位に90~95%という高い効率でGFP遺伝子がノックインされており,HITI法による遺伝子のノックインは正確であることが明らかにされた.さらに,30~50%ものGFP陽性細胞において両方の対立遺伝子において遺伝子がノックインされていた.肝臓からゲノムDNAを抽出し標的となる部位のほかの部位へのノックインについて調べたところ,オフターゲット部位の変異が少ないことも示された.
おわりに
この研究において,非分裂細胞における遺伝子のノックインに成功し,生きたままのマウスおよびラットのさまざまな臓器などにおいて局所的あるいは全身性でゲノムの任意の部位に遺伝子をノックインすることが可能になった.このHITI法を遺伝子のノックインによる遺伝子改変動物の作製の例のない霊長類の脳に応用することにより,複雑な思考力をつかさどる脳機能の解明,脳の一部が関与する疾患の機構の解明につながることが期待される.
現時点では,HITI法は生体の一部の臓器において約3~10%の細胞のゲノムを改変できる.今後,HITI法の分子機構を解明することによりさらなる改良をくわえ,ノックインの効率の上昇をめざしている.そのうえで,十分に安全性を検討したのちには,成人の神経,筋肉,網膜など終末分化細胞に異常をもつさまざまな難治性の遺伝病に対し,その原因となる異常な遺伝子を病変の部位において直接に修復する遺伝子治療へと応用できる可能性があると考えている.
文 献
- Mali, P., Yang, L., Esvelt, K. M. et al.: RNA-guided human genome engineering via Cas9. Science, 339, 823-826 (2013)[PubMed]
- Cong, L., Ran, F. A., Cox, D. et al.: Multiplex genome engineering using CRISPR/Cas systems. Science, 339, 819-823 (2013)[PubMed]
- Orthwein, A., Noordermeer, S. M., Wilson, M. D. et al.: A mechanism for the suppression of homologous recombination in G1 cells. Nature, 528, 422-426 (2015)[PubMed]
- Cox, D. B. T., Platt, R. J. & Zhang, F.: Therapeutic genome editing: prospects and challenges. Nat. Med., 21, 121-131 (2015)[PubMed]
- Maresca, M., Lin, V. G., Guo, N. et al.: Obligate ligation-gated recombination (ObLiGaRe): custom-designed nuclease-mediated targeted integration through nonhomologous end joining. Genome Res., 23, 539-546 (2013)[PubMed]
- Auer, T. O., Duroure, K., De Cian, A. et al.: Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homologyindependent DNA repair. Genome Res., 24, 142-153 (2014)[PubMed]
- D’Cruz, P. M. Yasumura, D., Weir, J. et al.: Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat. Hum. Mol. Genet., 9, 645-651 (2000)[PubMed]
- Madisen, L., Zwingman, T. A., Sunkin, S. M. et al.: A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat. Neurosci., 13, 133-140 (2010)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 埼玉大学大学院理工学研究科 修了,2006年 埼玉医科大学 特任研究員,2009年 同 助教を経て,2010年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:ゲノム編集技術を用いたヒトの遺伝性疾患の分子機構の解明,および,新規のゲノム編集技術の開発.
Juan Carlos Izpisua Belmonte
米国Salk Institute for Biological StudiesにてProfessor.
研究室URL:http://www.salk.edu/labs/belmonte/
© 2016 鈴木啓一郎・Juan Carlos Izpisua Belmonte Licensed under CC 表示 2.1 日本